EQUILIBRES CHIMIQUES Professeur TANGOUR Bahoueddine 1 ENTHALPIE LIBRE

EQUILIBRES CHIMIQUES Professeur TANGOUR Bahoueddine

1 -ENTHALPIE LIBRE G Le critère d’évolution lié à une fonction d’état G qui peut se définir par la relation mathématique : G = H - T. S pour une transformation effectuée à température et pression constantes. Par application du deuxième principe on a : - pour une transformation réversible où ΔG = 0 : aucune modification des variables du système n’a lieu, le système est en état d’équilibre thermodynamique; - pour une transformation irréversible, d’où ΔG < 0, le système peut évoluer spontanément; - pour le cas où ΔG > 0, le système ne peut plus évoluer spontanément dans le sens considéré pour la transformation sans apport d’énergie de l’extérieur. La fonction G exprime donc le critère de spontanéité des processus d’évolution des systèmes.

2 - POTENTIEL CHIMIQUE Définition On écrit pour un système qui dépend du nombre de moles n: d. U = d. Q+ d. W + μ. dn Le terme μ. dn représente une nouvelle forme d’énergie : c’est l’énergie chimique. L’enthalpie libre molaire d’une espèce s’appelle potentiel chimique et se note par la lettre grecque μ. Pour un processus réversible, on écrit d. U = T. d. S - P. d. V + μ. dn d. H= d(U+PV) = d. U + d(PV) = d. U + Pd. V+ Vd. P d. H=Td. S - P. d. V + μ. dn + Pd. V+ Vd. P = T. d. S + μ. dn + Vd. P d. G =d(H-TS)= d. H-d(TS) = T. d. S + μ. dn + Vd. P -Td. S -Sd. T d. G = - S. d. T + V. d. P + μ. dn

suite d. G = - S. d. T + V. d. P + μ. dn Puisque G est une fonction d’État, on peut écrire La fonction G a en outre l’intérêt que la valeur de g est identique à la valeur de μ pour une mole de corps pur: μ = g = Pour un système comportant plusieurs corps purs: Remarque: Le potentiel chimique règle les échanges de molécules tout comme la pression règle les échanges de volume et la température les échanges d’entropie.

3 -ÉQUILIBRE ENTRE DEUX PHASES D’UN CORPS PUR Si On suppose que les deux phases sont à la même température T et sous la même pression P. la condition d’équilibre est d. G = 0. Si G 1 et G 2 sont les enthalpies libres deux phases du système, on a : G = G 1 + G 2 et la condition d’équilibre s’écrit : d. G = d. G 1 + d. G 2 = 0, avec n = n 1 + n 2. or d. G 1 = μ 1. dn 1 ; d. G 2 = μ 2. dn 2 ; d. G = μ 1. dn 1 + μ 2. dn 2 d’où, avec dn = 0 si le système est fermé : dn 1 + dn 2 = 0 et dn 1 = - dn 2 d. G = μ 1. dn 1 + μ 2. dn 2 = (μ 1 - μ 2). dn 1 = 0 μ 1 - μ 2= 0 ou μ 1 = μ 2

4 -POTENTIEL CHIMIQUE D’UN GAZ PARFAIT Rappelons que l’équation d’état d’un gaz parfait s’écrit : P. V. = n. R. T et que l’énergie interne ne dépend que de la température. En utilisant ces simplifications, on peut démontrer que pour un gaz parfait, on a : μ = μ° + R. T. Ln (P/P°) où μ° est le potentiel chimique standard et ne dépend que de la température. P 0 = 1 atmosphère ou 1 bar

DÉMONSTRATION On sait que m= et d. G = - S. d. T + V. d. P + μ. dn m vérifie l’égalité suivante (relation pour une fonction d’état) Pour un gaz parfait on a PV=n. RT D’où et

5 -POTENTIEL CHIMIQUE MÉLANGE DE GAZ PARFAITS Chaque constituant est caractérisé par une expression analogue où Pi est la pression partielle du gaz dans le mélange : μi = μi° + R. T. Ln (Pi/P°) où Pi = xi. P, et x représente la fraction molaire du gaz dans le mélange. soit : μi = μi° + R. T. Ln (P/P 0) + R. T. Ln (xi) Ou encore : μi = μi°* + R. T. Ln (xi)

6 -POTENTIEL CHIMIQUE DANS LES SOLUTIONS Par égalité des valeurs des potentiels chimiques entre phases, l’expression des potentiels chimiques des solutions est analogue à celle des gaz parfaits : μA = μA° + R. T. Ln (x. A) où x. A représente une fraction molaire. Si la solution n’est pas idéale, Il faut utiliser un terme correctif: μA = μA° + R. T. Ln (g. A x. A) où le terme (g. x) s’appelle activité (se note a) du composé A dans la solution. Le terme γ s’appelle coefficient d’activité du composé. On a donc la formule générale: μ = μ° + R. T. Ln (a)

7 -POTENTIELS CHIMIQUES Expressions: Type de mélange Gaz parfaits ak=xk activité Etat standard de référence Approximation Cas non idéal: Coefficient d’activité Mélange condensé idéal Solution infiniment diluée Solvant ak =1 Soluté ak=xk Gaz Parfait pur sous P 0=1 bar Corps pur Soluté en dans le même sous P 0 concentration état sous P 0 C 0 sous P 0 ----- Influence de la pression négligée Gaz réel Mélange condensé ak=gk xk Solution diluée ak=gk xk

8 -EQUILIBRES CHIMIQUES Soit une réaction chimique d’équation: Comme on a : μ = μ° + R. T. Ln a Q est appelée quotient de la réaction

9 -ÉVOLUTION D’UN SYSTÈME CHIMIQUE Dr. G = Dr. G 0 + RT ln Q A l’équilibre on a Dr. G = 0 alors Dr. G 0 = - RT ln K K s’appelle constante d’équilibre. Elle prend une valeur (sans dimensions) donnée pour une réaction donnée à une température donnée. On peut la noter aussi K 0 T si on travaille dans les conditions standard. Dr. G = - RT ln K + RT ln Q Dr. G = RT ln ( Q / K ) Pour prévoir comment va évoluer un système chimique une fois il subit une variation de température, de pression ou modification du nombre de mole d'un des constituants, il faudrait comparer Q à K. Si Q diminue, Dr. G diminue et l'équilibre se déplace dans le sens 2. Si Q augmente, Dr. G augmente et l'équilibre se déplace dans le sens 1. Si Q ne varie pas Dr. G ne varie pas et l'équilibre reste inchangé.

10 - EXPRESSION DES CONSTANTES D’ÉQUILIBRE Pour les gaz et selon le choix de l’expression de l’activité choisie, on a plusieurs formes de la constante d’équilibre. Kp si Pk désignant une pression partielle. Kc si Ck désignant une concentration Kx si ak=xk xk désignant la fraction molaire

suite En ajoutant l’équation des gaz parfaits PV=n. RT et P = CRT, on trouve la relation suivante: En remplaçant la pression partielle Pk = xk P , on trouve la relation suivante:

APPLICATION 1 On peut caractériser les ions fer III par la coloration rouge sang de l'ion Fe. SCN 2+ que l'on obtient lorsqu'on ajoute une solution de thiocyanate de potassium KSCN à une solution d'ion fer (III). 1. Écrire l'équation de la réaction modélisant cette transformation. 2. Exprimer la constante d'équilibre K associer à cette équation. 3. On ajoute à 100 m. L d'une solution Fe 3+ (aq) de concentration molaire c=0, 01 mol. L-1, 0, 001 mol d'ion SCN- (aq) (sans variation sensible du volume). Déterminer la quantité d'ion Fe 3+ (aq) de la solution dans l'état d'équilibre sachant que K=160.
![Réponse Fe 3+ + SCN- = Fe. SCN 2+ K = [Fe. SCN 2+] Réponse Fe 3+ + SCN- = Fe. SCN 2+ K = [Fe. SCN 2+]](http://slidetodoc.com/presentation_image_h/820ad4d316a10e82e1ad5aa944ba65ed/image-16.jpg)
Réponse Fe 3+ + SCN- = Fe. SCN 2+ K = [Fe. SCN 2+] / ([Fe 3+ ][SCN- ]) conservation de l'élément fer : [Fe 3+ ]+ [Fe. SCN 2+] = 0, 01 mol/L (1) conservation élément azote : [SCN- ]+ [Fe. SCN 2+] = 0, 001 / 0, 1 = 0, 01 mol/L (2) d'où [Fe 3+ ]= [SCN- ] = x et [Fe. SCN 2+] = 0, 01 -x K= (0, 01 -x) / x² soit : K x² = 0, 01 -x ou bien Kx²+ x -0, 01 =0 160 x² + x-0, 01 = 0 D= 1²-4*160*(-0, 01) = 7, 4 racine carrée (D)= 2, 72 x= (-1 +2, 72) /(2*160) = 0, 0054 mol/L. l'autre valeur est négative, donc exclue.

Application 2 Calculer la constante d’équilibre de la réaction d’équation : H 2 + I 2 <==> 2 HI A 25 °C les concentrations à l’équilibre sont : [H 2] = 0. 0505 M [I 2] = 0. 0498 M [HI] = 0. 389 M Réponse = (0. 389)2 / [(0. 0505) (0. 0498)]= 60. 2

11 - LOI DE MODÉRATION PRINCIPE DE LE CHATELIER Cette loi indique qu’un système à l’équilibre cherche toujours à s’opposer aux variations qu’on veut lui imposer. 11 -1: Modification de la quantité d’un composé actif Ainsi, si on ajoute un corps, l'équilibre va généralement se déplacer dans le sens de disparition de ce corps. Inversement si on élimine un corps l'équilibre va se généralement déplacer dans le sens de formation de ce corps.
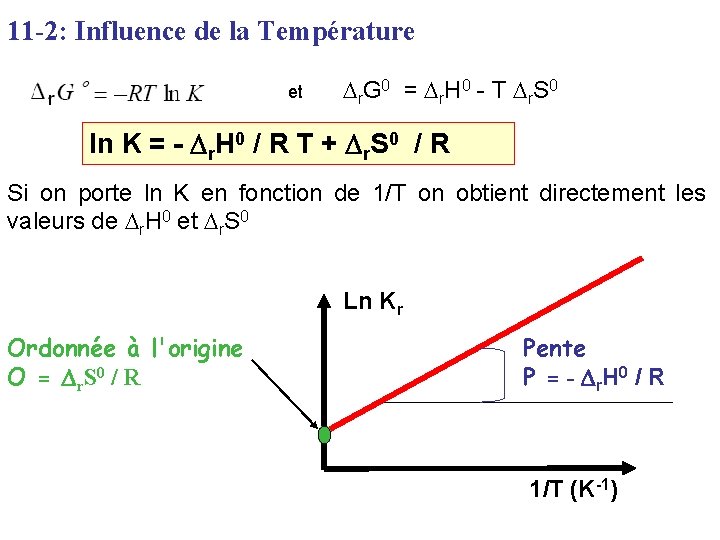
11 -2: Influence de la Température et Dr. G 0 = Dr. H 0 - T Dr. S 0 ln K = - Dr. H 0 / R T + Dr. S 0 / R Si on porte ln K en fonction de 1/T on obtient directement les valeurs de Dr. H 0 et Dr. S 0 Ln Kr Ordonnée à l'origine O = D r S 0 / R Pente P = - D r. H 0 / R 1/T (K-1)

Suite 1 ln K = - Dr. H 0 / R T + Dr. S 0 / R Si on suppose que Dr. H 0 et Dr. S 0 ne dépendent pas de la température, on peut dérive par rapport à T : Loi de Vant'Hoff Cette relation permet de prévoir l'influence de T sur un équilibre. Par intégration on a :

Suite 2 Il suffit donc de connaître la valeur de K à deux températures différentes pour connaître Dr. H 0 et Dr. S 0 Pente : P = - Dr. H 0 / R Connaissant Dr. H 0 on peut ensuite facilement calculer Dr. S 0 Ln K Dr. S 0 = R Ln K 1 + Dr. H 0 / T 1 D(Ln. K) D(1/T) 1/T

SUITE 3 Comme RT 2 est un terme obligatoirement positif: R T 2 > 0 Soit le cas d’une élévation de température (d. T>0). Si Dr. H 0 < 0 (Réaction exothermique): d. Ln. K et d. T sont de signes contraires donc K diminue puisque T augmente. Ceci implique la quantité des produits diminue et le système évolue dans le sens 2, ici le sens endothermique.

SUITE 4 Si Dr. H 0 > 0 (Réaction endothermique) : d. Ln. K et d. T sont de même signes donc K augmente car T augmente. Ceci implique la quantité des produits augmente et le système évolue dans le sens 1, ici aussi le sens endothermique. Dans les deux cas, une élévation de température favorise donc le sens correspondant à la réaction endothermique. Inversement, un abaissement de température favorise le sens correspondant à la réaction exothermique. Si une réaction possède un Dr. H 0 nul, la température est sans influence sur l’équilibre.

SUITE et fin Dans les deux cas, une élévation de température favorise donc le sens correspondant à la réaction endothermique. Inversement, un abaissement de température favorise le sens correspondant à la réaction exothermique. Si une réaction possède un Dr. H 0 nul, la température est sans influence sur l’équilibre.

Exemple

11 -3: Influence de la Pression d/d. P (Ln Kx) = d/d. P (Ln KP – Dn Ln P ) = 0 – Dn/P Car KP ne dépend que de la température. Pour une compression; d. P >0. Si Dn >0, alors d/d. P(Ln KX) <0 Kx décroit On favorise la formation des réactifs. L’équilibre se déplace dans le sens 2. Si Dn <0, alors d/d. P(Ln KX) >0 Kx croit On favorise la formation des produits. L’équilibre se déplace dans le sens 1.

suite Dans les deux cas, le déplacement de l’équilibre va dans le sens de la réaction où le nombre de moles total de gaz diminue. * si P augmente l’équilibre cherche à la faire diminuer en se déplaçant dans le sens de diminution du nombre de mole gazeuses. * si P diminue l’équilibre cherche à la faire augmenter en se déplaçant dans le sens de l’augmentation du nombre de mole gazeuses. * si au cours de la réaction le nombre de mole gazeuse ne varie pas, la pression est sans influence sur l’équilibre.

Exemples

11 -4: Ajout isotherme d’un gaz Inerte à Volume constant Le gaz inerte ne réagit avec aucun des composés du mélange réactionnel contenant des corps gazeux. Le nombre de moles nk de chacun des composés en présence reste constant. Reste lui aussi constant car T et V ne sont pas modifiés. La constante d’équilibre s’exprime en fonction des pressions partielles et ne sera pas modifiée. Cet ajout, bien qu’il augmente la pression totale du mélange gazeux, reste sans effet sur l’état d’équilibre étudié P’=P mélange initial +Pgaz inerte

11 -5: Ajout isotherme d’un gaz Inerte à Pression constante Avant l’ajout on a: Après l’ajout on a: Ce qui donne juste après l’ajout: Le système répond pour augmenter les pressions partielles donc les fractions molaires donc le nombre de mole de chaque réactif donc le nombre de moles total de gaz. On a l’effet inverse de l’augmentation de pression déjà étudié.

12 - AFFINITÉ CHIMIQUE On utilise aussi l’affinité chimique, A définie par A = - Dr. G, comme outil de prévision de l’évolution des réactions chimiques.
- Slides: 31