LIAISON COVALENTE EFFETS ELECTRONIQUES Lorsque les deux atomes


- Slides: 28

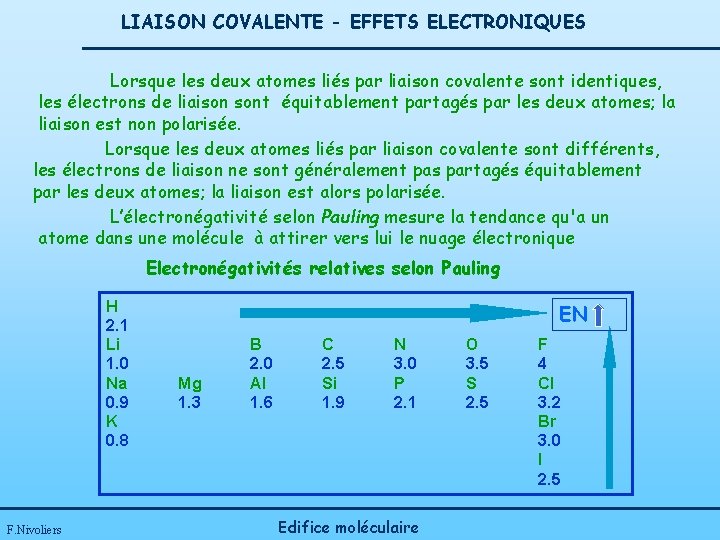
LIAISON COVALENTE - EFFETS ELECTRONIQUES Lorsque les deux atomes liés par liaison covalente sont identiques, les électrons de liaison sont équitablement partagés par les deux atomes; la liaison est non polarisée. Lorsque les deux atomes liés par liaison covalente sont différents, les électrons de liaison ne sont généralement pas partagés équitablement par les deux atomes; la liaison est alors polarisée. L’électronégativité selon Pauling mesure la tendance qu'a un atome dans une molécule à attirer vers lui le nuage électronique Electronégativités relatives selon Pauling H 2. 1 Li 1. 0 Na 0. 9 K 0. 8 F. Nivoliers EN Mg 1. 3 B 2. 0 Al 1. 6 C 2. 5 Si 1. 9 N 3. 0 P 2. 1 Edifice moléculaire O 3. 5 S 2. 5 F 4 Cl 3. 2 Br 3. 0 I 2. 5

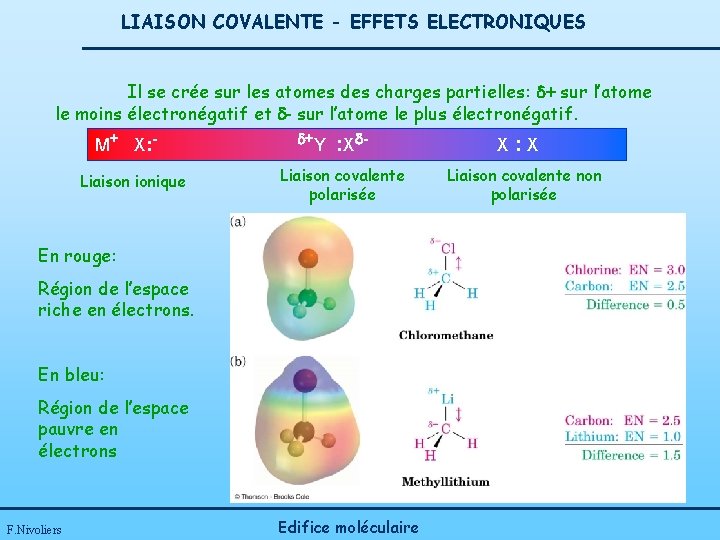
LIAISON COVALENTE - EFFETS ELECTRONIQUES Il se crée sur les atomes des charges partielles: d+ sur l’atome le moins électronégatif et d- sur l’atome le plus électronégatif. M+ X: Liaison ionique d+Y : Xd- Liaison covalente polarisée En rouge: Région de l’espace riche en électrons. En bleu: Région de l’espace pauvre en électrons F. Nivoliers Edifice moléculaire X: X Liaison covalente non polarisée

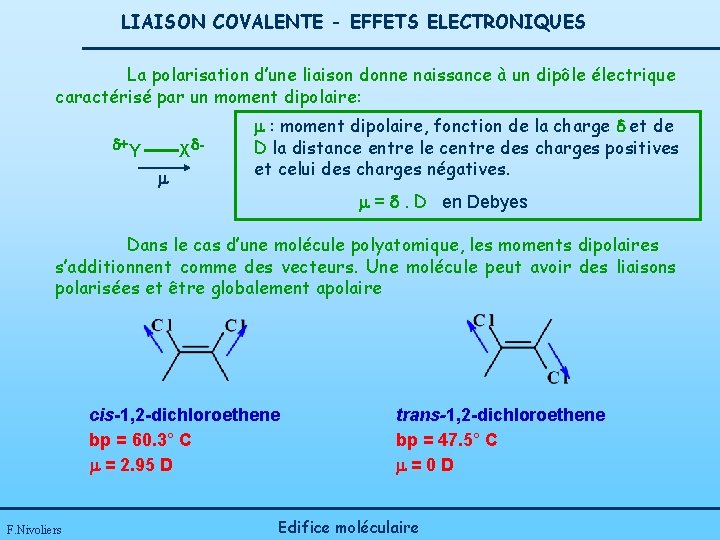
LIAISON COVALENTE - EFFETS ELECTRONIQUES La polarisation d’une liaison donne naissance à un dipôle électrique caractérisé par un moment dipolaire: d+Y Xd : moment dipolaire, fonction de la charge d et de D la distance entre le centre des charges positives et celui des charges négatives. = d. D en Debyes Dans le cas d’une molécule polyatomique, les moments dipolaires s’additionnent comme des vecteurs. Une molécule peut avoir des liaisons polarisées et être globalement apolaire cis-1, 2 -dichloroethene bp = 60. 3° C = 2. 95 D F. Nivoliers trans-1, 2 -dichloroethene bp = 47. 5° C =0 D Edifice moléculaire

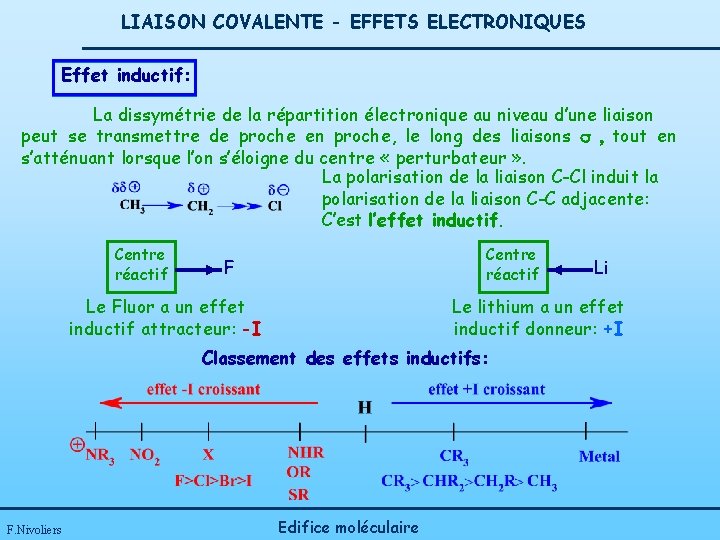
LIAISON COVALENTE - EFFETS ELECTRONIQUES Effet inductif: La dissymétrie de la répartition électronique au niveau d’une liaison peut se transmettre de proche en proche, le long des liaisons s , tout en s’atténuant lorsque l’on s’éloigne du centre « perturbateur » . La polarisation de la liaison C-Cl induit la polarisation de la liaison C-C adjacente: C’est l’effet inductif. Centre réactif F Le Fluor a un effet inductif attracteur: -I Le lithium a un effet inductif donneur: +I Classement des effets inductifs: F. Nivoliers Li Edifice moléculaire

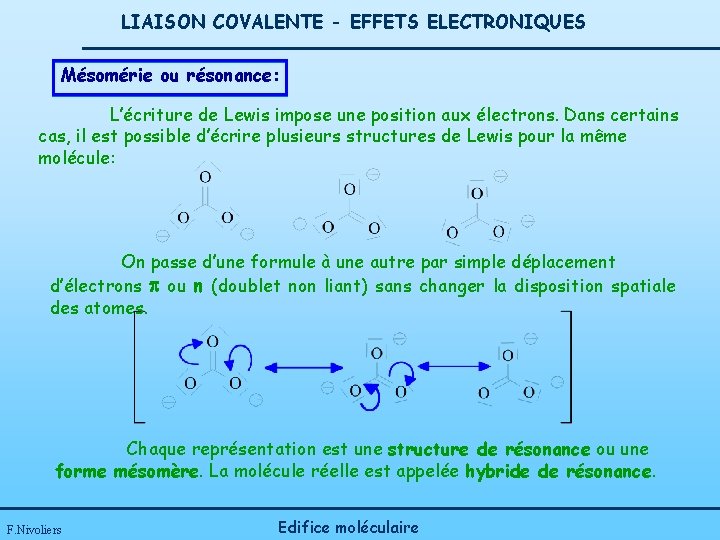
LIAISON COVALENTE - EFFETS ELECTRONIQUES Mésomérie ou résonance: L’écriture de Lewis impose une position aux électrons. Dans certains cas, il est possible d’écrire plusieurs structures de Lewis pour la même molécule: On passe d’une formule à une autre par simple déplacement d’électrons p ou n (doublet non liant) sans changer la disposition spatiale des atomes. Chaque représentation est une structure de résonance ou une forme mésomère. La molécule réelle est appelée hybride de résonance. F. Nivoliers Edifice moléculaire

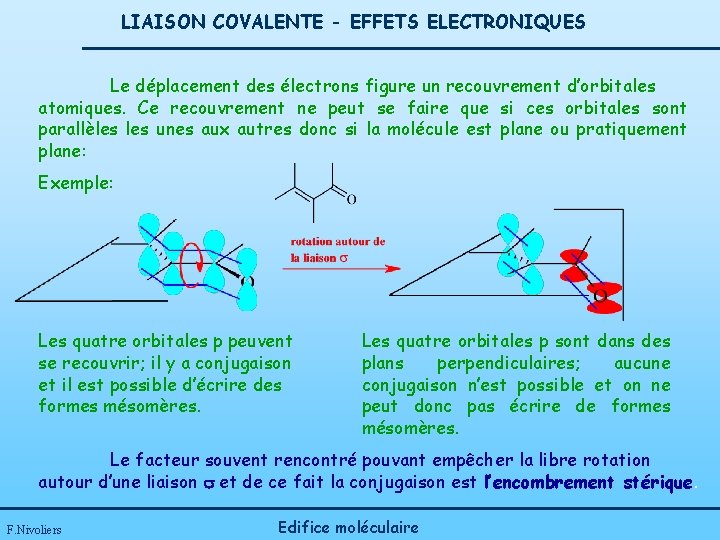
LIAISON COVALENTE - EFFETS ELECTRONIQUES Le déplacement des électrons figure un recouvrement d’orbitales atomiques. Ce recouvrement ne peut se faire que si ces orbitales sont parallèles unes aux autres donc si la molécule est plane ou pratiquement plane: Exemple: Les quatre orbitales p peuvent se recouvrir; il y a conjugaison et il est possible d’écrire des formes mésomères. Les quatre orbitales p sont dans des plans perpendiculaires; aucune conjugaison n’est possible et on ne peut donc pas écrire de formes mésomères. Le facteur souvent rencontré pouvant empêcher la libre rotation autour d’une liaison s et de ce fait la conjugaison est l’encombrement stérique. F. Nivoliers Edifice moléculaire

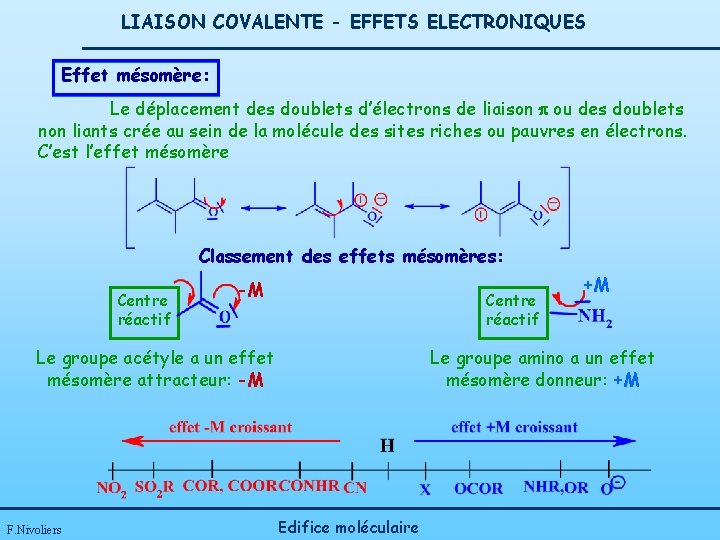
LIAISON COVALENTE - EFFETS ELECTRONIQUES Effet mésomère: Le déplacement des doublets d’électrons de liaison p ou des doublets non liants crée au sein de la molécule des sites riches ou pauvres en électrons. C’est l’effet mésomère Classement des effets mésomères: Centre réactif -M Centre réactif Le groupe acétyle a un effet mésomère attracteur: -M F. Nivoliers +M Le groupe amino a un effet mésomère donneur: +M Edifice moléculaire

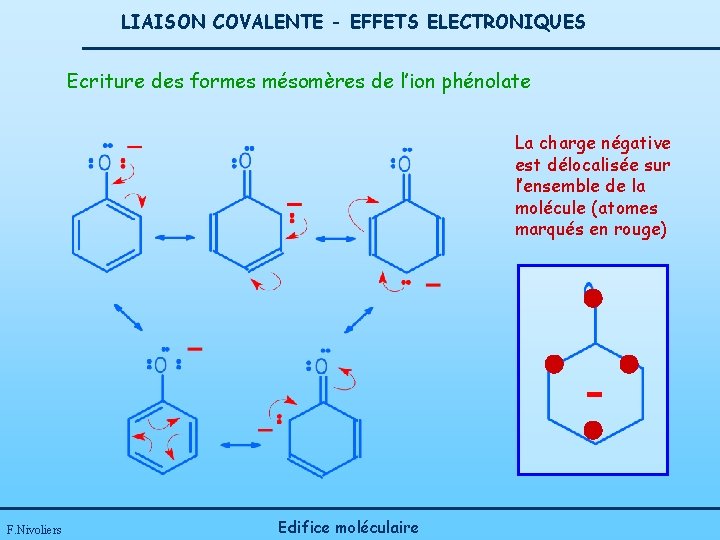
LIAISON COVALENTE - EFFETS ELECTRONIQUES Ecriture des formes mésomères de l’ion phénolate La charge négative est délocalisée sur l’ensemble de la molécule (atomes marqués en rouge) F. Nivoliers Edifice moléculaire

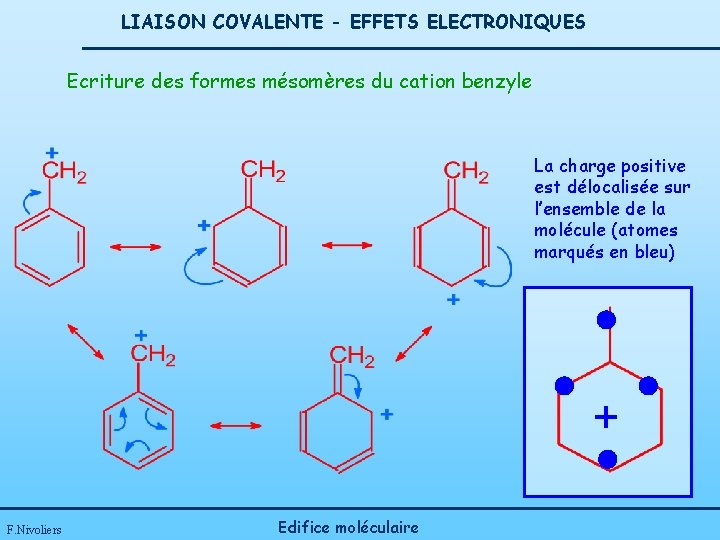
LIAISON COVALENTE - EFFETS ELECTRONIQUES Ecriture des formes mésomères du cation benzyle La charge positive est délocalisée sur l’ensemble de la molécule (atomes marqués en bleu) + F. Nivoliers Edifice moléculaire

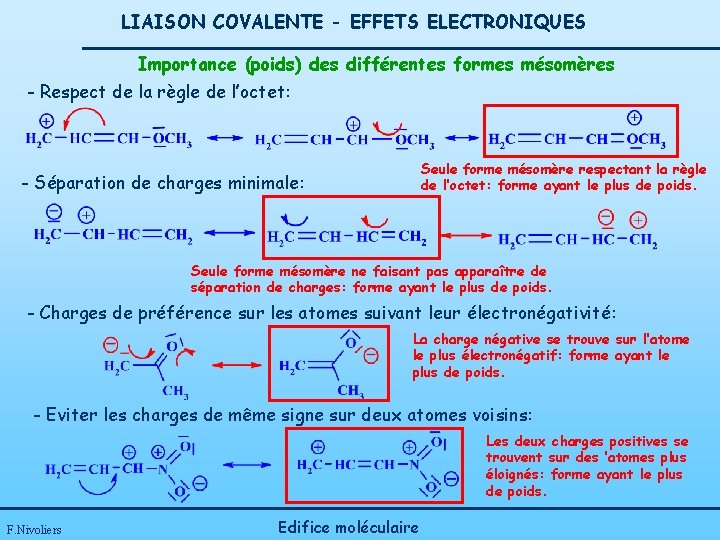
LIAISON COVALENTE - EFFETS ELECTRONIQUES Importance (poids) des différentes formes mésomères - Respect de la règle de l’octet: Seule forme mésomère respectant la règle de l’octet: forme ayant le plus de poids. - Séparation de charges minimale: Seule forme mésomère ne faisant pas apparaître de séparation de charges: forme ayant le plus de poids. - Charges de préférence sur les atomes suivant leur électronégativité: La charge négative se trouve sur l’atome le plus électronégatif: forme ayant le plus de poids. - Eviter les charges de même signe sur deux atomes voisins: Les deux charges positives se trouvent sur des ’atomes plus éloignés: forme ayant le plus de poids. F. Nivoliers Edifice moléculaire

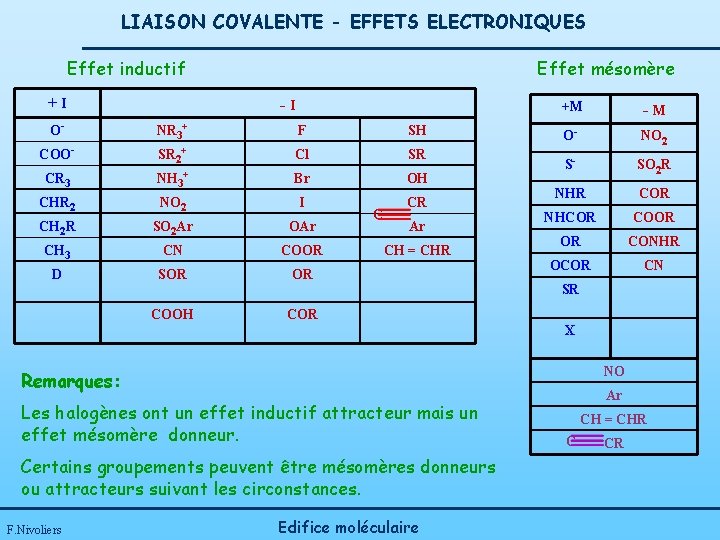
LIAISON COVALENTE - EFFETS ELECTRONIQUES Effet inductif +I Effet mésomère -I O- NR 3+ F SH COO- Cl SR CR 3 SR 2+ NH 3+ Br OH CHR 2 NO 2 I CR CH 2 R SO 2 Ar OAr CH 3 CN COOR D SOR OR COOH COR C Ar CH = CHR +M -M O- NO 2 S- SO 2 R NHR COR NHCOR COOR OR CONHR OCOR CN SR X NO Remarques: Les halogènes ont un effet inductif attracteur mais un effet mésomère donneur. Certains groupements peuvent être mésomères donneurs ou attracteurs suivant les circonstances. F. Nivoliers Edifice moléculaire Ar CH = CHR C CR

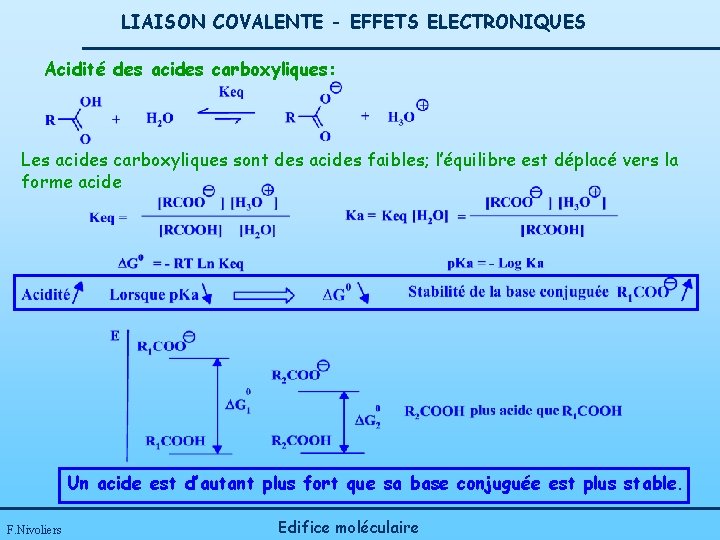
LIAISON COVALENTE - EFFETS ELECTRONIQUES Acidité des acides carboxyliques: Les acides carboxyliques sont des acides faibles; l’équilibre est déplacé vers la forme acide Un acide est d’autant plus fort que sa base conjuguée est plus stable. F. Nivoliers Edifice moléculaire

LIAISON COVALENTE - EFFETS ELECTRONIQUES Influence de l’effet inductif sur l’acidité des acides carboxyliques F. Nivoliers Edifice moléculaire

LIAISON COVALENTE - EFFETS ELECTRONIQUES Influence de l’effet inductif sur l’acidité des acides carboxyliques F. Nivoliers Edifice moléculaire

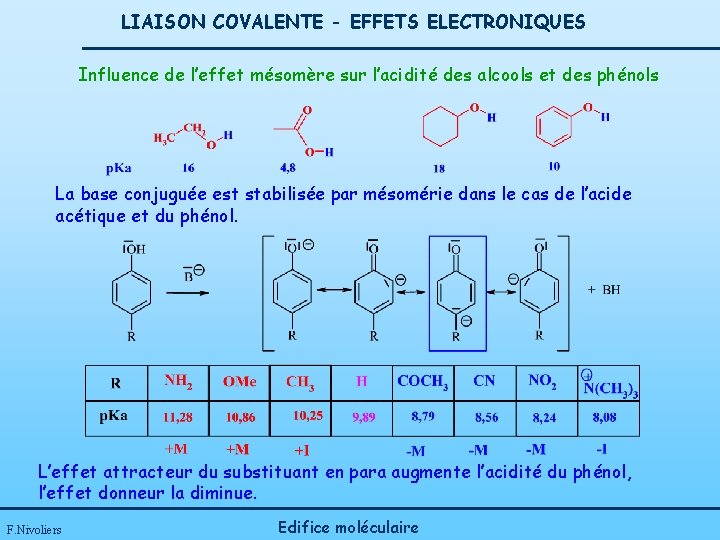
LIAISON COVALENTE - EFFETS ELECTRONIQUES Influence de l’effet mésomère sur l’acidité des alcools et des phénols La base conjuguée est stabilisée par mésomérie dans le cas de l’acide acétique et du phénol. L’effet attracteur du substituant en para augmente l’acidité du phénol, l’effet donneur la diminue. F. Nivoliers Edifice moléculaire

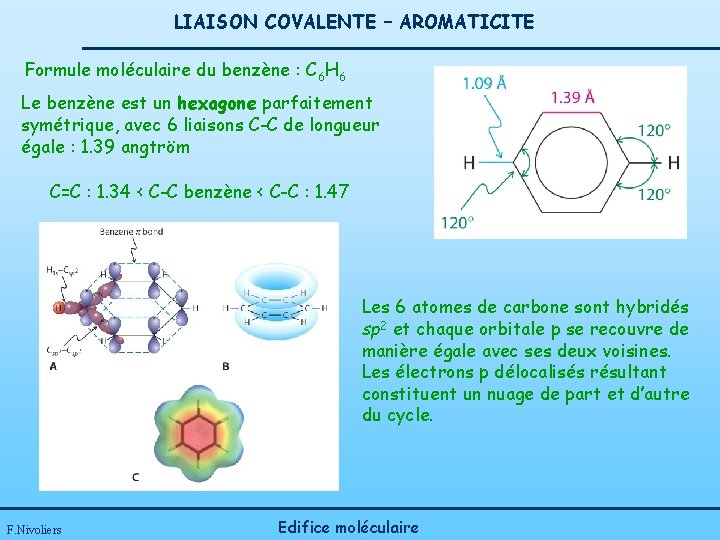
LIAISON COVALENTE – AROMATICITE Formule moléculaire du benzène : C 6 H 6 Le benzène est un hexagone parfaitement symétrique, avec 6 liaisons C-C de longueur égale : 1. 39 angtröm C=C : 1. 34 < C-C benzène < C-C : 1. 47 Les 6 atomes de carbone sont hybridés sp 2 et chaque orbitale p se recouvre de manière égale avec ses deux voisines. Les électrons p délocalisés résultant constituent un nuage de part et d’autre du cycle. F. Nivoliers Edifice moléculaire

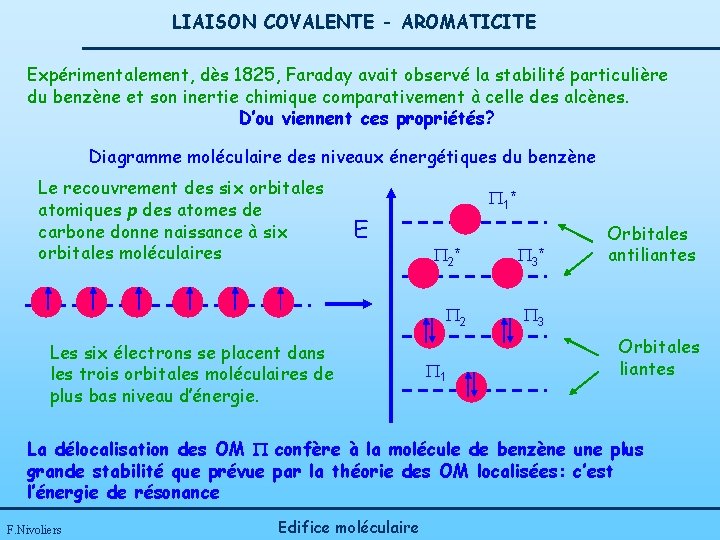
LIAISON COVALENTE - AROMATICITE Expérimentalement, dès 1825, Faraday avait observé la stabilité particulière du benzène et son inertie chimique comparativement à celle des alcènes. D’ou viennent ces propriétés? Diagramme moléculaire des niveaux énergétiques du benzène Le recouvrement des six orbitales atomiques p des atomes de carbone donne naissance à six orbitales moléculaires 1 * E Les six électrons se placent dans les trois orbitales moléculaires de plus bas niveau d’énergie. 2 * 3 * 2 3 1 Orbitales antiliantes Orbitales liantes La délocalisation des OM confère à la molécule de benzène une plus grande stabilité que prévue par la théorie des OM localisées: c’est l’énergie de résonance F. Nivoliers Edifice moléculaire

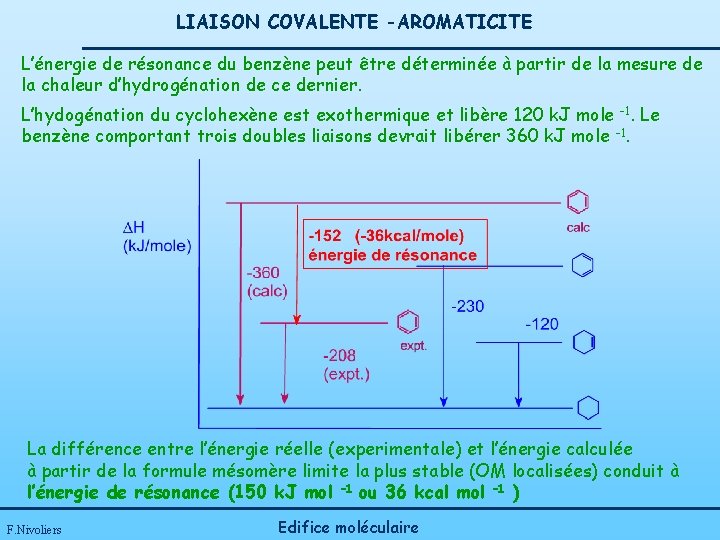
LIAISON COVALENTE -AROMATICITE L’énergie de résonance du benzène peut être déterminée à partir de la mesure de la chaleur d’hydrogénation de ce dernier. L’hydogénation du cyclohexène est exothermique et libère 120 k. J mole -1. Le benzène comportant trois doubles liaisons devrait libérer 360 k. J mole -1. La différence entre l’énergie réelle (experimentale) et l’énergie calculée à partir de la formule mésomère limite la plus stable (OM localisées) conduit à l’énergie de résonance (150 k. J mol – 1 ou 36 kcal mol – 1 ) F. Nivoliers Edifice moléculaire

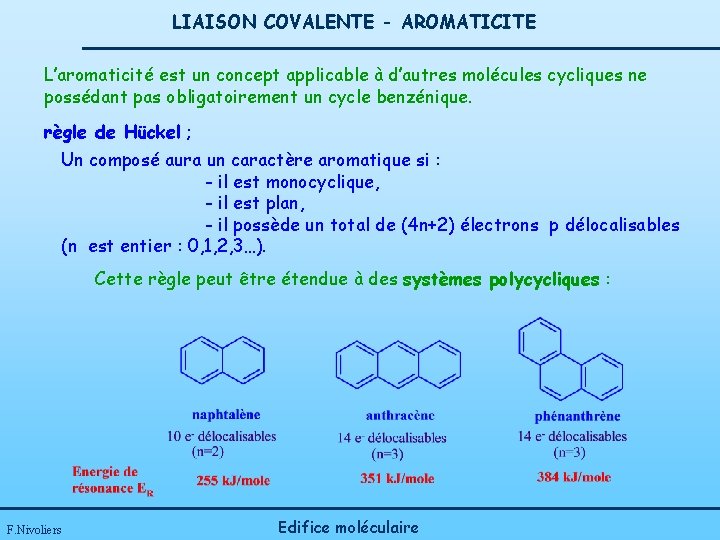
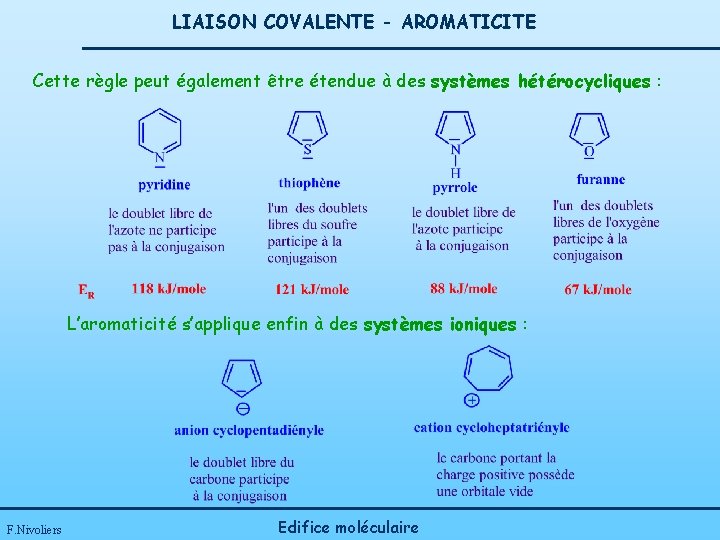
LIAISON COVALENTE - AROMATICITE L’aromaticité est un concept applicable à d’autres molécules cycliques ne possédant pas obligatoirement un cycle benzénique. règle de Hückel ; Un composé aura un caractère aromatique si : - il est monocyclique, - il est plan, - il possède un total de (4 n+2) électrons p délocalisables (n est entier : 0, 1, 2, 3…). Cette règle peut être étendue à des systèmes polycycliques : F. Nivoliers Edifice moléculaire

LIAISON COVALENTE - AROMATICITE Cette règle peut également être étendue à des systèmes hétérocycliques : L’aromaticité s’applique enfin à des systèmes ioniques : F. Nivoliers Edifice moléculaire

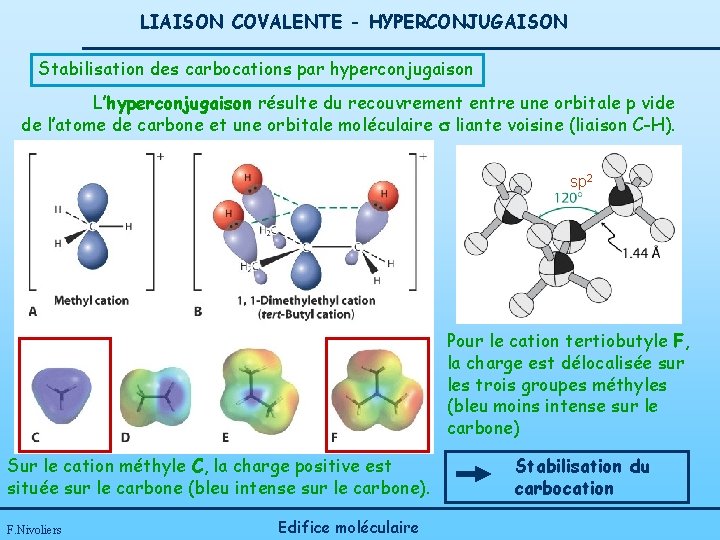
LIAISON COVALENTE - HYPERCONJUGAISON Stabilisation des carbocations par hyperconjugaison L’hyperconjugaison résulte du recouvrement entre une orbitale p vide de l’atome de carbone et une orbitale moléculaire s liante voisine (liaison C-H). sp 2 Pour le cation tertiobutyle F, la charge est délocalisée sur les trois groupes méthyles (bleu moins intense sur le carbone) Sur le cation méthyle C, la charge positive est située sur le carbone (bleu intense sur le carbone). F. Nivoliers Edifice moléculaire Stabilisation du carbocation

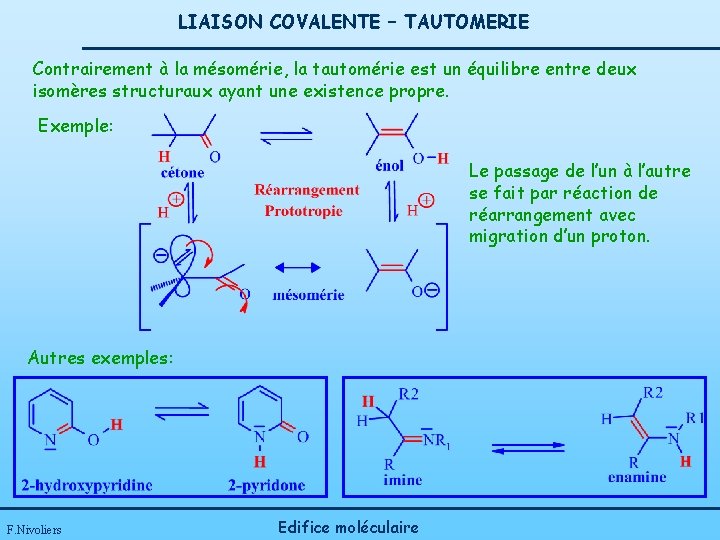
LIAISON COVALENTE – TAUTOMERIE Contrairement à la mésomérie, la tautomérie est un équilibre entre deux isomères structuraux ayant une existence propre. Exemple: Le passage de l’un à l’autre se fait par réaction de réarrangement avec migration d’un proton. Autres exemples: F. Nivoliers Edifice moléculaire

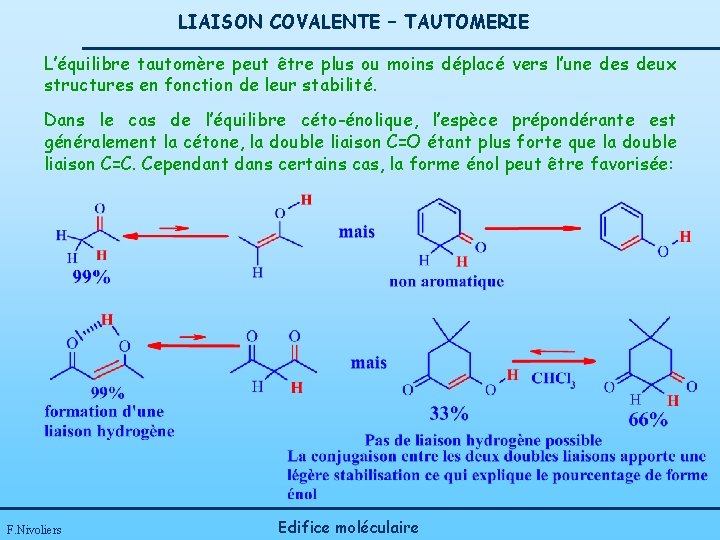
LIAISON COVALENTE – TAUTOMERIE L’équilibre tautomère peut être plus ou moins déplacé vers l’une des deux structures en fonction de leur stabilité. Dans le cas de l’équilibre céto-énolique, l’espèce prépondérante est généralement la cétone, la double liaison C=O étant plus forte que la double liaison C=C. Cependant dans certains cas, la forme énol peut être favorisée: F. Nivoliers Edifice moléculaire

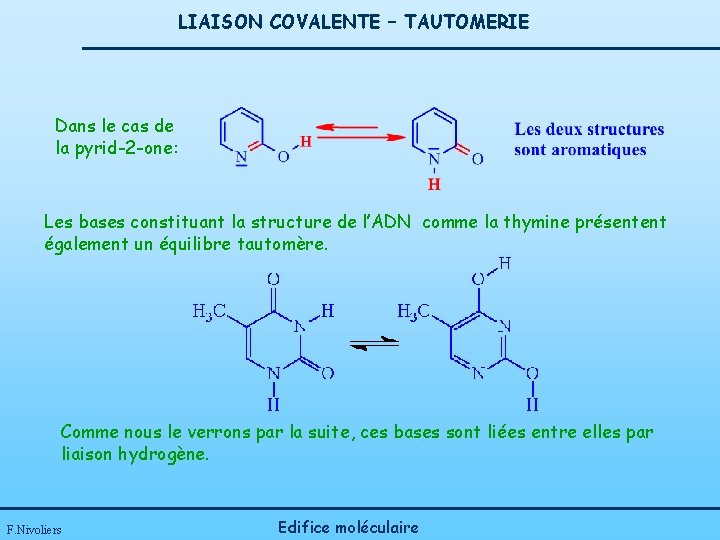
LIAISON COVALENTE – TAUTOMERIE Dans le cas de la pyrid-2 -one: Les bases constituant la structure de l’ADN comme la thymine présentent également un équilibre tautomère. Comme nous le verrons par la suite, ces bases sont liées entre elles par liaison hydrogène. F. Nivoliers Edifice moléculaire

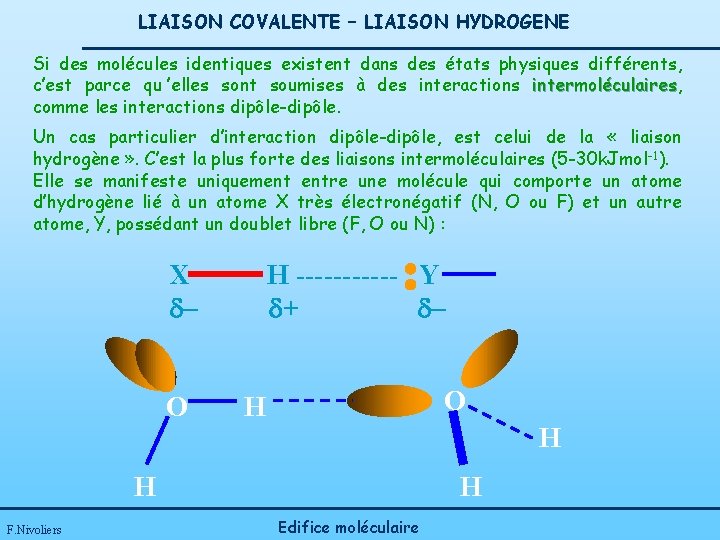
LIAISON COVALENTE – LIAISON HYDROGENE Si des molécules identiques existent dans des états physiques différents, c’est parce qu ’elles sont soumises à des interactions intermoléculaires, intermoléculaires comme les interactions dipôle-dipôle. Un cas particulier d’interaction dipôle-dipôle, est celui de la « liaison hydrogène » . C’est la plus forte des liaisons intermoléculaires (5 -30 k. Jmol -1). Elle se manifeste uniquement entre une molécule qui comporte un atome d’hydrogène lié à un atome X très électronégatif (N, O ou F) et un autre atome, Y, possédant un doublet libre (F, O ou N) : X d. O H ------ Y d+ d. O H H F. Nivoliers Edifice moléculaire

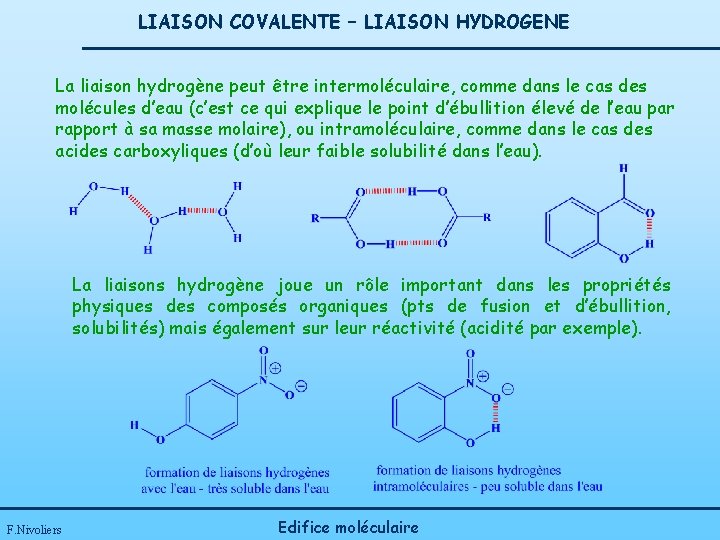
LIAISON COVALENTE – LIAISON HYDROGENE La liaison hydrogène peut être intermoléculaire, comme dans le cas des molécules d’eau (c’est ce qui explique le point d’ébullition élevé de l’eau par rapport à sa masse molaire), ou intramoléculaire, comme dans le cas des acides carboxyliques (d’où leur faible solubilité dans l’eau). La liaisons hydrogène joue un rôle important dans les propriétés physiques des composés organiques (pts de fusion et d’ébullition, solubilités) mais également sur leur réactivité (acidité par exemple). F. Nivoliers Edifice moléculaire

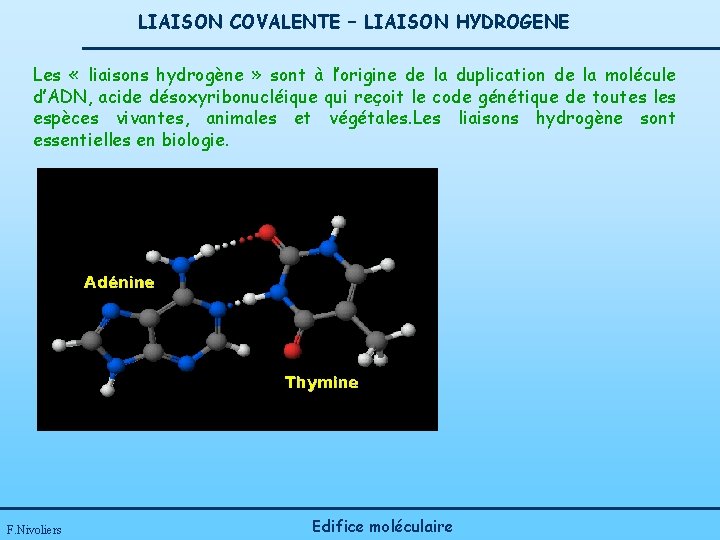
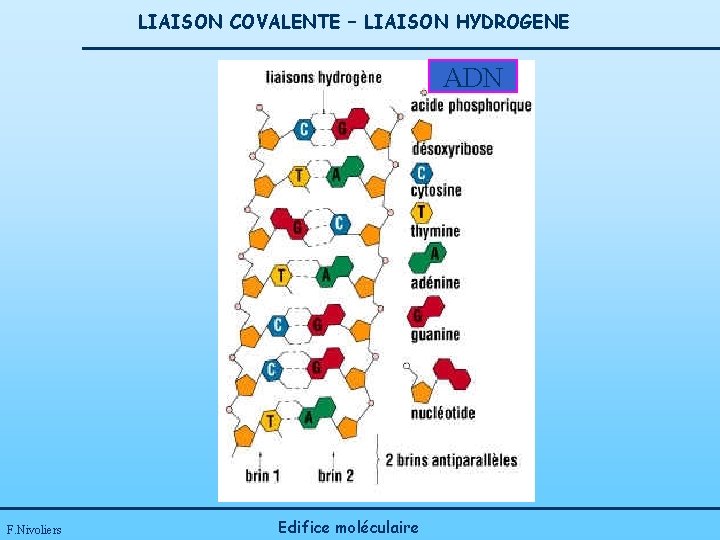
LIAISON COVALENTE – LIAISON HYDROGENE Les « liaisons hydrogène » sont à l’origine de la duplication de la molécule d’ADN, acide désoxyribonucléique qui reçoit le code génétique de toutes les espèces vivantes, animales et végétales. Les liaisons hydrogène sont essentielles en biologie. F. Nivoliers Edifice moléculaire

LIAISON COVALENTE – LIAISON HYDROGENE ADN F. Nivoliers Edifice moléculaire
 Les effets électroniques
Les effets électroniques Effet mésomère attracteur
Effet mésomère attracteur échéance moyenne formule
échéance moyenne formule Composition atomes
Composition atomes Atomes d'oxygène
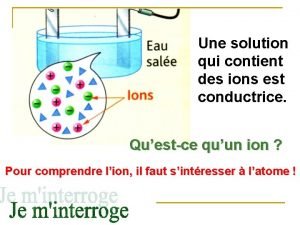
Atomes d'oxygène Les composés ioniques
Les composés ioniques Glissement métacognitif
Glissement métacognitif Les effets de la louange en actes 16 25-26
Les effets de la louange en actes 16 25-26 Les effets de commerce
Les effets de commerce Lorsque le ciel retentit de louanges
Lorsque le ciel retentit de louanges Les tableaux a deux dimension en algorithme
Les tableaux a deux dimension en algorithme Jeanne fine
Jeanne fine Quelles sont les deux phases de la bataille de verdun
Quelles sont les deux phases de la bataille de verdun Infinitif ou subjonctif reliez les deux sequences
Infinitif ou subjonctif reliez les deux sequences Adverbes de liaison
Adverbes de liaison Hyperhédonie définition
Hyperhédonie définition Cholangite lymphocytaire chat
Cholangite lymphocytaire chat Abilify effets positifs
Abilify effets positifs Synerboost effets secondaires
Synerboost effets secondaires Alpha bloquant effets secondaires
Alpha bloquant effets secondaires Romarinex classique
Romarinex classique Beano effets secondaires
Beano effets secondaires Clomipramine toc
Clomipramine toc Atripla effets secondaires
Atripla effets secondaires Resyl plus effets secondaires
Resyl plus effets secondaires Ezetimbre
Ezetimbre Sustancias ionicas
Sustancias ionicas Regla del octeto ejemplos
Regla del octeto ejemplos Carga formal formula
Carga formal formula