Unit 1 Les Atomes les lments et les













- Slides: 14

Unité 1 – Les Atomes, les Éléments, et les Composés Chapitre 3 – Les composés : une combinaison d’éléments

Les Composés • Tous les éléments qui ne sont pas des gaz nobles doivent essayer de trouver des façons de devenir plus stable comme les gaz nobles. • Un Compose est une substance pur qui est constituée de deux ou de plusieurs éléments différents combinés chimiquement de manière très précise

Les Composés • Les atomes sont reliés entre eux par des liaisons chimiques. • Il y a deux types de composés : – Les Composés Covalent – Les Composés Ioniques

Les Composés Covalent • Les atomes se combinent en partageant des électrons afin de former des molécules. • Une molécule est un groupe d’atomes liés ensemble et partageant une ou plusieurs paires d’électrons • Formé seulement par des non-métaux • Ils ne conduisent pas l’électricité. • Peuvent être à l’état solide, liquide or gazeux à la température ambiante • Ex: L’eau – H 2 O, le Dioxyde de Carbone CO 2

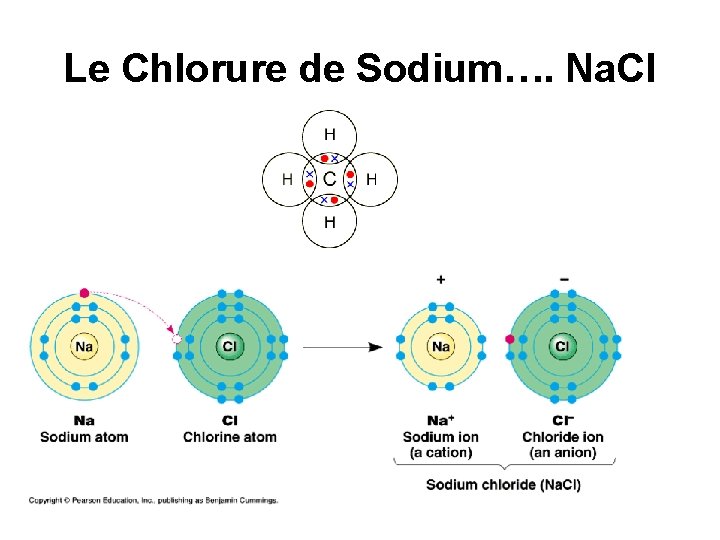
Les Composés Ioniques • • Les atomes gagnent ou perdent des électrons afin de former des ions Tous les ions positifs attirent tous les ions négatifs présents n’importe où dans le même cristal Formé par des métaux et des non-métaux Tous sont solides à la température ambiante Ils ont des points de fusion et d’ébullition élèves. Ils conduisent l’électricité quand ils sont dissous dans l’eau ou lorsqu’ils sont fondus. Aussi nommé les sels Ex: le Sel - Na. Cl, le carbonate de calcium Ca. Co 3

Le Chlorure de Sodium…. Na. Cl

Les Noms des Composés Chaque composé a • Un nom qui indique les types d’ions ou d’atomes qu’il contient. • Un formule chimique qui donne la proportion de ces ions ou de ces atomes. – On les a relie par la préposition de

Les Règles pour Écrire le Nom des Composés Ioniques Des Étapes pour écrire le nom 1. Nomme l’ion non métallique en ajoutant le suffixe ure a la racine du nom de l’élément. Inscris oxyde s’il s’agit de l’oxygène. 2. Nomme L’ion Métallique 3. Écris le nom du composé. ***Regarde page 82 pour des exemples ***Le nom du première ion porte le suffixe ure ( ou yde dans le cas d’oxygène), tandis que le nom de seconde ion reste inchangé.

Les Règles pour Écrire le Nom des Composés Covalents Des Étapes pour écrire le nom 1. Nomme le seconde élément en y ajoutant le suffixe –ure (oxygène devient oxyde). 2. Ajoute un préfixe a chaque élément pour indiquer le nombre d’atomes. 3. Nomme le premier élément. 4. Écris le nom du composé. ***Regarde page 83 pour des exemples ***Les atomes deviennent toujours d’éléments nonmétalliques.

Les Changements Physiques • L’apparence d’une substance peut changer, MAIS les liaisons retenant les atomes ensemble dans les molécules et les ions n’ont pas été brisés et il n’y a pas eu formation de nouvelles liaisons. • Ne modifie pas l’identité d’une substance • Normalement ils sont facile à inverser

Les Changements Chimiques • Produit de nouvelles substances ayant des propriétés nouvelles, perceptibles ou non. • Caractérisé par la formation de nouvelles liaisons pendant que d’autres se brisent • ** On peut écrire les équations chimiques pour ______ les changements chimiques • ** il y a 5 manifestations indiquant qu’un changement chimique a eu lieu

Les Changements Chimiques • Les équations chimiques, par exemple, l’eau 2 H₂ + O₂ → 2 H₂O les réactifs les produits • Dans une réaction chimique: – la masse des réactifs = la masse des produits • Les éléments sont préservé mais pas les composés

Les 5 manifestations d’un Changement Chimique 1. Changement du couleur 2. Production (ou absorption) de chaleur, de lumière et du bruit 3. Formation de bulles de gaz 4. Formation possible d’un précipité 5. Difficulté d’inverser le processus

L’utilisation des changements chimiques 1. La combustion 2. Traiter ou tanner la peau 3. De confectionner des teintures et des médicaments a partir des plantes 4. Conserver la nourriture 5. L’Utilisation du graisse comme l’huile des lampes et la fabrication du savon