LES EFFETS ELECTRONIQUES ET STERIQUES 1 Effet inductif






- Slides: 9

LES EFFETS ELECTRONIQUES ET STERIQUES

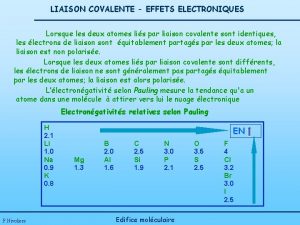
1 - Effet inductif ou inducteur ( ± I ) Il est une extension de la polarisation aux chaînes de liaisons covalentes ( liaisons s ). Représenté par une flèche au milieu de la liaison orientée vers l’atome ou le groupe d’atomes électrons attracteurs, son intensité s’annule pratiquement au 3 e atome de carbone. Halogène = attracteur Métal = répulsif Les effets inductifs sont additifs et influencent les propriétés physicochimiques, ( m, p. Ka, sites électrophiles/nucléophiles…).

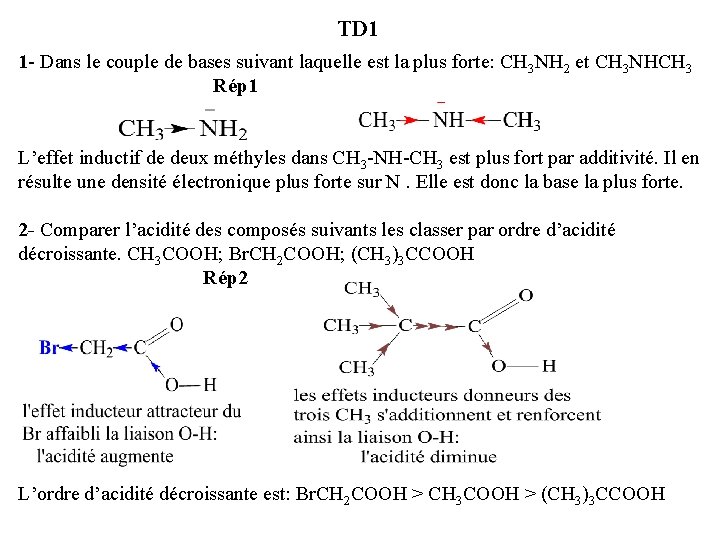
TD 1 1 - Dans le couple de bases suivant laquelle est la plus forte: CH 3 NH 2 et CH 3 NHCH 3 Rép 1 L’effet inductif de deux méthyles dans CH 3 -NH-CH 3 est plus fort par additivité. Il en résulte une densité électronique plus forte sur N. Elle est donc la base la plus forte. 2 - Comparer l’acidité des composés suivants les classer par ordre d’acidité décroissante. CH 3 COOH; Br. CH 2 COOH; (CH 3)3 CCOOH Rép 2 L’ordre d’acidité décroissante est: Br. CH 2 COOH > CH 3 COOH > (CH 3)3 CCOOH

2 - Effet mésomère ( ) Il est consécutif à la délocalisation des électrons p ou p libres contribuant à la formation des structures « limites » (ou résonantes ou mésomères). L’effet mésomère est représenté par une flèche courbe traduisant le déplacement des électrons. On relie les structures mésomères par une flèche à double sens ( ) - La délocalisation implique une stabilisation par énergie de résonnance c’à d que les mécanismes à plusieurs formes mésomères sont favorisés - L’effet mésomère dans les structures conjuguées leur impose une planéité

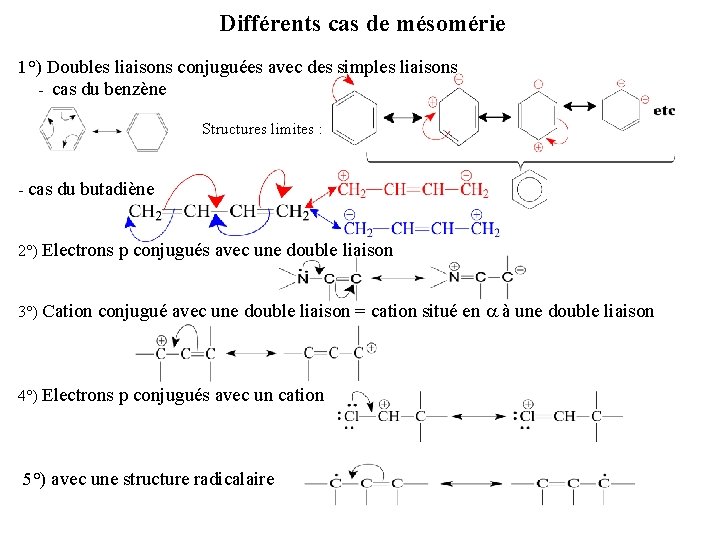
Différents cas de mésomérie 1°) Doubles liaisons conjuguées avec des simples liaisons - cas du benzène Structures limites : - cas du butadiène 2°) Electrons p conjugués avec une double liaison 3°) Cation conjugué avec une double liaison = cation situé en a à une double liaison 4°) Electrons p conjugués avec un cation 5°) avec une structure radicalaire

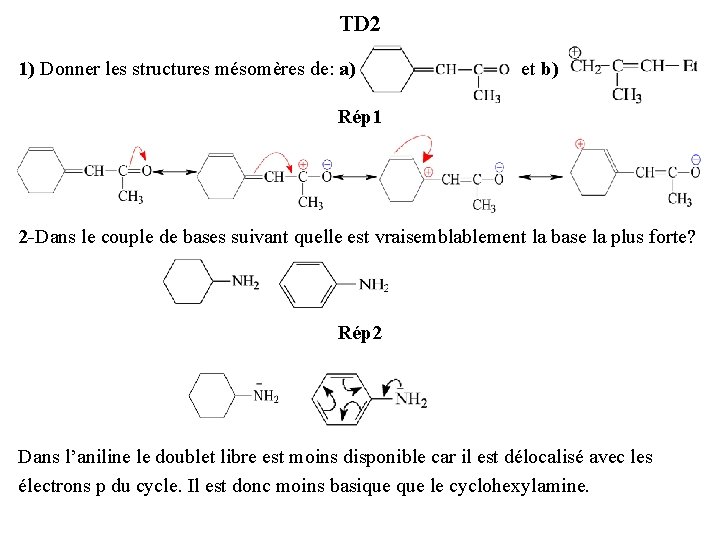
TD 2 1) Donner les structures mésomères de: a) et b) Rép 1 2 -Dans le couple de bases suivant quelle est vraisemblablement la base la plus forte? Rép 2 Dans l’aniline le doublet libre est moins disponible car il est délocalisé avec les électrons p du cycle. Il est donc moins basique le cyclohexylamine.

Compétition entre effet mésomère et effet inductif Si l’effet mésomère et l’effet inductif sont en compétition, l’effet mésomère l’emporte sur l’effet inductif. Il stabilise la structure et influence ses propriétés physico-chimiques. Effet M > effet I Exemple: Le chlorure de vinyle L’effet M l’emporte car les mécanismes à plusieurs formes sont favorisés

Effets stériques Ils sont consécutifs à la stéréochimie (volume des atomes, longueur des liaisons, angles de liaisons ou de torsion). Il en résulte l’accessibilité ou non des sites réactionnels, la proximité ou non et l’absence ou non de tension.

FIN