Le niveau chimique 2 Les atomes et les






















































- Slides: 63

Le niveau chimique § 2

Les atomes et les molécules • Chimie: science qui étudie la structure de la matière • Matière: substance qui occupe un volume et possède une masse • Masse: = quantité de matière, détermine le poids d’un objet sur la terre

Structure de l’atome (p. 29) • Atome = plus petite unité de matière stable • Composé de particules subatomiques: • Protons charge positive • Neutrons • Électrons charge négative • Les atomes s’attirent en fonction de leurs charges

• Atome = système solaire miniature • L’atome est formé d’un noyau et d’un nuage électronique Protons et neutrons au centre de l’atome, dans le noyau ( dense, charge positive ) Électrons tournent autour du noyau ( charge négative) = nuage électronique La plus grande partie du volume d’un atome est vide, presque toute sa masse est concentrée dans le noyau qui se trouve au centre

Les molécules (p. 29) • Molécule: - interaction entre deux atomes - création d’une structure plus grosse et plus complexe

Principaux éléments du corps humain • p. 31 • 13 éléments les plus courants • Oligoéléments • Connaitre le symbole chimique (13 él. ) • Pouvoir citer quelques oligoéléments

Électrons / niveaux d’énergie • Les atomes sont électriquement neutres • Augmentation du numéro atomique • Nuage électronique / séquence structurée du niveau d’énergie • Trajet complexe autour du noyau • Première couche / niveau d’énergie le plus bas

Éléments réactifs • Niveau d’énergie le plus externe = surface de l’atome • Niveaux d’énergie incomplets = recherche de stabilité en complétant le niveau d’énergie externe • Niveau d’énergie externe complet = atome stable et réagissant peu avec les autres atomes

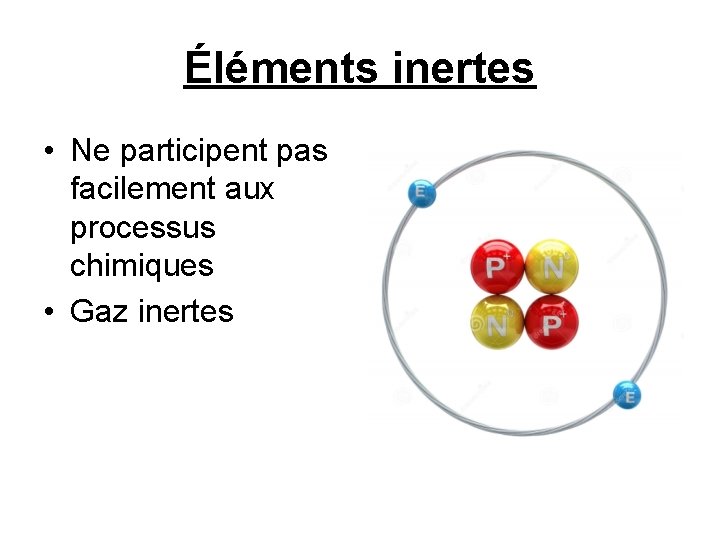
Éléments inertes • Ne participent pas facilement aux processus chimiques • Gaz inertes

Éléments réactifs / stabilité • Les éléments réactifs / niveau d’énergie incomplet / interaction ou combinaison facile avec d’autres atomes • Stabilité = gagner, perdre ou mettre en commun électron de la couche externe • Perte électron au niveau d’énergie ext. = atome n’est plus électriquement neutre (possède plus de protons que d’électrons) • Atome charge nette positive = ion positif = cation • p. 33

Éléments réactifs / stabilité • Compléter le niveau d’énergie ext. • Obtenir des électrons auprès d’autres atomes • N’est plus électriquement neutre (possède plus d’électrons que de protons) • Atome charge nette négative = ion négatif = anion

Liaisons chimiques • Interactions qui stabilisent le niveau d’énergie ext. • Retiennent ensemble les atomes lorsque la réaction est terminée • Ioniques et covalentes • Liaison chimique = nouvelles entités chimiques crées = molécules et composés • Composé: substance chimique composée de deux ou plusieurs atomes différents

Liaisons ioniques • Attraction électrique anions / cations • Transfert d’un ou plusieurs électrons - atome perdant - atome gagnant

Liaisons covalentes • Mise en commun des électrons avec d’autres atomes • Molécule = structure chimique d’atomes réunis par une liaison covalente • Molécule non polaire = ne possède pas de charge • Hydrogène, oxygène, dioxyde de carbone • p. 35

Liaisons covalentes avec partage inégal d’électrons • Ex. molécule d’eau (H 2 O) • Molécule polaire (H lég + /O lég -) • Il y a deux atomes H (charges lég +) qui vont être attirées par des charges lég – • Changement de la forme des molécules ou rapprochement des molécules voisines • Liaisons hydrogènes

Les réactions chimiques (p. 37) • Création de nouvelles liaisons entre des atomes • Les réactifs sont réorganisés pour former de nouvelles substances : les produits • Métabolisme = ensembles des réactions chimiques dans les cellules et les tissus du corps • Cellule = usine de produits chimiques

Travail / énergies • Travail: mouvement d’un objet ou changement de la structure physique • Énergie: capacité à effectuer un travail • Énergie cinétique: mouvement • Énergie potentielle: sous forme stockée

Énergie d’activation / enzymes / catalyseurs (p. 39) • Énergie d’activation: quantité d’énergie nécessaire pour activer une réaction • Enzymes: protéines particulières qui interviennent dans la plupart des réactions complexes de l’organisme, facilitent les réactions chimiques, font parties des catalyseurs • Catalyseurs: accélèrent les réactions chimiques, sans être modifiés • Les réactions enzymatiques sont en général réversibles

La voie métabolique • • Réactions complexes néc. à la vie Suite d’étapes reliées Régies par une enzyme précise Énergie d’activation / déclenchement d’une réaction chimique • Réactions exothermiques / endothermiques

Types de réactions chimiques • Dégradation, hydrolyse, catabolisme • Synthèse, synthèse par déshydratation, anabolisme, métabolisme • Échange • p. 40 -41

Eau • Le plus important et le plus abondant dans le corps • Env. 2/3 masse corporelle • Variation de la quantité d’eau dans le corps = peut avoir des conséquences fatales


Propriétés de l’eau • • Lubrification Réactivité Grande capacité thermique Solubilité

Lubrification • Peu de friction entre les molécules d’eau • Mince couche d’eau entre deux surfaces = diminution importante de la friction • L’eau réduit la friction dans les articulations et les cavités corporelles

réactivité • Des réaction chimiques se produisent dans l’eau • Les molécules d’eau participent à certaines réactions (hydrolyse, synthèse) • • exemples digérer des aliments permet le transport des nutriments, des déchets support des sécrétions (salive, mucus, suc gastrique, bile ), des hormones

Grande capacité thermique • Capacité d’absorber de la chaleur et de la conserver (liaisons hydrogène) • Vapeur d’eau • Transpiration • Inertie thermique

Grande capacité thermique • Exemples: • absorbe ou dégage une grande quantité de chaleur avant que la T° corporelle ne change de façon marquée • empêche les changements soudains de température (facteurs externes, rayons du soleil, exposition au vent, ou processus internes, activité musculaire intense qui libère une importante quantité de chaleur) • permet au corps de transpirer, en s’évaporant l’eau prélève de la chaleur, refroidit la peau et permet ainsi au corps de maintenir une température constante

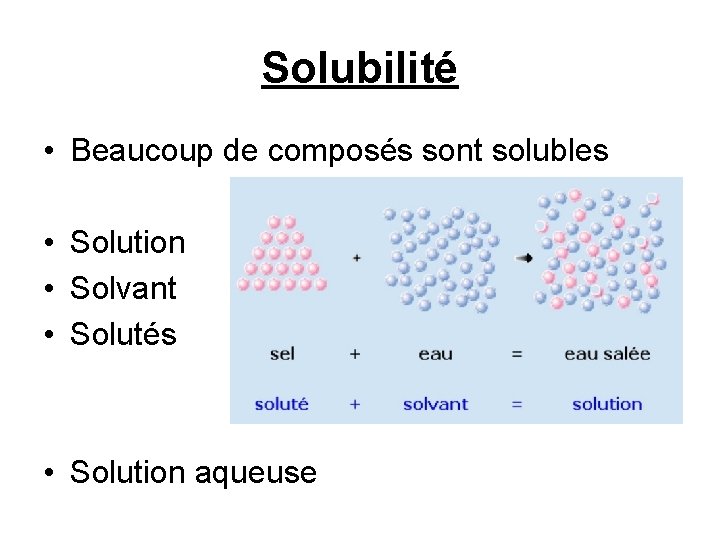
Solubilité • Beaucoup de composés sont solubles • Solution • Solvant • Solutés • Solution aqueuse

L’eau • l’eau n’est pas nécessaire à la vie, l’eau c’est la vie (A. de Saint-Exupéry) • l’eau facilite le déroulement de tous les processus biologiques et sans elle la vie n’est pas possible • l’eau du corps, donc 99% de nos cellules se renouvelle tous les 10 jours • l’eau que l’on ingère quotidiennement deviendra l’eau qui nous constitue • l’eau de notre corps est notre mer intérieure

Rose Lynn Fischer analyse les larmes • Larmes lors d’une catastrophe nationale • Larmes de changement

Larmes • Pleurs • Larmes de rire jusqu’aux pleurs

Larmes du rire aux larmes de douleur larmes dues aux oignons

Masaru Emoto

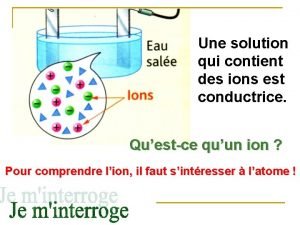
Électrolytes (p. 44) • = composés solubles(dont les ions) • peuvent conduire un courant électrique dans une solution • les forces électriques qui traversent les membranes cellulaires ont une incidence sur le fonctionnement de toutes les cellules • interviennent par exemple dans - la propagation de l’influx nerveux - la contraction musculaire, la coagulation sanguine - le transport d’O 2, la perméabilité des cellules - le métabolisme et bien d’autres réactions

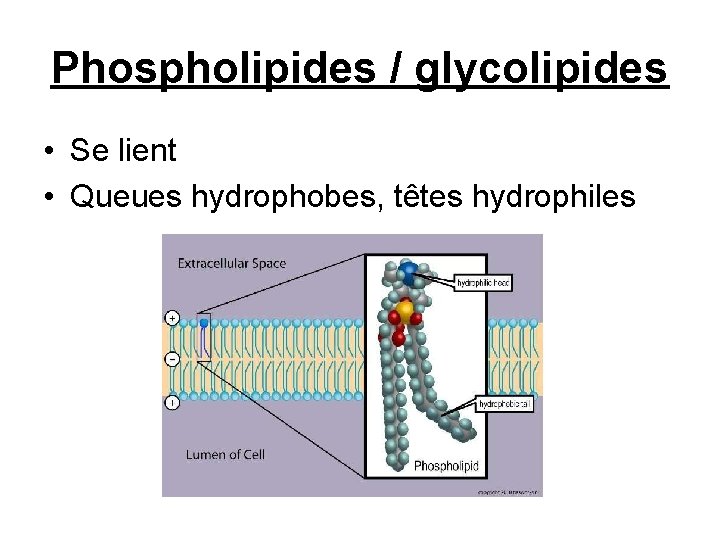
Hydrophiles / hydrophobes • Molécules hydrophiles: interagissent facilement avec les molécules d’eau, se lient fortement à l’eau (ex: glucose) • Molécules hydrophobes: ne se dissolvent pas lorsqu’elles sont exposées à l’eau, elles n’interagissent pas facilement avec les molécules d’eau (ex: huiles et graisses)

Concentration • = quantité de soluté par unité de volume de solution (gr/litre) • Une variation d’une de concentration en dehors des valeurs normales peut être une indication d’une maladie • Ex: analyse sanguine

Régulation du p. H (p. 46) • La régulation du p. H des liquides corporels est essentielle au maintien de l’homéostasie • Ion hydrogène H+, extrêmement réactif • Concentration des ions hydrogène dans les liquides corporels influe sur les processus physiologiques • Échelle de p. H: de 0 à 14

p. H du sang • Varie normalement entre 7, 35 et 7, 45 • Fluctuations du p. H • Acidose: baisse du p. H sanguin en dessous de 7, 35 • Alcalose: p. H anormalement élevé, audelà de 7, 45 • p. H supérieur à 7, 8: contractions des muscles squelettiques incontrôlables et constantes


Acide • • • Soluté qui se dissocie dans une solution Libère des ions hydrogène Abaisse le p. H Donneur de protons Ex: acide chlorhydrique HCl = H+ et Cl-

Base • Soluté qui enlève des ions hydrogène dans une solution • Agit comme un accepteur de protons • Libère des ions hydroxyde (OH) forte affinité avec les ions hydrogène pour former des molécules d’eau

Les tampons • Composés qui stabilisent le p. H d’une solution • Enlèvent ou remplacent des ions hydrogène • Sont constitués d’acides et de bases faibles, ne se dissocient pas complètement • Les tampons et systèmes tampons des liquides corporels permettent de maintenir le p. H dans les limites normales

Sels • • Composé ionique formé soit d’un cation(+), sauf ion hydrogène d’un anion (-), sauf ion hydroxyde Sont maintenu par des liaison ioniques = se dissolvent complètement dans l’eau • Ex: Na. Cl

Métabolites / nutriments • Métabolites: molécules métabolisées à l’intérieur du corps humain • Nutriments: métabolites essentiels qui proviennent du régime alimentaire Deux grandes catégories: - Composés organiques - Composés inorganiques

Composés organiques • Contiennent toujours du carbone et de l’hydrogène, généralement aussi oxygène • Glucides, lipides, protéines et acides nucléiques (produits par les organismes vivants)

Composés inorganiques • La plupart n’ont pas le carbone et l’hydrogène comme principaux constituants structuraux • Oxygène, eau, acides forts, bases fortes, sels

Glucides • Sucres, amidon • Composent environ la moitié du régime alimentaire • Sources d’énergie (catabolisées plutôt que stockées) • Participent à la structure de certaines composantes cellulaires (membrane cellulaire) • Principaux glucides utiles à l’organisme (p. 50)

Lipides • Graisses, huiles, cires • La plupart sont insolubles dans l’eau, mécanismes spéciaux pour leur transport dans le sang • Dépôts de lipides = réserves d’énergie (homme: 12 -18% poids total, femme 18 -24%) • Principaux lipides utiles à l’organisme (p. 53)

Acide gras saturé / insaturé • Acide gras: longue chaine de carbone et atomes d’hydrogène(= queue), tête • Acide gras saturé: chaque atome de carbone de la queue possède quatre liaisons covalentes simple • Acide gras insaturé: une ou plusieurs liaisons covalentes simples sont remplacées par des liaisons covalentes doubles

Acide gras insaturé • Chaque atome de carbone avec une liaison covalente double se lie a une seul atome d’hydrogène (plutôt qu’à deux) • =changement de forme de la queue • =changement de manière dont l’organisme va métaboliser l’acide gras • Mono-insaturé: une liaison double • Polyinsaturé: plusieurs liaison double

Graisses • Les acides gras doivent se fixer au glycérol (composé) pour former des chaines • Monoglycéride: glycérol et un acide gras • Diglycéride: glycérol et deux acides gras • Triglycéride: glycérol et trois acides gras (graisses les plus courantes de l’organisme) • p. 63 lire et résumer le texte: «bonne nouvelle, tous les gras ne sont pas mauvais»

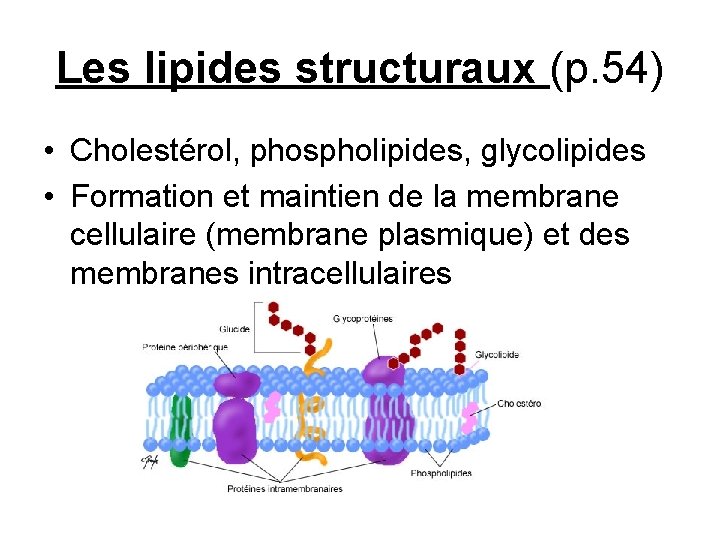
Les lipides structuraux (p. 54) • Cholestérol, phospholipides, glycolipides • Formation et maintien de la membrane cellulaire (membrane plasmique) et des membranes intracellulaires

Les stéroïdes • Grosses molécules de lipides • Structure particulière en forme d’anneaux de carbone • Cholestérol: entretien membrane plasmique, croissance et division de la cellule • Cortisol: hormone produite par les surrénales, rôle important lors de stress à long terme • Œstrogènes, testostérone: hormones sexuelles, régulation de la fonction sexuelle

Phospholipides / glycolipides • Se lient • Queues hydrophobes, têtes hydrophiles

Les protéines • Constituant organique le plus abondant dans le corps humain (20% du poids) • Nombreuses protéines différentes • Contiennent toutes du carbone, de l’oxygène et de l’azote, et év. un peu de soufre et phosphore • Composées de molécules organiques: acides aminés

Les acides aminés • 20 sont présents en grandes quantités dans l’organisme • Une protéine typique = 1000 a. a • Les plus grosses 100’ 000 ou plus • Liaison entre les a. a: liaison peptidique • Peptide: molécules formées de a. a • Dipeptide: molécule qui contient deux a. a • Tripeptide: trois a. a • Polypeptide: chaînes de peptides • Protéines: contient plus de 100 a. a

Dénaturation des proteines • T° corporelle dépasse les valeurs normales = changement de forme des protéines et détérioration de la fonction enzymatique • T° sup à 43° = issue fatale (mort) • Les variations importantes de p. H peuvent aussi dénaturer les protéines

Les enzymes (p. 58) • Sont des protéines qui assurent d’importantes fonctions de régulation • Enzymes spécifiques • Substrats: réactifs des réactions enzymatiques • Site actif • Complexe enzyme-substrat • Énergie d’activation / produit fini

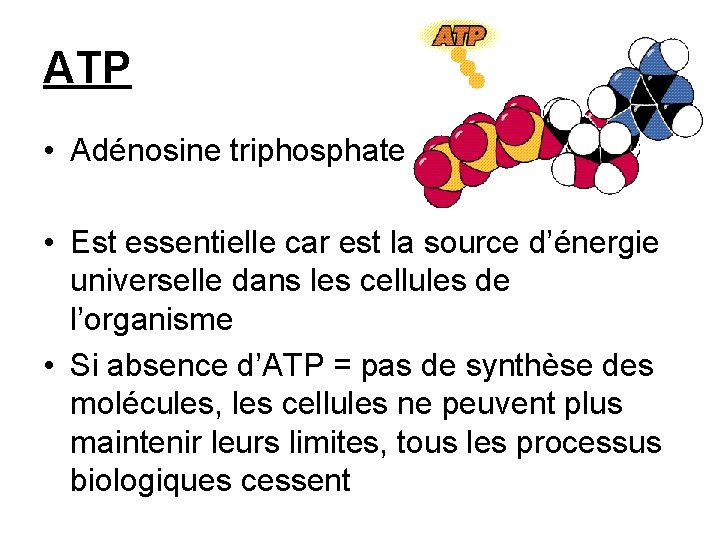
ATP: adénosine triphosphate • = énergie (c’est un composé de grande énergie qui contient des liaisons de grande énergie) • Rupture des liaisons covalentes = libération d’énergie • L’ATP fournit l’énergie nécessaire à de nombreuses fonctions vitales (contraction musculaire, synthèse des protéines, glucides, lipides)

ATP • Adénosine triphosphate • Est essentielle car est la source d’énergie universelle dans les cellules de l’organisme • Si absence d’ATP = pas de synthèse des molécules, les cellules ne peuvent plus maintenir leurs limites, tous les processus biologiques cessent

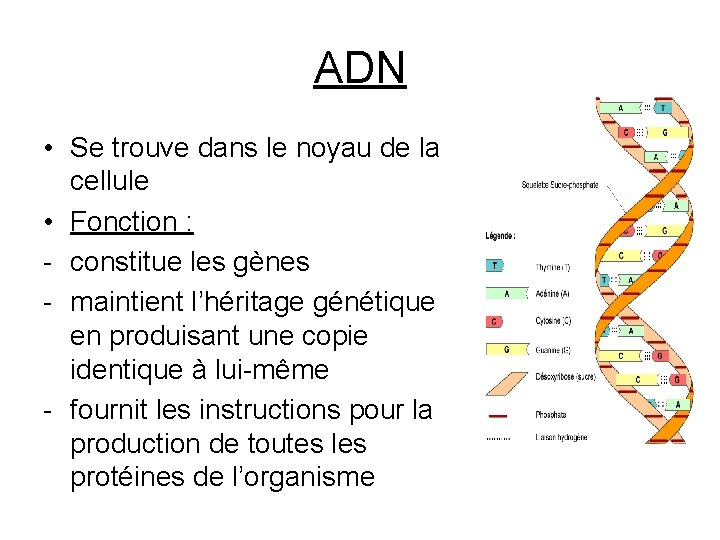
Acides nucléiques: ADN/ARN • ADN acide désoxyribonucléique • ARN acide ribonucléique • Rôle fondamental : stocker et transférer l’information (synthèse des protéines) • Sous-unité acides nucléiques: nucléotides • constituent les gênes qui déterminent quel type d’organisme nous sommes, notre croissance, notre développement • Lire attentivement p. 63 l’identification génétique

ADN • Se trouve dans le noyau de la cellule • Fonction : - constitue les gènes - maintient l’héritage génétique en produisant une copie identique à lui-même - fournit les instructions pour la production de toutes les protéines de l’organisme

ARN • Se trouve dans le cytoplasme de la cellule • Fonction : - assure la synthèse des protéines en suivant l’instruction de l’ADN
 Les composés ioniques
Les composés ioniques Composition atomes
Composition atomes Atomes d'oxygène
Atomes d'oxygène Potentiel chimique
Potentiel chimique Déplacement chimique
Déplacement chimique Formule chimique basalte
Formule chimique basalte Risque chimique définition
Risque chimique définition Molécule simple
Molécule simple Flu produit chimique
Flu produit chimique équilibre chimique
équilibre chimique Systme digestif
Systme digestif Traceur chimique
Traceur chimique Formule cuivre
Formule cuivre Procédé chimique
Procédé chimique Famille chimique
Famille chimique Affinité chimique
Affinité chimique Procédé chimique
Procédé chimique Les dérives du pétrole sont des matériaux synthétiques
Les dérives du pétrole sont des matériaux synthétiques Elmet berango
Elmet berango Famille chimique
Famille chimique Composition chimique du poisson
Composition chimique du poisson Club niveau
Club niveau Demi-fond eps nouveaux programmes
Demi-fond eps nouveaux programmes Niveau a0
Niveau a0 Trilvork werking
Trilvork werking Matresse
Matresse Dilemma sociaal werk
Dilemma sociaal werk Sadt niveau a0
Sadt niveau a0 Grafcet
Grafcet Lipome intradural
Lipome intradural Niveau sonore
Niveau sonore 1 jarige mbo opleiding niveau 2
1 jarige mbo opleiding niveau 2 Ligne de niveau
Ligne de niveau Niveau anglais terminale
Niveau anglais terminale Zelcom niveau
Zelcom niveau Niveau de granularité
Niveau de granularité Compressibilité des gaz niveau 2
Compressibilité des gaz niveau 2 Oefentoets anatomie niveau 3
Oefentoets anatomie niveau 3 Dpecf niveau
Dpecf niveau Curriculum niveau 3
Curriculum niveau 3 Examenopdracht ondernemend gedrag
Examenopdracht ondernemend gedrag 5 niveau de dépendance selon virginia henderson
5 niveau de dépendance selon virginia henderson Verkoopspecialist niveau 3
Verkoopspecialist niveau 3 Gemengd locatiesysteem
Gemengd locatiesysteem Exercice pendage
Exercice pendage Quidistance
Quidistance Niveau natation
Niveau natation Brain out niveau 25 morpion
Brain out niveau 25 morpion Aperitoneální
Aperitoneální Merkspecifiek niveau
Merkspecifiek niveau Grafcet en ladder
Grafcet en ladder Parts de les fulles
Parts de les fulles Trouvez les réponses. écrivez-les en chiffres (numbers).
Trouvez les réponses. écrivez-les en chiffres (numbers). Texte expressif exemple
Texte expressif exemple Les trois obstacles et les quatre démons
Les trois obstacles et les quatre démons La fin tragique de maître hauchecorne
La fin tragique de maître hauchecorne Les mots qu'on ne dit pas sont les fleurs du silence
Les mots qu'on ne dit pas sont les fleurs du silence Grand corps malade le train
Grand corps malade le train Mots variable et invariable
Mots variable et invariable Parts d una flor
Parts d una flor Fonction technique scooter
Fonction technique scooter Oh quel beau mystère amour merveilleux paroles
Oh quel beau mystère amour merveilleux paroles Les constellations les plus connues
Les constellations les plus connues Mot de relation
Mot de relation