La structure de la matire Evaluation diagnostique Acquis

























- Slides: 28

La structure de la matière Evaluation diagnostique Acquis du collège

Remarque : il peut y avoir plusieurs réponses possibles par proposition.

1. Comment sont réparties les charges dans l’atome de carbone ? + A + + C + B + + -+ + -- - -- + + + + + - - D - + + + - -

2. Le modèle de l’atome : associer chaque modèle au schéma correspondant. Modèle de Thomson (1897) : l’atome est constitué de deux parties : une positive (le noyau) et une négative (les électrons) ; les électrons baignent dans une « soupe » de charges positives. Modèle de Rutherford (1911) : les charges positives sont concentrées dans le noyau; les charges négatives gravitent autour du noyau. A -+ -+ - +- + -+ - B + - + + - -

3. Quelles sont les entités chimiques électriquement neutres ? La molécule d’eau L’ion chlorure L’atome d’oxygène L’ion fer II

4. Sur le document, combien y a-t-il : ► De molécules ? ► D’atomes ?

5. Quelle est la formule chimique de la molécule de dihydrogène ? H H 2 2 H H 2

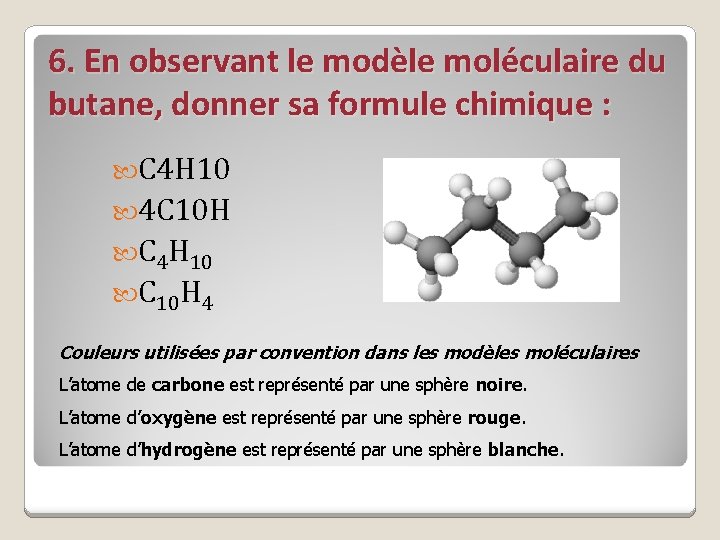
6. En observant le modèle moléculaire du butane, donner sa formule chimique : C 4 H 10 4 C 10 H C 4 H 10 C 10 H 4 Couleurs utilisées par convention dans les modèles moléculaires L’atome de carbone est représenté par une sphère noire. L’atome d’oxygène est représenté par une sphère rouge. L’atome d’hydrogène est représenté par une sphère blanche.

7. La molécule d’éthanol, de formule C 2 H 6 O, est constituée de : Un atome de carbone, deux atomes d’hydrogène et six atomes d’oxygène. Deux atomes de carbone, six atomes d’hydrogène et un atome d’oxygène. Un atome de carbone, un atome d’hydrogène et un atome d’oxygène.

8. La formule de l’ion cuivre II est : Cu 2+ 2+Cu Cu 2+ 2+ Cu

9. La représentation de l’atome d’oxygène est donnée ci-contre : - + + ++ + - Aide : un ion est formé à partir d’un atome qui a perdu ou gagné un ou plusieurs électrons. - - - Quelle est la représentation de l’ion oxygène, O 2− ? A - - + + ++ + - - + - + + ++ + B + + - - - C - - + + + - -

10. Quelle est la composition de l’ion sodium ? Information : l’atome de sodium contient 11 charges positives et 11 électrons - - - ++ + + ++ - - - L’ion sodium, Na+ contient : ………électrons ……… charges positives dans le noyau.

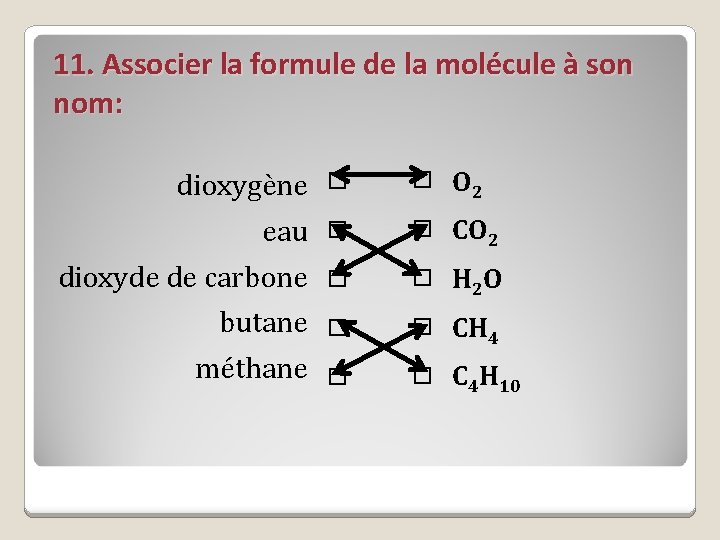
11. Associer la formule de la molécule à son nom: dioxygène O 2 eau CO 2 dioxyde de carbone H 2 O butane CH 4 méthane C 4 H 10

12. Associer la formule de l’ion à son nom : Ion hydrogène Ion sodium Cℓ – Fe 2+ Ion chlorure Cu 2+ Ion fer II HO – Ion fer III Fe 3+ Ion cuivre II Na+ Ion hydroxyde H+


La structure de la matière Correction Evaluation diagnostique Acquis du collège

1. Comment sont réparties les charges dans l’atome de carbone ? + A + + C + B + + -+ + -- - -- + + + + + - - D - + + + - -

2. Le modèle de l’atome : associer chaque modèle au schéma correspondant. Modèle de Thomson (1897) : l’atome est constitué de deux parties : une positive (le noyau) et une négative (les électrons) ; les électrons baignent dans une « soupe » de charges positives. Modèle de Rutherford (1911) : les charges positives sont concentrées dans le noyau; les charges négatives gravitent autour du noyau. A -+ -+ - +- + -+ - B + - + + - -

3. Quelles sont les entités chimiques électriquement neutres ? La molécule d’eau L’ion chlorure L’atome d’oxygène L’ion fer II

4. Sur le document, combien y a-t-il : ► De molécules ? Deux ► D’atomes ? Cinq atomes de carbone Quatorze atomes d’hydrogène soit dix-neuf atomes

5. Quelle est la formule chimique de la molécule de dihydrogène ? H H 2 2 H H 2

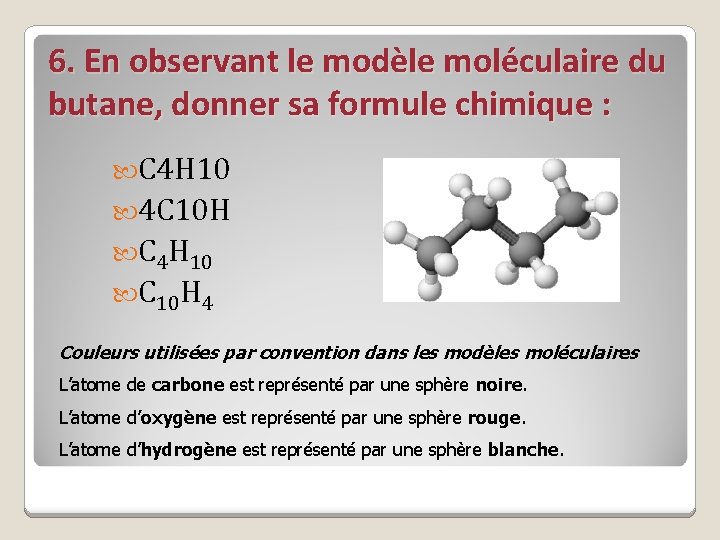
6. En observant le modèle moléculaire du butane, donner sa formule chimique : C 4 H 10 4 C 10 H C 4 H 10 C 10 H 4 Couleurs utilisées par convention dans les modèles moléculaires L’atome de carbone est représenté par une sphère noire. L’atome d’oxygène est représenté par une sphère rouge. L’atome d’hydrogène est représenté par une sphère blanche.

7. La molécule d’éthanol, de formule C 2 H 6 O, est constituée de : Un atome de carbone, deux atomes d’hydrogène et six atomes d’oxygène. Deux atomes de carbone, six atomes d’hydrogène et un atome d’oxygène. Un atome de carbone, un atome d’hydrogène et un atome d’oxygène.

8. La formule de l’ion cuivre II est : Cu 2+ 2+Cu Cu 2+ 2+ Cu

9. La représentation de l’atome d’oxygène est donnée ci-contre : - + + ++ + - Aide : un ion est formé à partir d’un atome qui a perdu ou gagné un ou plusieurs électrons. - - - Quelle est la représentation de l’ion oxygène, O 2− ? A - - + + ++ + - - + - + + ++ + B + + - - - C - - + + + - -

10. Quelle est la composition de l’ion sodium ? Information : l’atome de sodium contient 11 charges positives et 11 électrons - - - ++ + + ++ - - - L’ion sodium, Na+ contient : 10 électrons 11 charges positives dans le noyau. -

11. Associer la formule de la molécule à son nom: dioxygène O 2 eau CO 2 dioxyde de carbone H 2 O butane CH 4 méthane C 4 H 10

12. Associer la formule de l’ion à son nom : Ion hydrogène Ion sodium Cℓ – Ion chlorure Cu 2+ Ion fer II HO – Ion fer III Fe 3+ Ion cuivre II Na+ Ion hydroxyde Fe 2+ H+