ETERI EPOSSIDI SOLFURI Eteri Nomenclatura IUPAC come alcossi

























- Slides: 71


ETERI EPOSSIDI SOLFURI

Eteri

Nomenclatura

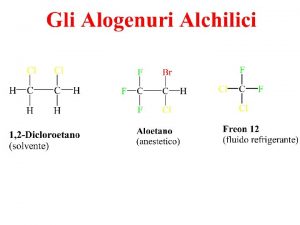
IUPAC come alcossi derivati degli alcani o con il nome dei gruppi alchilici seguiti dalla parole etere CH 3 OCH 2 CH 3 metossietano etil metil etere CH 3 CH 2 OCH 2 CH 3 ethoxyethane dietil etere CH 3 CH 2 OCH 2 CH 2 Cl 1 -cloro-3 -etossipropano 3 -cloropropil etere

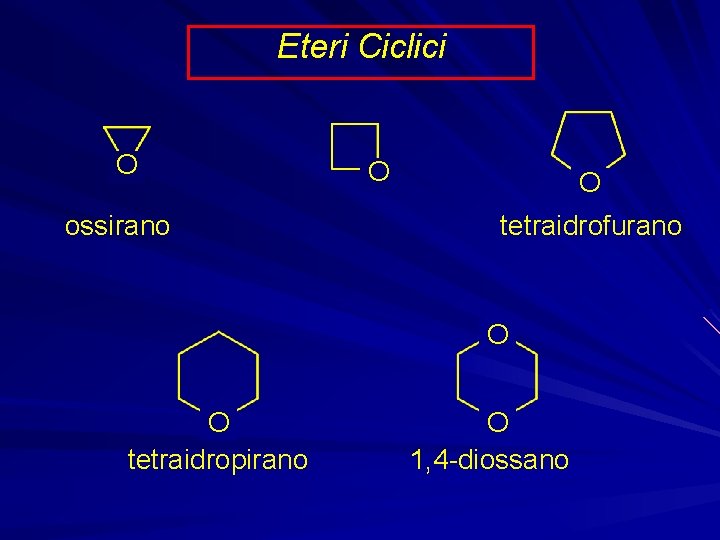
Eteri Ciclici O ossirano O O tetraidrofurano O O tetraidropirano O 1, 4 -diossano

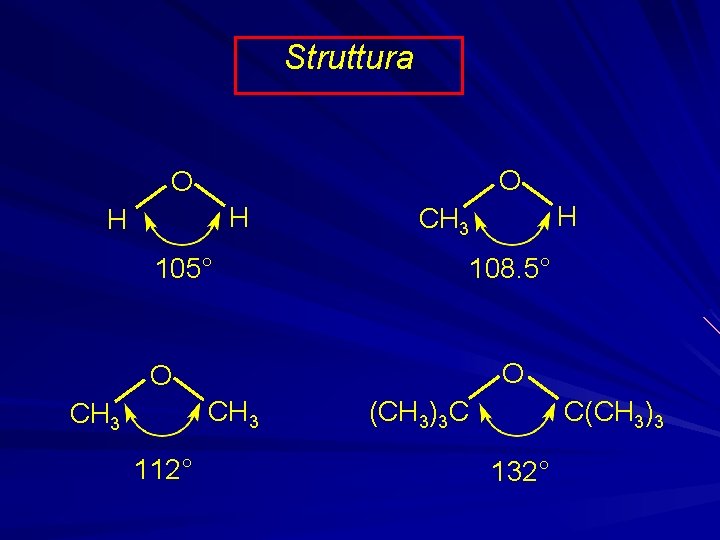
Struttura O O H H 105° 108. 5° O O CH 3 112° H CH 3 C(CH 3)3 C 132°

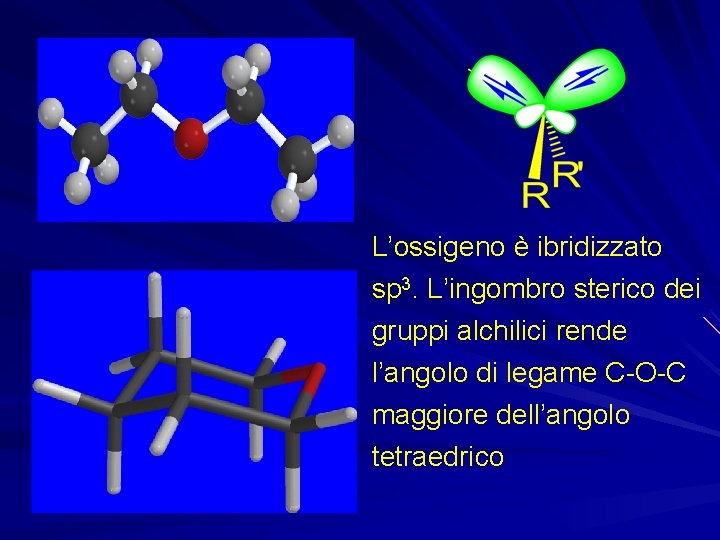
L’ossigeno è ibridizzato sp 3. L’ingombro sterico dei gruppi alchilici rende l’angolo di legame C-O-C maggiore dell’angolo tetraedrico

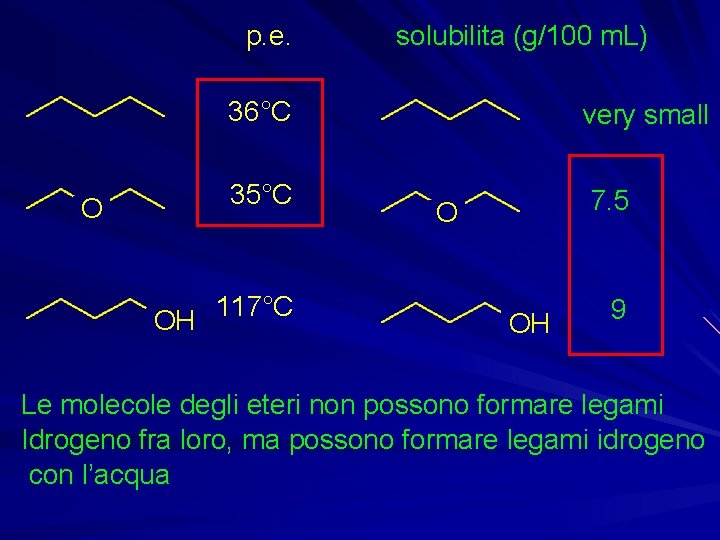
Proprietà fisiche

p. e. solubilita (g/100 m. L) 36°C O 35°C 117°C OH very small 7. 5 O OH 9 Le molecole degli eteri non possono formare legami Idrogeno fra loro, ma possono formare legami idrogeno con l’acqua

Preparazione

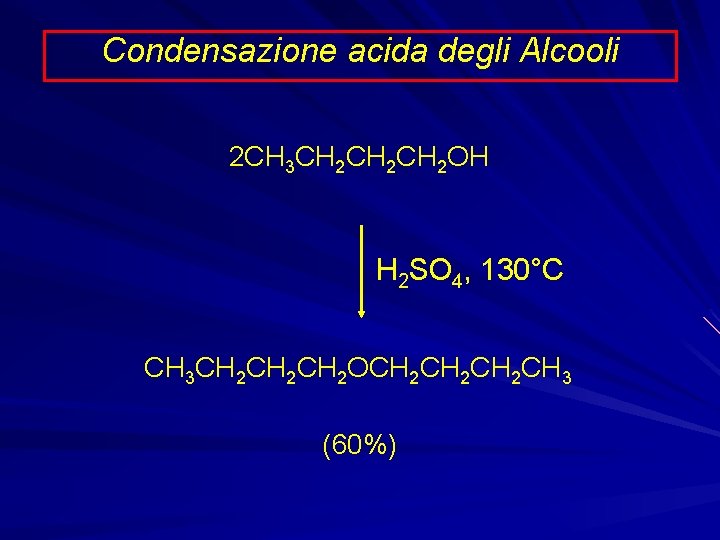
Condensazione acida degli Alcooli 2 CH 3 CH 2 CH 2 OH H 2 SO 4, 130°C CH 3 CH 2 CH 2 OCH 2 CH 2 CH 3 (60%)

(CH 3)2 C=CH 2 + CH 3 OH H+ Il tert-butil metil etere (MTBE) quantitativamente è il secondo (CH 3)3 COCH 3 tert-butil metil etere

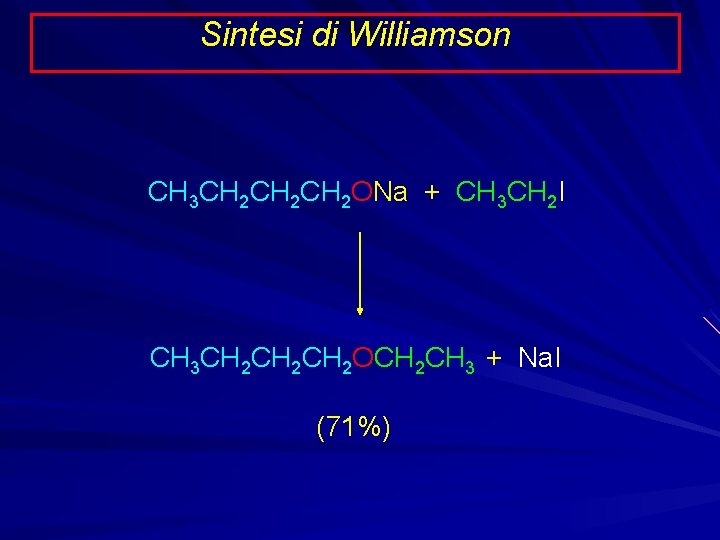
Sintesi di Williamson CH 3 CH 2 CH 2 ONa + CH 3 CH 2 I CH 3 CH 2 CH 2 OCH 2 CH 3 + Na. I (71%)

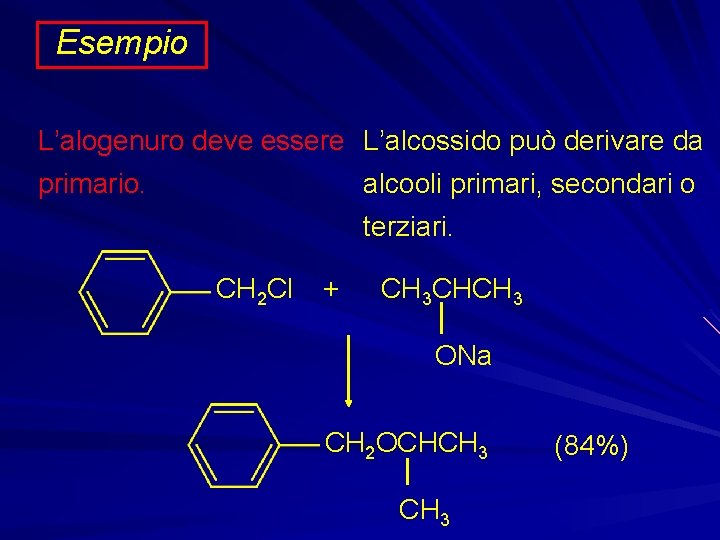
Esempio L’alogenuro deve essere L’alcossido può derivare da primario. alcooli primari, secondari o terziari. CH 2 Cl + CH 3 CHCH 3 ONa CH 2 OCHCH 3 (84%)

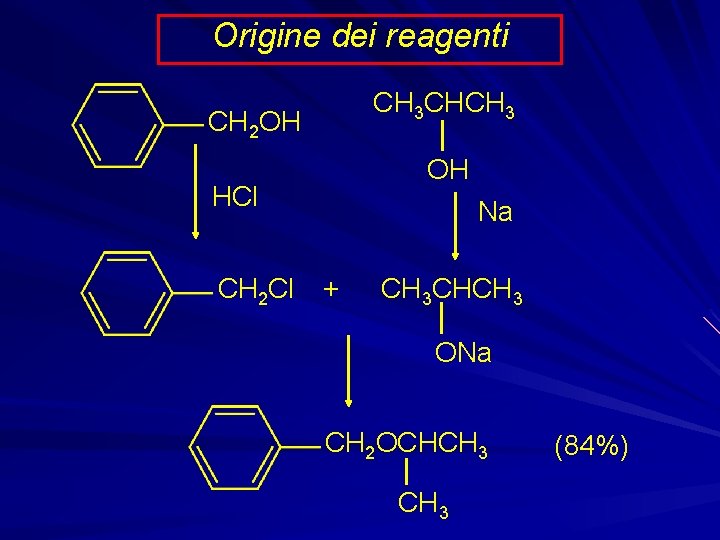
Origine dei reagenti CH 3 CHCH 3 CH 2 OH OH HCl Na CH 2 Cl + CH 3 CHCH 3 ONa CH 2 OCHCH 3 (84%)

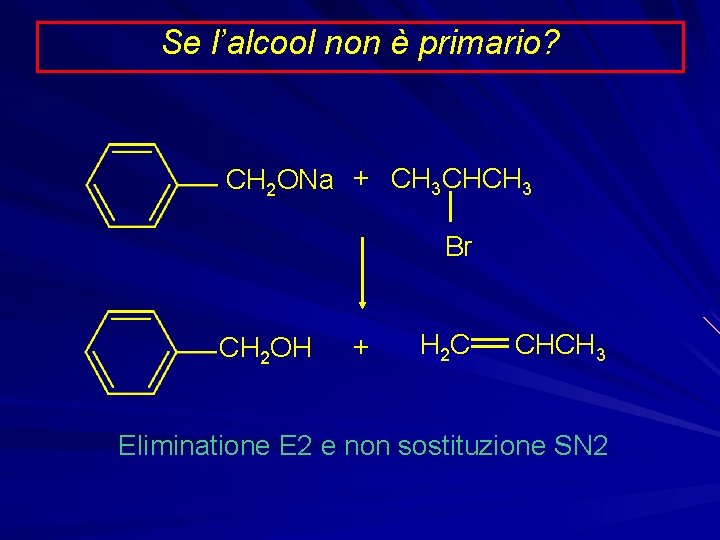
Se l’alcool non è primario? CH 2 ONa + CH 3 CHCH 3 Br CH 2 OH + H 2 C CHCH 3 Eliminatione E 2 e non sostituzione SN 2

Reazioni Gli eteri sono poco reattivi e per questo vengono usati spesso come solventi Per ossidazione all’aria formano perossidi ed idroperossidi esplosivi. Con acidi a caldo si scindono.

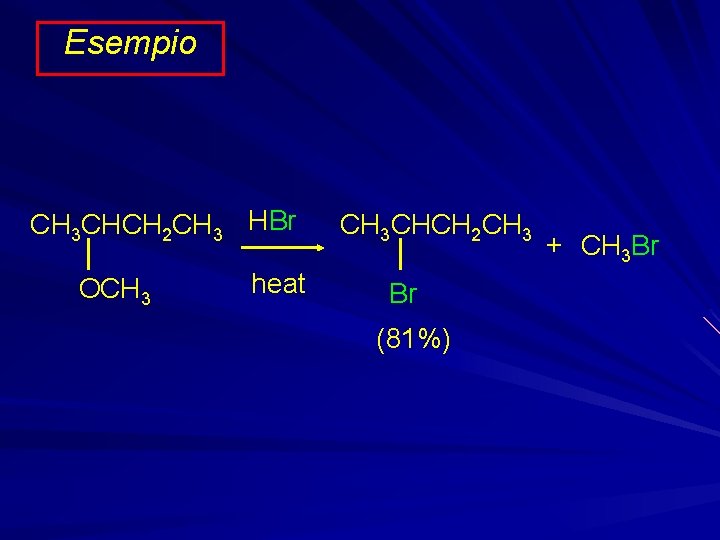
Esempio CH 3 CHCH 2 CH 3 HBr OCH 3 heat CH 3 CHCH 2 CH 3 Br (81%) + CH 3 Br

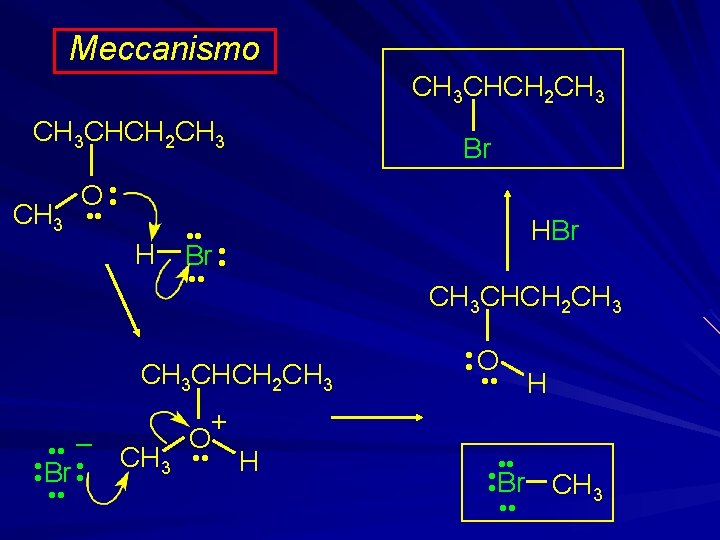
Meccanismo CH 3 CHCH 2 CH 3 Br O • • CH 3 • • H HBr • • Br • • CH 3 CHCH 2 CH 3 • • – • • Br • • + O CH 3 • • H • • O • • Br • • H CH 3

Spettroscopia

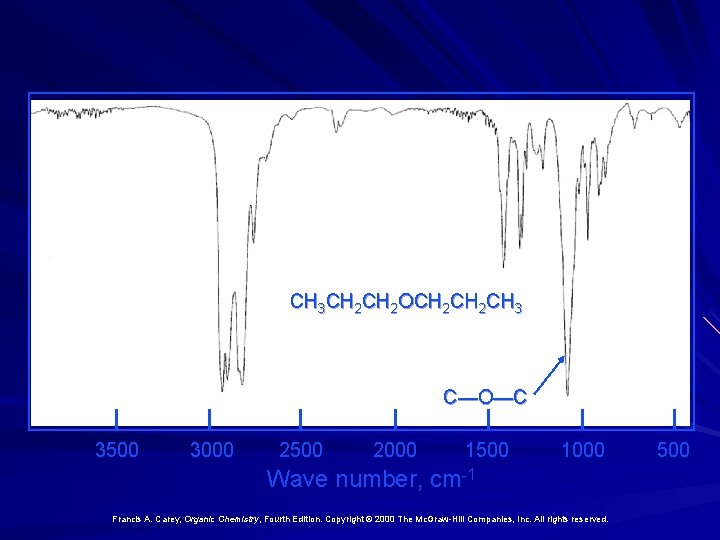
Infrarosso C—O stretching: 1070 and 1150 cm-1

CH 3 CH 2 OCH 2 CH 3 C—O—C 3500 3000 2500 2000 1500 1000 Wave number, cm-1 Francis A. Carey, Organic Chemistry, Fourth Edition. Copyright © 2000 The Mc. Graw-Hill Companies, Inc. All rights reserved. 500

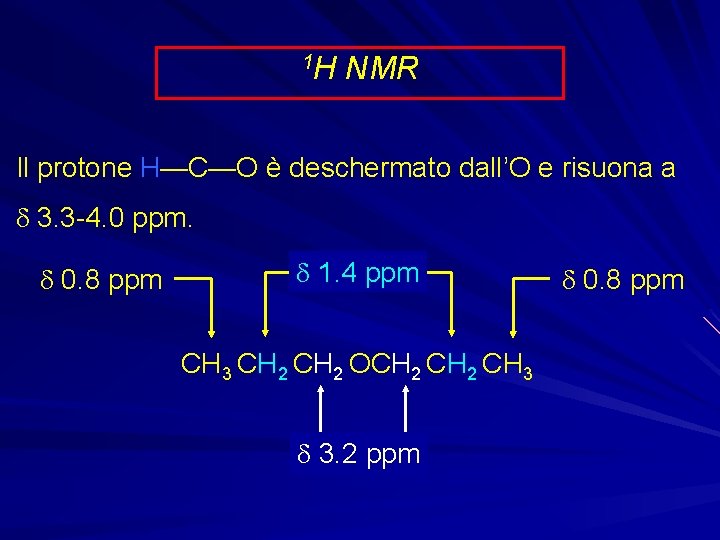
1 H NMR Il protone H—C—O è deschermato dall’O e risuona a d 3. 3 -4. 0 ppm. d 0. 8 ppm d 1. 4 ppm CH 3 CH 2 OCH 2 CH 3 d 3. 2 ppm d 0. 8 ppm

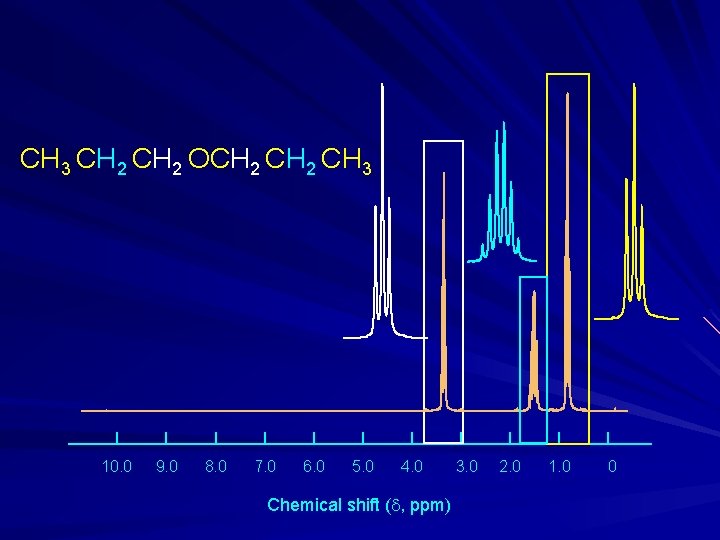
CH 3 CH 2 OCH 2 CH 3 10. 0 9. 0 8. 0 7. 0 6. 0 5. 0 4. 0 Chemical shift (d, ppm) 3. 0 2. 0 1. 0 0

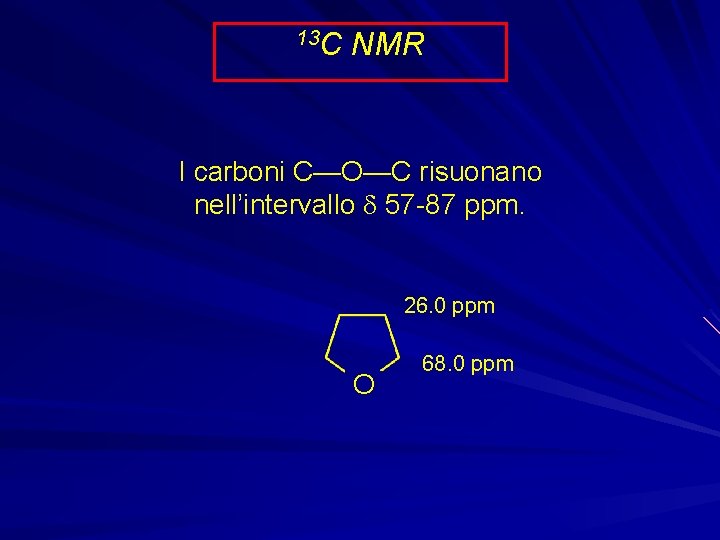
13 C NMR I carboni C—O—C risuonano nell’intervallo d 57 -87 ppm. 26. 0 ppm O 68. 0 ppm

UV-VIS Gli eteri semplici hanno il massimo di assorbimento a 185 nm e sono trasparenti alle radiazioni UV.

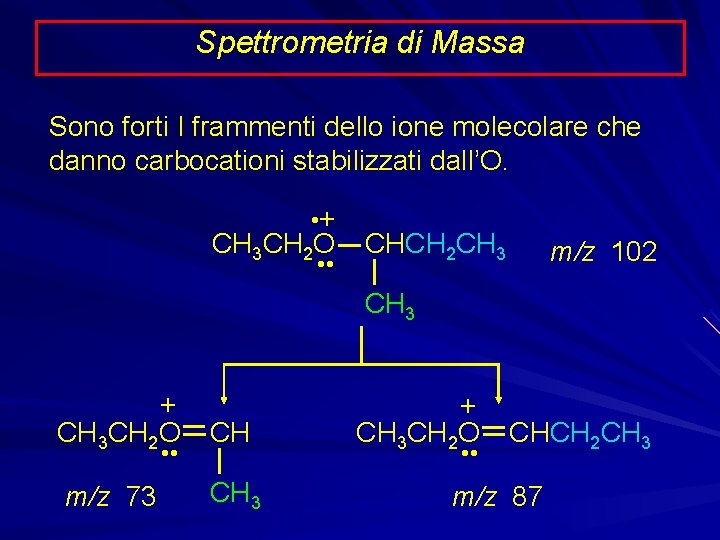
Spettrometria di Massa Sono forti I frammenti dello ione molecolare che danno carbocationi stabilizzati dall’O. • + CH 3 CH 2 O • • CHCH 2 CH 3 m/z 102 CH 3 + CH 3 CH 2 O CH • • m/z 73 CH 3 + CH 3 CH 2 O CHCH 2 CH 3 • • m/z 87

Epossidi

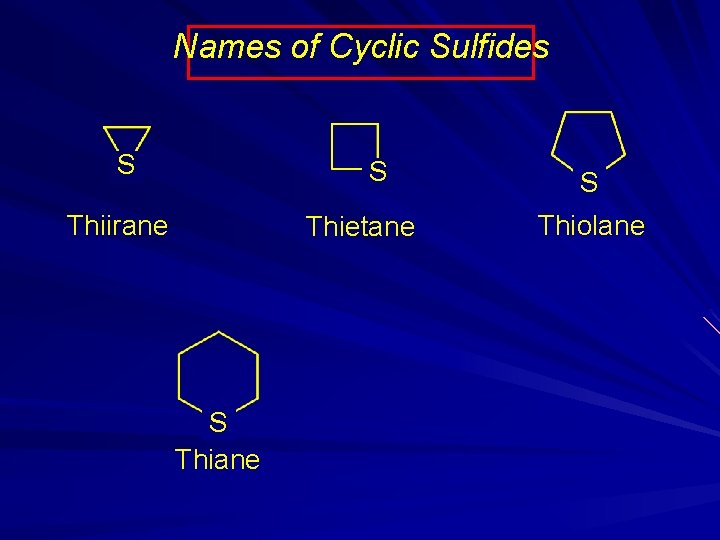
Names of Cyclic Sulfides S S Thiirane Thietane S Thiolane

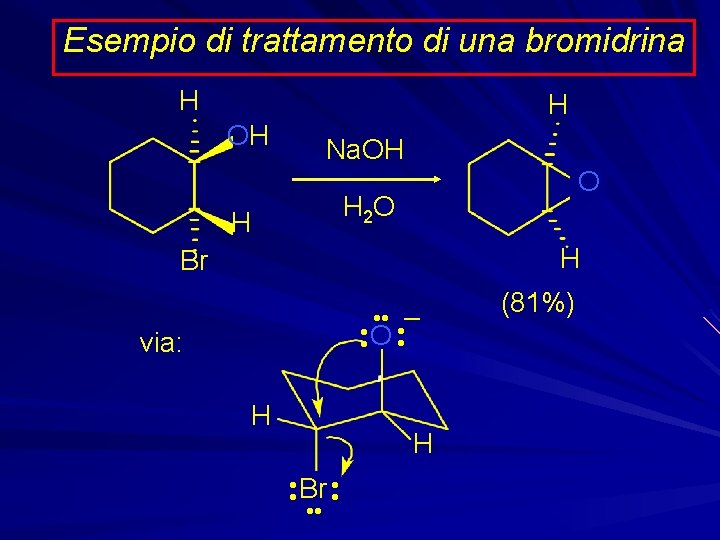
Preparazione Gli epossidi sono preparati dagli alcheni: • Per trattamento con peracidi. • Per formazione di aloidrine e trattamento successivo con basi.


Esempio di trattamento di una bromidrina H OH H Na. OH O H 2 O H Br • • – • • O • • via: H H • • Br • • H (81%)

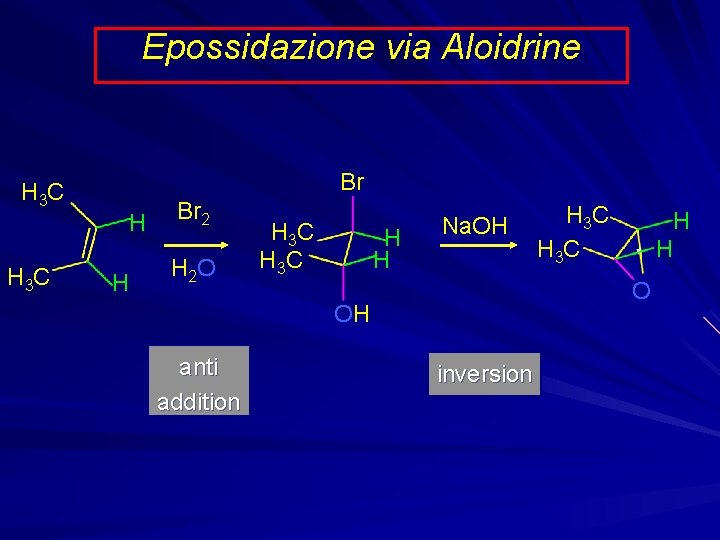
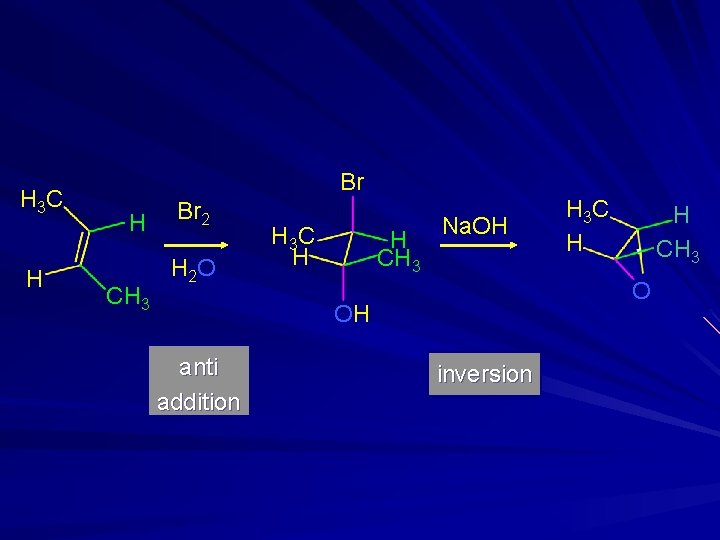
Epossidazione via Aloidrine H 3 C Br H H Br 2 H 2 O H 3 C H H Na. OH H H O OH anti addition H 3 C inversion

H 3 C H Br H CH 3 Br 2 H 2 O H 3 C H H CH 3 Na. OH H CH 3 O OH anti addition H 3 C H inversion

Reazioni

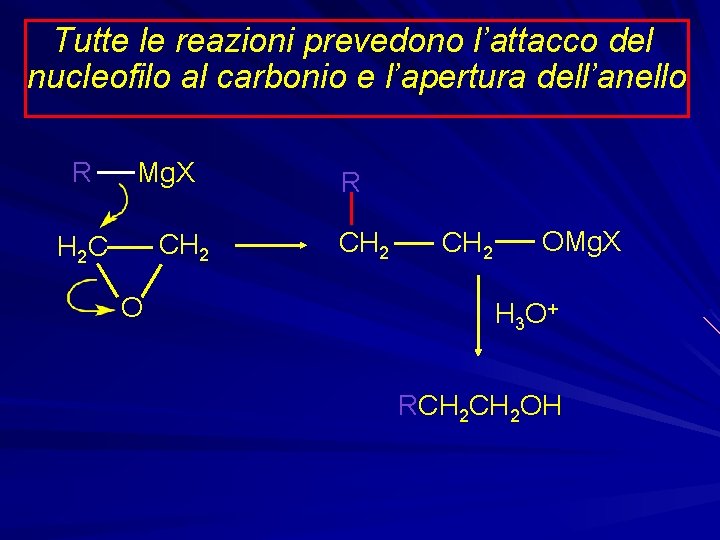
Tutte le reazioni prevedono l’attacco del nucleofilo al carbonio e l’apertura dell’anello R Mg. X CH 2 H 2 C O R CH 2 OMg. X H 3 O + RCH 2 OH

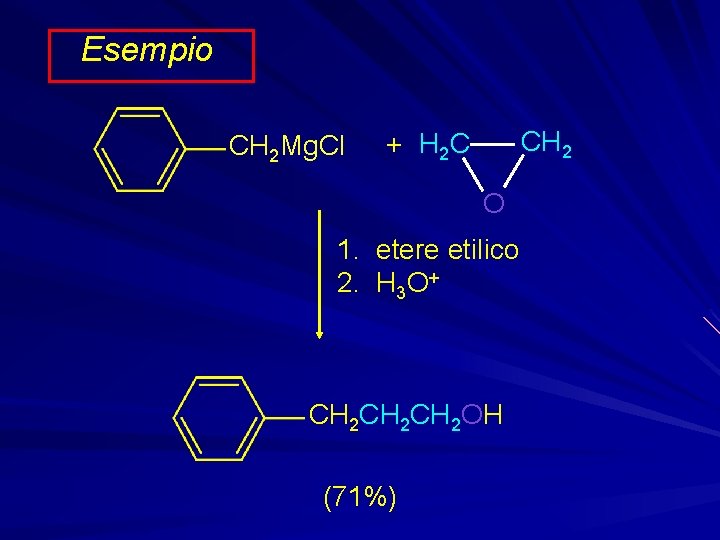
Esempio CH 2 Mg. Cl CH 2 + H 2 C O 1. etere etilico 2. H 3 O+ CH 2 CH 2 OH (71%)

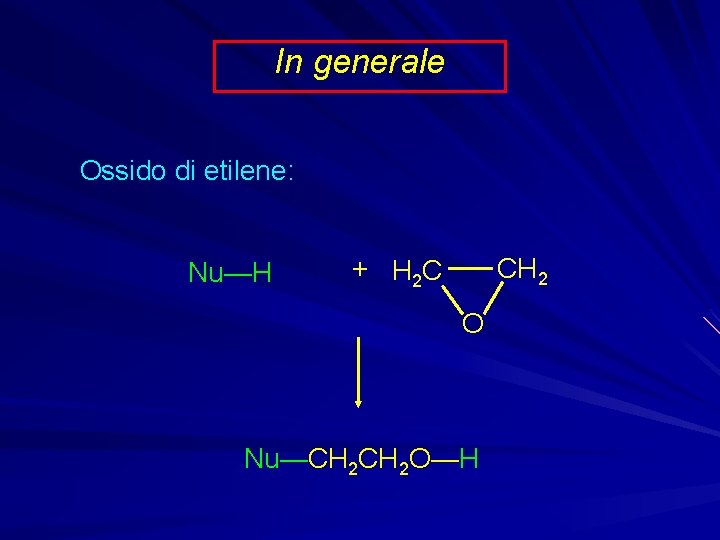
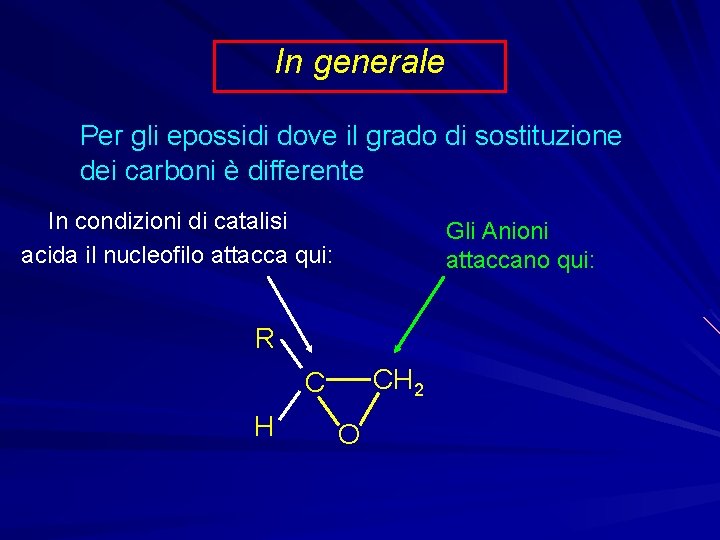
In generale Ossido di etilene: Nu—H CH 2 + H 2 C O Nu—CH 2 O—H

In generale Per gli epossidi dove il grado di sostituzione dei carboni è differente In condizioni di catalisi acida il nucleofilo attacca qui: Gli Anioni attaccano qui: R CH 2 C H O

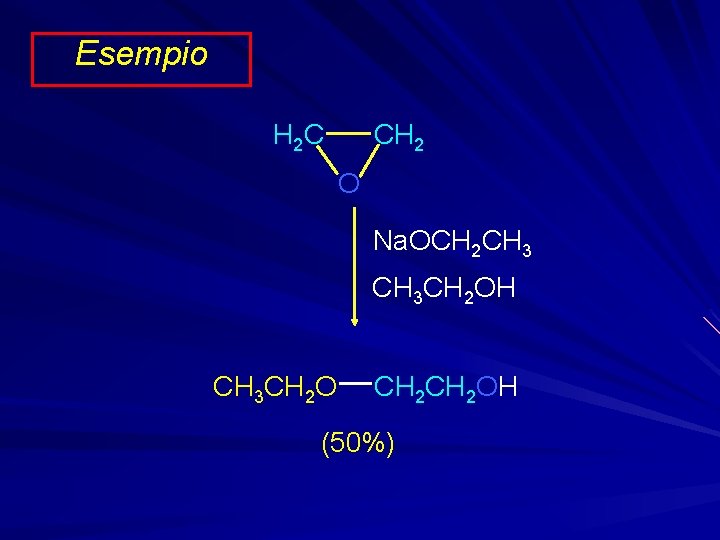
Esempio CH 2 H 2 C O Na. OCH 2 CH 3 CH 2 OH CH 3 CH 2 OH (50%)


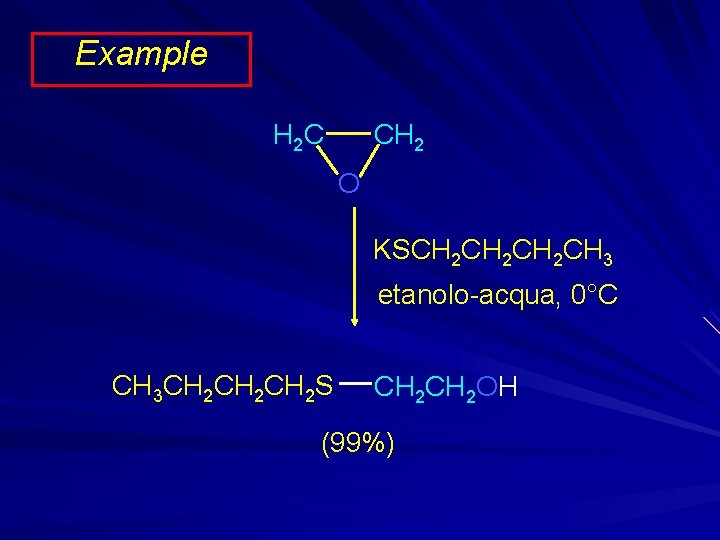
Example CH 2 H 2 C O KSCH 2 CH 2 CH 3 etanolo-acqua, 0°C CH 3 CH 2 CH 2 S CH 2 OH (99%)

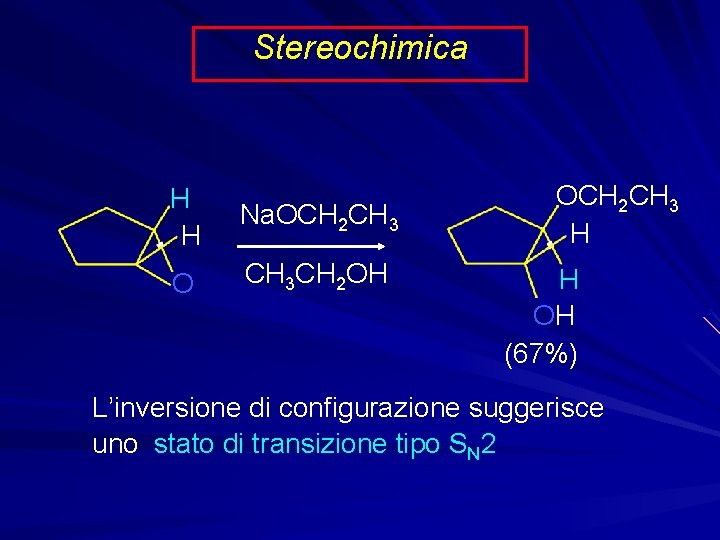
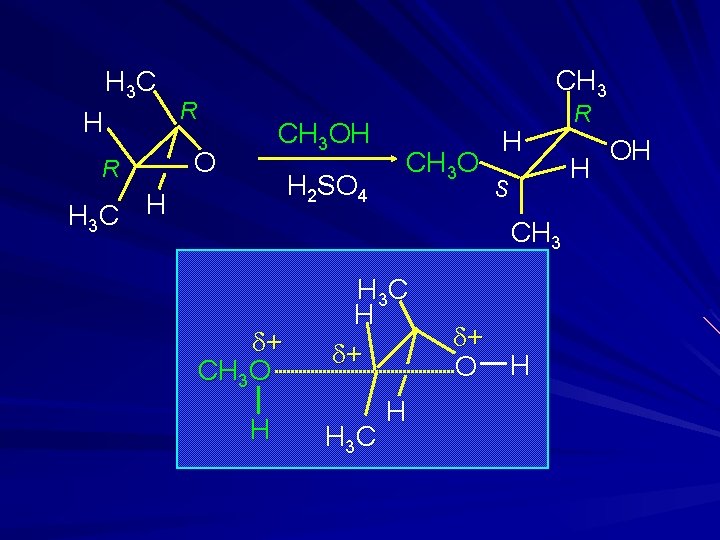
Stereochimica H H Na. OCH 2 CH 3 O CH 3 CH 2 OH OCH 2 CH 3 H H OH (67%) L’inversione di configurazione suggerisce uno stato di transizione tipo SN 2

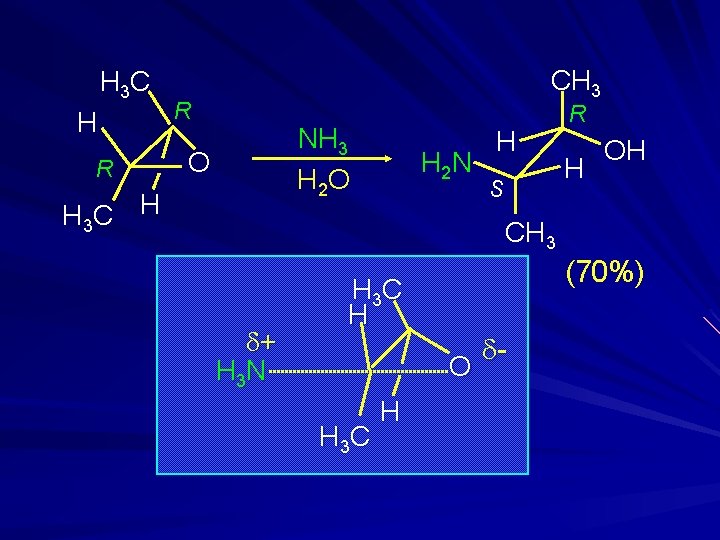
H 3 C H R CH 3 R NH 3 H 2 O O H 3 C H H 2 N H S R H OH CH 3 d+ H 3 N (70%) H 3 C H O H 3 C H d-

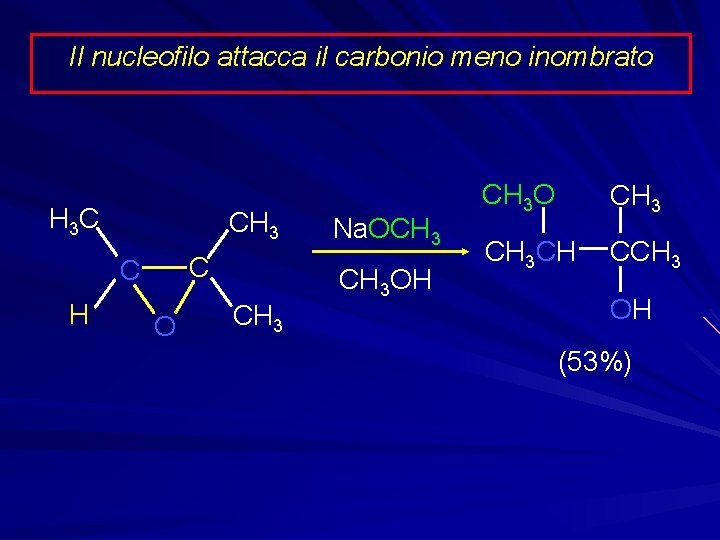
Il nucleofilo attacca il carbonio meno inombrato H 3 C CH 3 C C H O CH 3 Na. OCH 3 OH CH 3 O CH 3 CH CCH 3 OH (53%)

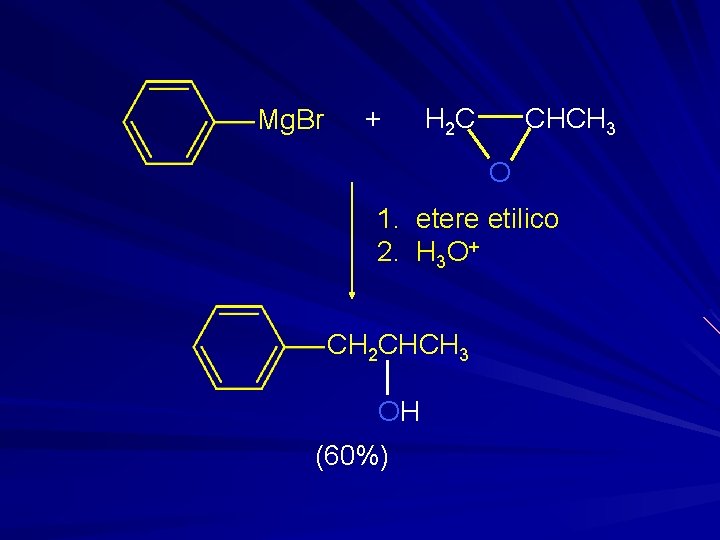
Mg. Br + CHCH 3 H 2 C O 1. etere etilico 2. H 3 O+ CH 2 CHCH 3 OH (60%)

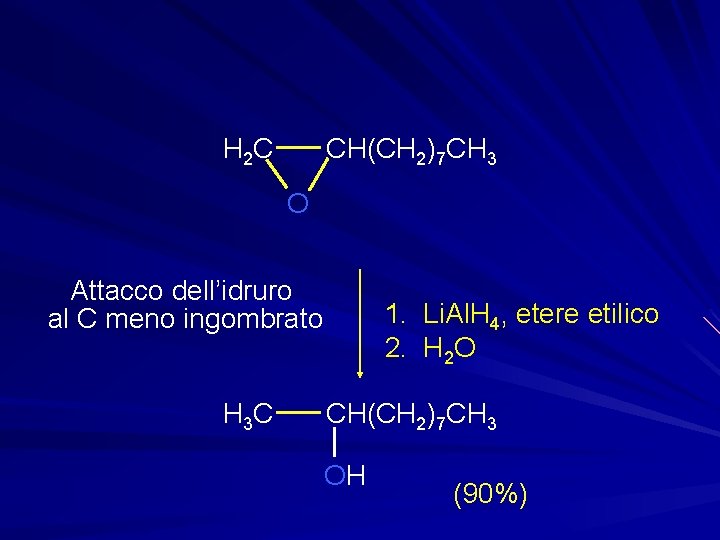
CH(CH 2)7 CH 3 H 2 C O Attacco dell’idruro al C meno ingombrato H 3 C 1. Li. Al. H 4, etere etilico 2. H 2 O CH(CH 2)7 CH 3 OH (90%)

Apertura con catalisi acida

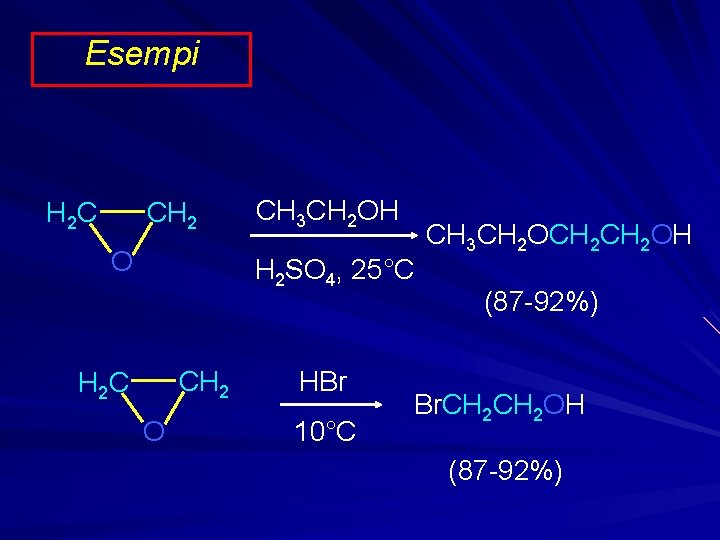
Esempi CH 2 H 2 C O CH 3 CH 2 OH H 2 SO 4, 25°C CH 2 H 2 C O HBr 10°C CH 3 CH 2 OCH 2 OH (87 -92%) Br. CH 2 OH (87 -92%)


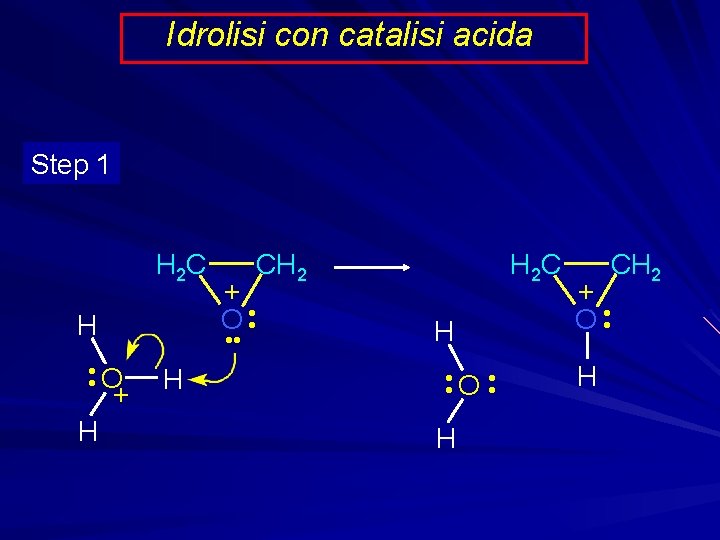
Idrolisi con catalisi acida Step 1 H 2 C H + O • • O + + H CH 2 H H 2 C H • • O • • H CH 2 + O • • H



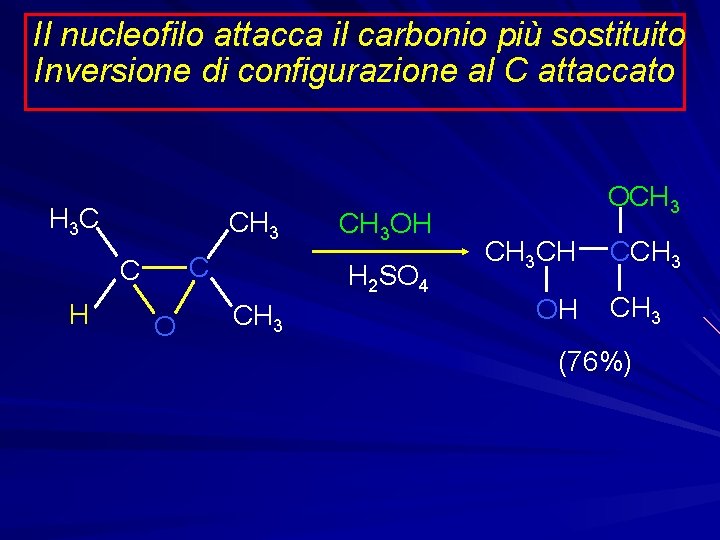
Il nucleofilo attacca il carbonio più sostituito Inversione di configurazione al C attaccato H 3 C CH 3 C C H O CH 3 OH H 2 SO 4 CH 3 OCH 3 CH OH CCH 3 (76%)

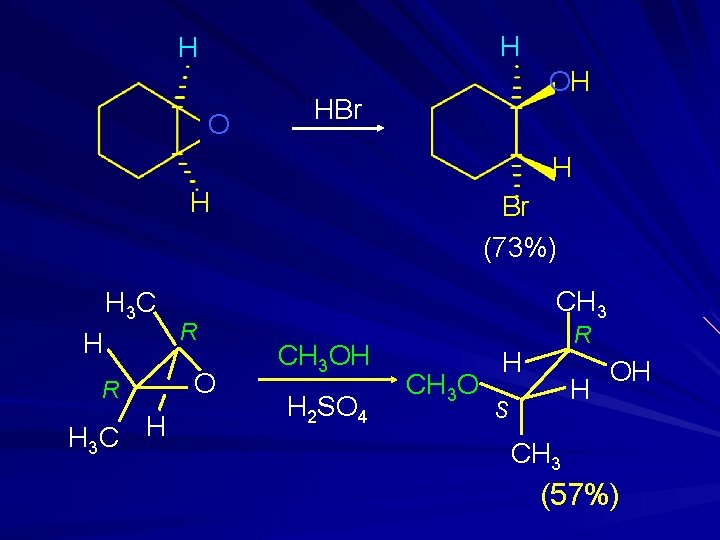
H H O OH HBr H H H 3 C H R O Br (73%) CH 3 OH H 2 SO 4 CH 3 O R H H S OH CH 3 (57%)

H 3 C H R CH 3 OH O H 2 SO 4 H 3 C H CH 3 O H S CH 3 d+ CH 3 O H H 3 C H d+ O H R H OH

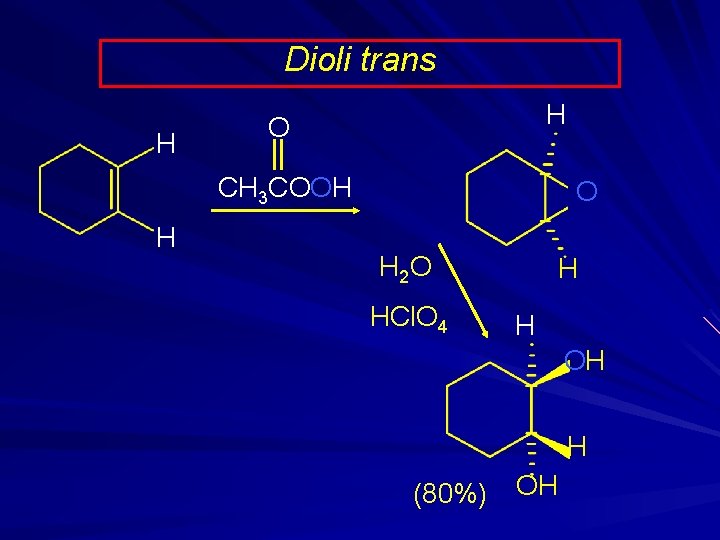
Dioli trans H H O CH 3 COOH H O H 2 O HCl. O 4 H H OH H (80%) OH

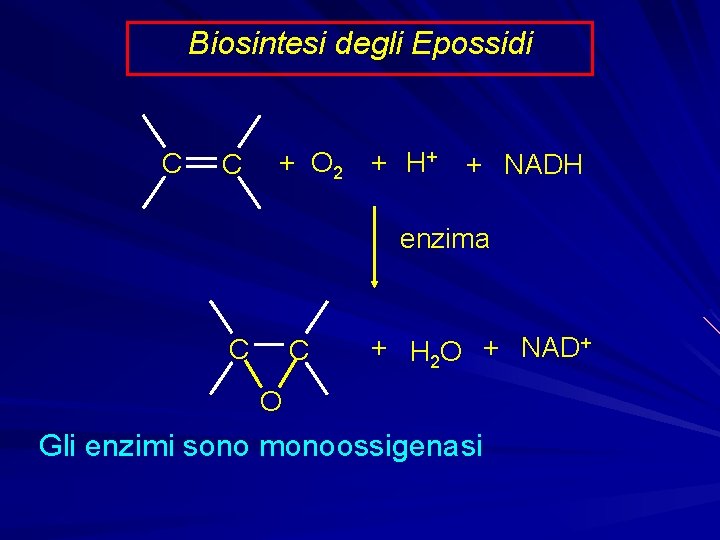
Biosintesi degli Epossidi C C + O 2 + H+ + NADH enzima C C + H 2 O + NAD+ O Gli enzimi sono monoossigenasi

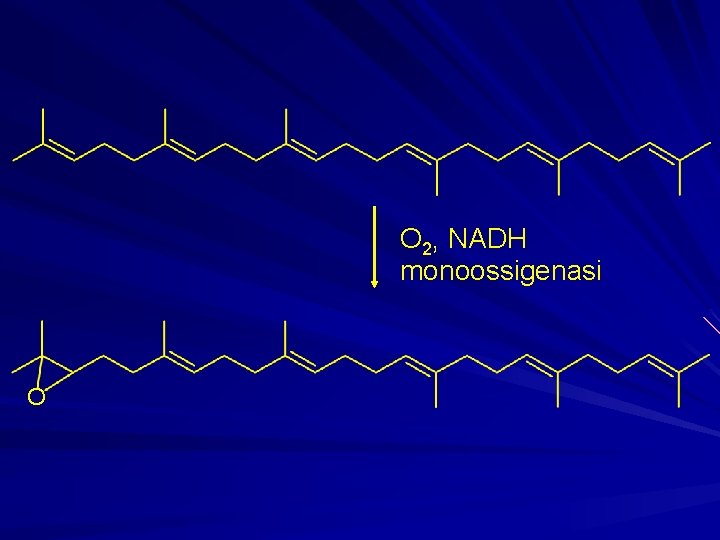
O 2, NADH monoossigenasi O

Solfuri

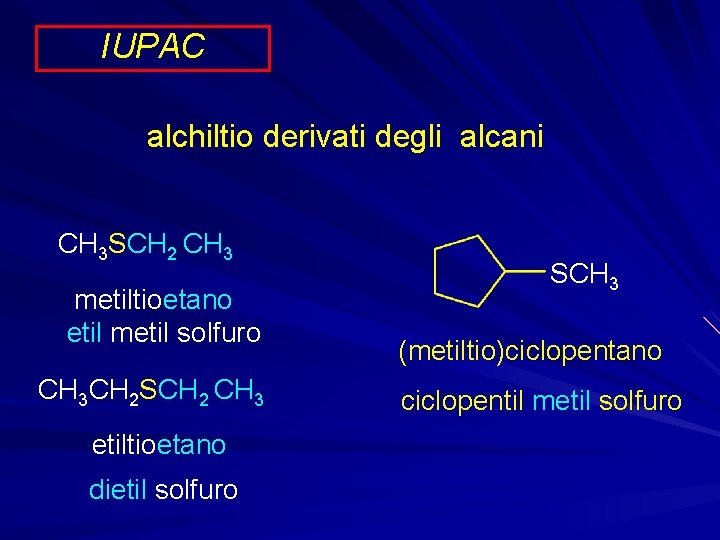
IUPAC alchiltio derivati degli alcani CH 3 SCH 2 CH 3 metiltioetano etil metil solfuro CH 3 CH 2 SCH 2 CH 3 etiltioetano dietil solfuro SCH 3 (metiltio)ciclopentano ciclopentil metil solfuro

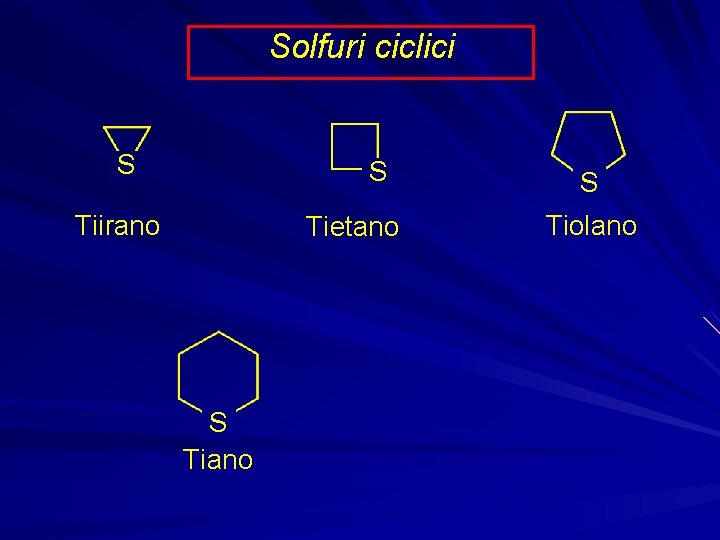
Solfuri ciclici S S Tiirano Tietano S Tiolano

Preparazione

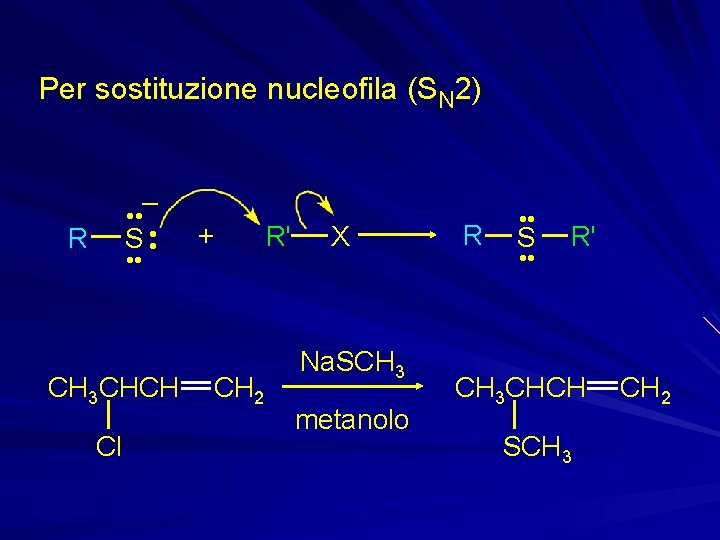
Per sostituzione nucleofila (SN 2) – • • – S • • R CH 3 CHCH Cl + CH 2 R' X Na. SCH 3 metanolo R • • S • • R' CH 3 CHCH SCH 3 CH 2

Ossidazione


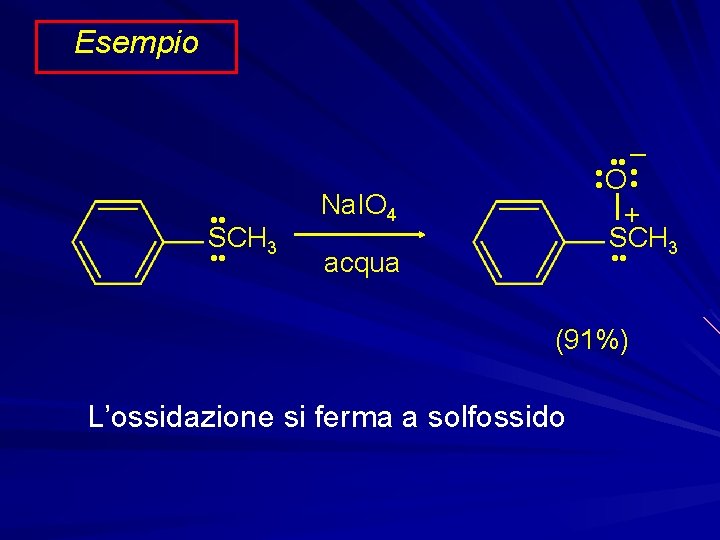
Esempio • • Na. IO 4 • • acqua SCH 3 – • • O • • + SCH 3 • • (91%) L’ossidazione si ferma a solfossido

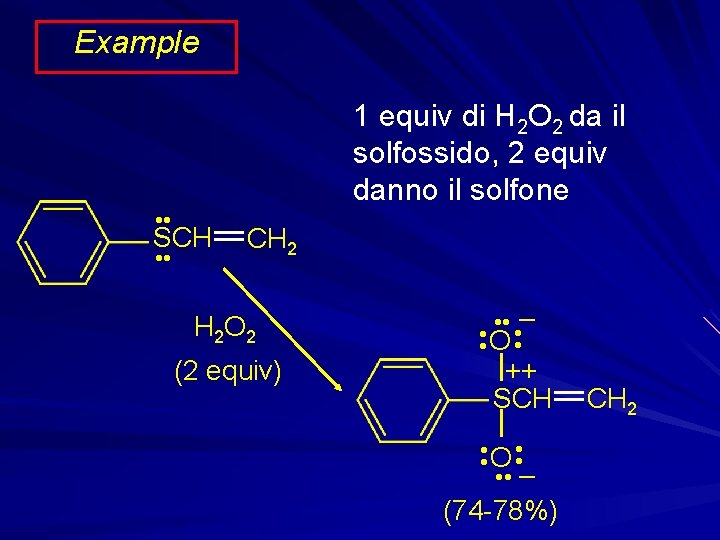
Example • • 1 equiv di H 2 O 2 da il solfossido, 2 equiv danno il solfone SCH • • CH 2 H 2 O 2 (2 equiv) – • • O • • ++ SCH • • O • • – (74 -78%) CH 2

Alchilazione

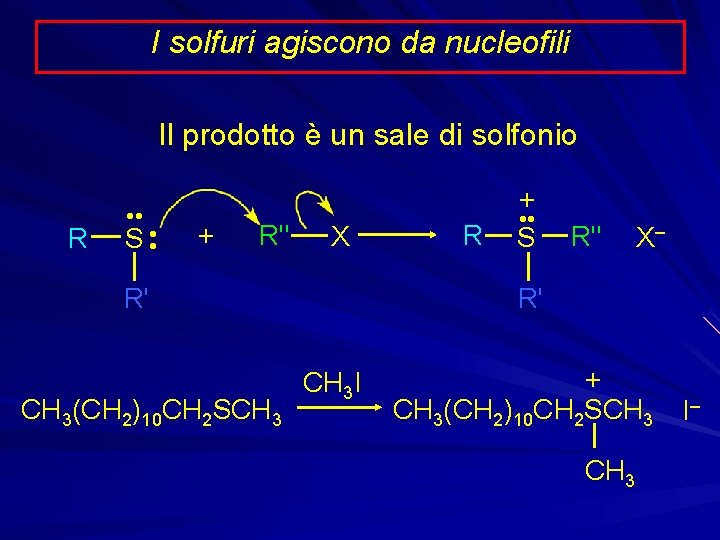
I solfuri agiscono da nucleofili Il prodotto è un sale di solfonio R • • S • • + R" X R' CH 3(CH 2)10 CH 2 SCH 3 R + • • S R" X– R' CH 3 I + CH 3(CH 2)10 CH 2 SCH 3 I– CH 3
 Ch3ch2ch2och(ch3)2
Ch3ch2ch2och(ch3)2 Isobutil
Isobutil Nomenclatura iupac
Nomenclatura iupac Nitrilo grupo funcional
Nitrilo grupo funcional Grupos funcionales tabla completa
Grupos funcionales tabla completa Nomenclatura tradicional del hci
Nomenclatura tradicional del hci Grupos funcionales de quimica organica
Grupos funcionales de quimica organica Idracido esempio
Idracido esempio Nomenclatura iupac
Nomenclatura iupac Come rico, come sano
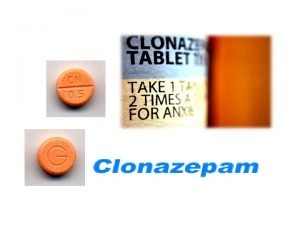
Come rico, come sano Clonazepam iupac name
Clonazepam iupac name Iupac stands for
Iupac stands for Beta oxidation fatty acids
Beta oxidation fatty acids 3-hydroxycyclopentanecarbaldehyde
3-hydroxycyclopentanecarbaldehyde Acido malico nombre iupac
Acido malico nombre iupac Ethan propan butan pentan hexan
Ethan propan butan pentan hexan Aldehidos
Aldehidos Nombre iupac de la cetona que se utiliza como quitaesmalte
Nombre iupac de la cetona que se utiliza como quitaesmalte What functional group is ch3
What functional group is ch3 Caoutchoutique
Caoutchoutique Physical properties of esters
Physical properties of esters Iupac name for cycloalkane
Iupac name for cycloalkane Cumulated diene examples
Cumulated diene examples Monochlorination of butane
Monochlorination of butane What is the iupac name of the base naoh?
What is the iupac name of the base naoh? Saturated hydrocarbon
Saturated hydrocarbon Naming alkynes
Naming alkynes What is the iupac name of ch3ch2ch2ch2ch2i
What is the iupac name of ch3ch2ch2ch2ch2i Oil rig explosion
Oil rig explosion Pcl
Pcl Alkanals
Alkanals Ch3-ch2-ch=ch-ch3
Ch3-ch2-ch=ch-ch3 Iupac name search by image
Iupac name search by image Katlma
Katlma Benennung organischer verbindungen übungen
Benennung organischer verbindungen übungen Chlorobutanol reaction mechanism
Chlorobutanol reaction mechanism Iupac kuralı
Iupac kuralı Organic chemistry nomenclature
Organic chemistry nomenclature Nama iupac
Nama iupac Butanoic acid solubility in water
Butanoic acid solubility in water Blm gold book
Blm gold book Test for carbonyl group
Test for carbonyl group Sodium oxidanide
Sodium oxidanide ıupac sistemi
ıupac sistemi Na pcl6 iupac name
Na pcl6 iupac name Get in touch with god turn your radio on
Get in touch with god turn your radio on Come thou fount come thou king lyrics
Come thou fount come thou king lyrics Come in come in and sit down
Come in come in and sit down Come lord jesus come and be born in our hearts lyrics
Come lord jesus come and be born in our hearts lyrics Come mi chiamo come mi chiamo
Come mi chiamo come mi chiamo Tear past and past participle
Tear past and past participle Softly and tenderly jesus is calling
Softly and tenderly jesus is calling Come holy spirit dove divine
Come holy spirit dove divine Throw past and past participle
Throw past and past participle Emmanuel son of god
Emmanuel son of god Vorrei essere al mare
Vorrei essere al mare Hey come on out story
Hey come on out story Come in come in and sit down
Come in come in and sit down Come mi chiamo
Come mi chiamo Como saber el grupo funcional de un compuesto
Como saber el grupo funcional de un compuesto Butino
Butino Nomenclatura composti aromatici
Nomenclatura composti aromatici Funciones quimicas
Funciones quimicas Dibromuro de trioxígeno
Dibromuro de trioxígeno Giaguaro
Giaguaro Nomenclatura del voleibol
Nomenclatura del voleibol Nomenclatura rs
Nomenclatura rs Oxoacidos
Oxoacidos Nomenclatura de peptidos
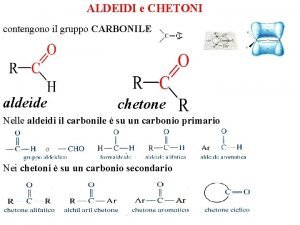
Nomenclatura de peptidos Chetoni nomenclatura
Chetoni nomenclatura Asi5 nomenclatura
Asi5 nomenclatura Scit key
Scit key