NOMENCLATURA INORGANICA La nomenclatura qumica es el sistema
















- Slides: 17

NOMENCLATURA INORGANICA La nomenclatura química es el sistema de normas, comunes en todo el mundo, para denominar a los elementos y compuestos químicos. El organismo encargado de dictar tales normas se llama Unión Internacional de Química Pura y Aplicada (IUPAC).



Elemento: Se denomina elemento a toda sustancia que no puede descomponerse en otras más sencillas por métodos químicos. Nombre y símbolo de un elemento: Cada elemento se identifica por un nombre y se representa mediante una letra o conjunto de letras denominado símbolo. Moléculas: Se denomina molécula a la cantidad mínima de materia capaz de existir conservando todas las propiedades de la sustancia original. Las moléculas se pueden encontrar como : Sustancias simples y sustancias compuestas


Sustancias compuestas o simplemente compuestos: Son aquellas sustancias puras formadas por combinación de dos o más elementos, en relación constante de masas. Las moléculas de un compuestos están constituidas por dos o más clases de átomos. Por ejemplo, el agua (H 2 O), cuya molécula está formada por dos átomos de hidrógeno y un átomo de oxígeno

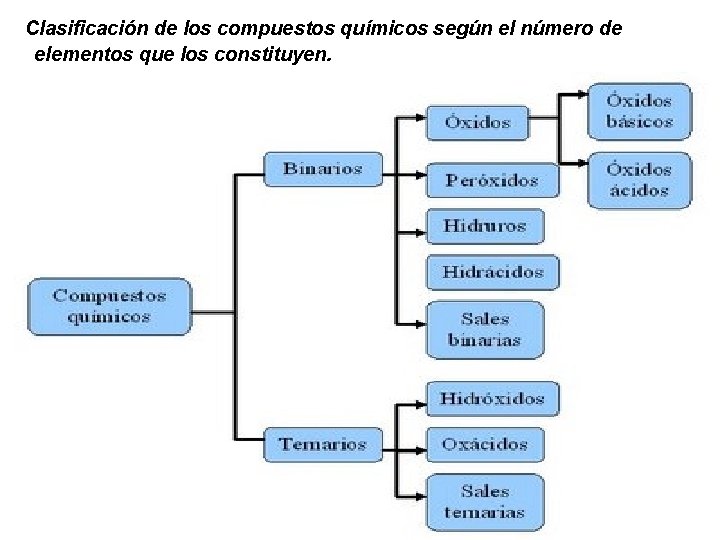
Clasificación de los compuestos químicos según el número de elementos que los constituyen.

Reglas para asignar números de oxidación 1. En los elementos libres (es decir, en estado no combinado), cada átomo tiene un número de oxidación cero. Así, cada átomo en H 2, Br 2, Na, Be, K, O 2 y P 2 tiene el mismo número de oxidación: Cero. 2. Para los elementos constituidos por un solo átomo, el número de oxidación es igual a la carga, cuando se forma un ión. Entonces el Li+ tiene un número de oxidación +1; el ion Ba 2+, +2; el Fe+3, +3 el ion I-, -1, etc. Los metales alcalinos tienen un número de oxidación +1, y los metales alcalinotérreos tienen un número de oxidación +2 en todos sus compuestos. El aluminio tiene un número de oxidación +3 en todos sus compuestos.

3. El número de oxidación del oxigeno en la mayoría de los compuesto (por Ej. ; Mg. O y H 2 O) es -2, pero en el peróxido de hidrógeno H 2 O 2 es -1. 4. El número de oxidación del hidrógeno es +1, excepto cuando está enlazado con metales en compuestos binarios. En estos casos (por Ej. : Li. H, Na. H, Ca. H 2), su número de oxidación es -1.

5. El flúor tiene número de oxidación -1 en todos sus compuestos, los otros halógenos (Cl, Br y I) tienen números de oxidación negativos cuando existen como iones haluros en los compuestos. Cuando están combinados con oxígeno por ejemplo en los oxiácidos y oxianiones, tienen números de oxidación positivos. 6. En una molécula neutra, la suma de los números de oxidación debe dar cero. En un ion poliatómico, la suma de los números de oxidación de todos los elementos debe ser igual a la carga neta del ion. Por ejemplo, el ion amonio, NH 4+, el número de la oxidación del N es -3 y el del H, +1, por lo tanto la suma de los número de oxidación es -3 *1+4 *(+1) = +1, que es igual a la carga neta del ion





Combinaciones binarias del Oxígeno Deben nombrarse como óxidos tanto las combinaciones de oxígeno con metales como con no metales. Para formularlos se escribe siempre, a la izquierda, el elemento más electropositivo, intercambiándose los números de oxidación del oxígeno (-2) y del otro elemento.


 Quimica inorganica nomenclatura
Quimica inorganica nomenclatura Tabla comparativa de quimica organica e inorganica
Tabla comparativa de quimica organica e inorganica Analisi qualitativa inorganica
Analisi qualitativa inorganica Parte organica e inorganica do osso
Parte organica e inorganica do osso Materia organica a inorganica
Materia organica a inorganica Matriz inorgánica del hueso
Matriz inorgánica del hueso Basura organica
Basura organica Materia inorgánica
Materia inorgánica Propiedades de la materia intensivas y extensivas
Propiedades de la materia intensivas y extensivas Entalpia
Entalpia Ejemplos de epimeros
Ejemplos de epimeros Qumica
Qumica Qumica
Qumica Na y cl
Na y cl Entalpia de formação
Entalpia de formação Qumica
Qumica Cintica
Cintica Qumica
Qumica