Tema 12 Modelos atmicos Sistema peridico Departamento de
































- Slides: 51

Tema 12. Modelos atómicos. Sistema periódico Departamento de Física y Química I. E. S. Pablo Gargallo

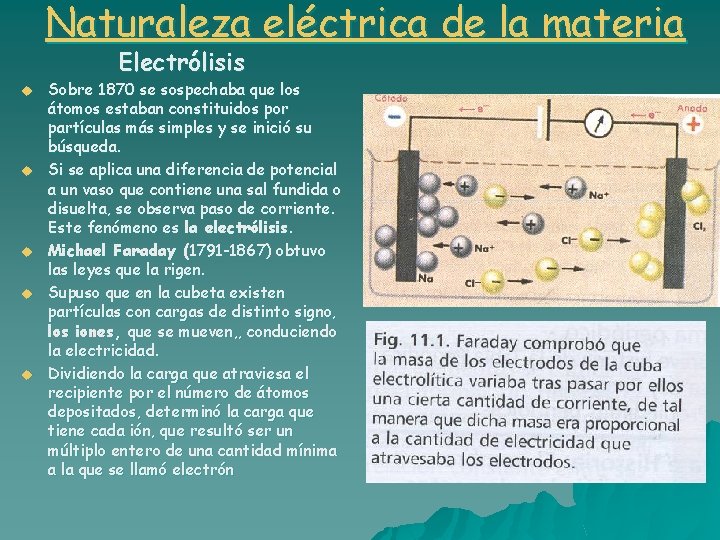
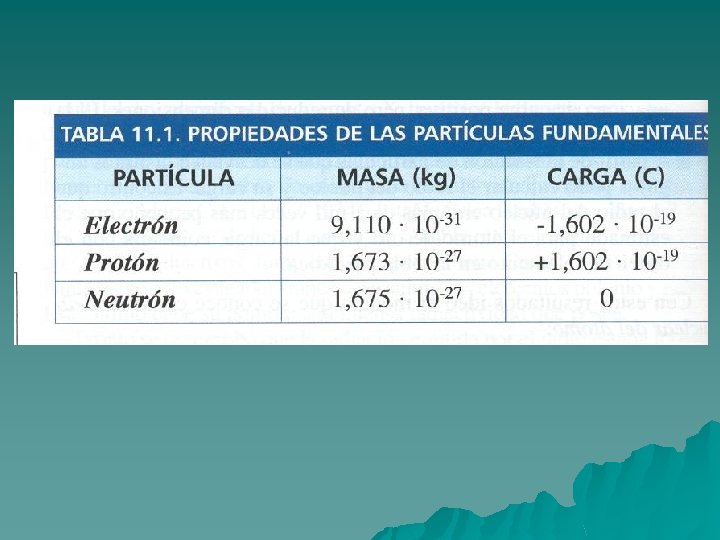
Naturaleza eléctrica de la materia Electrólisis u u u Sobre 1870 se sospechaba que los átomos estaban constituidos por partículas más simples y se inició su búsqueda. Si se aplica una diferencia de potencial a un vaso que contiene una sal fundida o disuelta, se observa paso de corriente. Este fenómeno es la electrólisis. Michael Faraday (1791 -1867) obtuvo las leyes que la rigen. Supuso que en la cubeta existen partículas con cargas de distinto signo, los iones, que se mueven, , conduciendo la electricidad. Dividiendo la carga que atraviesa el recipiente por el número de átomos depositados, determinó la carga que tiene cada ión, que resultó ser un múltiplo entero de una cantidad mínima a la que se llamó electrón

Rayos catódicos: descubrimiento del electrón A mediados del siglo XIX se estudiaba la conductividad de los gases en tubos de descarga a baja presión. u Al establecer entre los electrodos una diferencia de potencial alta, el gas era atravesado por unos rayos procedentes del cátodo, los rayos catódicos, emitiéndose una luz característica para cada gas. u

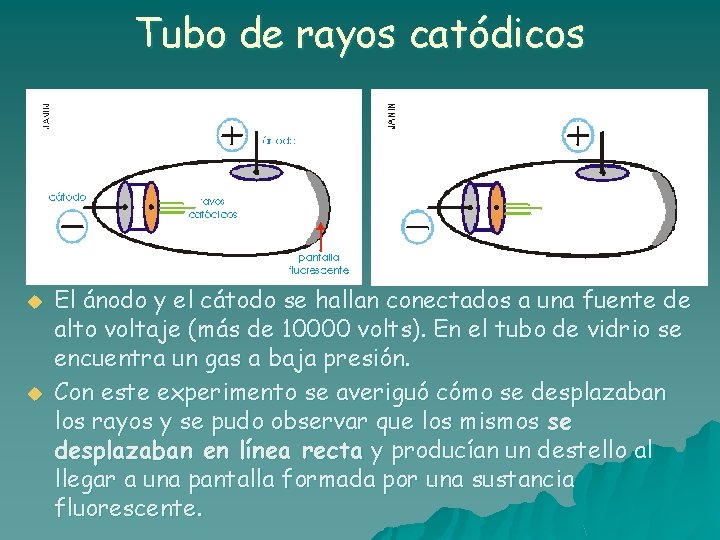
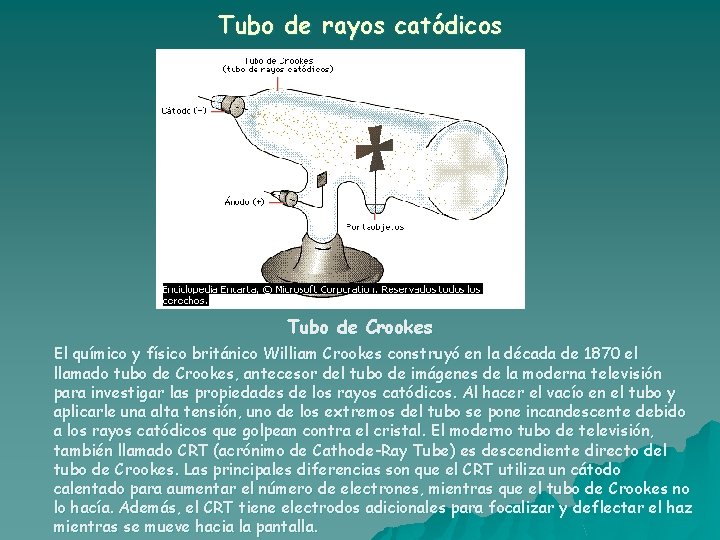
Tubo de rayos catódicos u u El ánodo y el cátodo se hallan conectados a una fuente de alto voltaje (más de 10000 volts). En el tubo de vidrio se encuentra un gas a baja presión. Con este experimento se averiguó cómo se desplazaban los rayos y se pudo observar que los mismos se desplazaban en línea recta y producían un destello al llegar a una pantalla formada por una sustancia fluorescente.

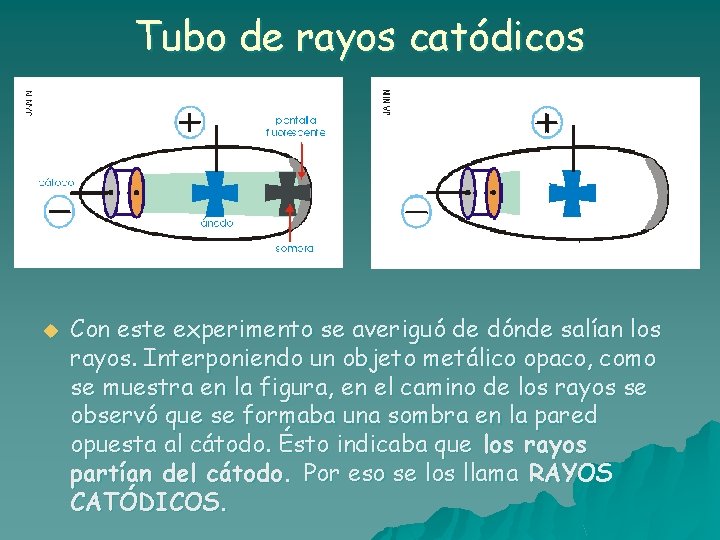
Tubo de rayos catódicos u Con este experimento se averiguó de dónde salían los rayos. Interponiendo un objeto metálico opaco, como se muestra en la figura, en el camino de los rayos se observó que se formaba una sombra en la pared opuesta al cátodo. Ésto indicaba que los rayos partían del cátodo. Por eso se los llama RAYOS CATÓDICOS.

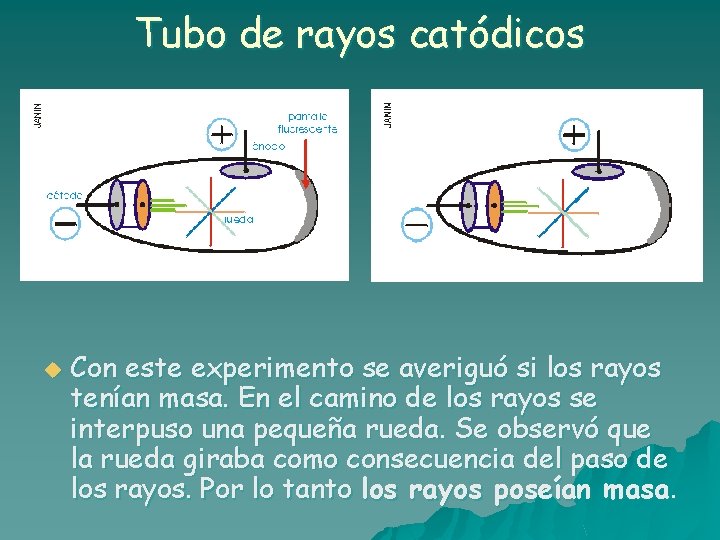
Tubo de rayos catódicos u Con este experimento se averiguó si los rayos tenían masa. En el camino de los rayos se interpuso una pequeña rueda. Se observó que la rueda giraba como consecuencia del paso de los rayos. Por lo tanto los rayos poseían masa.

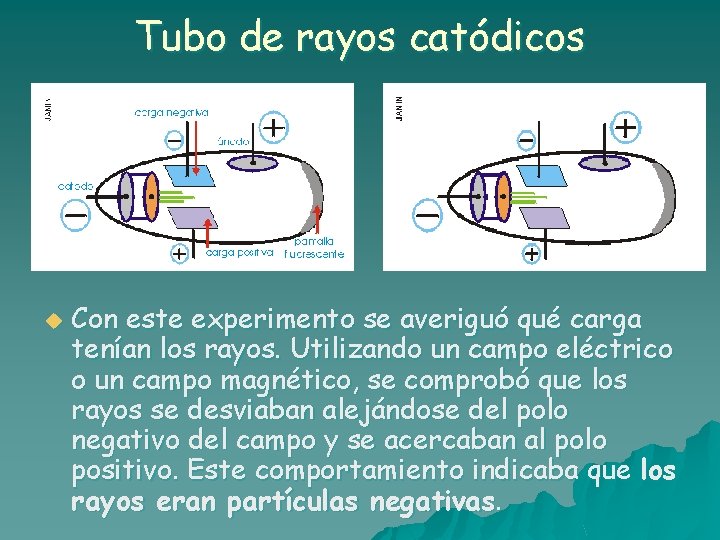
Tubo de rayos catódicos u Con este experimento se averiguó qué carga tenían los rayos. Utilizando un campo eléctrico o un campo magnético, se comprobó que los rayos se desviaban alejándose del polo negativo del campo y se acercaban al polo positivo. Este comportamiento indicaba que los rayos eran partículas negativas.

Rayos catódicos: descubrimiento del electrón u u William Crookes (1832 -1919) mejorando las condiciones de vacío demostró que los rayos catódicos tienen estas propiedades: 1. Se propagan en línea recta. 2. Se desvían cuando se les somete a campos eléctricos y magnéticos. 3. Provocan la luminiscencia de los cuerpos. De acuerdo con estas propiedades dedujo que los rayos catódicos eran un flujo de partículas de dimensiones mucho menores que los átomos. Más tarde se demostró que las propiedades de los rayos catódicos eran independientes de la composición del gas residual, por tanto las partículas integrantes de estos rayos tienen que ser componentes de todos los átomos. Thomson (1897) con un tubo de descarga como el de la figura, utlilizando un campo eléctrico y otro magnético perpendiculares, para desviar de forma conveniente el haz de rayos catódicos, determinó la relación carga masa de estas partículas: A esta primera partícula se le denominó electrón como se había sugerido a raíz de los experimentos de electrolisis, para el portador de la carga mínima.

Tubo de rayos catódicos Tubo de Crookes El químico y físico británico William Crookes construyó en la década de 1870 el llamado tubo de Crookes, antecesor del tubo de imágenes de la moderna televisión para investigar las propiedades de los rayos catódicos. Al hacer el vacío en el tubo y aplicarle una alta tensión, uno de los extremos del tubo se pone incandescente debido a los rayos catódicos que golpean contra el cristal. El moderno tubo de televisión, también llamado CRT (acrónimo de Cathode-Ray Tube) es descendiente directo del tubo de Crookes. Las principales diferencias son que el CRT utiliza un cátodo calentado para aumentar el número de electrones, mientras que el tubo de Crookes no lo hacía. Además, el CRT tiene electrodos adicionales para focalizar y deflectar el haz mientras se mueve hacia la pantalla.

Modelo atómico de Thomson propuso un modelo atómico, que consideraba al átomo como una nube difusa y esférica de carga positiva, con los electrones flotando en esa nube, como pasas embebidas en un pudín u La carga positiva era la necesaria para compensar la negativa de los electrones. u Este modelo tan sencillo explicaba, mediante la ganancia o pérdida de electrones: u – Los fenómenos de electrización. – La formación de iones y la corriente eléctrica.

Rayos X u 1. 2. 3. u u Wilheim Röentgen en 1895 observó que durante el funcionamiento de los tubos de descarga, si se introducía una pieza metálica adicional, el choque de los rayos catódicos con dicha pieza producía una nueva radiación que tenía las siguientes propiedades: Ser capaz de atravesar materiales de gran espesor. Ennegrecer placas fotográficas. No desviarse ante un campo eléctrico o magnético, lo que significa que no contiene carga eléctrica. Debido a la naturaleza desconocida de estos rayos llamó rayos X. Hoy sabemos que se trata de radiación electromagnética de alta energía, es decir, luz no visible.

u u u Radiactividad Henry A. Becquerel (18521908), como consecuencia del descubrimiento de los rayos X, investigó la fluorescencia producida por una sal de uranio En 1896 observó que esta sal y todos los compuestos que contenían uranio emitían una radiación similar a los rayos X. Había descubierto la radiactividad. Marie Curie (1867 -1934) y Pierre Curie (1859 -1906) descubrieron otros elementos radiactivos: El polonio y el radio. Más tarde se comprobó que la radiación emitida por el radio estaba formada por tres componentes, ya que al someterla a campos eléctricos y magnéticos dos haces se desviaban en sentidos opuestos y un tercero no se desviaba Rutherford les puso nombre a estas radiaciones ( ver figura):

Modelo atómico de Rutherford u u Rutherford y sus colaboradores bombardearon láminas finas metálicas de oro con radiación α. Si se va girando el microscopio se puede calcular la fracción de partículas alfa que se desvían a distintos ángulos: – La mayor parte de las partículas atraviesan la lámina sin desviarse. – Un número relativamente pequeño experimentan desviaciones pequeñas. – Y algunas de ellas, muy pocas, se desviaban ángulos mayores de 90º, es decir rebotan. De lo observado Rutherford concluyó: 1. El átomo está prácticamente vacío. Pues la mayor parte de las partículas no se desvían 2. Existe una zona de carga positiva pero de dimensiones reducidas a la que llamó núcleo. 3. Pudo calcular el radio del núcleo y su carga determinando la fracción de partículas alfa que se desvían a distintos ángulos A partir de estos resultados propuso un modelo llamado “modelo nuclear del átomo”: – Un átomo está formado por núcleo y corteza. – En el núcleo se encuentra la carga positiva y casi toda la masa del átomo. – El resto del átomo está prácticamente vacío y a gran distancia del núcleo se encuentra la corteza electrónica.

Descubrimiento del protón u u Cuando se emplean tubos de descarga con el cátodo perforado, se observa detrás de él, un haz de luz producido por determinados rayos que atraviesan los orificios. (Rayos canales o rayos positivos). Los estudió Thomson en 1911 y obtuvo la relación q/m cuando el gas residual era hidrógeno. El valor obtenido coincidía con el que se calculó en la electrólisis para los iones hidrógeno. Si el gas residual era otro la relación q/m siempre era menor. En 1919 Rutherford bombardeó con partículas alfa gas nitrógeno y observó que algunas daban lugar a oxígeno -17 y otra partícula cuyas propiedades coincidían con las observadas por Thomson en los rayos positivos, cuando el gas residual era hidrógeno: Posteriormente Rutherford observó que esta partícula se producía en otras reacciones nucleares, con lo que dedujo que era una partícula elemental a la que llamó protón.

Descubrimiento del neutrón Pero Rutherford se dio cuenta de que la masa del núcleo no era la suma de los protones que contenía u Así una partícula alfa (núcleos de helio) tenía una carga de dos protones pero su masa era aproximadamente cuatro veces la del protón. u Por eso supuso que en el núcleo tenía que existir otra partícula de masa similar pero sin carga u En 1932 James Chadwick (1891 -1974) descubrió el neutrón en la siguiente reacción nuclear: u



Dificultades del modelo de Rutherford Si los electrones (partículas cargadas) giraran, debían de emitir energía según la teoría electromagnética clásica, con lo que se precipitarían en el núcleo y el átomo sería inestable.

Interacciones de la radiación con la materia



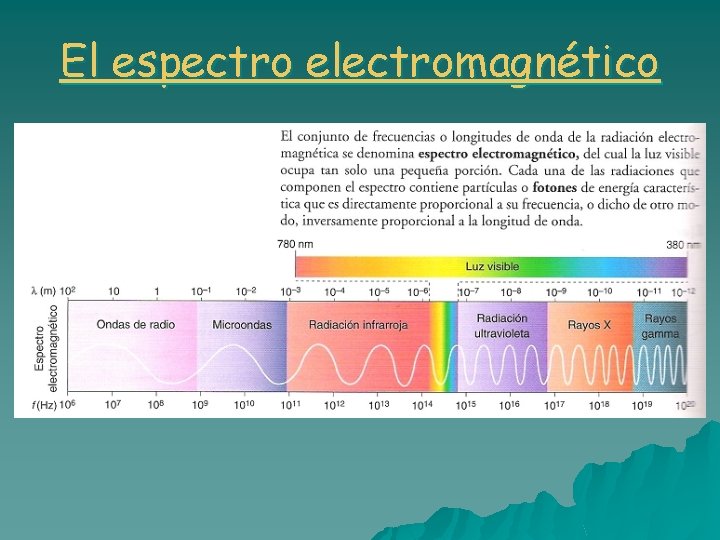
El espectro electromagnético

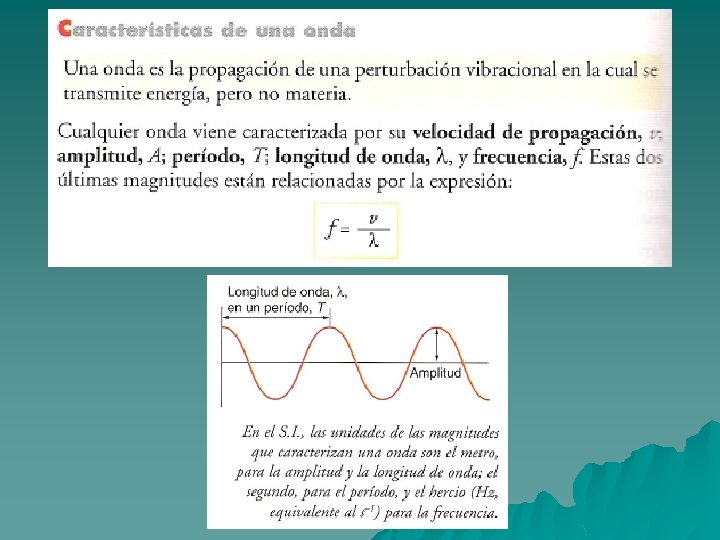
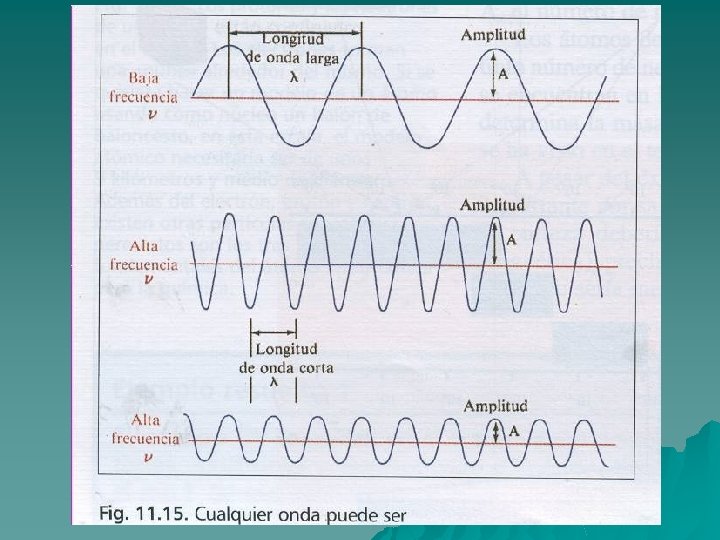
El espectro electromagnético u El sol y los cuerpos incandescentes emiten luz de todas las frecuencias. Esto es el llamado espectro continuo. u Newton, mediante un prisma óptico obtuvo el espectro del sol. u El prisma óptico descompone los rayos solares en los distintos colores de la luz. u Hoy se sabe que el visible es solo una parte del llamado espectro electromagnético. u El espectro es el conjunto de valores de las frecuencias de radiación que emite un cuerpo.

Espectroscopio u Joseph von Fraunhoffer (1787 – 1826) inventó el espectroscopio y con él analizó la luz emitida por el sol y las estrellas. Detectó líneas oscuras en estos espectros y pudo ver con claridad la más brillantes.


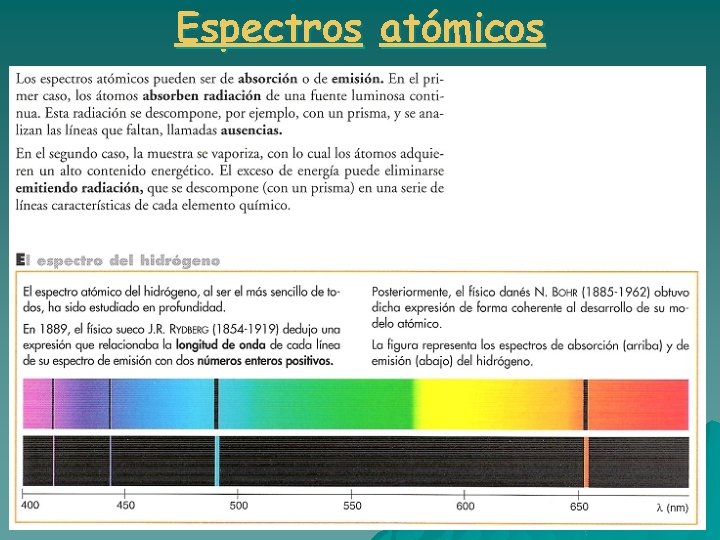
Espectros atómicos

Espectros atómicos u u Johan Balmer en 1885 dedujo una fórmula empírica que calculaba las longitudes de onda de las nueve líneas de la serie del espectro del hidrógeno ( las conocidas hasta entonces): Johannes R. Rydberg (1854 – 1919) intentó obtener fórmulas similares para otros átomos y puso la fórmula de Balmer en función del inverso de la longitud de onda:

Espectros atómicos u El que los espectros atómicos estén formados por un conjunto de líneas lleva a pensar que los átomos de los gases excitados deben tener un número limitado de valores de energía. u Pero la física clásica y el modelo atómico nuclear eran incapaces de explicar los espectros atómicos. u Había que buscar un nuevo modelo atómico…

Hipótesis de Planck u u - Max Planck (1858 – 1947) presento el 14/12/1900, la teoría que explica la radiación térmica de los cuerpos. Había nacido “la mecánica cuántica”. Planck introducía en su trabajo una hipótesis que estaba en contra de un principio básico de la Física clásica: “Ésta suponía que la energía, igual que cualquier otra magnitud física podía tener un valor cualquiera y aumentar o disminuir de una forma contínua”. Pero Plank supuso: Que los átomos que emiten la radiación se comportan como osciladores armónicos. Cada oscilador absorbe o emite energía de la radiación en cantidad proporcional a su frecuencia de oscilación : Los paquetes de energía se llaman “cuantos”, de manera que la energía de los osciladores está “cuantizada” y “n” es un número cuántico.

Modelo atómico de Böhr u u Niels Böhr (1885 – 1962) propuso en 1913 un modelo que explicaba el espectro del hidrógeno. Los postulados en los que se fundamenta este modelo son: 1. El electrón se mueve en una órbita circular alrededor del núcleo, debido a la atracción eléctrica de éste: 2. Para el electrón sólo son posibles órbitas para las que se cumple: 3. Mientras el electrón se mueve en una de las órbitas permitidas no radia energía, la energía es constante (órbita estacionaria). Si el electrón está inicialmente en una órbita de energía E 1 y pasa a una órbita de energía E 2 (E 2<E 1), emite una radiación electromagnética de frecuencia: 4. Por el contrario para pasar del nivel de energía E 2 al E 1 debe absorber una radiación electromagnética de la misma frecuencia anterior.

Modelo atómico de Bohr u u u Del segundo postulado se deduce que el electrón solo puede tener determinados valores de la energía que vienen dados en función de n, el número cuántico: Cuando el electrón se encuentra en el nivel u órbita de más baja energía (n=1), está en el estado fundamental. Si absorbe energía y pasa a un nivel superior, el átomo se encuentra en un estado excitado. Al cabo de cierto tiempo emite energía en forma de radiación electromagnética , pasando al estado fundamental (Espectros de emisión).

Modelo atómico de Bohr

Estructura electrónica de los átomos u u u u Pero el modelo de Böhr no sirve para explicar los espectros de átomos polielectrónicos. Cuando se obtienen espectros de hidrógeno con espectroscopios de alta resolución aparecen líneas desdobladas (estructura fina). Para interpretar esta estructura fina, Sommerfeld (18651951) supuso que el electrón del átomo de hidrógeno podía girar también en órbitas elípticas. Esto le llevó a introducir otro número cuántico, relacionado con la forma de las órbitas. Por tanto la energía del electrón en las distintas órbitas viene determinada por el valor de esos dos números cuánticos. De esta forma pudo interpretarse la estructura fina. En 1896 Peter Zeeman (anterior a la teoría de Böhr) observó que cuando los átomos de un elemento se excitan en presencia de un campo magnético las líneas del espectro se desdoblan, lo que obligó a introducir un tercer número cuántico. Con tanto añadido la teoría de Böhr-Sommerfield perdía elegancia, era necesario un cambio conceptual brusco, LA TEORÍA CUÁNTICA

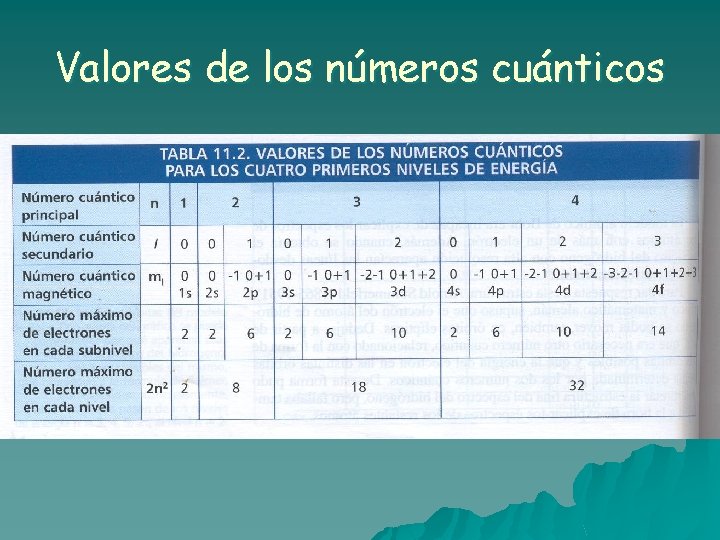
Estructura electrónica de los átomos. Teoría cuántica. u Erwin Schrödinger (1887 -1961) y Werner Heisenberg (1901 – 1976) crearon la nueva teoría cuántica de la que surgen como consecuencia de un tratamiento matemático los números cuánticos que caracterizan los estados energéticos posibles de los electrones en los átomos: 1. Número cuántico principal (n): Puede tomar los valores 1, 2, 3, …y es el que más influye en la energía. Caracteriza los niveles de energía. 2. Número cuántico secundario o del momento angular (l): Afecta en menor medida a los valores de energía y toma los valores siguientes para un valor de n dado: l=0, 1, 2, … n-1. Caracteriza los subniveles de energía. Cada subnivel corresponde a un tipo de orbital atómico. A los distintos valores se les asignan letras: 0(s), 1(p), 2(d), 3(f)…

Estructura electrónica de los átomos. Teoría cuántica. 3. Número cuántico magnético (ml): Aparece como consecuencia del desdoblamiento de los subniveles en presencia de un campo magnético. Indica las posibles orientaciones que puede tomar un orbital dado. Para un valor de l toma los valores: ml = -l, -l+1, … 0, …. l-1, l 4. Número cuántico de espín (ms): Cada electrón posee uno de estos valores: +1/2 y -1/2 y están relacionados con una propiedad magnética propia de los electrones.

Valores de los números cuánticos

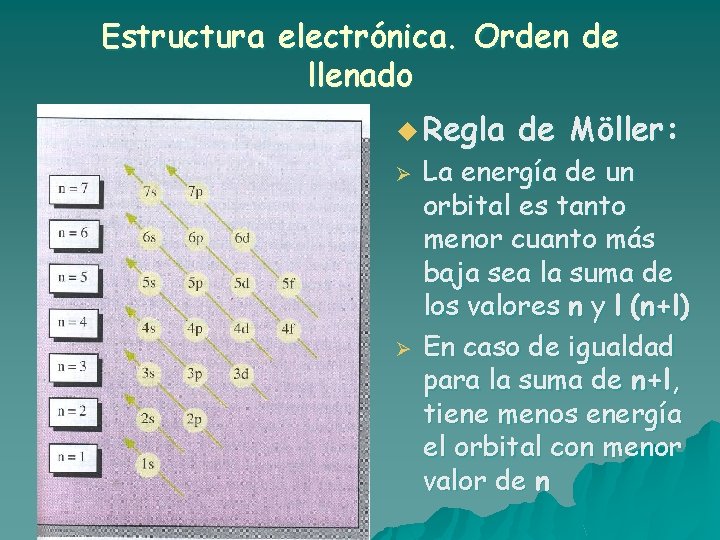
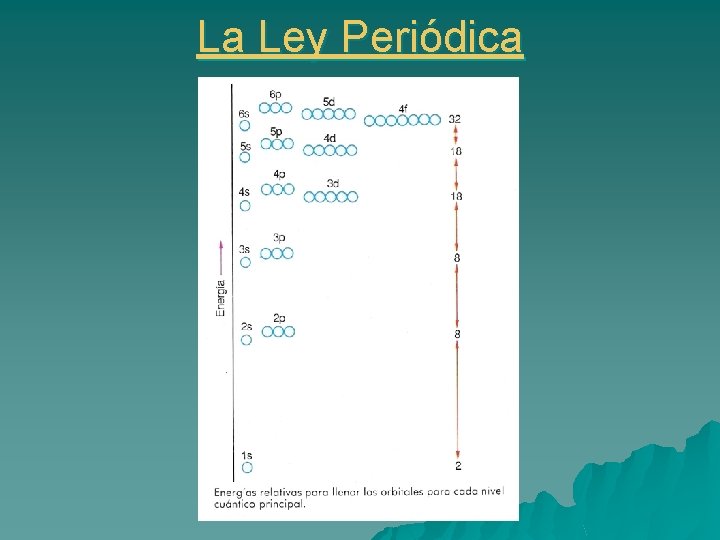
Estructura electrónica. Orden de llenado u Regla Ø Ø de Möller: La energía de un orbital es tanto menor cuanto más baja sea la suma de los valores n y l (n+l) En caso de igualdad para la suma de n+l, tiene menos energía el orbital con menor valor de n

Estructura electrónica. Orden de llenado u Principio de construcción progresiva: La u Principio de exclusión de Pauli: Establece que en un u Principio de Hund: Nos indica que cuando en un u configuración de un elemento se obtiene a partir de la del elemento anterior añadiendo un nuevo electrón, llamado electrón diferenciador. átomo polielectrónico no puede haber dos electrones que tengan los cuatro números cuánticos iguales. subnivel energético existen varios orbitales disponibles, los electrones tienden a ocupar el máximo número de ellos, y, además, con espines paralelos. La configuración electrónica que se refiere al nivel energético más externo ocupado de un elemento, se denomina configuración electrónica de la capa de valencia

Sistema periódico Breve historia de la Tabla Periódica (1) u u u Es una agrupación en la que aparecen ordenados todos los elementos químicos conocidos. Se distribuyen en filas y columnas, llamadas respectivamente períodos y grupos. Joham W. Döbereiner (1780 -1849), en 1817 hizo uno de los primeros intentos de clasificación: – Indicó que muchos elementos podían agruparse por tener propiedades similares en tríadas (Lítio, Sodio, Potasio), (cloro, bromo y yodo) etc. En cada tríada el elemento central tiene una masa atómica aproximadamente igual a la media de los otros dos. u En 1864, A. R. Newlands propuso la ley de las octavas: Al ordenar los elementos en orden creciente de masas atómicas, cada uno tenía propiedades similares al que estaba ocho lugares antes y al que se encontraba ocho lugares después.

Sistema periódico Breve historia de la Tabla Periódica (2) u En 1869, Lothar Meyer y Dimitri I. Mendeleiev propusieron dos tablas muy parecidas: – Mendeliev ordenó los 63 elementos conocidos entonces bajo el criterio de masas atómicas crecientes, con lo que logró que los elementos con propiedades químicas similares quedaran en la misma columna, aunque en algunos casos para conseguir esto, invirtiera la colocación de ciertas parejas de elementos y cuando no se correspondían las propiedades dejaba un hueco (elemento no descubierto). De esta forma predijo la existencia de cinco elementos: Sc, Ge, Ga, Tc y Re. En 1894 Ramsay y Rayleigh descubrieron el argón y durante los años siguientes se descubrieron otros cuatro elementos. A los cinco se les llamó gases nobles: Parecían mantenerse al margen del resto de los elementos y no se combinaban con ellos. Para incorporarlos a la tabla hubo que añadir una columna más.

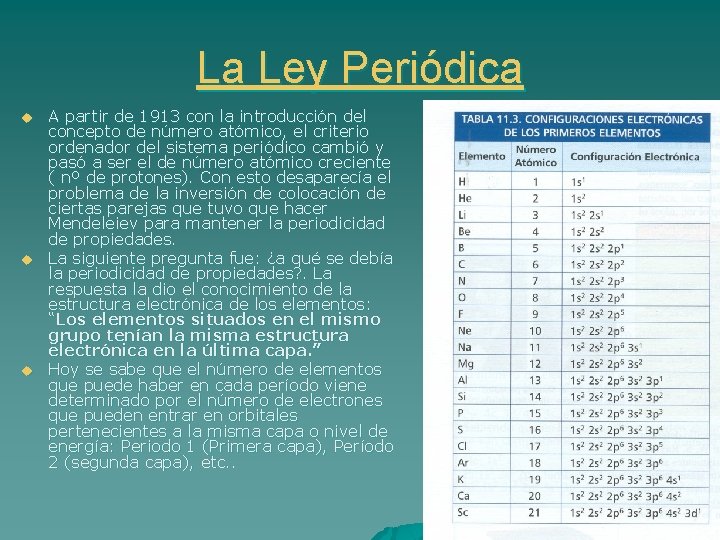
La Ley Periódica u u u A partir de 1913 con la introducción del concepto de número atómico, el criterio ordenador del sistema periódico cambió y pasó a ser el de número atómico creciente ( nº de protones). Con esto desaparecía el problema de la inversión de colocación de ciertas parejas que tuvo que hacer Mendeleiev para mantener la periodicidad de propiedades. La siguiente pregunta fue: ¿a qué se debía la periodicidad de propiedades? . La respuesta la dio el conocimiento de la estructura electrónica de los elementos: “Los elementos situados en el mismo grupo tenían la misma estructura electrónica en la última capa. ” Hoy se sabe que el número de elementos que puede haber en cada período viene determinado por el número de electrones que pueden entrar en orbitales pertenecientes a la misma capa o nivel de energía: Periodo 1 (Primera capa), Período 2 (segunda capa), etc. .

La Ley Periódica

La Ley Periódica

Algunas observaciones sobre la estructura electrónica

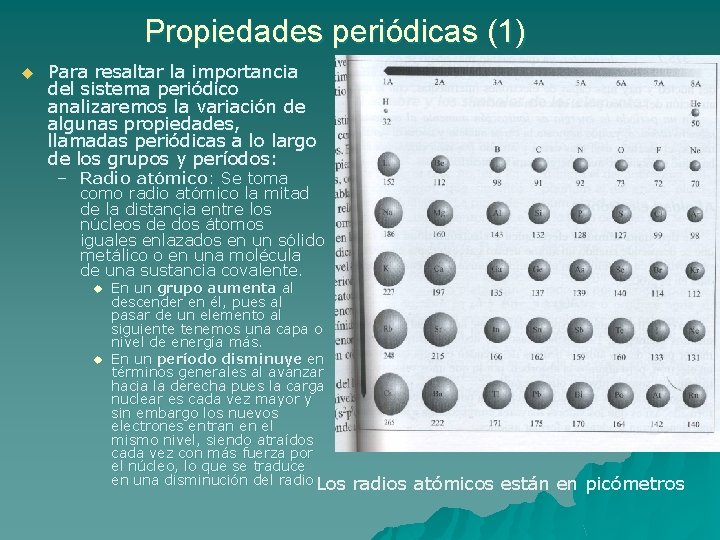
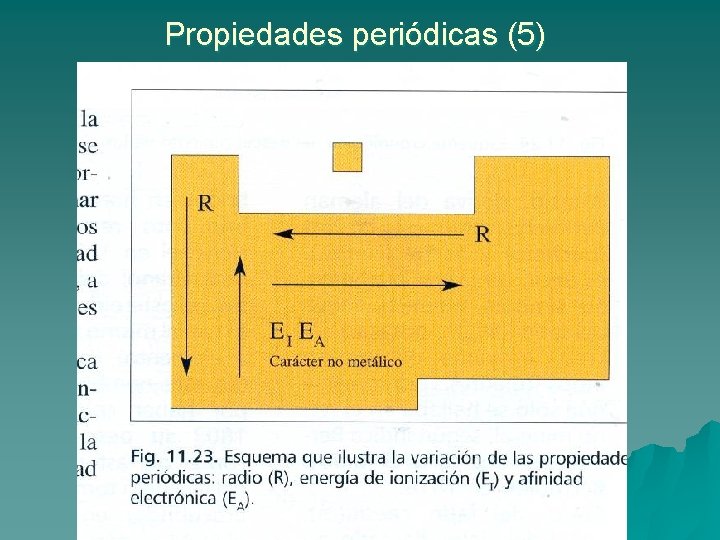
Propiedades periódicas (1) u Para resaltar la importancia del sistema periódico analizaremos la variación de algunas propiedades, llamadas periódicas a lo largo de los grupos y períodos: – Radio atómico: Se toma como radio atómico la mitad de la distancia entre los núcleos de dos átomos iguales enlazados en un sólido metálico o en una molécula de una sustancia covalente. u u En un grupo aumenta al descender en él, pues al pasar de un elemento al siguiente tenemos una capa o nivel de energía más. En un período disminuye en términos generales al avanzar hacia la derecha pues la carga nuclear es cada vez mayor y sin embargo los nuevos electrones entran en el mismo nivel, siendo atraídos cada vez con más fuerza por el núcleo, lo que se traduce en una disminución del radio Los radios atómicos están en picómetros

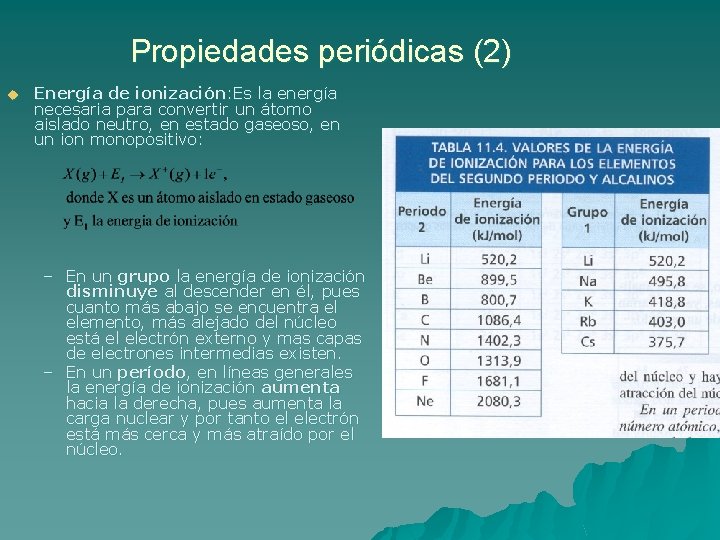
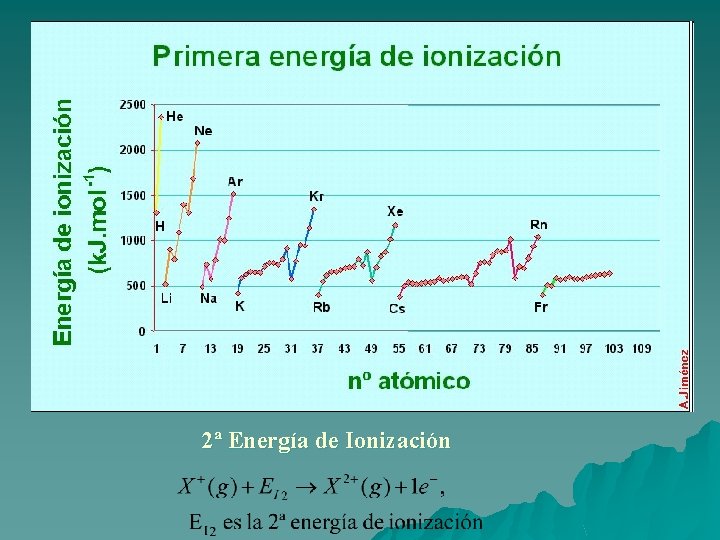
Propiedades periódicas (2) u Energía de ionización: Es la energía necesaria para convertir un átomo aislado neutro, en estado gaseoso, en un ion monopositivo: – En un grupo la energía de ionización disminuye al descender en él, pues cuanto más abajo se encuentra el elemento, más alejado del núcleo está el electrón externo y mas capas de electrones intermedias existen. – En un período, en líneas generales la energía de ionización aumenta hacia la derecha, pues aumenta la carga nuclear y por tanto el electrón está más cerca y más atraído por el núcleo.

2ª Energía de Ionización

Propiedades periódicas (3) u La afinidad electrónica o electroafinidad es la energía que se intercambia (normalmente se desprende) cuando un átomo neutro gaseoso capta un electrón y se convierte en un ión negativo: – Disminuye al descender en los grupos. – Aumenta en líneas generales al avanzar hacia la derecha en los períodos.

Propiedades periódicas ELECTRONEGATIVIDAD Es la capacidad que tiene un átomo de un elemento dado de atraer hacia sí el par de electrones compartidos en un enlace covalente. Está íntimamente relacionada con la energía de ionización y con la afinidad electrónica. Su variación en la tabla es la misma que dichas propiedades.

Propiedades periódicas (4) u Carácter metálico y no metálico: – A los elementos que tienen valores bajos de la energía de ionización, de la afinidad electrónica y de la electronegatividad se les llama metales y tienen tendencia por tanto a perder electrones (formar iones positivos o cationes). – A los elementos que tienen valores altos de la energía de ionización, la electroafinidad y electronegatividad y por lo tanto tienen tendencia a convertirse en aniones se les llama no metales. – La mayor parte de los elementos tienen carácter metálico más o menos marcado, excepto los que se encuentran en la parte derecha de la tabla. – Lógicamente el carácter metálico es tanto mayor cuanto más hacia abajo y hacia la izquierda se encuentre el elemento (menor EI y EA).

Propiedades periódicas (5)
 Peridico
Peridico El peridico
El peridico Peridico
Peridico Peridico reforma
Peridico reforma Peridico la jornada
Peridico la jornada El peridico
El peridico Tema-tema teologi perjanjian lama
Tema-tema teologi perjanjian lama El tema y sub tema
El tema y sub tema Entrevista no estructurada
Entrevista no estructurada Translate
Translate Delimitacion del tema ejemplo
Delimitacion del tema ejemplo Departamento de zootecnia ufpr
Departamento de zootecnia ufpr Departamento de investigación en una agencia de publicidad
Departamento de investigación en una agencia de publicidad Organización del departamento de enfermería
Organización del departamento de enfermería Departamento solicitante
Departamento solicitante Demanda insatisfecha formula
Demanda insatisfecha formula Departamento de housekeeping
Departamento de housekeeping Organigrama de departamento de contabilidad
Organigrama de departamento de contabilidad Departamento forestal
Departamento forestal Departamento de higiene de los alimentos
Departamento de higiene de los alimentos La señora guajardo compra un departamento
La señora guajardo compra un departamento Departamento de farmacologia
Departamento de farmacologia Unidad 1 el departamento de recursos humanos
Unidad 1 el departamento de recursos humanos Projeto doutorado
Projeto doutorado Objetivos del departamento de enfermería
Objetivos del departamento de enfermería Atributo multivaluado entidad relacion
Atributo multivaluado entidad relacion Departamento de economia
Departamento de economia Potencialidad de cochabamba
Potencialidad de cochabamba Departamento del valle del cauca
Departamento del valle del cauca Departamento del quiche
Departamento del quiche Preparatoria abierta puebla gratuita
Preparatoria abierta puebla gratuita Organismos pluricelulares
Organismos pluricelulares Departamento ceres
Departamento ceres Departamento ceres
Departamento ceres El significado de departamento
El significado de departamento Antigenos virales
Antigenos virales Planos sistema europeo
Planos sistema europeo Sistema 1 sistema 2
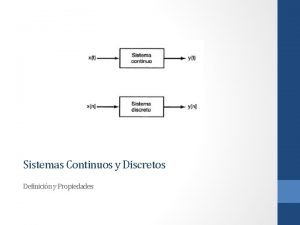
Sistema 1 sistema 2 Diferencia entre sistema continuo y discreto
Diferencia entre sistema continuo y discreto Sistema semashko o sistema centralizado
Sistema semashko o sistema centralizado Texto informativo con preguntas
Texto informativo con preguntas Modelos cognitivos
Modelos cognitivos Modelo sistemico y ecologico
Modelo sistemico y ecologico Modelos de la psicopatología
Modelos de la psicopatología Personalidad concepto
Personalidad concepto Tipos de aps
Tipos de aps Modelo clasico de diseño de puestos
Modelo clasico de diseño de puestos Programación lineal
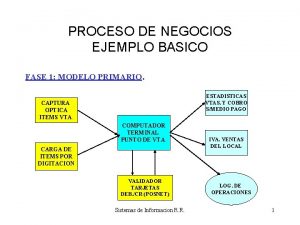
Programación lineal Modelos de negocios ejemplos
Modelos de negocios ejemplos Modelo atomico de bohr limitaciones
Modelo atomico de bohr limitaciones Modelos eruditos
Modelos eruditos Modelo de registro
Modelo de registro