QUMICA PROF CARLOS EDUARDO Modelos Atmicos Dalton Modelos








![(SSA- UPE- 2009) O número total de elétrons do íon complexo [X(NH 3)4]2+ é (SSA- UPE- 2009) O número total de elétrons do íon complexo [X(NH 3)4]2+ é](https://slidetodoc.com/presentation_image/016ecfe49b2d8052c39e485d0c21b0bb/image-10.jpg)
![[X(NH 3)4]2+ Dados: N = 4 x 7 = 28 N=7 H = 12 [X(NH 3)4]2+ Dados: N = 4 x 7 = 28 N=7 H = 12](https://slidetodoc.com/presentation_image/016ecfe49b2d8052c39e485d0c21b0bb/image-11.jpg)




- Slides: 16

QUÍMICA PROF. CARLOS EDUARDO

Modelos Atômicos Dalton

Modelos Atômicos Thomson

Modelos Atômicos Thomson

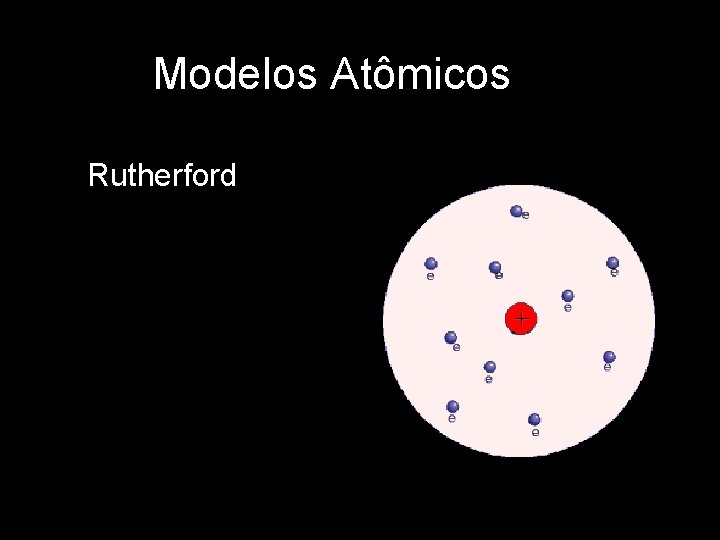
Modelos Atômicos Rutherford

Modelos Atômicos Rutherford

Modelos Atômicos Bohr

Modelos Atômicos Quântico

- (Puc RS) I. Orbital é a região do espaço onde a probabilidade de encontrar o átomo é máxima II. Quando o elétron passa de um nível de energia interno para outro mais externo, emite um quantum de energia. III. O elétron apresenta comportamento duplo, isto é, pode ser interpretado como partícula ou onda, conforme o fenômeno estudado. IV. É impossível determinar simultaneamente a posição e a velocidade de um elétron em um átomo. Pela análise das afirmativas, conclui-se que está correta a alternativa a) I e II b) I e III c) II e III d) II e IV e) III e IV
![SSA UPE 2009 O número total de elétrons do íon complexo XNH 342 é (SSA- UPE- 2009) O número total de elétrons do íon complexo [X(NH 3)4]2+ é](https://slidetodoc.com/presentation_image/016ecfe49b2d8052c39e485d0c21b0bb/image-10.jpg)
(SSA- UPE- 2009) O número total de elétrons do íon complexo [X(NH 3)4]2+ é igual a 68. A distribuição eletrônica do cátion X 2+ é: Dados: N(Z=7) e H(Z=1) a) 1 s 22 p 63 s 23 p 64 s 23 d 8 b) 1 s 22 p 63 s 23 p 64 s 23 d 10 c) 1 s 22 p 63 s 23 p 63 d 10 d) 1 s 22 p 63 s 23 p 65 s 23 d 10 e) 1 s 22 p 63 s 23 p 64 d 10
![XNH 342 Dados N 4 x 7 28 N7 H 12 [X(NH 3)4]2+ Dados: N = 4 x 7 = 28 N=7 H = 12](https://slidetodoc.com/presentation_image/016ecfe49b2d8052c39e485d0c21b0bb/image-11.jpg)
[X(NH 3)4]2+ Dados: N = 4 x 7 = 28 N=7 H = 12 x 1 = 12 H=1 Total = 68 X + N 4 + H 12 = 68 X + 28 +12 = 68 X = 68 – 28 – 12 X = 28

1 s 2 Diagrama de Pauling 2 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 4 p 6 4 d 10 4 f 14 5 s 2 5 p 6 5 d 10 5 f 14 6 s 2 6 p 6 6 d 10 7 s 2 7 p 6 3 d 8

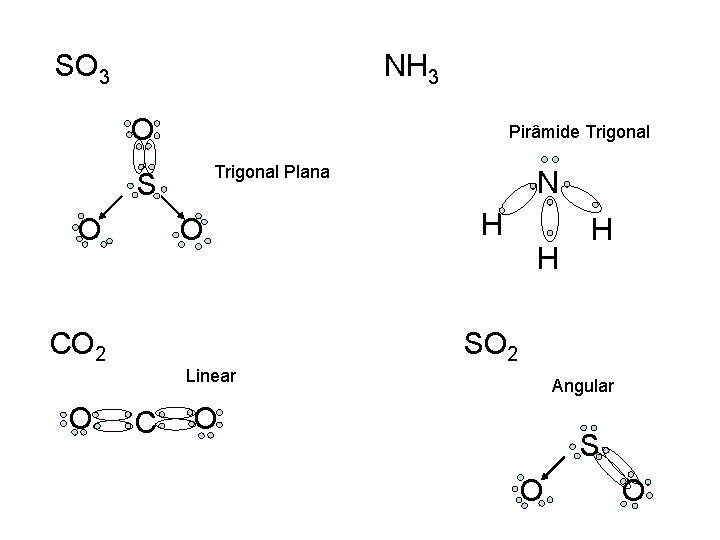
(UFRGS-RS) O modelo de repulsão dos pares de elétrons da camada de valência estabelece que a configuração eletrônica dos elementos que constituem uma molécula é responsável pela sua geometria molecular. Relacione as moléculas com as respectivas geometrias. Dados: números atômicos: H(Z=1), C(Z=6), N(Z=7), O(Z=8), S(Z=16). Coluna I: Geometria molecular 1. linear 2. quadrada 3. trigonal plana 4. angular 5. pirâmide trigonal 6. bipirâmide trigonal Coluna II: Moléculas ( ) SO 3 ( ) NH 3 ( ) CO 2 ( ) SO 2 A relação numérica, de cima para baixo, da coluna II, que estabelece a sequência de associações corretas é: a) 5 – 3 – 1 – 4 b) 3 – 5 – 4 – 6 c) 3 – 5 – 1 – 4 d) 5 – 3 – 2 – 1 e) 2 – 3 – 1 – 6

Dados: números atômicos: H(Z=1), C(Z=6), N(Z=7), O(Z=8), S(Z=16). H - 1 s 1 C - 1 s 2 2 p 2 N - 1 s 2 2 p 3 O - 1 s 2 2 p 4 S - 1 s 2 2 p 6 3 s 2 3 p 4

SO 3 NH 3 O Pirâmide Trigonal Plana S O O CO 2 N H H H SO 2 Linear O C Angular S O O O