MODELOS ATMICOS MODELOS ATMICOS FILSOFOS GREGOS Tales de















- Slides: 26

MODELOS ATÔMICOS

MODELOS ATÔMICOS FILÓSOFOS GREGOS Tales de Mileto (625 -547) • A ÁGUA é a essência de tudo. Anaxímenes (séc. VI a. C. ) • O AR seria o elemento que constituiria O universo. Heráclito (540 -480 a. C. ) • O FOGO é o terceiro elemento da Matéria, capaz de transformá-la. Empédocles (480 -430 a. C. ) • A TERRA é o quarto elemento da Matéria. Aristóteles (séc. IV a. C. ) • Água, Ar, Fogo e Terra podem se transformar um no outro, dando origem a Novos materiais. Professor Fabiano Ramos Costa

MODELOS ATÔMICOS FILÓSOFOS GREGOS Demócrito (470 -360 a. C. ) Leucipo (séc V a. C. ) • A matéria não pode ser dividida infinitamente. • A matéria tem um limite com as Características do todo. • Este limite seriam partículas bastante Pequenas que não poderiam ser Divididas, os ÁTOMOS. NÃO DIVIDIR ÁTOMO = INDIVISÍVEL Professor Fabiano Ramos Costa

MODELOS ATÔMICOS 1º MODELO ATÔMICO EXPERIMENTAL John DALTON (1766 -1844) • Os átomos são esféricos e maciços. • São indivisíveis e indestrutíveis • Átomos de elementos diferentes têm Massas diferentes. • Átomos combinam-se em várias Proporções de números simples, Formando substâncias. • Durante uma reação química, os Átomos não são criados nem destruídos, Apenas trocam de parceiros para Produzirem novas substâncias. DEFEITO DO MODELO • Não explicou a eletricidade. • Não explicou a radioatividade. Professor Fabiano Ramos Costa

MODELOS ATÔMICOS A ELETRICIDADE E O ELÉTRON Tales de Mileto (Antigüidade) • Lã atritada a pedaço de âmbar (elektron) Eletriza-se. Michael Faraday (1791 -1867) • Uma solução atravessada pela corrente Elétrica, deposita materiais com massas Proporcionais à corrente. • A eletricidade está relacionada com Uma partícula. William Crookes (1832 -1919) • Ampolas de gás a baixa pressão submetida A elevada diferença de potencial emitiam raios Luminosos do pólo negativo para o positivo. J. J. Thomson (1856 -1909 • Os raios catódicos das ampolas de Crookes Desviavam na direção do pólo positivo, portanto Têm carga elétrica negativa, chamados ELÉTRONS. Professor Fabiano Ramos Costa

MODELOS ATÔMICOS O MODELO ATÔMICO DE DALTON PROPUNHA QUE O ÁTOMO ERA UMA ESFERA INDIVISÍVEL E INDESTRUTÍVEL, COMPLETAMENTE MACIÇA E, SENDO ASSIM, NÃO PODERIA EXPLICAR SATISFATORIAMENTE OS FENÔMENOS ELÉTRICOS DA MATÉRIA. PORTANTO, O MODELO ESTÁ INCORRETO! Professor Fabiano Ramos Costa

MODELOS ATÔMICOS MODELO ATÔMICO DE THOMSON J. J. Thomson (1856 -1909) • O átomo como um todo tem carga nula. • Assim sendo, se há a presença de Elétrons com carga negativa, há também A presença de cargas positivas no átomo. CONTRIBUIÇÃO DE THOMSON SOBRE O MODELO ATÔMICO • Thomson propôs que o átomo seria uma Espécie de bolha gelatinosa, completamente Maciça onde haveria a totalidade da carga Positiva homogeneamente distribuída. • Incrustada nessa gelatina estariam os Elétrons (de carga negativa). • Juntos à massa, formariam uma carga Líquida igual a zero. O MODELO ATÔMICO DE THOMSON FOI DERRUBADO EM 1908 POR ERNERST RUTHERFORD. Professor Fabiano Ramos Costa

MODELOS ATÔMICOS A RADIOATIVIDADE E A DERRUBADA DO MODELO ATÔMICO DE THOMSON Wilhelm Röntgen (1845 -1923) • Estudava raios emitidos pela ampola de Crookes. • Repentinamente, notou que raios Desconhecidos saíam dessa ampola, Atravessavam corpos e impressionavam Chapas fotográficas. • Como os raios eram desconhecidos, Chamou-os de RAIOS-X. Henri Becquerel (1852 -1908) • Tentava relacionar fosforescência de Minerais à base de urânios com os raios-X. • Pensou que dependiam da luz solar. • Num dia nublado, guardou uma amostra De urânio numa gaveta embrulhada em Papel preto e espesso. Mesmo assim, Revelou uma chapa fotográfica. • Inicia-se, portanto os estudos relacionados À RADIOATIVIDADE. Professor Fabiano Ramos Costa

MODELOS ATÔMICOS CASAL CURIE versus RADIOATIVIDADE Pierre Curie (1859 -1906) Marie Curie (1867 -1934) • Estudaram incansavelmente os fenômenos Relacionados à radioatividade, mas não Puderam explicar a origem da radiação Emitida por determinados átomos. SENDO O ÁTOMO, ATÉ ENTÃO, COMPLETAMENTE MACIÇO, COMO EXPLICAR TAL FENÔMENO? QUAL A CARGA DAS PARTÍCULAS RADIOATIVAS: NEGATIVA, POSITIVA OU NEUTRA? QUAL SUA MASSA? Um outro pesquisador, Ernerst Rutherford, Convencido por J. J. Thomson, começa a Pesquisar materiais radioativos e, aos 26 anos De idade, notou que havia dois tipos de radiação: Uma positiva (alfa) e outra negativa (beta). Assim Inicia-se o processo para determinação de NOVO MODELO ATÔMICO. Professor Fabiano Ramos Costa

10/26 MODELOS ATÔMICOS MODELO ATÔMICO DE RUTHERFORD Ernerst Rutherford (1871 -1937) • Observou que as partículas alfa (positivas) Desviavam bem pouco da sua trajetória ao Passar um campo elétrico, quando comparadas Com o desvio das partículas beta (negativas) • CONCLUSÃO: a partícula alfa tem mais Massa que a partícula beta. • A velocidade das partículas alfa era da ordem De 21. 000 km/s. RUTHERFORD PROPÕE A DOIS DE SEUS ALUNOS, JOHANNES HANS WILHELM GEIGER E ERNERST MARSDEN QUE BOMBARDEASSEM FINAS FOLHAS DE METAIS COM AS PARTÍCULAS ALFA A FIM DE COMPROVAR, OU NÃO, O MODELO DE ÁTOMO DE THOMSON. Professor Fabiano Ramos Costa

MODELOS ATÔMICOS MODELO ATÔMICO DE RUTHERFORD Caso o Modelo de Thomson Estivesse CORRETO!!! • Como o átomo, segundo Thomson, era uma Espécie de bolha gelatinosa, completamente Neutra, no momento em que as partículas Alfa (numa velocidade muito grande) colidissem Com esses átomos, passariam direto, podendo Sofrer pequeníssimos desvios de sua trajetória. O QUE REALMENTE FOI OBSERVADO? ? ? ? ? • A maioria das partículas alfa passou direto Pela fina folha de metal, sem sofrer desvios. Contudo, vez em quando, algumas partículas Alfa desviavam bastante da trajetória com ngulos até mesmo superiores a 90º. Algumas partículas retornaram. . . ENTÃO, COMO EXPLICAR TAL FATO? Professor Fabiano Ramos Costa

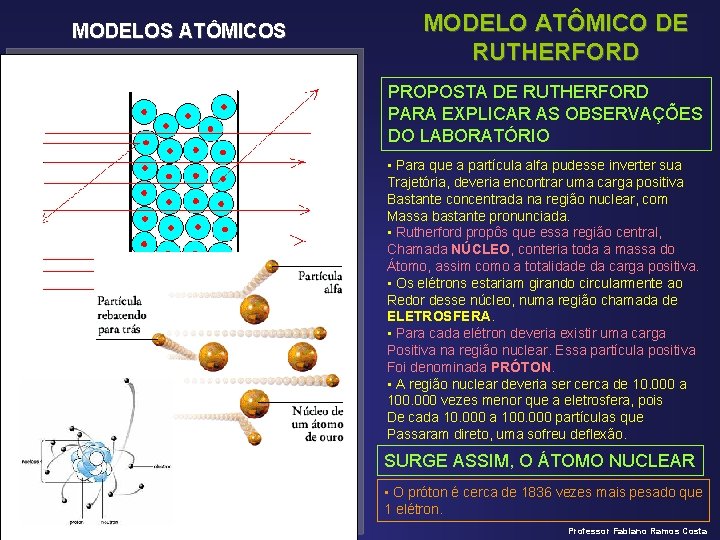
MODELOS ATÔMICOS MODELO ATÔMICO DE RUTHERFORD PROPOSTA DE RUTHERFORD PARA EXPLICAR AS OBSERVAÇÕES DO LABORATÓRIO • Para que a partícula alfa pudesse inverter sua Trajetória, deveria encontrar uma carga positiva Bastante concentrada na região nuclear, com Massa bastante pronunciada. • Rutherford propôs que essa região central, Chamada NÚCLEO, conteria toda a massa do Átomo, assim como a totalidade da carga positiva. • Os elétrons estariam girando circularmente ao Redor desse núcleo, numa região chamada de ELETROSFERA. • Para cada elétron deveria existir uma carga Positiva na região nuclear. Essa partícula positiva Foi denominada PRÓTON. • A região nuclear deveria ser cerca de 10. 000 a 100. 000 vezes menor que a eletrosfera, pois De cada 10. 000 a 100. 000 partículas que Passaram direto, uma sofreu deflexão. SURGE ASSIM, O ÁTOMO NUCLEAR • O próton é cerca de 1836 vezes mais pesado que 1 elétron. Professor Fabiano Ramos Costa

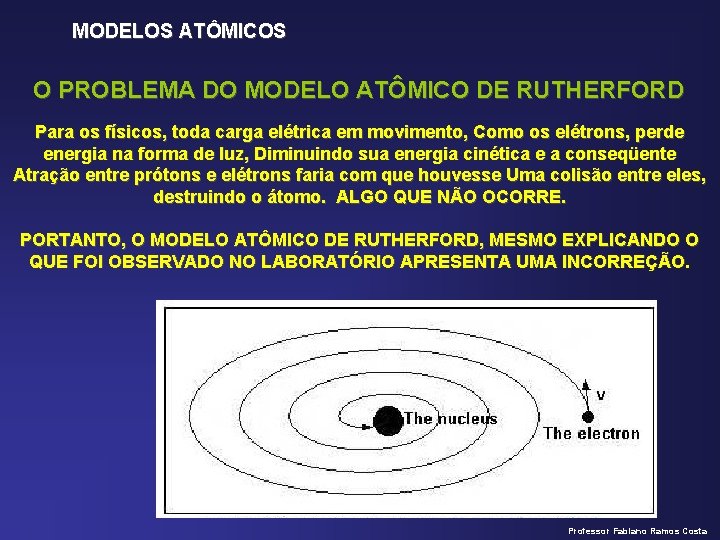
MODELOS ATÔMICOS O PROBLEMA DO MODELO ATÔMICO DE RUTHERFORD Para os físicos, toda carga elétrica em movimento, Como os elétrons, perde energia na forma de luz, Diminuindo sua energia cinética e a conseqüente Atração entre prótons e elétrons faria com que houvesse Uma colisão entre eles, destruindo o átomo. ALGO QUE NÃO OCORRE. PORTANTO, O MODELO ATÔMICO DE RUTHERFORD, MESMO EXPLICANDO O QUE FOI OBSERVADO NO LABORATÓRIO APRESENTA UMA INCORREÇÃO. Professor Fabiano Ramos Costa

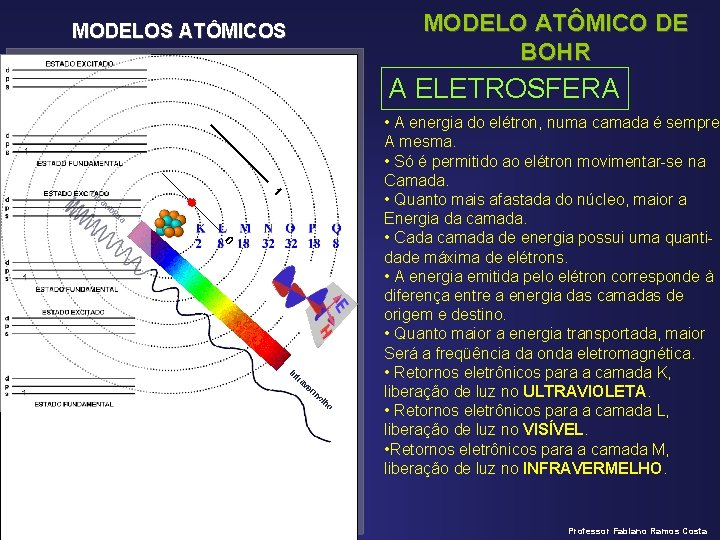
MODELOS ATÔMICOS MODELO ATÔMICO DE BOHR Niels Bohr (1885 -1962) • Estudava espectros de emissão do gás hidrogênio. • O gás hidrogênio aprisionado numa ampola Submetida a alta diferença de potencial emitia Luz vermelha. Ao passar por um prisma, essa Luz se subdividia em diferentes comprimentos De onda e freqüência, caracterizando um Espectro luminoso descontínuo. A EXPLICAÇÃO • Os elétrons estão movimentando ao redor do Núcleo em órbitas de energia FIXA, QUANTIZADA E ESTACIONÁRIA (AS CAMADAS). • Ao receber energia, o elétron salta para uma Camada mais externa (mais energética), ficando Num estado EXCITADO. • Ao retornar para uma camada menos energéTica, libera parte da energia absorvida na forma De ondas eletromagnética (LUZ), que pode ser Visível, ou não. Professor Fabiano Ramos Costa

MODELOS ATÔMICOS MODELO ATÔMICO DE BOHR Professor Fabiano Ramos Costa

MODELOS ATÔMICOS MODELO ATÔMICO DE BOHR A ELETROSFERA • A energia do elétron, numa camada é sempre A mesma. • Só é permitido ao elétron movimentar-se na Camada. • Quanto mais afastada do núcleo, maior a Energia da camada. • Cada camada de energia possui uma quantidade máxima de elétrons. • A energia emitida pelo elétron corresponde à diferença entre a energia das camadas de origem e destino. • Quanto maior a energia transportada, maior Será a freqüência da onda eletromagnética. • Retornos eletrônicos para a camada K, liberação de luz no ULTRAVIOLETA. • Retornos eletrônicos para a camada L, liberação de luz no VISÍVEL. • Retornos eletrônicos para a camada M, liberação de luz no INFRAVERMELHO. Professor Fabiano Ramos Costa

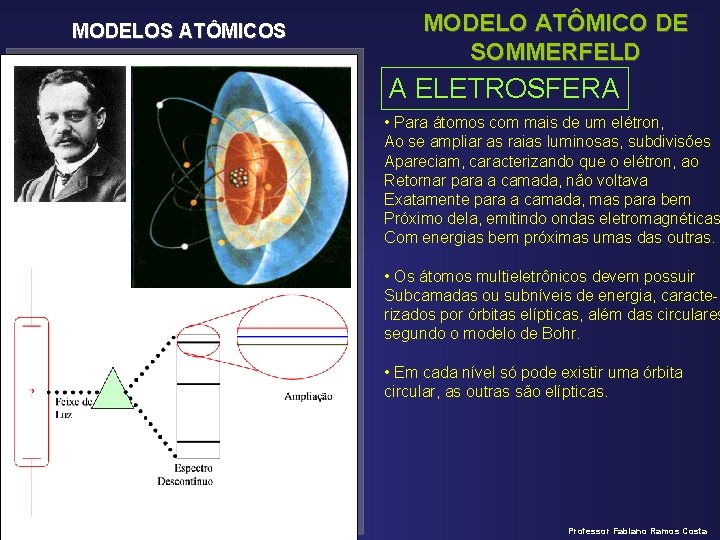
MODELOS ATÔMICOS MODELO ATÔMICO DE SOMMERFELD A ELETROSFERA • Para átomos com mais de um elétron, Ao se ampliar as raias luminosas, subdivisões Apareciam, caracterizando que o elétron, ao Retornar para a camada, não voltava Exatamente para a camada, mas para bem Próximo dela, emitindo ondas eletromagnéticas Com energias bem próximas umas das outras. • Os átomos multieletrônicos devem possuir Subcamadas ou subníveis de energia, caracterizados por órbitas elípticas, além das circulares segundo o modelo de Bohr. • Em cada nível só pode existir uma órbita circular, as outras são elípticas. Professor Fabiano Ramos Costa

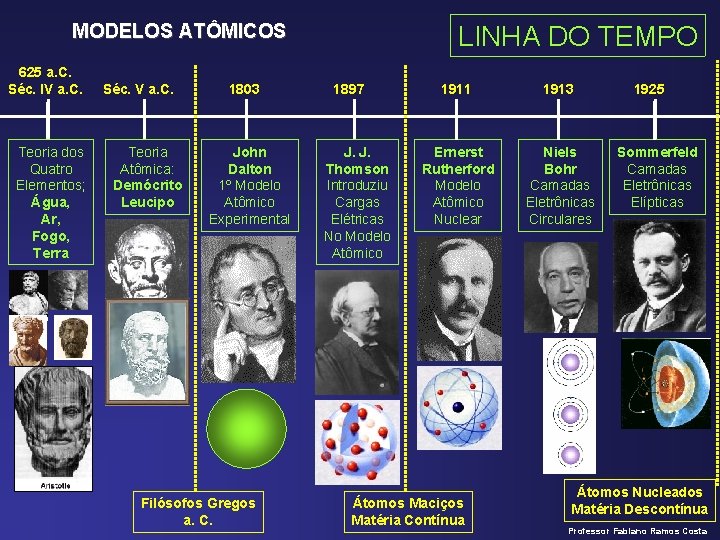
MODELOS ATÔMICOS 625 a. C. Séc. IV a. C. Teoria dos Quatro Elementos; Água, Ar, Fogo, Terra Séc. V a. C. Teoria Atômica: Demócrito Leucipo 1803 John Dalton 1º Modelo Atômico Experimental Filósofos Gregos a. C. LINHA DO TEMPO 1897 J. J. Thomson Introduziu Cargas Elétricas No Modelo Atômico 1911 1913 Ernerst Rutherford Modelo Atômico Nuclear Niels Bohr Camadas Eletrônicas Circulares Átomos Maciços Matéria Contínua 1925 Sommerfeld Camadas Eletrônicas Elípticas Átomos Nucleados Matéria Descontínua Professor Fabiano Ramos Costa

MODELOS ATÔMICOS MODELO ATÔMICO ATUAL (ORBITAL) Problemas Acerca do Modelo de Bohr • 1924 – Louis de Broglie: Dualidade da Matéria Toda e qualquer massa pode se comportar como onda. • Heisenberg: Princípio da Incerteza É impossível determinar ao mesmo tempo a posição e a velocidade do elétron. • Schrödinger: Orbitais O elétron, como onda, pode ser encontrado ao redor do núcleo em regiões de máxima Probabilidade (orbital). Professor Fabiano Ramos Costa

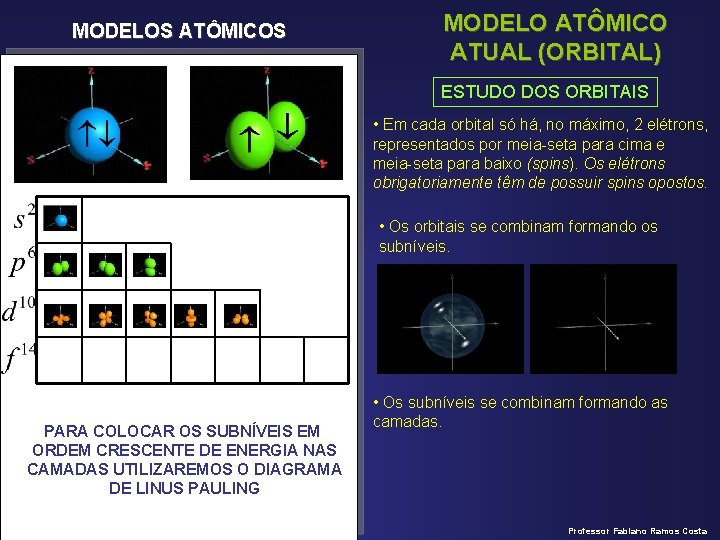
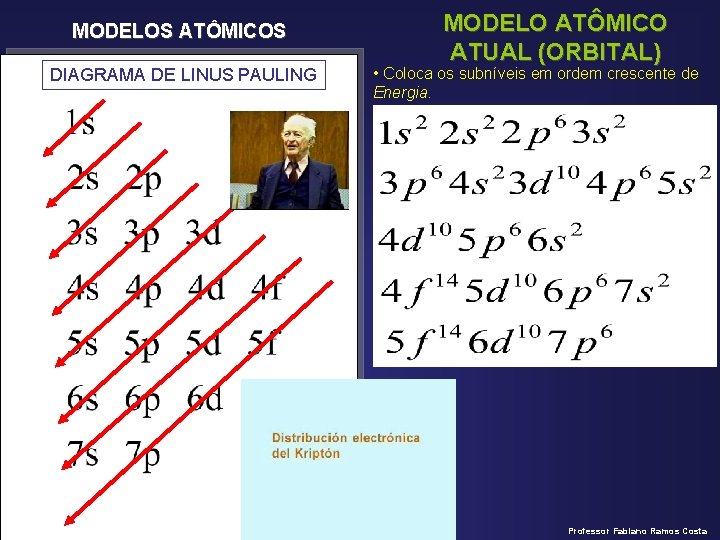
MODELOS ATÔMICOS MODELO ATÔMICO ATUAL (ORBITAL) ESTUDO DOS ORBITAIS • Em cada orbital só há, no máximo, 2 elétrons, representados por meia-seta para cima e meia-seta para baixo (spins). Os elétrons obrigatoriamente têm de possuir spins opostos. • Os orbitais se combinam formando os subníveis. PARA COLOCAR OS SUBNÍVEIS EM ORDEM CRESCENTE DE ENERGIA NAS CAMADAS UTILIZAREMOS O DIAGRAMA DE LINUS PAULING • Os subníveis se combinam formando as camadas. Professor Fabiano Ramos Costa

MODELOS ATÔMICOS DIAGRAMA DE LINUS PAULING MODELO ATÔMICO ATUAL (ORBITAL) • Coloca os subníveis em ordem crescente de Energia. Professor Fabiano Ramos Costa

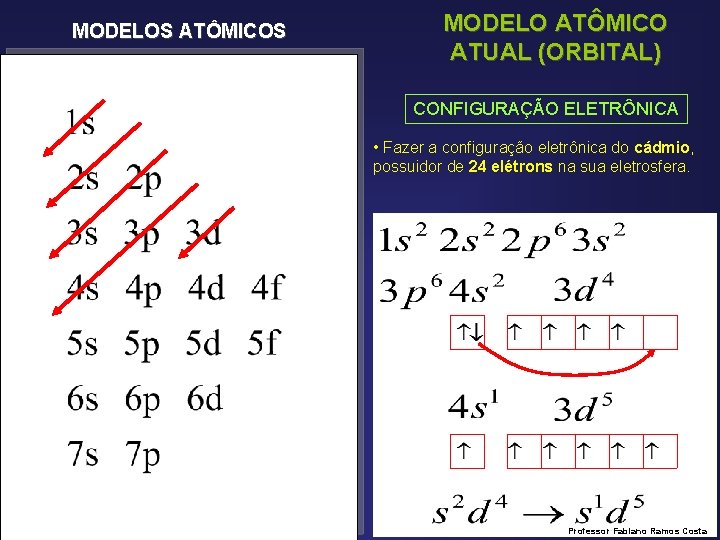
MODELOS ATÔMICOS MODELO ATÔMICO ATUAL (ORBITAL) CONFIGURAÇÃO ELETRÔNICA • Fazer a configuração eletrônica do cádmio, possuidor de 24 elétrons na sua eletrosfera. Professor Fabiano Ramos Costa

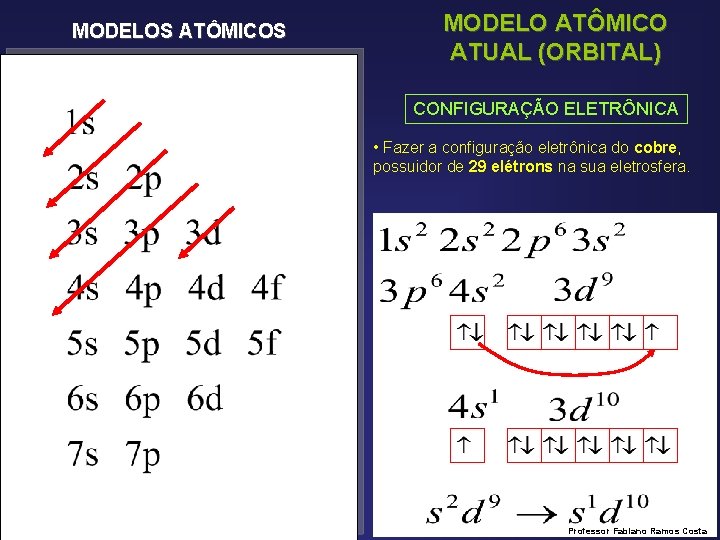
MODELOS ATÔMICOS MODELO ATÔMICO ATUAL (ORBITAL) CONFIGURAÇÃO ELETRÔNICA • Fazer a configuração eletrônica do cobre, possuidor de 29 elétrons na sua eletrosfera. Professor Fabiano Ramos Costa

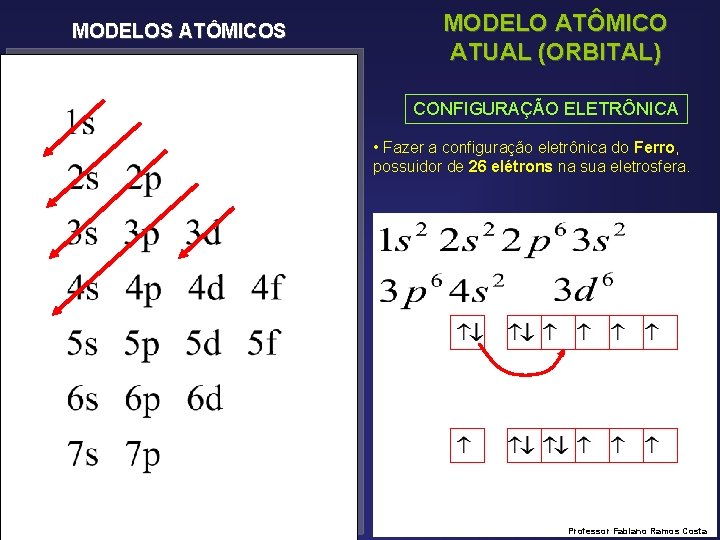
MODELOS ATÔMICOS MODELO ATÔMICO ATUAL (ORBITAL) CONFIGURAÇÃO ELETRÔNICA • Fazer a configuração eletrônica do Ferro, possuidor de 26 elétrons na sua eletrosfera. Professor Fabiano Ramos Costa

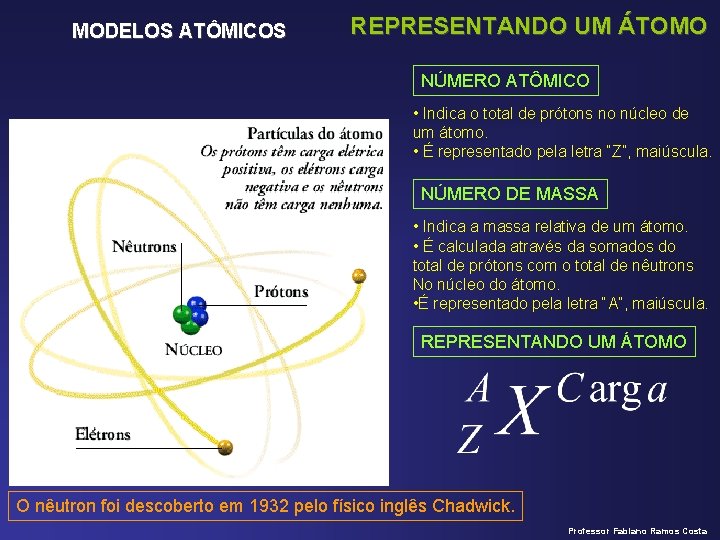
MODELOS ATÔMICOS REPRESENTANDO UM ÁTOMO NÚMERO ATÔMICO • Indica o total de prótons no núcleo de um átomo. • É representado pela letra “Z”, maiúscula. NÚMERO DE MASSA • Indica a massa relativa de um átomo. • É calculada através da somados do total de prótons com o total de nêutrons No núcleo do átomo. • É representado pela letra “A”, maiúscula. REPRESENTANDO UM ÁTOMO O nêutron foi descoberto em 1932 pelo físico inglês Chadwick. Professor Fabiano Ramos Costa

25/26 REPRESENTANDO UM ÁTOMO MODELOS ATÔMICOS Z = 20 p+ = 20 A = 40 nº = 20 Z = 19 p+ A = 39 nº = 20 Z = 16 p+ = 16 A = 32 nº = 16 = 19 = 20 • Total de prótons = total elétrons. • ÁTOMO NEUTRO. = 18 • Total de prótons > total elétrons. • ÍON POSITIVO = CÁTION. • e- = Z(P) – carga, e-=19 -1=18 e- = 18 • Total de prótons < total elétrons. • ÍON NEGATIVO = NION. • e- = Z(P) – carga, e-=16 -(-2)=18 e- e- Professor Fabiano Ramos Costa