Modelos atmicos a travs de la Historia Modelos













- Slides: 25

Modelos atómicos a través de la Historia. Modelos atómicos de: • Dalton • Thomson • Rutherford • Bohr • Mecano - cuántico

Objetivos Analizar de forma critica la evolución de los modelos atómicos en la historia. Comprender la razón por la cual fueron desechados los primeros.

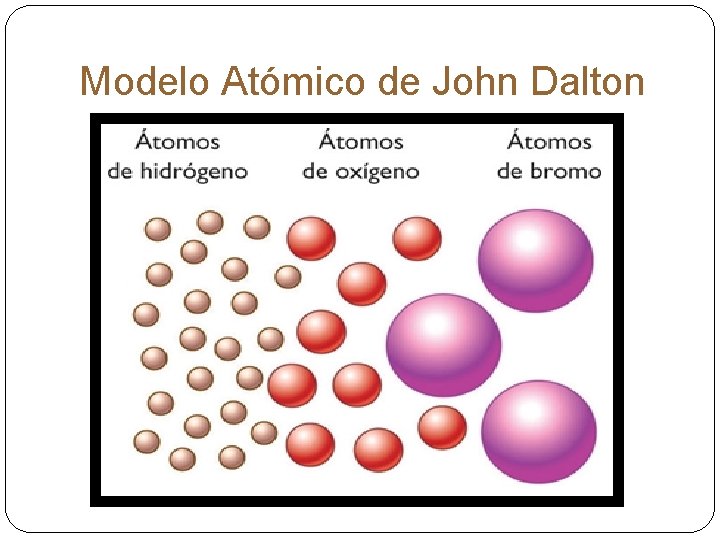
Tuvieron que pasar veinte siglos para que un químico inglés llamado John Dalton retomara las ideas de Demócrito y publicase, en 1808, su famosa teoría atómica: “La materia no es continua, sino que está formada por partículas indivisibles (átomos). Los átomos se pueden unir para crear combinaciones de átomos que forman los compuestos químicos. ”

Modelo Atómico de John Dalton

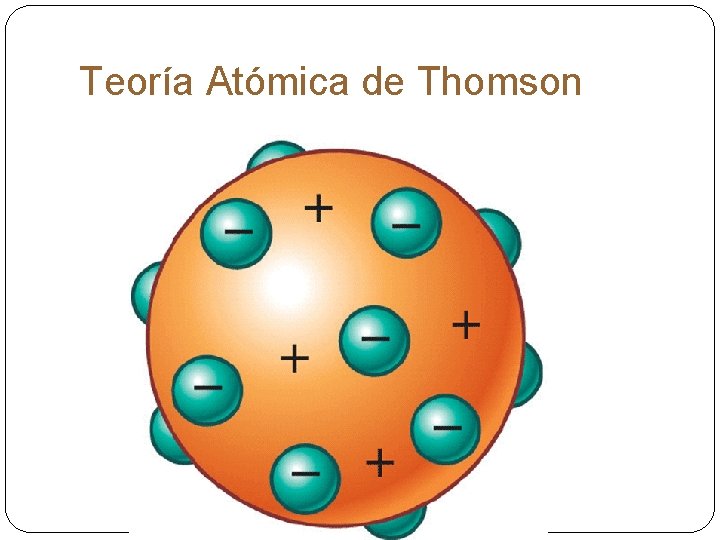
Las ideas de Dalton fueron perfeccionadas por otros científicos. En 1897, el británico Joseph John Thomson descubrió unas partículas con propiedades sorprendentes: prácticamente no tenían masa y tenían carga eléctrica negativa. Las llamó electrones.

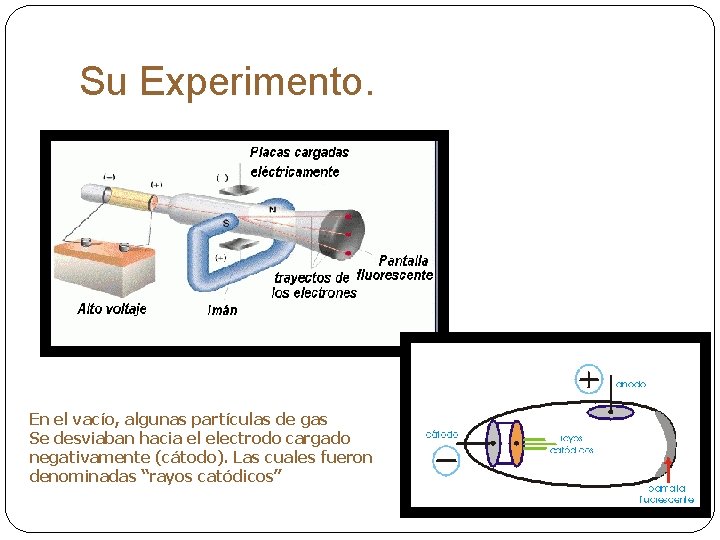
Su Experimento. En el vacío, algunas partículas de gas Se desviaban hacia el electrodo cargado negativamente (cátodo). Las cuales fueron denominadas “rayos catódicos”

Teoría Atómica de Thomson

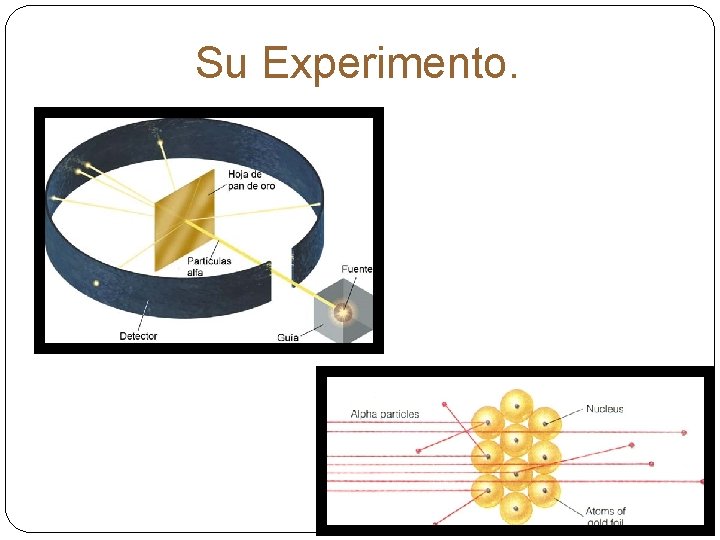
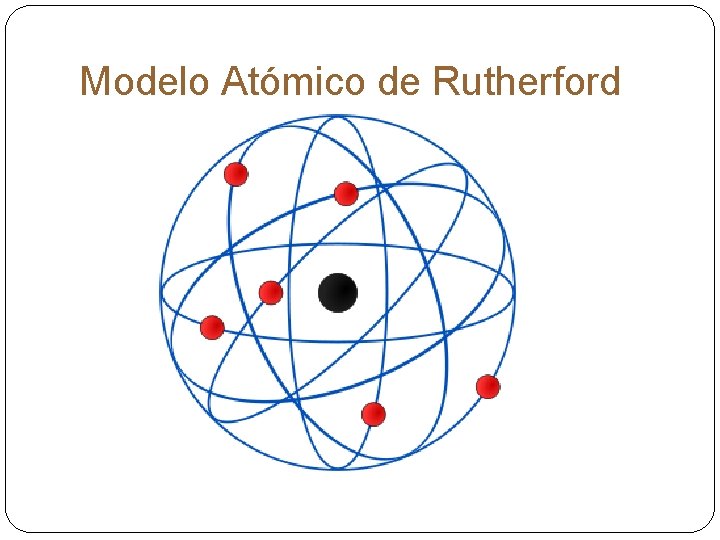
En 1911, el físico británico Ernest Rutherford descubrió que el interior de los átomos estaba prácticamente hueco, a excepción de la zona central ocupada por un pequeño núcleo, en el que se concentraba toda la masa del átomo y que, además, tenía carga eléctrica positiva.

Su Experimento.

Modelo Atómico de Rutherford

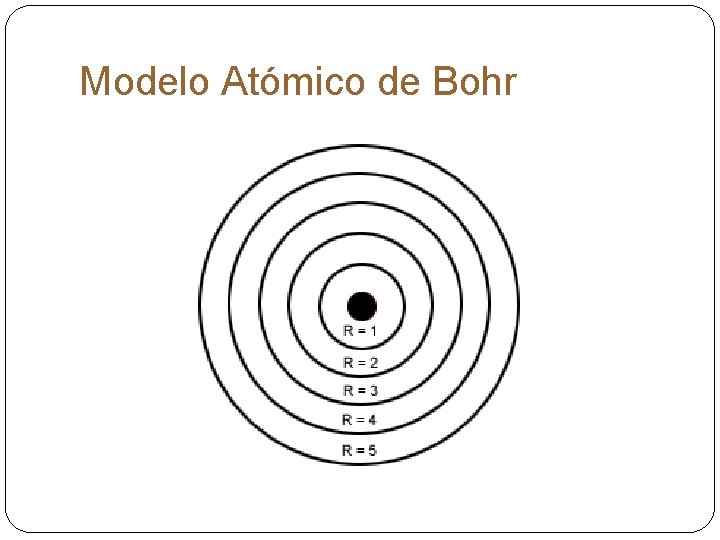
Niels Bohr, físico danés, propone su modelo atómico el año 1913. El cual consiste en que, en torno al núcleo atómico, el número de electrones en cada órbita aumenta desde el interior hacia el exterior

Modelo Atómico de Bohr

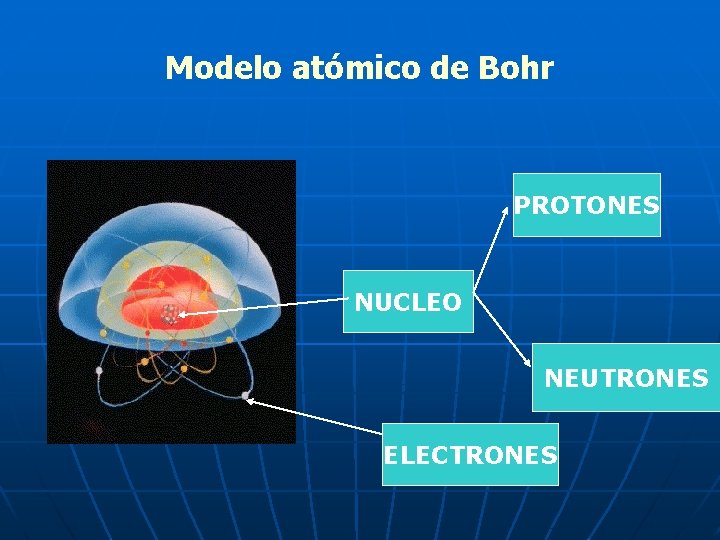
Modelo atómico de Bohr PROTONES NUCLEO NEUTRONES ELECTRONES

Modelo Actual: Mecano Cuántico Louis de Broglie Werner Heisenberg Erwin Schrödinger

Modelo Atomico de Schrödinger En 1926, Schrödinger, partiendo de ideas de Plank y Luis Broglie y las matematicas de William Rowam Hamilton, desarrollo un modelo matematico en donde aparecen tres parlamentos: n, l y m.

En 1916, Arnold Sommerfeld, con la ayuda de la relatividad de Albert Einstein, hizo las siguientes modificaciones al modelo de Bohr: Los electrones se mueven alrededor del núcleo en órbitas circulares o elípticas. A partir del segundo nivel energético existen dos o más subniveles en el mismo nivel. El electrón es una corriente eléctrica minúscula.

1926, físico alemán Werner Heisenberg, después de haber diseñado varios experimentos hipotéticos para determinar con precisión la posición y velocidad del electrón, llegó a la conclusión de que esa determinación era imposible. ¨Es imposible determinar con precisión y simultáneamente su posición y velocidad de un electrón ya que al precisar su posición su velocidad se altera y viceversa.


Principio de exclusión de Pauli. En un átomo no puede haber dos electrones con los cuatro número cuánticos iguales. Regla de Hund. Al llenar orbitales de igual energía (los tres orbitales p, los cinco orbitales d, o los siete orbitales f) los electrones se distribuyen, siempre que sea posible, con sus espines paralelos, es decir, desapareados.

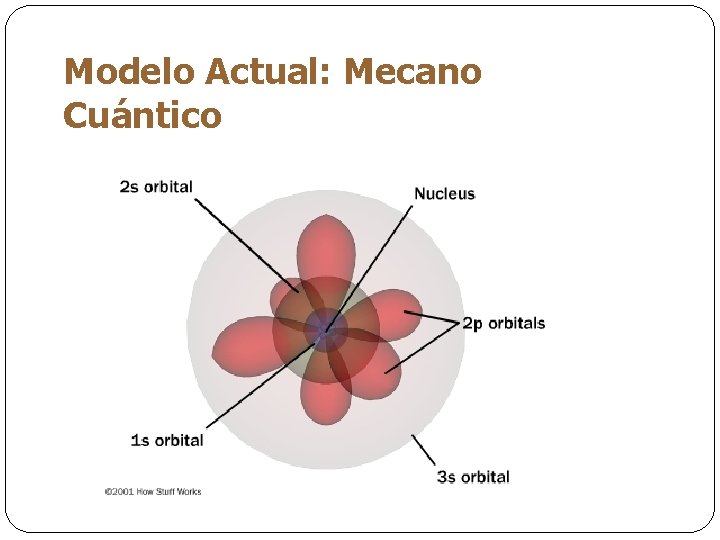
Modelo Actual: Mecano Cuántico

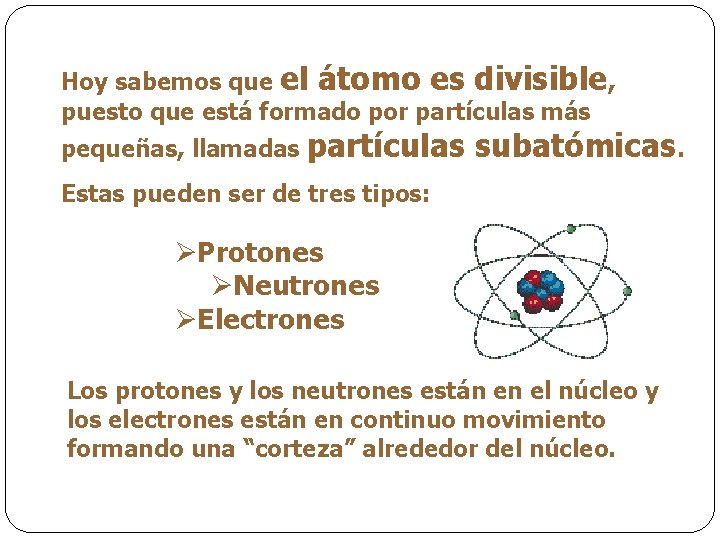
Hoy sabemos que el átomo es divisible, puesto que está formado por partículas más pequeñas, llamadas partículas subatómicas. Estas pueden ser de tres tipos: ØProtones ØNeutrones ØElectrones Los protones y los neutrones están en el núcleo y los electrones están en continuo movimiento formando una “corteza” alrededor del núcleo.

LOS ELECTRONES: • Poseen una masa 1. 840 veces menor que la del átomo más pequeño (el de hidrógeno) • Tienen carga eléctrica negativa • Se están moviendo constantemente alrededor del núcleo siguiendo unas “órbitas”

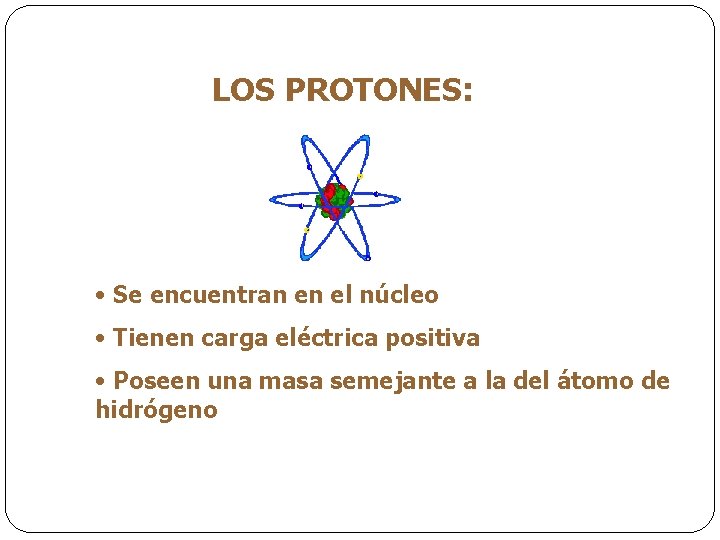
LOS PROTONES: • Se encuentran en el núcleo • Tienen carga eléctrica positiva • Poseen una masa semejante a la del átomo de hidrógeno

LOS NEUTRONES: • Constituyen los núcleos de los átomos junto con los protones. • No tienen carga eléctrica (son neutros) • Poseen una masa prácticamente igual a la del protón

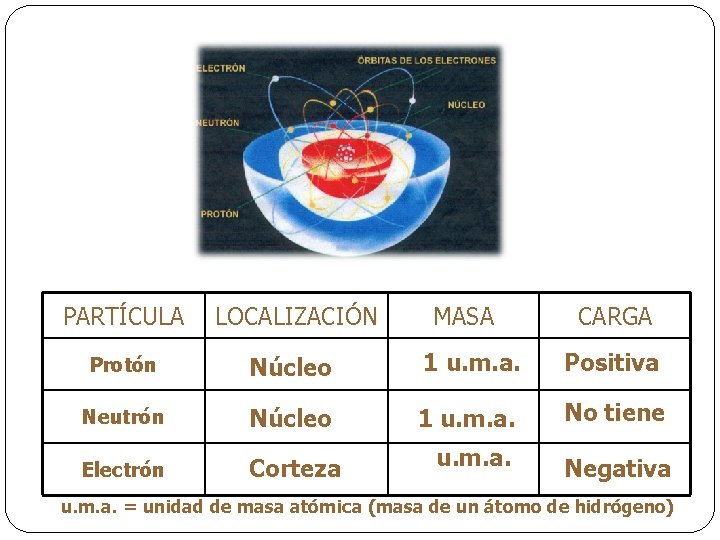
PARTÍCULA LOCALIZACIÓN MASA CARGA Protón Núcleo 1 u. m. a. Positiva Neutrón Núcleo 1 u. m. a. No tiene Electrón Corteza u. m. a. Negativa u. m. a. = unidad de masa atómica (masa de un átomo de hidrógeno)