Estrutura atmica 2 Modelos atmicos Natureza eltrica da



















- Slides: 24

Estrutura atômica 2 - Modelos atômicos

Natureza elétrica da matéria Há milênios, a humanidade conhece a eletricidade, mas sem entendê-la: raios, choques, atração e repulsão entre corpos friccionados uns nos outros, etc. Benjamin Franklin (1706 -1790), cientista, inventor e político norte-americano (participou da independência dos EUA), foi quem propôs a denominação “positiva” e “negativa” para os dois tipos de cargas elétricas. Famosa experiência de Franklin: durante uma tempestade de raios, a chave amarrada na linha de uma pipa fica eletrizada. Disponível em: http: //commons. wikimedia. org/wiki/File: Frankli nwithkey. jpg – Acesso em 11. 02. 2014.

Franklin percebeu que: - Corpos eletrizados com cargas diferentes se atraem; enquanto corpos com cargas diferentes se repelem. - Cargas elétricas podem ser obtidas, friccionando materiais diferentes uns nos outros, como o vidro na lã. Alguns materiais “roubam” eletricidade de outros. Máquina de Franklin Girando a manivela, o cilindro gira e tira cargas elétricas da escova por fricção. Disponível: http: //commons. wikimedia. org/wiki/File: PSM_V 51_D 758_Franklin_electrical_mac hine. png – Acesso em 11. 02. 2014. - Em todos os fenômenos investigados, a carga negativa tem mobilidade, passando entre diferentes corpos e objetos; enquanto a positiva é fixa. - Corpos com deficiência de cargas negativas ficam eletrizados positivamente.

Eletricidade e magnetismo - Faraday O cientista Michael Faraday (1791 -1867) pesquisou diversos fenômenos elétricos, magnéticos e químicos importantes. Seus trabalhos deram origem aos motores elétricos, dínamos e processos eletroquímicos. Uma das suas maiores contribuições teóricas foi a de conseguir perceber a relação entre eletricidade e magnetismo. Motores elétricos funcionam porque a eletricidade passa nos fios enrolados da bobina (quadrado escuro no centro da figura) e gera um campo magnético, que por sua vez sofre repulsão dos polos dos ímãs, fazendo a bobina girar. Disponível: http: //commons. wikimedia. org/wiki/File: Ejs_Open_Source_Direct_Current_El ectrical_Motor_Model_Java_Applet_(_DC_Motor_)_50_degree_split_ring. gif – Acesso em 11. 02. 2014.

Motores elétricos simples, fáceis de construir: Acesse os sites abaixo, e veja como é fácil montar um motor elétrico com materiais caseiros, como pilhas, fios, parafusos e imãs. Vídeo 1: http: //upload. wikimedia. org/wikipedia/commons/c/c 7/Homopolar_motor. we bm Vídeo 2: http: //upload. wikimedia. org/wikipedia/commons/4/46/Homopolarmotor_MA Q 03891_smial_wp. ogv O princípio de funcionamento é sempre o mesmo: em torno do fio em que esteja passando eletricidade, surge um campo magnético. Os ímãs também têm seus campos magnéticos, mas são permanentes. O campo magnético do ímã interage com o campo magnético do fio, criando atração e/ou repulsão, fazendo o ímã ou o fio girar, dependendo do modelo do motor.

Faraday (1791 -1867) e a “gaiola de Faraday”: A descarga elétrica não penetra na gaiola ou na roupa metálica. Disponíveis: http: //commons. wikimedia. org/wiki/File: Cage_de_Far aday. jpg e http: //commons. wikimedia. org/wiki/File: Michael_Far aday. jpg – Acesso em 11. 2. 2014.

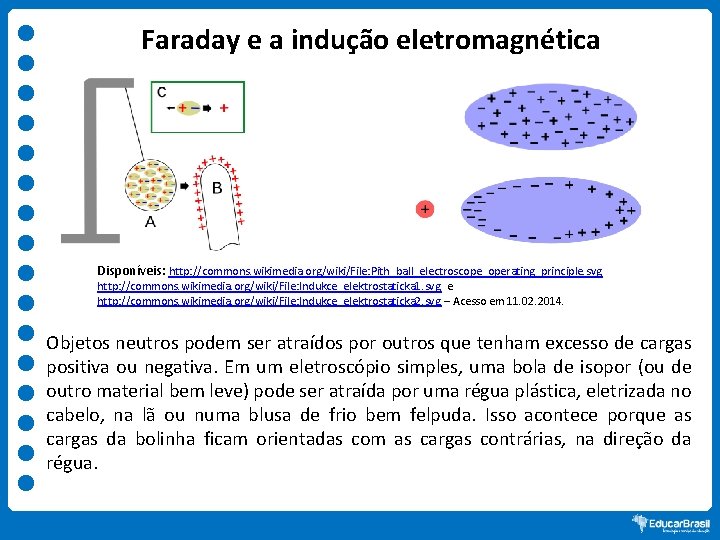
Faraday e a indução eletromagnética Disponíveis: http: //commons. wikimedia. org/wiki/File: Pith_ball_electroscope_operating_principle. svg http: //commons. wikimedia. org/wiki/File: Indukce_elektrostaticka 1. svg e http: //commons. wikimedia. org/wiki/File: Indukce_elektrostaticka 2. svg – Acesso em 11. 02. 2014. Objetos neutros podem ser atraídos por outros que tenham excesso de cargas positiva ou negativa. Em um eletroscópio simples, uma bola de isopor (ou de outro material bem leve) pode ser atraída por uma régua plástica, eletrizada no cabelo, na lã ou numa blusa de frio bem felpuda. Isso acontece porque as cargas da bolinha ficam orientadas com as cargas contrárias, na direção da régua.

Você deve conhecer a experiência da régua que atrai pedacinhos de papel: - Em um dia seco, sem sinais de umidade ou chuva, escolha alguém com o cabelo bem seco. Se repetir a experiência várias vezes, você verá que alguns pedacinhos de papel são repelidos pela régua, voando para longe. Isso acontece, porque eles já estão com excesso da mesma carga contida na régua. Disponível: http: //commons. wikimedia. org/wiki/File: Op findelsernes_bog 3_fig 281. png – Acesso em 11. 02. 2014. - Esfregue rapidamente e várias vezes uma régua de material sintético (plástico ou acrílico) no cabelo dessa pessoa. - Aproxime a régua de pedacinhos bem pequenos de papel ou restos de lápis, que você tenha acabado de apontar. - Você verá que a régua atrai os papeizinhos, que voam na direção da régua.

Eletroscópio simples: Quando a régua eletrizada se aproxima do “sensor” do eletroscópio (no alto) , suas cargas positivas atraem as cargas negativas do eletroscópio, que se deslocam para cima do conjunto. Apenas a aproximação da régua eletrizada faz as folhas se abrirem no interior da câmara do eletroscópio. Disponíveis: http: //commons. wikimedia. org/wiki/File: Ele ctroscope_showing_induction. png e http: //commons. wikimedia. org/wiki/File: Ch arges_repulsion_attraction. svg – Acesso em 11. 02. 2014. Por causa desse deslocamento, as folhas metálicas, no interior da câmara, ficam com excesso de cargas positivas; e, por isso, se repelem e se abrem.

Disponível: http: //commons. wikimedia. org/wiki/File: Flatterblatt-Elektroskop. gif – Acesso em 11. 02. 2014. Desconsiderando o atrito e a perda de cargas para o ambiente, um eletroscópio, com dois lados de cargas opostas, pode fazer uma folha metálica ficar oscilando de um lado para outro. O contato da folha com o lado positivo (vermelho) faz a folha perder carga negativa, o que a torna positiva; isso gera repulsão com o polo vermelho, fazendo a folha se deslocar para o polo negativo (azul). No lado oposto, a folha recebe cargas negativas e sofre repulsão, afastando-se de novo e voltando para o lado esquerdo, recomeçando o movimento. Assista ao video e veja como fazer um eletroscópio caseiro: http: //www. youtube. com/watch? v=q. Ases. Jky. Z 4 Q

Outros modelos de eletroscópio A escala mede a inclinação da folha metálica, demonstrando a intensidade da repulsão, que corresponde à intensidade do campo elétrico próximo ao “sensor” (esfera no alto). Disponíveis: http: //commons. wikimedia. org/wiki/File: Elektroskop. PNG, http: //commons. wikimedia. org/wiki/File: %D 0%AD%D 0%BB%D 0%B 5%D 0%BA%D 1%82%D 1%80%D 0%BE%D 0%BC%D 0%B 5%D 1%8 2%D 1%80_%D 0%9 A%D 0%BE%D 0%BB%D 1%8 C%D 0%B 1%D 0%B 5. jpg e http: //commons. wikimedia. org/wiki/File: Influenz. jpg – Acesso em 11. 02. 2014.

O atrito do corpo do menino contra o material sintético do escorregador faz um corpo retirar cargas do outro. O menino fica com excesso de cargas elétricas iguais, que se acumulam nele, na sua roupa e nos fios de cabelo. Com cargas iguais, os fios de cabelo se repelem, afastando-se, deixando o menino com o cabelo arrepiado. Disponível: http: //commons. wikimedia. org/wiki/File: Static_slide. jpg – Acesso em 11. 02. 2014.

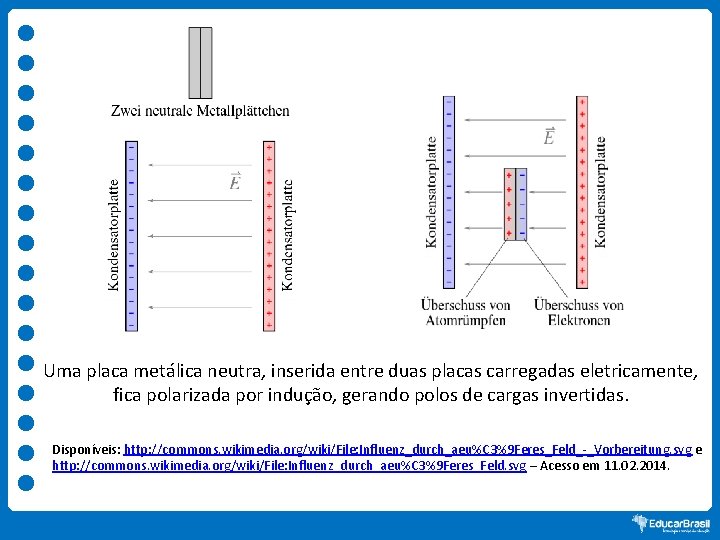
Uma placa metálica neutra, inserida entre duas placas carregadas eletricamente, fica polarizada por indução, gerando polos de cargas invertidas. Disponíveis: http: //commons. wikimedia. org/wiki/File: Influenz_durch_aeu%C 3%9 Feres_Feld_-_Vorbereitung. svg e http: //commons. wikimedia. org/wiki/File: Influenz_durch_aeu%C 3%9 Feres_Feld. svg – Acesso em 11. 02. 2014.

Faraday descobriu que a eletricidade não é uma força separada da matéria; mas, ao contrário, faz parte dela. Certamente, o modelo de Dalton ainda é muito útil quando precisamos desenhar moléculas, sem precisar de mais detalhes da estrutura interna do átomo. Disponível: http: //commons. wikimedia. org/wiki/File: Common_ molecules_and_atoms. png – Acesso em 11. 02. 2014. Mas o modelo de Dalton não podia estar completo. Os átomos deveriam ser mais do que simples esferas maciças, até porque ainda não havia explicação sobre as forças que mantêm os átomos unidos para formar as substâncias.

Eletricidade em gases rarefeitos No fim do século 18, os cientistas pesquisavam o comportamento dos gases sob efeito de descargas elétricas. Normalmente, os gases são isolantes elétricos; mas, quando rarefeitos, deixam passar a eletricidade. Se a pressão for baixa o suficiente, aparece um raio esverdeado, conhecido como “raio catódico”, que parte do polo negativo (cátodo), em direção ao polo positivo (ânodo). Ampola de Crookes No lado esquerdo do desenho, está conectado o polo negativo (cátodo), de onde partem os raios. O polo positivo é ligado acima, à esquerda. Os filtros A e B garantem que o raio parta em linha reta. Disponíveis: http: //commons. wikimedia. org/wiki/File: JJ_Thomson_crookes_tube. jpg e http: //upload. wikimedia. org/wikipedia/commons/b/b 3/J_J_Thomsons_cathode_ray_tube_with_magnet_coils%2 C_1897. _%28966380 7404%29. jpg - Acesso em 11. 02. 2014.

Alguns testes realizados com os raios catódicos demonstram suas propriedades: Colocando um anteparo na trajetória, formou-se uma “sombra” projetada no vidro oposto. Outro modelo de “ampola de Crookes” para demonstrar a sombra projetada. O polo negativo está à esquerda e o positivo, embaixo. Os raios se projetam em linha reta. Os raios catódicos podem movimentar uma ventoinha, demonstrando que eles possuem massa, ainda que muito pequena. Assista ao vídeo no link, abaixo, sobre testes com raios catódicos: http: //www. youtube. com/watch? v=Csj. LYLW_3 G 0

A descoberta do elétron (1897) Ligando campos elétricos na trajetória dos raios catódicos, o cientista Joseph John Thomson (1856 -1940) percebeu que os raios se curvam sempre na direção do campo positivo, o que indica que são constituídos de cargas negativas. O vidro onde batem os raios fica cintilando, o que deu origem à televisão comum, décadas depois. Thomson, o descobridor do elétron. Disponíveis: http: //commons. wikimedia. org/wiki/File: Thomson_cathode_ray_exp. gif e http: //commons. wikimedia. org/wiki/File: J. J_Thomson. jpg - Acesso em 11. 01. 2014. Como esses raios não são constituídos por átomos, mas sim por partículas ainda menores, esse experimento é considerado como “a descoberta do elétron”, partícula responsável pela eletricidade, que é também constituinte do átomo.

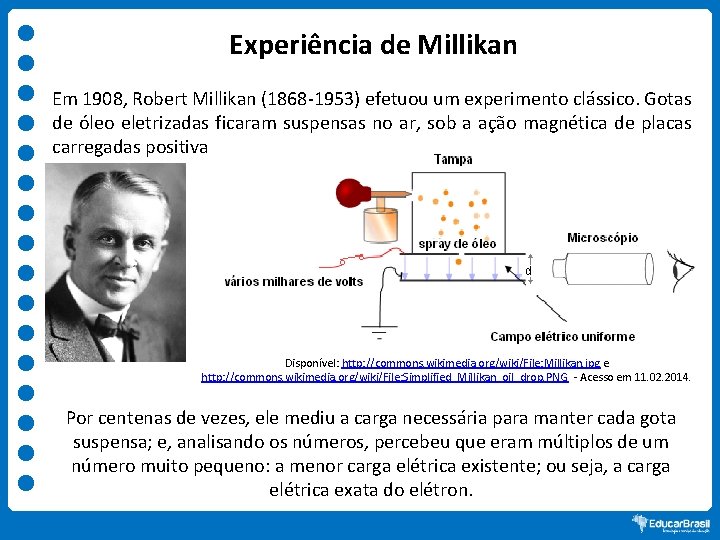
Experiência de Millikan Em 1908, Robert Millikan (1868 -1953) efetuou um experimento clássico. Gotas de óleo eletrizadas ficaram suspensas no ar, sob a ação magnética de placas carregadas positiva e negativamente. Disponível: http: //commons. wikimedia. org/wiki/File: Millikan. jpg e http: //commons. wikimedia. org/wiki/File: Simplified_Millikan_oil_drop. PNG - Acesso em 11. 02. 2014. Por centenas de vezes, ele mediu a carga necessária para manter cada gota suspensa; e, analisando os números, percebeu que eram múltiplos de um número muito pequeno: a menor carga elétrica existente; ou seja, a carga elétrica exata do elétron.

Modelo atômico de Thomson Quando Thomson descobriu os elétrons, os “prótons” ainda não tinham sido isolados experimentalmente. Mas era evidente que as cargas positivas teriam que existir, de alguma forma, no átomo para neutralizá-lo. 10 -10 m Como as partículas negativas têm mais mobilidade que as positivas, Thomson imaginou um modelo atômico em que os elétrons estivessem uniformemente distribuídos, incrustados em uma esfera de cargas positivas fixas. Os elétrons estariam incrustados na esfera, como passas incrustadas em um pudim, podendo entrar ou sair do átomo. Por isso, esse modelo ficou conhecido como “pudim de passas”. Disponível: http: //commons. wikimedia. org/wiki/File: Plum_pudding_atom. svg – Acesso em 11. 02. 2014.

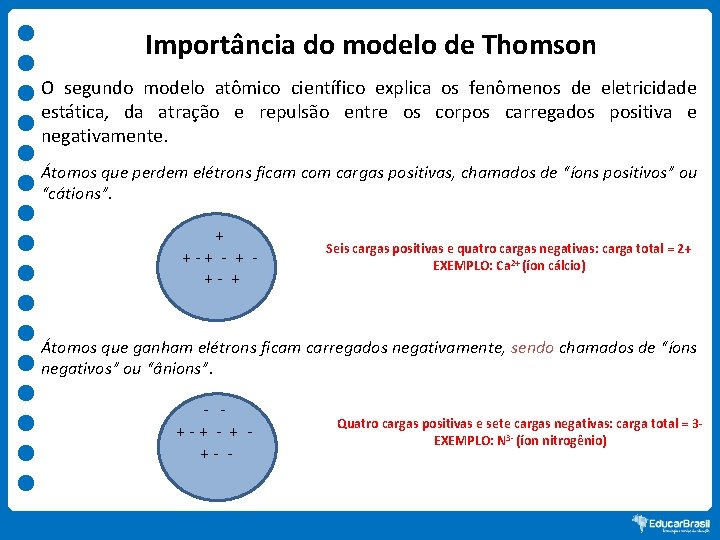
Importância do modelo de Thomson O segundo modelo atômico científico explica os fenômenos de eletricidade estática, da atração e repulsão entre os corpos carregados positiva e negativamente. Átomos que perdem elétrons ficam com cargas positivas, chamados de “íons positivos” ou “cátions”. + +-+ - + +- + Seis cargas positivas e quatro cargas negativas: carga total = 2+ EXEMPLO: Ca 2+ (íon cálcio) Átomos que ganham elétrons ficam carregados negativamente, sendo chamados de “íons negativos” ou “ânions”. - +-+ - + +- - Quatro cargas positivas e sete cargas negativas: carga total = 3 EXEMPLO: N 3 - (íon nitrogênio)

Átomos carregados negativa e positivamente se atraem, formando substâncias iônicas, como é o caso do sal de cozinha (cloreto de sódio, Na. Cl), formado de cátions Na+1 e ânions Cl-1 , que se atraem em rede, formando o cristal. Cristal de sal de cozinha. Os átomos do cátion sódio (Na+) estão representados por bolinhas azuis; e os ânions de cloro (Cl-), por bolinhas verdes e maiores. Disponível: http: //commons. wikimedia. org/wiki/File: Sodiumchloride-3 D-ionic. png – Acesso em 11. 2. 2014. Substâncias formadas por átomos carregados costumam ser solúveis em água, pois atraem os polos negativos ou positivos das moléculas de H 2 O. Disponível: http: //commons. wikimedia. org/wiki/File: Na%2 BH 2 O. svg – Acesso em 11. 2. 2014.

QUESTÕES QUESTÃO 01 Um átomo com dez cargas positivas, inicialmente neutro, perdeu três elétrons. Quantos elétrons ele tinha, antes e depois da ionização? QUESTÃO 02 Qual a carga total de um íon que tem vinte prótons e dezoito elétrons? QUESTÃO 03 Desenhe um átomo, de acordo com o modelo de Thomson, que possua carga total igual a 3+ e cinco elétrons (partículas negativas). Quantas cargas positivas você desenhou? QUESTÃO 04 Por que Thomson propôs um modelo para o átomo com cargas positivas e negativas, sendo que apenas o elétron tinha sido descoberto? QUESTÃO 05 Desenhe um átomo de oxigênio que esteja no estado de íon “óxido” (O 2 -), de acordo com o modelo de Thomson, sabendo que todo oxigênio tem oito prótons. Quantas cargas negativas você desenhou?

QUESTÃO 06 Por que o modelo atômico de Dalton se tornou obsoleto para explicar as propriedades da matéria, a partir do final do século 19? QUESTÃO 07 Como Thomson deduziu que o elétron possui carga elétrica negativa, a partir do experimento dos raios catódicos com a ampola de Crokies? QUESTÃO 08 Por que Millikan teve que repetir centenas de vezes o mesmo experimento para descobrir o valor da carga elétrica de um elétron? QUESTÃO 09 Por que a proporção de átomos de sódio e cloro, no sal de cozinha, é de 1: 1? Por que não poderia ser de 2: 1?

 Atmica
Atmica Relacion molar
Relacion molar Atmica
Atmica Atmica
Atmica Joseph thomson
Joseph thomson Las partículas fundamentales del átomo son
Las partículas fundamentales del átomo son Atmica
Atmica Atmica
Atmica Masa atomica absoluta
Masa atomica absoluta Atmica
Atmica Contrato social hobbes
Contrato social hobbes Conteúdos disciplinares de natureza científica
Conteúdos disciplinares de natureza científica Eu tô perdido
Eu tô perdido N
N Ufpr 2017 os processos industriais nao imitam a natureza
Ufpr 2017 os processos industriais nao imitam a natureza Classificação dos materiais na natureza
Classificação dos materiais na natureza A filosofia grega parece começar com uma ideia absurda
A filosofia grega parece começar com uma ideia absurda Poemas natureza
Poemas natureza Cantigas de amigo natureza
Cantigas de amigo natureza Constantes da natureza
Constantes da natureza União internacional para a conservação da natureza
União internacional para a conservação da natureza Imprima somente o necessario a natureza agradece
Imprima somente o necessario a natureza agradece Os cinco reinos
Os cinco reinos Estudo sobre a natureza do cristo
Estudo sobre a natureza do cristo Simetrias na natureza
Simetrias na natureza