Opte metode za odreivanje i izraunavanje ravnotenih konstanti












![Drugi postupak: → CL = CM + [L] zavisnost CL od CM je prava Drugi postupak: → CL = CM + [L] zavisnost CL od CM je prava](https://slidetodoc.com/presentation_image_h2/8b27361cdb82c141b485e5dc519c74dd/image-15.jpg)


![Ako je odnos sukcesivnih konstanti K 1/K 2 ≥ 104 pri bilo kojoj [L] Ako je odnos sukcesivnih konstanti K 1/K 2 ≥ 104 pri bilo kojoj [L]](https://slidetodoc.com/presentation_image_h2/8b27361cdb82c141b485e5dc519c74dd/image-18.jpg)
![Opšti zaključak: Kn se može izračunati iz vrednosti za [L] koja odgovara polucelim vrednostima Opšti zaključak: Kn se može izračunati iz vrednosti za [L] koja odgovara polucelim vrednostima](https://slidetodoc.com/presentation_image_h2/8b27361cdb82c141b485e5dc519c74dd/image-20.jpg)










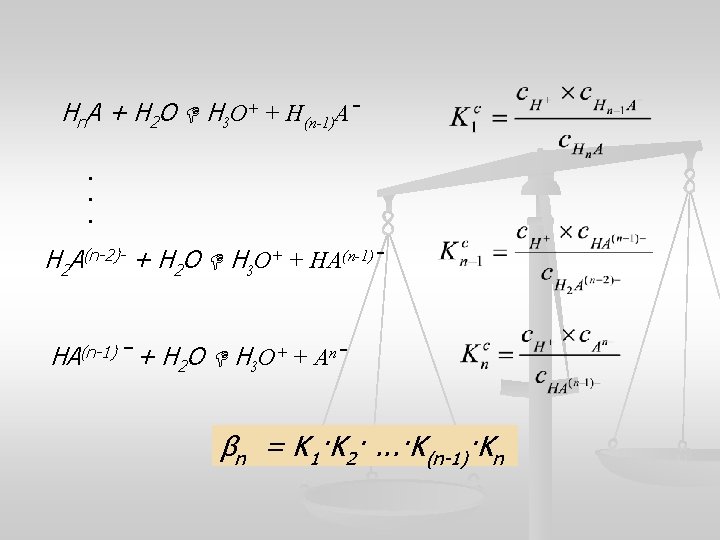





























- Slides: 64

Opšte metode za određivanje i izračunavanje ravnotežnih konstanti = osnovni principi eksperimentalnih postupaka i računske obrade podataka koji se mogu primeniti na sve ravnotežne sisteme 1. Izračunavanje na osnovu termodinamičkih parametara: ΔG 0 = - RTln. Ka ili: ΔG 0 = - 2, 3 RTlog. Ka Δ r. G 0 = Σ p Δ f G 0 - Σ rΔ f G 0 Δr. G 0 = Δr. H 0 – TΔr. S 0

Ako se hemijska reakcija odigrava na reverzibilnoj elektrodi, konstanta ravnoteže odgovarajuće redoks reakcije može se izračunati na osnovu elektrohemijskih podataka: E 0 = standardni redoks potencijal redoks reakcije, F = Faradejeva konstanta (96487 C), z = broj molova elektrona koji učestvuju u reakciji.

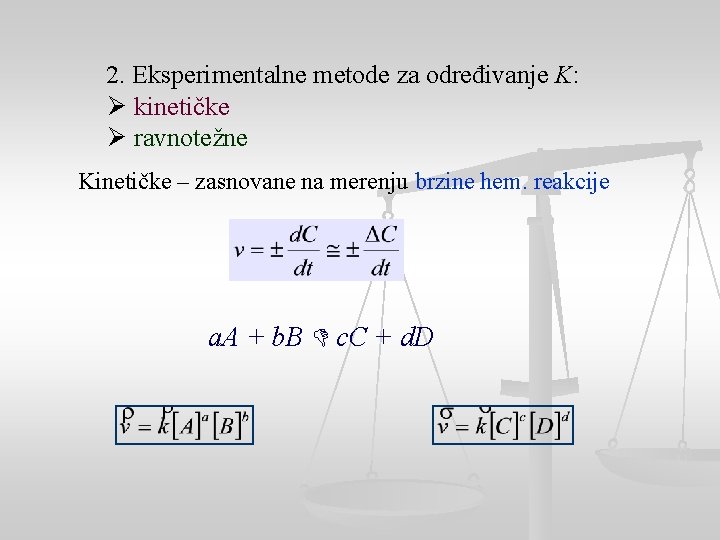
2. Eksperimentalne metode za određivanje K: Ø kinetičke Ø ravnotežne Kinetičke – zasnovane na merenju brzine hem. reakcije a. A + b. B c. C + d. D

Osnovni princip: praćenje promene C (tačnije neke fizičke veličine proporcionalne sa C: apsorpcija u UV/vis oblasti, fluorescencija, provodljivost. . . ) sa vremenom Dobijene vrednosti SAMO indikacija reda veličine K! Primena: proučavanje mehanizama reakcija koje dovode do uspostavljanja ravnoteže

Ravnotežne metode: Ø hem. analiza svih supstanci u rastvoru (sporo uspostavljanje ravnoteže; veoma inertni sistemi; primer: građenje kompleksa Cr(III) sa SCN¯; relativno brze reakcije “zamrzavanje” ravnoteže) Ø merenje nekog svojstva rastvora koje se kvantitativno menja sa promenom sastava rastvora: - merena veličina proporcionalna koncentraciji date supstance – optičke metode - merena veličina proporcionalna aktivitetu određene supstance – elektrohemijske metode

Opšti postupak za obradu eksperimentalnih podataka • Najčešće se eksperimentalno određuje c ili a samo jedne ravnotežne čestice: Npr. M + L ML Teorijski: samo jedan rastvor poznate CM i CL → određivanje samo M, L ili ML !!! Međutim, NESIGURNO, kod složenijih sistema i NEPRIMENLJIVO Praktični postupak: serija rastvora različitih C veći broj eksperimentalnih podataka

Izračunavanja u složenim sistemima su komplikovanija Nekoliko koraka: 1. Pretpostaviti “hemijski model” sistema i napisati ravnotežne reakcije i izraze za odgovarajuće konstante 2. Postaviti onoliko jednačina koliko ima nepoznatih koncentracija (dodatne jednačine: balans masa, balans naelektrisanja, funkcija građenja) 3. Sukcesivno rešavati sistem jednačina - aproksimacije 4. Po dobijanju konačnog rezultata proveriti učinjene pretpostavke 5. Ako je potrebno izračunavanja ponoviti!

Balans masa (BM): zbir koncentracija svih čestica koje nastaju transformacijom supstance dodate u rastvor jednak je stehimetrijskoj (analitičkoj ili totalnoj) koncentraciji date supstance. Na primer, u rastvoru Na. H 2 PO 4 jednačine BM za dihidrogen-fosfatni i natrijumov jon su:

Jednačina BN zasniva se na elektroneutralnosti rastvora: ukupna koncentracija pozitivnog naelektrisanja mora biti jednaka ukupnoj koncentraciji negativnog naelektrisanja. BP (balans protona) podrazumeva izjednačavanje koncentracija čestica sa viškom protona sa koncentracijama čestica sa “manjkom” protona.

Funkcija građenja (ili srednji koordinacioni, odnosno srednji ligandni broj), = srednji broj liganada vezanih sa jonom metala u svim oblicima kompleksa, tj. : CL i CM = stehiometrijske koncentracije liganda i metala [L] je koncentracija slobodnog liganda; CL - [L] odgovara koncentraciji vezanih liganada.

Jednačina BM za metal: BM za ligand:

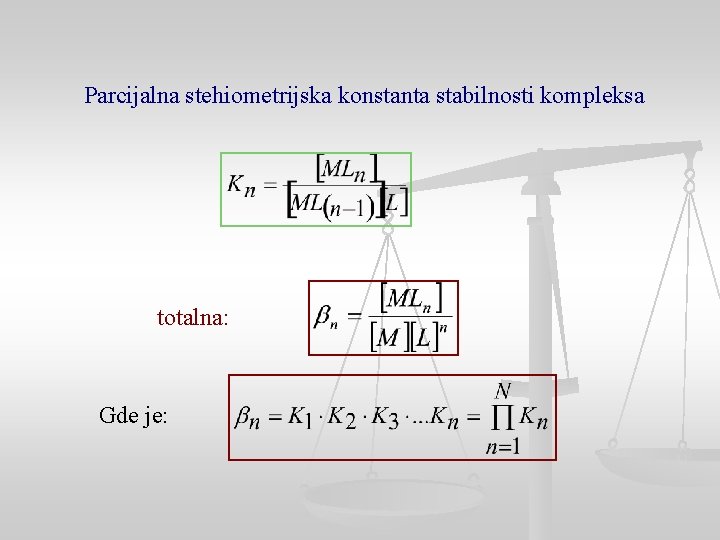
Parcijalna stehiometrijska konstanta stabilnosti kompleksa totalna: Gde je:

Ili: zavisi samo od koncentracije slobodnog liganda

Dve osnovne metode za određivanje koncentracije slobodnog liganda: 1. Ako se koncentracija slobodnog liganda može neposredno meriti (potenciometrijski pomoću jon-selektivnih elektroda) polazeći od poznatih stehiometrijskih koncentracija metala i liganda za svaku merenu vrednost koncentracije slobodnog liganda izračunava se srednji ligandni broj Ne može ako su kompleksi nestabilni ili ako je CM jako malo: Niske vrednosti razlike CL - [L] blisko nuli
![Drugi postupak CL CM L zavisnost CL od CM je prava Drugi postupak: → CL = CM + [L] zavisnost CL od CM je prava](https://slidetodoc.com/presentation_image_h2/8b27361cdb82c141b485e5dc519c74dd/image-15.jpg)
Drugi postupak: → CL = CM + [L] zavisnost CL od CM je prava sa nagibom i odsečkom na ordinati [L] CL CM

Izračunavanje K na osnovu funkcije Ø Način primene f-je zavisi od složenosti sistema Ø Računske i grafičke metode Ø Prednost grafičkih metoda: - istovremeno razmatranje većeg broja podataka - lakše uočavanje grešaka Ø Osnovni nedostatak: izračunavanje K u nekoliko koraka greške se adiraju!

Značajnije grafičke metode: metoda polucelih vrednosti funkcije građenja metoda linearne ekstrapolacije metoda “isključenja nepoznatog” metoda podudarnih krivih Npr. U rastvoru se grade kompleksi ML 2:
![Ako je odnos sukcesivnih konstanti K 1K 2 104 pri bilo kojoj L Ako je odnos sukcesivnih konstanti K 1/K 2 ≥ 104 pri bilo kojoj [L]](https://slidetodoc.com/presentation_image_h2/8b27361cdb82c141b485e5dc519c74dd/image-18.jpg)
Ako je odnos sukcesivnih konstanti K 1/K 2 ≥ 104 pri bilo kojoj [L] u rastvoru se u ravnoteži nalaze praktično samo dve čestice.

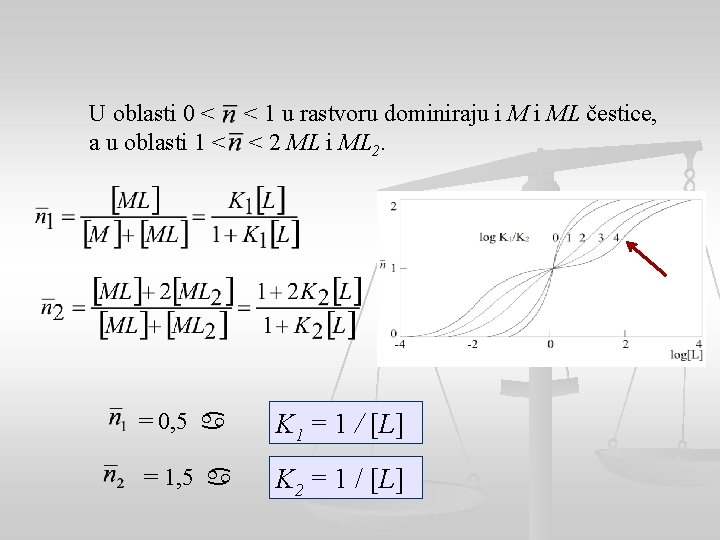
U oblasti 0 < < 1 u rastvoru dominiraju i ML čestice, a u oblasti 1 < < 2 ML i ML 2. = 0, 5 K 1 = 1 / [L] = 1, 5 K 2 = 1 / [L]
![Opšti zaključak Kn se može izračunati iz vrednosti za L koja odgovara polucelim vrednostima Opšti zaključak: Kn se može izračunati iz vrednosti za [L] koja odgovara polucelim vrednostima](https://slidetodoc.com/presentation_image_h2/8b27361cdb82c141b485e5dc519c74dd/image-20.jpg)
Opšti zaključak: Kn se može izračunati iz vrednosti za [L] koja odgovara polucelim vrednostima srednjeg ligandnog broja

Nedostatak: K se određuje na osnovu SAMO JEDNOG podatka ne može da se proceni pouzdanost određivanja! Preporuka: koristiti maksimalno dostupan broj podataka Iz:

i iz nagiba se mogu grafički odrediti K 1 i K 2 Metoda podudarnih (normiranih) krivih: Pogodna za serijsko proučavanje jednostavnih sistema

Sl. 3 -4. Krive građenja kompleksa ML: a – normirana kriva; b – ek-sperimentalna kriva; c – najbolje preklopljene krive a i b; d – uticaj sistematske greške.

Može da se transformiše u: Odakle se dobija:

ü Primena računara ü klasične metode još uvek u upotrebi ü izbor računarske metode zavisi od složenosti sistema ü osnovni postupak: svakoj eksperimentalnoj tački i nađe se vrednost yi koja se može izraziti pomoću dva parametra: βx i (χi 1, χi 2, . . . , χin) Na osnovu merenih veličina CM, CL i [L]:

Kiselinsko-bazne ravnoteže Prema Brönsted-Lowry-jevoj teoriji (1923. g. ) pod kiselinom se podazumeva svaka supstanca koja može da oda proton (proton donor), dok je baza svaka supstanca koja može da primi proton (proton akceptor). Svakoj kiselini HA odgovara konjugovana baza Aˉ : HA H+ + Aˉ a svakoj bazi B konjugovana kiselina BH+: B + H+ BH+

Kiselina HA (ili BH+) pokazuje veću težnju da gubi proton njena konjugovana baza Aˉ (ili B) ima manju težnju da primi proton Zbog malih dimenzija i visoke gustine naelektrisanja proton ne može samostalno da postoji u rastvoru Stabilizacija sa molekulima rastvarača HA + B Aˉ + BH k 1 b 2 b 1 k 2

Voda = amfiprotični rastvarač HA (ili BH+) + H 2 O H 3 O+ + Aˉ (ili B) + H 2 O HA (ili BH+) + OHˉ Kvantitativno se jačina kiseline u odnosu na vodu izražava ravnotežnom konstantom:

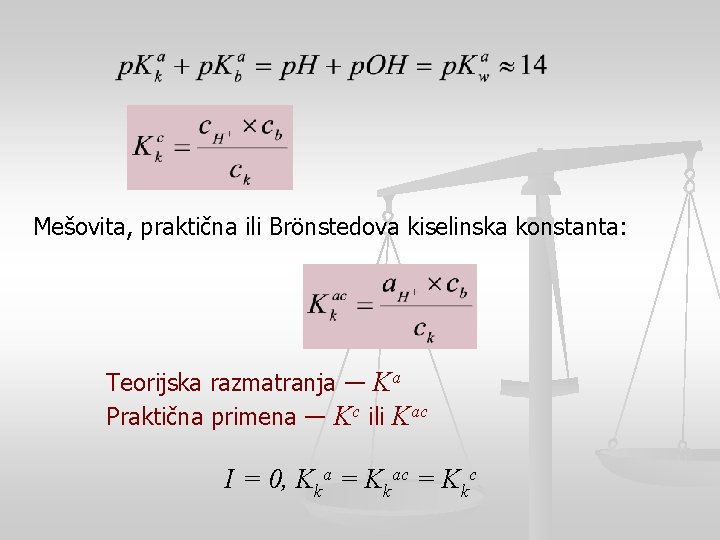
ili Upoređivanje jačine kiselina i baza vrši se u istoj p. Kk skali: što je kiselina jača njena p. Kk je manja, a što je baza jača njena p. Kk je veća. p. Kk za sirćetnu kis. , amonijum-jon i fenol: 4, 75; 9, 25 i 10, 0

Mešovita, praktična ili Brönstedova kiselinska konstanta: Teorijska razmatranja ― Ka Praktična primena ― Kc ili Kac I = 0, Kka = Kkac = Kkc

Aˉ + H 3 O+ HA + H 2 O Konstanta asocijacije ili protonovanja: Ako se kiselinsko-bazna reakcija odigrava u više stupnjeva za svaki stupanj jačina kiseline ili baze izražava se parcijalnom kiselinskom konstantom
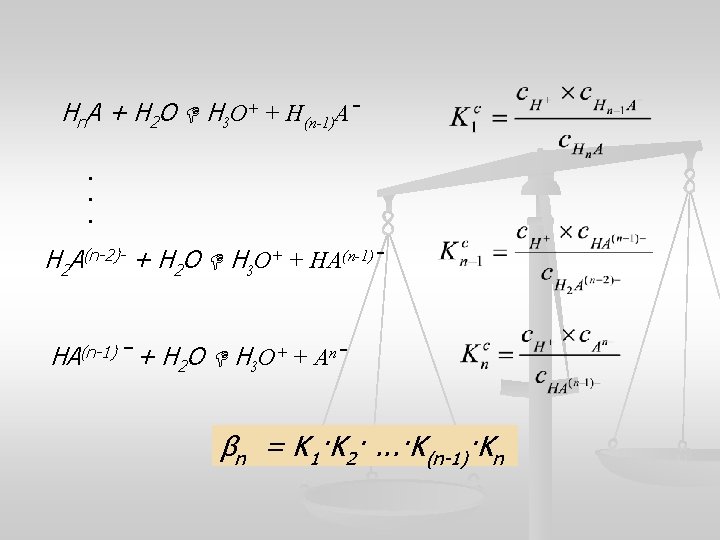
Hn. A + H 2 O H 3 O+ + H(n-1)Aˉ. . . H 2 A(n-2)- + H 2 O H 3 O+ + HA(n-1)ˉ + H 2 O H 3 O+ + Anˉ βn = K 1·K 2·. . . ·K(n-1)·Kn

Uticaj temperature na kiselinske konstante Ø Određivanje kiselinskih konstanti najčešće na temperaturama bliskim sobnoj Ø Različite kiseline i baze pokazuju različitu osetljivost na promenu temperature. Predviđanje uticaja temperature na kiselinske konstante u okviru određene klase supstanci: Polazeći od: ΔS 0 = d(ΔG 0)/d. T i izraza: - ΔG 0= RTln. Kka =2, 3 RTlog. Kka

Za obične monokarboksilne kiseline p. Kk se kreće između 4 i 5, a ΔS 0 na 25 ºC iznosi -88 ± 17 JK-1 mol-1 p. Kk vrednost monokarboksilnih kiselina se vrlo malo menja sa promenom T Slika 4 -1. Zavisnost Kk sirćetne kiseline od temperature. Kod fenola i njegovih derivata, p. Kk je oko 10, a ΔS 0 = -100 ± 17 JK-1 mol-1 na 25 ºC, d(p. Kk)/d. T ~ -0, 01 p. Kk opada za 0, 01 jedinicu za svaki stepen povišenja T (fenol postaje jača kiselina)

Uticaj rastvarača na kiselinsko-bazne ravnoteže Voda = najvažniji i najbolji rastvarač za ispitivanje kiselinsko-baznih ravnoteža Za supstance niske rastvorljivosti ili nepogodnih spektralnih karakteristika moraju se koristiti i drugi rastvarači. Većina uobičajenih rastvarača ponašaju se kao kiseline i/ili baze, imaju različite dielektrične konstante i različitu moć solvatacije utiču na aktivitet i pokretljivost jona. Značajna uloga rastvarača u većini k-b reakcija

Nivelirajući i diferencirajući efekat rastvarača Rastvarači koji se ponašaju kao donori protona (npr. glacijalna sirćetna i sumporna kiselina) = = kiseli ili protogeni Rastvarači koji su proton akceptori (npr. tečni amonijak i etilen-diamin) = = bazni ili protofilni Rastvarači, koji su sposobni i da primaju i da odaju protone (voda ili alkohol) = amfiprotični (amfoliti ili amfoterni)

Svi podležu autoprotolizi pri čemu nastaju liat (Sˉ ) i lionijum (SH 2+) jon: 2 SH SH 2+ + Sˉ 2 H 2 O H 3 O+ + OHˉ 2 CH 3 COOH 2+ + CH 3 COOˉ 2 NH 3 NH 4+ + NH 2ˉ. Rastvarači koji ne mogu niti da gube niti da primaju proton (npr. ugljovodonici) nazivaju se inertni.

Bazni rastvarači niveliraju jačinu kiselina koje su jače od njihovog lionijum-jona, a diferenciraju jačinu kiselina koje su slabije od lionijum-jona. Kiseli rastvarači niveliraju jačinu baza koje su jače od njihovog liat-jona, a diferenciraju jačinu baza koje su slabije od njihovog liat-jona. Vodeni rastvor: najjača kiselina je H 3 O+-jon, a najjača baza OHˉ-jon sve „jake kiseline“ kvantitativno predaju proton vodi i niveliraju se do jačine H 3 O+-jona, a jake baze primaju proton od vode i niveliraju se na jačinu OHˉ-jona.

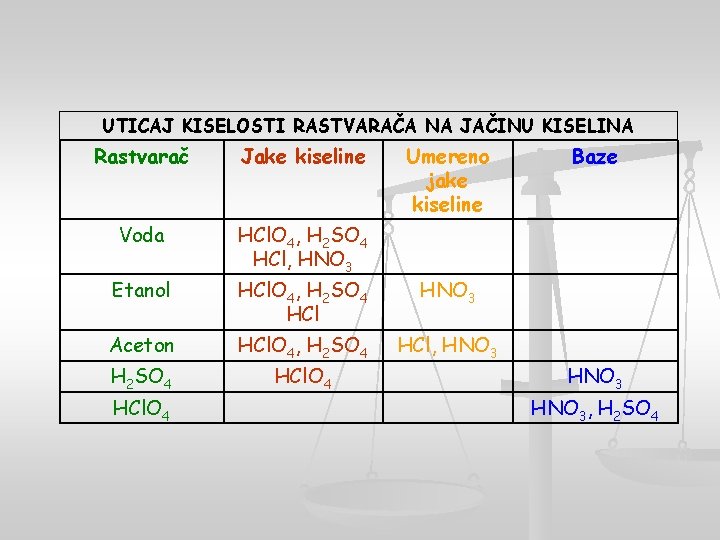
UTICAJ KISELOSTI RASTVARAČA NA JAČINU KISELINA Rastvarač Jake kiseline Voda HCl. O 4, H 2 SO 4 HCl, HNO 3 Etanol Aceton H 2 SO 4 HCl. O 4 Umereno jake kiseline HCl. O 4, H 2 SO 4 HCl HNO 3 HCl. O 4, H 2 SO 4 HCl, HNO 3 HCl. O 4 Baze HNO 3, H 2 SO 4

Protolitičke ravnoteže i dielektrična konstanta rastvarača jonizacija disocija HA + SH 2+A- SH 2+ + Ajonski par Stepen jonizacije zavisi od relativne jačine konjugovanih k-b parova kiseline (HA/Aˉ) i rastvarača (SH 2+/SH). Disocija jonskog para zavisi od naelektrisanja jonskog para i dielektrične konstante rastvarača, ε. Npr. sirćetna kiselina u vodi (ε = 78, 5) ima p. Kk 4, 75, dok u alkoholu (ε = 24, 3) postaje slabija, p. Kk = 10, 3 ε > 40 �disocija; ε < 10 �jonski parovi

Metode za određivanje kiselinskih konstanti Izbor metode obično zavisi od postupka za određivanje molskog odnosa konjugovanog kiselinsko-baznog para pri određenoj kiselosti rastvora. Većina metoda omogućava vrlo precizno određivanje ovog odnosa pouzdanost dobijenih konstanti zavisi od tačnosti merenja kiselosti rastvora.

Dobija se merenjem EMS u elementima bez difuzionog potencijala sa elektrodama reverzibilnim u odnosu na vodonične i hloridne jone. Preciznost do ± 0, 001 p. Kk-jedinice. Za merenje kiselosti rastvora primenjuju se praktično pogodniji elementi (p. H-metri) sa difuzionim potencijalom i elektrodnim parom staklena/kalomelova elektroda. Ovako izmerena kiselost rastvora izražava se praktičnom p. H-jedinicom kiselosti.

Praktična skala kiselosti pokriva p. H-interval od 2 do 12, Preciznost određenih konstanti: oko ± 0, 003 p. Kk-jedinice. Van ove oblasti tačnost p. H-merenja postaje nesigurna. �koriste se druge skale kiselosti Dve opšte grupe (prema postupku za određivanje molskog odnosa konjugovanog kiselinsko-baznog para): 1. Zasnovane na merenju p(a. Hy. Cl) ili p. H-vrednosti u rastvorima poznatog stehiometrijskog sastava; 2. Zasnovane na direktnom merenju koncentracija konjugovanog kiselinsko-baznog para u rastvorima poznate kiselosti.

1. Seriji puferskih rastvora poznatih stehiometrijskih koncentracija konjugovanog kiselinsko-baznog para i poznate koncentracije hloridnog jona meri se p(a. Hy. Cl) u ćelijama bez difuzionog potencijala. Mnogo jednostavnija, ali manje tačna varijanta: p. H-merenje tokom potenciometrijske titracije 2. Kvantitativno merenje bilo kojeg fizičkog svojstva koje se menja u toku protonovanja u rastvoru poznate kiselosti. Tipičan primer: spektrofotometrija

U jako kiselim i jako alkalnim rastvorima (12 < p. H < 2) mogu se dobiti neprecizne vrednosti za p. Kk. Preko 90% određenih p. Kk-vrednosti nalazi se između 2 i 12, ali u ovoj p. H-oblasti protonuje se samo oko 5% grupa koje su uobičajene kod organskih supstanci (većina tek u konc. sumpornoj kiselini)

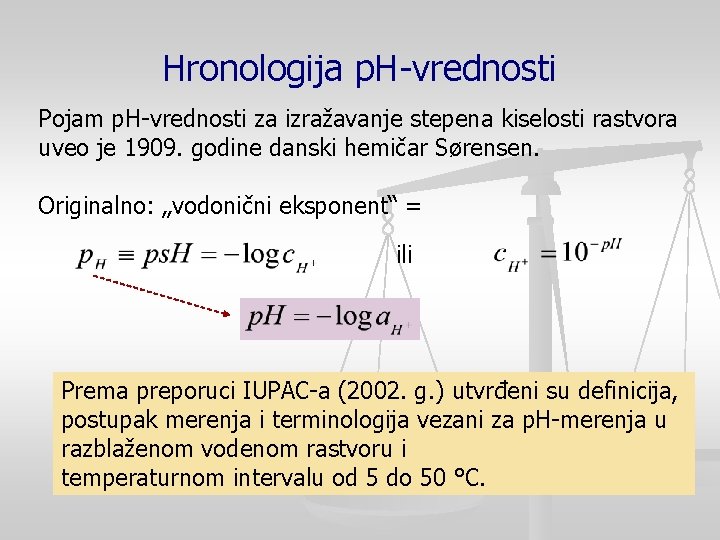
Hronologija p. H-vrednosti Pojam p. H-vrednosti za izražavanje stepena kiselosti rastvora uveo je 1909. godine danski hemičar Sørensen. Originalno: „vodonični eksponent“ = ili Prema preporuci IUPAC-a (2002. g. ) utvrđeni su definicija, postupak merenja i terminologija vezani za p. H-merenja u razblaženom vodenom rastvoru i temperaturnom intervalu od 5 do 50 °C.

www. iupac. org

Najpogodnija metoda za određivanje p. H-vrednosti: merenje EMS galvanskog elementa sa reverzibilnom vodoničnom elektrodom. Osnovni element ovog tipa (Sørensen): Pt, H 2(g), Standardna vodonična elektroda (SVE) rastvor X | KCl, rastvor | 0, 1 M KCl, Hg 2 Cl 2(č), Hg(č) mereni rastvor soni most referentna kalomelova elektroda (KE) Danas se obično umesto vodonične elektrode koristi staklena, ređe hinhidronova ili antimonova elektroda. Najčešće referentne elektrode pored 0, 1 M mogu biti 1, 0 M; 3, 5 M ili zasićena KE, kao i Ag/Ag. Cl, Clˉ elektroda.

Razlika u EMS merena u elementima koji su sadržavali rastvore različitih koncentracija H+, izražavala se u skladu sa Nernstovom jednačinom: εX i ε 0 korigovane za difuzioni potencijal, a (c. H+)0 i (c. H+)X = koncentracije H+-jona u odgovarajućim rastvorima.

Debye-Hückel-ova teorija jakih elektrolita (1924. g. ) nova jedinica kiselosti: Uslovno pa. H vrednost se može odrediti merenjem EMS u elementu sa difuzionim potencijalom EMS je: Ed = zbir difuzionih potencijala na krajevima sonog mosta, ε 0 je EMS hipotetičnog elementa u kojem su i a. H i a. Cl = 1, Ed 0 je difuzioni potencijal, a. H je aktivitet H+-jona u rastvoru X, a. Cl aktivitet Clˉ- jona u rastvoru KCl kalomelove elektrode, EH = potencijal vodonične elektrode (pri standardnim uslovima jednak nuli)

Može se prihvatiti da su Ed 0 i a. Cl konstante za dati element i temperaturu Gde je:

Aktivitet pojedinačnih jona nema realni udeo u EMS galvanskog elementa termodinamički ispravnija jedinica kiselosti: gde je y± srednji koeficijent aktiviteta binarnog (1: 1) elektrolita u merenom rastvoru Ø ima nejasno značenje ukoliko rastvor sadrži druge tipove elektrolita ili smešu elektrolita Strogo termodinamičke zahteve u pogledu definisanja kiselosti rastvora ispunjava jedino funkcija kiselosti p(a. Hy. Cl) :

Primarna metoda merenja kiselosti Funkcija kiselosti povezana je sa konvencionalno prihvaćenom p. H jedinicom kao standardnom vrednošću aktiviteta vodoničnih jona izrazom: „primarna metoda merenja“ sastoji se u: • određivanju funkcije kiselosti u elementima bez difuzionog potencijala, • definisanju primarnih puferskih standarda (PS), • odnos PS prema sekundarnim standardima (SS) merenim primenom sekundarnih metoda • uslove uključivanja p. H iz konvencionalne jedinice u internacionalni merni sistem (SI).

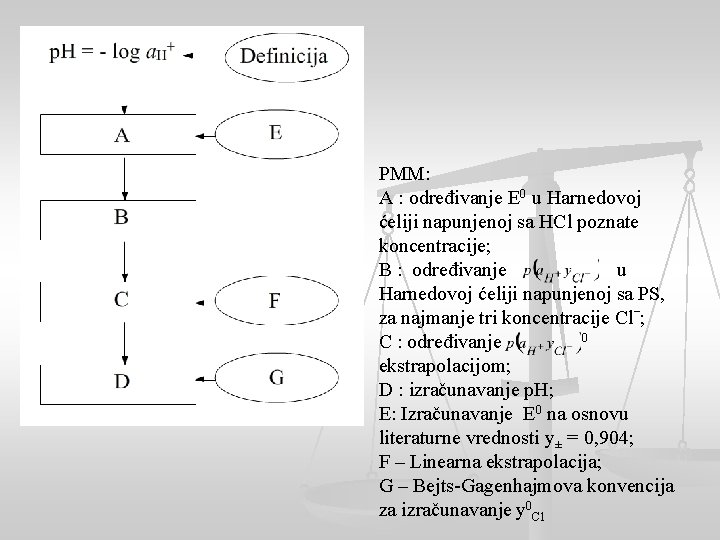
PMM: A : određivanje E 0 u Harnedovoj ćeliji napunjenoj sa HCl poznate koncentracije; B : određivanje u Harnedovoj ćeliji napunjenoj sa PS, za najmanje tri koncentracije Clˉ; 0 C : određivanje ekstrapolacijom; D : izračunavanje p. H; E: Izračunavanje E 0 na osnovu literaturne vrednosti y± = 0, 904; F – Linearna ekstrapolacija; G – Bejts-Gagenhajmova konvencija za izračunavanje y 0 Cl

Primarni standardi moraju da poseduju: reproduktivnost (Δp. H(PS) < 0, 003), stabilnost, visoki puferski kapacitet, mali efekat razblaženja i temperaturni koeficijent, nisku jonsku silu (I ≤ 0, 1) ograničen p. H-interval od 3 do 10 PS: kalijum-hidrogentartarat, kalijum-dihidrogencitrat, kalijum-hidrogenftalat, dinatrijum-hidrogenfosfat, kalijum-dihidrogenfosfat i dinatrijum-tetraborat.

Supstance čije su p. H-vrednosti određene u odnosu na PS predstavljaju sekundarne standarde (kalcijum-hidroksid, kalijum-tetraoksalat, azotne baze tipa BH+, zwitter-jonski puferi). Gornja granica nesigurnosti = 0, 01 (za 95%-tni interval pouzdanosti)

IUPAC (2002. g. ) uvedena je skala kiselosti koja predstavlja kompromisno rešenje između teorijskih i praktičnih zahteva Praktična p. H-merenja izvode se pomoću elementa Staklena │ Rastvor KCl │ Rastvor p. H(S) │ Referentna elektroda │ zasićeni │ ili p. H(X) │ elektroda (El. V)

Standardni potencijal elementa zavisi od mnogo faktora i vremenski se menja treba ga češće proveravati Nepraktično uveden jednostavniji postupak (ne zahteva poznavanje standardnog potencijala): p. H-metar se kalibriše u odnosu na odgovarajući standardni pufer poznate p. H(S)-vrednosti; zamenom standardnog rastvora „nepoznatim“ meri se njegova EMS (εX).

Za širi opseg p. H-merenja: kalibracija sa dva standardna pufera, čije su p. H-vrednosti neposredno ispod i iznad p. H(X). Merena EMS u nepoznatom rastvoru se transformiše direktno u p. H-mereno. Uobičajeni standardi za p. H-merenja su 0, 05 M kalijum-hidrogenftalat (p. H = 4, 01; 25°C) i 0, 01 M natrijum-borat (boraks, p. H = 9, 18; 25°C). Za merenje van p. H-oblasti 3 – 11: 0, 05 M kalijum-tetraoksalat (p. H = 1, 68; 25°C) i zasićeni rastvor kalcijum-hidroksida (p. H = 12, 45; 25°C)

Upoređivanjem p. H-vrednosti praktične skale kiselosti i p. H-vrednosti dobijenih u elementima bez difuzionog potencijala utvrđeno je da u p. H-intervalu od 2, 5 do 11, 5 postoji razlika do oko 0, 03 p. H-jedinice. Pod „normalnim“ uslovima prihvaćena greška „praktičnog“ merenja je: p. H(X) = -loga. H ± 0, 02 pri većim jonskim silama postoje razlike izražene kroz p. H = -log c. Hy?

U praksi: drugi postupci za preračunavanje merenih p. H-vrednosti u koncentraciju vodoničnih jona Npr. Irwingov postupak: - p. H-metrijski se titruje razblaženi standardni rastvor jake kiseline rastvorom jake baze u odgovarajućoj jonskoj sredini -p. H-metar prethodno standardizovan (p. H(S)) -Za svaku titracionu tačku izračunava se pc. H iz poznate koncentracije kiseline (pc. H = -log[H+] = -log[HCl]) i očitava merena p. H-vrednost (p. Hm). Razlika u jonskoj sili između pufera i ispitivanog rastvora očitano p. Hm : p. Hm = p. H(S) – ΔEd = pc. H + logy – ΔEd = pc. H + A gde je A korekcioni faktor. (H. M. Irving, M. G. Miles and L. D. Pettit, Anal. Chim. Acta, 38 (1967) 475 -488)

Skale kiselosti za nevodene rastvore Elektrolitička ćelija sa difuzionim potencijalom (p. H-metar) koja se kalibriše za vodene rastvore ne može se koristiti za merenje u nevodenim ili mešovitim rastvorima relativna skala kiselosti (p. H*-skala) zasnovana na p. H-merenjima u odnosu na standardne pufere u odgovarajućoj sredini na način analogan postupku koji se primenjuje za p. H-skalu u vodi.

Merenja u p. H*-skali: konvencionalnih p. H-metar kalibrisan pomoću pogodnih standardnih pufera (p. H*(S)) u istom sistemu rastvarača Aproksimativni postupak: p. H-metar se standardizuje korišćenjem vodenih rastvora pufera, očitana p. H(R)-vrednost u delimično vodenom ili nevodenom rastvoru razlikuje se za neku određenu veličinu, δ, od očitane p. H*-vrednosti koja se dobije kada se p. H-metar kalibriše korišćenjem odgovarajućeg p. H*-standarda. p. H* = p. H(R) – δ.

Univerzalna p. H-skale za različite sisteme rastvarača? Gotovo nemoguće zbog nemogućnosti da se odredi individualni efekat sredine na vodonični jon. Operaciona p. D-skala p. D = p. H(R) + 0, 40
 Metode euler metode numerik
Metode euler metode numerik Metode tertutup metode numerik
Metode tertutup metode numerik Metode-metode pengelolaan anggaran
Metode-metode pengelolaan anggaran Metode-metode survei konsumsi makanan
Metode-metode survei konsumsi makanan Perbedaan survei dan eksperimen
Perbedaan survei dan eksperimen Metode kotor dan metode bersih
Metode kotor dan metode bersih Metode bruto dan metode netto
Metode bruto dan metode netto Pentingnya kesejahteraan karyawan adalah … *
Pentingnya kesejahteraan karyawan adalah … * Contoh soal metode harga pokok proses lanjutan metode fifo
Contoh soal metode harga pokok proses lanjutan metode fifo Contoh soal dan jawaban metode tangan bebas
Contoh soal dan jawaban metode tangan bebas Metode metode dalam psikologi pendidikan
Metode metode dalam psikologi pendidikan Contoh soal biseksi
Contoh soal biseksi Makalah survei konsumsi pangan
Makalah survei konsumsi pangan Metode simpleks dual
Metode simpleks dual Metode marginalist pricing pada kondisi ketidakpastian
Metode marginalist pricing pada kondisi ketidakpastian Aturan pembagian istimewa
Aturan pembagian istimewa Kekurangan binary search
Kekurangan binary search Investasi aset riil
Investasi aset riil Metode eliminasi gauss
Metode eliminasi gauss Metode payback period
Metode payback period Silabus metode penelitian
Silabus metode penelitian Artesis adalah
Artesis adalah Pi npv
Pi npv Metode big m riset operasi
Metode big m riset operasi Rumus trapezoidal
Rumus trapezoidal Metode simpleks
Metode simpleks Metode ralston
Metode ralston Soal integral tentang luas daerah yang diarsir
Soal integral tentang luas daerah yang diarsir Metode rada s djecom s posebnim potrebama
Metode rada s djecom s posebnim potrebama Psihanaliza metode
Psihanaliza metode Contoh metode naif
Contoh metode naif Epizodicko pamcenje
Epizodicko pamcenje Poststrukturalisme
Poststrukturalisme Pijipin
Pijipin Rumus trend
Rumus trend Metode prakiraan dampak
Metode prakiraan dampak Metode istraživanja u psihologiji
Metode istraživanja u psihologiji Metode penilaian investasi
Metode penilaian investasi Conversatia euristica
Conversatia euristica Studiul de caz metoda didactica
Studiul de caz metoda didactica Luaran kkn adalah
Luaran kkn adalah Komparativ casestudie
Komparativ casestudie Contoh model optimasi
Contoh model optimasi Suggestopedia adalah
Suggestopedia adalah Tipologi partai politik
Tipologi partai politik Program linear metode simpleks
Program linear metode simpleks Apa itu metode gravimetri
Apa itu metode gravimetri Metode sdlc
Metode sdlc Metode midpoint elastisitas
Metode midpoint elastisitas Contoh koreksi kesalahan beban
Contoh koreksi kesalahan beban Hermeneutiske spiral metode
Hermeneutiske spiral metode Samfundsfags metoder
Samfundsfags metoder Deret taylor
Deret taylor Contoh soal metode tabel
Contoh soal metode tabel Metode pencarian heuristik
Metode pencarian heuristik Meningskategorisering
Meningskategorisering Arus harga pokok bahan metode mpkp
Arus harga pokok bahan metode mpkp Metode pelaksanaan konstruksi jalan rel
Metode pelaksanaan konstruksi jalan rel Pengertian penelitian longitudinal
Pengertian penelitian longitudinal Kelebihan dan kekurangan metode ceramah
Kelebihan dan kekurangan metode ceramah Contoh soal argentometri metode fajans
Contoh soal argentometri metode fajans Sudjana 1992
Sudjana 1992 Contoh soal metode romberg
Contoh soal metode romberg Pravila integriranja
Pravila integriranja Rpp berbasis scl
Rpp berbasis scl