Modelos Atmicos I COLGIO INEDI Prof Luiz Antnio

































- Slides: 39

Modelos Atômicos I COLÉGIO INEDI Prof. Luiz Antônio Tomaz

Os gregos filósofos Demócrito e Leucipo acreditavam que haveria um limite para dividir a matéria, ou seja, a matéria seria, a partir de um dado instante, indivisível. Em grego, indivisível pode ser entendido como “átomo”.

Demócrito e Leucipo: pioneirismo. Durante séculos esquecidos.

O modelo de John Dalton O modelo atômico proposto (1808) por Dalton, também conhecido por “bola de bilhar”, por lembrar uma bola maciça e indivisível, foi suficiente para explicar as reações químicas como sendo um “rearranjo” entre os átomos.

John Dalton e seu modelo.

Os modelos evoluem Na segunda metade do século XIX, trabalhos envolvendo eletricidade (já adiantados na época, como a eletrólise ao lado) e radioatividade não encontravam explicações convincentes à luz do modelo de Dalton. Há necessidade, portanto, de um modelo melhor que o de Dalton.

Dividindo o indivisível: como começou? No século XIX, os trabalhos de Willian Crookes (1878) mostraram experimentalmente que, quando submetidos a baixas pressões, os gases podem se tornar condutores elétricos.

Ampola de Crookes: o que é ? Um tubo de vidro (ampola), apresentando nas extremidades dois metais chamados eletrodos. Estes são ligados a uma fonte (bateria) de alta “voltagem” ou tensão. O dispositivo é, então, ligado a uma bomba de vácuo para retirar o ar do interior.

Ampola de Crookes: como funciona ? Quando a pressão interna exercida pelo gás for reduzida a um décimo (1/10) da pressão ambiente, observa-se queo gás entre os eletrodos passa a emitir luminosidade.

Ampola de Crookes: como funciona ? Quando a pressão for reduzida para cerca de 1/100 000 da pressão ambiente, desaparece a luminosidade, restando uma “mancha” luminosa atrás do ânodo. Essa “mancha”, concluiu-se, provém do pólo positivo ou cátodo; por isso, os raios foram chamados raios catódicos.

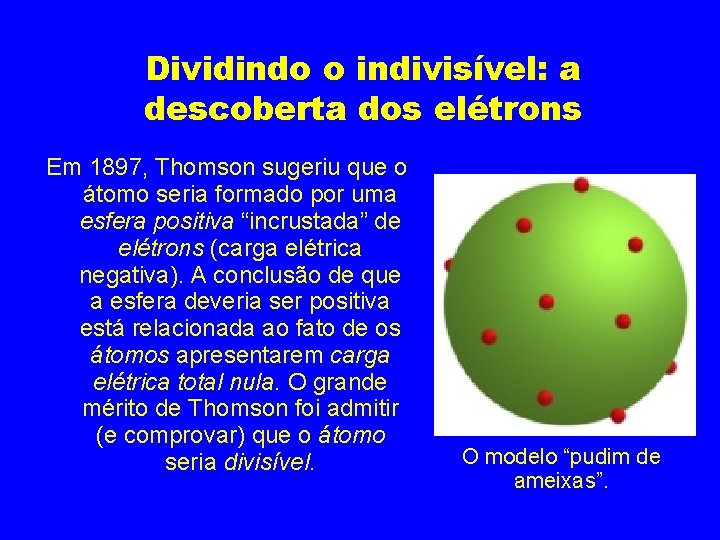
Dividindo o “indivisível”: a descoberta dos elétrons Referenciado-se nos trabalhos de Crookes e aperfeiçoando-os, Joseph Thomson (1887), esclareceu que os raios catódicos são, na verdade, constituídos por um fluxo de partículas menores do que os átomos e dotadas de cargas negativas. Denominou-as elétrons.

Dividindo o indivisível: descoberta dos elétrons Thomson concluiu que essas partículas (raios catódicos) eram dotadas de carga negativa, pois ao submetê-las a um campo elétrico eram atraídas pelo pólo positivo desse campo. Lembremo-nos: cargas elétricas de sinais contrários se atraem; de mesmo sinal, se repelem.

Dividindo o indivisível: a descoberta dos elétrons Em 1897, Thomson sugeriu que o átomo seria formado por uma esfera positiva “incrustada” de elétrons (carga elétrica negativa). A conclusão de que a esfera deveria ser positiva está relacionada ao fato de os átomos apresentarem carga elétrica total nula. O grande mérito de Thomson foi admitir (e comprovar) que o átomo seria divisível. O modelo “pudim de ameixas”.

Dividindo o indivisível: descoberta dos elétrons Thomson e seu modelo ao lado.

Dividindo o indivisível: descoberta dos elétrons Um dos fatores que contribuiu para a “vida curta” do modelo de Thomsom foi a descoberta da radioatividade.

Radioatividade: outra evidência de que o átomo é divisível Antoine Becquerel (1896) descobriu que certos materiais que contêm urânio emitem espontaneamente radiações (raios) de grande poder de penetração, capazes inclusive de “manchar” um filme fotográfico. Mais tarde o casal Marie e Pierre Curie descobriu que os elementos polônio e rádio também eram radioativos.

Radioatividade: outra evidência de que o átomo é divisível Através de experiências, como submeter emissões radioativas a um campo magnético, Rutherford (1903) verificou que elas sofriam diferentes desvios.

Radioatividade: outra evidência de que o átomo é divisível Pode, assim, identificar três tipos de emissões (denominadas por letras gregas):

Radioatividade: outra evidência de que o átomo é divisível Raios alfa ( ), partículas “pesadas” e carregadas positivamente; Raios beta ( ), partículas “leves” e carregadas negativamente; Raios gama ( ), ondas eletromagnéticas (sem “peso”) de grande energia e penetrantes.

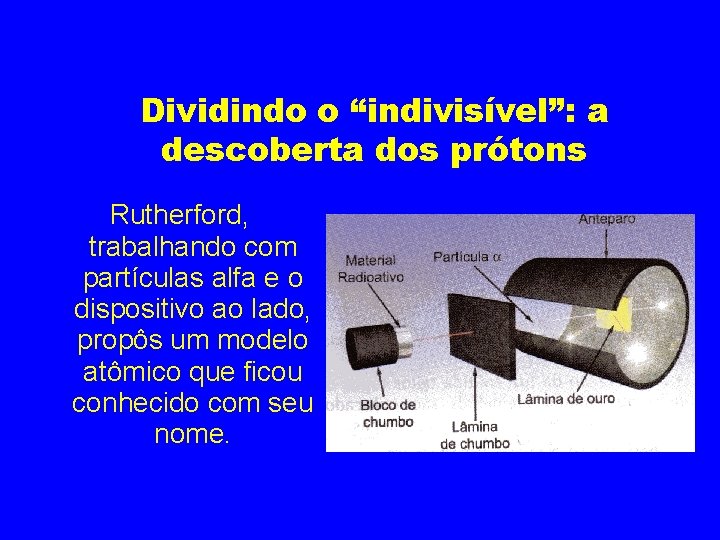
Dividindo o “indivisível”: a descoberta dos prótons Rutherford, trabalhando com partículas alfa e o dispositivo ao lado, propôs um modelo atômico que ficou conhecido com seu nome.

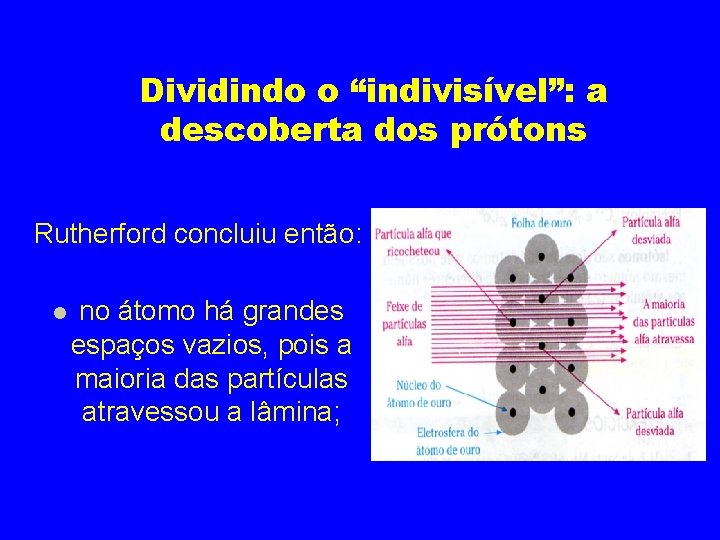
Dividindo o “indivisível”: a descoberta dos prótons No experimento realizado, a maioria das partículas alfa atravessou a lâmina de ouro, algumas poucas desviaram e outras poucas também ricochetearam.

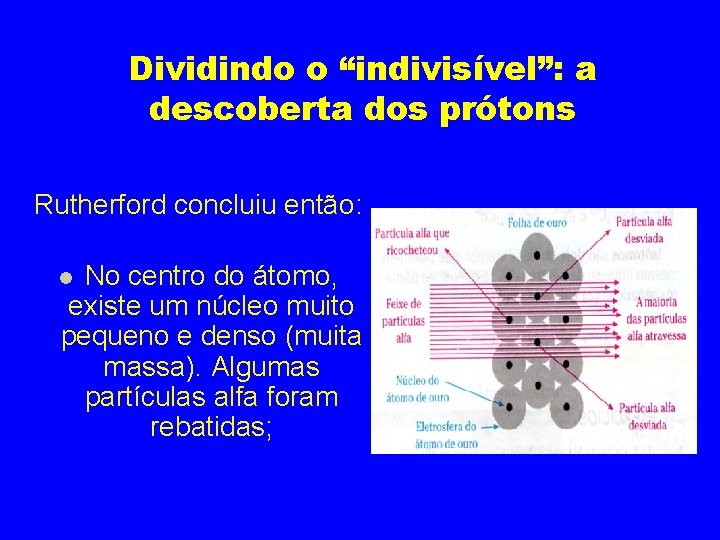
Dividindo o “indivisível”: a descoberta dos prótons Rutherford concluiu então: no átomo há grandes espaços vazios, pois a maioria das partículas atravessou a lâmina;

Dividindo o “indivisível”: a descoberta dos prótons Rutherford concluiu então: No centro do átomo, existe um núcleo muito pequeno e denso (muita massa). Algumas partículas alfa foram rebatidas;

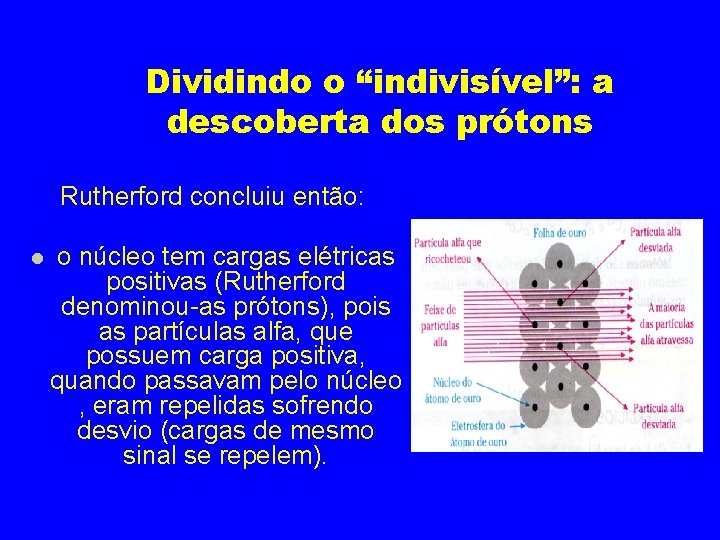
Dividindo o “indivisível”: a descoberta dos prótons Rutherford concluiu então: o núcleo tem cargas elétricas positivas (Rutherford denominou-as prótons), pois as partículas alfa, que possuem carga positiva, quando passavam pelo núcleo , eram repelidas sofrendo desvio (cargas de mesmo sinal se repelem).

Modelo planetário de Rutherford admitiu ainda que os elétrons estariam girando ao redor do núcleo, o mais afastados possível para não serem “engolidos” (cargas de sinais contrários se atraem). Modelo “planetário” de Rutherford

A contribuição de Niels Bohr O modelo proposto por Rutherford, embora revolucionário, apresentava um problema: era contraditório a um conhecimento já existente na época. As partículas elétricas em movimento acelerado emitem energia.

A contribuição de Niels Bohr Se os elétrons estiverem girando (com aceleração centrípeta) perdem energia gradativamente. Diminuindo a velocidade e em espiral, “caem” no núcleo.

A contribuição de Niels Bohr Em 1913, o dinamarquês Niels Bohr concluiu uma série de postulados, isto é, afirmações que não precisam comprovação (tanto experimental quanto teórica), a esse respeito. Esses postulados não faziam muito sentido, quando comparados aos conhecimentos de Física da época.

Postulados de Niels Bohr 1. Os elétrons giram em orbitas circulares e somente a determinadas distâncias do núcleo (essas órbitas são chamadas camadas ou níveis de energia). Salientese que um elétrons não pode permanecer entre dois níveis de energia;

Postulados de Niels Bohr 2. Um elétron pode passar de um nível para outro de maior energia, desde que absorva energia externa (energia elétrica, luz, calor, etc. );

Postulados de Niels Bohr 3. Quando o elétron retorna para o nível de energia menor, o átomo devolve essa energia (em geral na forma de luz).

Rutherford ou Bohr? Os postulados de Bohr não são contraditórios ao modelo de Rutherford, mas complementares. Por isso, ficou o modelo conhecido como modelo de Rutherford-Bohr.

Surge outro modelo? As modificações dos modelos atômicos não param por aí. Em 1915, o cientista Sommerfeld aperfeiçoou o modelo de Rutherford-Bohr admitindo não só a existência de orbitas circulares, mas também elípticas.

Surge outro modelo? Sommerfeld analisou a quantidade de energia que um elétron desprendia em forma de luz. Diferenças encontradas devem-se ao fato de as camadas possuirem subdivisões ou subníveis de energia.

A descoberta do nêutron Em 1932, James Chadwick descobriu uma outra partícula subatômica de massa muito próxima à massa do próton, mas sem carga elétrica (neutra, portanto). Essa partícula passou a ser chamada nêutron e localiza-se no núcleo do átomo.

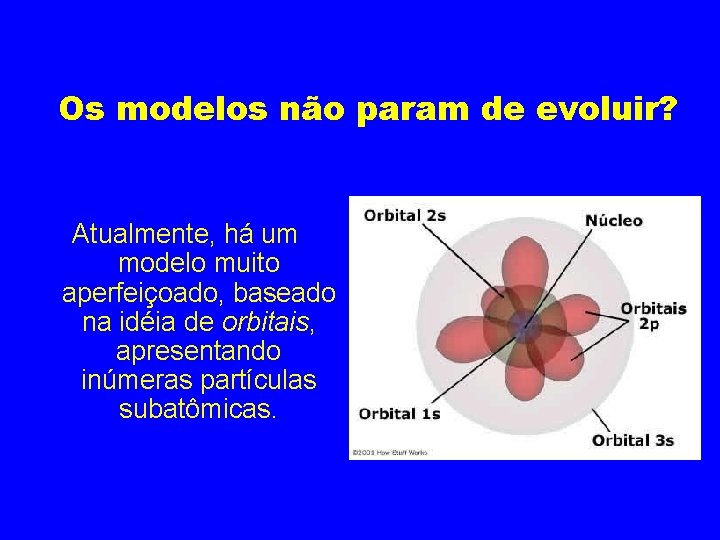
Os modelos não param de evoluir? Atualmente, há um modelo muito aperfeiçoado, baseado na idéia de orbitais, apresentando inúmeras partículas subatômicas.

Os modelos não param de evoluir? Entretanto, por enquanto, para estudar, entender, explicar, prever, . . . os fenômenos químicos bastanos estudar as três partículas fundamentais.

Os modelos não param de evoluir? A saber, de acordo com o modelo de Rutherford. Bohr, o próton, o elétron, o nêutron. Quanto os conceitos de Química exigirem uma abordagem de outros modelos, isso será feito.

Modelos atômicos That's all folks!
 Luiz felipe ramos
Luiz felipe ramos Ricardo luiz da silva
Ricardo luiz da silva Luiz pareto
Luiz pareto Cronograma projeto de tese doutorado
Cronograma projeto de tese doutorado Marcos luiz mucheroni
Marcos luiz mucheroni Músicas de luiz gonzaga
Músicas de luiz gonzaga Fernando luiz pellegrini pessoa
Fernando luiz pellegrini pessoa Celk penha
Celk penha A morte dos girassóis caio fernando abreu
A morte dos girassóis caio fernando abreu Louisi barsi
Louisi barsi Luiz carlos de castro
Luiz carlos de castro Marcos luiz mucheroni
Marcos luiz mucheroni Ronir raggio
Ronir raggio Luiz vicente de souza queiroz
Luiz vicente de souza queiroz Luiz marcio cysneiros
Luiz marcio cysneiros Fernando luiz pellegrini pessoa
Fernando luiz pellegrini pessoa Luiz di marcello
Luiz di marcello Desenho de pedro luiz padovini
Desenho de pedro luiz padovini Antônio luiz seabra
Antônio luiz seabra Pedro luiz de castro
Pedro luiz de castro Marcos luiz mucheroni
Marcos luiz mucheroni Marcelo de oliveira rosa
Marcelo de oliveira rosa Luiz felipe em japonês
Luiz felipe em japonês Washington luiz ferreira rios
Washington luiz ferreira rios Marcos luiz mucheroni
Marcos luiz mucheroni Luiz pizarro
Luiz pizarro Nossa gramática completa sacconi
Nossa gramática completa sacconi Assum preto luiz gonzaga
Assum preto luiz gonzaga Luiz moutinho
Luiz moutinho Angélica nascimento bussunda
Angélica nascimento bussunda Marcos luiz mucheroni
Marcos luiz mucheroni Luiz eduardo camanho
Luiz eduardo camanho Lucielene maria silva de luiz
Lucielene maria silva de luiz Modelos de transistores
Modelos de transistores Modelo cronograma de atividade
Modelo cronograma de atividade Modelos de mrp
Modelos de mrp Modelos atomicos de schrodinger
Modelos atomicos de schrodinger Modelos de envejecimiento
Modelos de envejecimiento Caracteristicas del regimen tradicional
Caracteristicas del regimen tradicional Sistema de orientacion
Sistema de orientacion