AULA 3 Fernando Luiz Pellegrini Pessoa TPQBq ESCOLA

AULA 3 Fernando Luiz Pellegrini Pessoa TPQBq ESCOLA DE QUÍMICA UNIVERSIDADE FEDERAL DO RIO DE JANEIRO

Qualquer variação no estado de equilíbrio de um sistema PVT gera variações nas propriedades dos fluidos no sistema Como consequência da 1 a e 2 a leis da TD, uma equação relaciona as variações que ocorrem nas propriedades termodinâmicas fundamentais U, V e S As demais propriedades termodinâmicas são criadas por definição e levam à formas alternativas das relações fundamentais

Propriedades físicas A termodinâmica, por si só, não pode prover propriedades físicas. Somente a teoria molecular ou experimentos podem fazê-lo. Entretanto, a termodinâmica reduz os esforços teóricos e experimentais, pois propicia várias relações entre propriedades físicas

Relação fundamental das propriedades para fases homogêneas Sistema fechado, contendo n moles, • processo reversível: d(n. U) = d. Qrev + d. Wrev • d. Wrev = - Pd(n. V) • d. Qrev = Td(n. S) • d(n. U) = Td(n. S) – Pd(n. V) •

1. Equação diferencial básica relacionando U, S , V • 2. Envolve 1 a e 2 a leis da Termodinâmica • 3. Derivada para o caso especial reversível • 4. Contém só funções de estado • 5. Se aplica a qualquer processo • 6. Variação diferencial de um estado de equilíbrio • para outro 7. O sistema pode ter uma fase (homogêneo), • várias fases (heterogêneo), ocorrer reação, etc; • SÓ É PRECISO QUE O SISTEMA SEJA FECHADO • E QUE A VARIAÇÃO OCORRA ENTRE ESTADOS DE EQUILÍBRIO

As equações de Gibbs • Equação • Relação intensiva

• Definindo: • Pode-se obter a série de equações para H, A, G, etc.

As equações para propriedades intensivas na forma derivada: EQUAÇÕES GERAIS PARA UM FLUIDO HOMOGÊNEO DE COMPOSIÇÃO CONSTANTE

As equações para propriedades extensivas na forma diferencial

Pode-se aplicar o critério de exatidão das equações diferenciais para se obter outros conjuntos de equações Se • A diferencial total de F é definida por • Ou d. F = Mdx + Ndy • com •

Então • Podendo-se obter • Quando F é uma função de x e y, uma • expressão diferencial exata Para • d. U = Td. S - Pd. V •

Equações de Maxwell Várias outras equações podem ser geradas

H e S como funções de T e P Tem-se que • Tomando d. H = Td. S + Vd. P • Dividindo por d. T a P constante • Logo •

Relação de Maxwell: • d. H = Td. S + Vd. P dividindo por d. P a T constante • Logo • As relações funcionais de H=H(T, P) e S=S(T, P): •
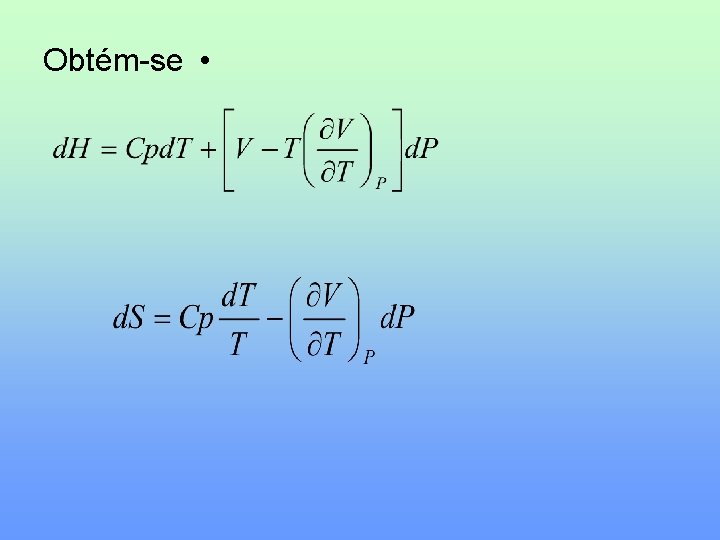
Obtém-se •

U como uma função de P Tem-se que H = U + PV ou Diferenciando • Como • Então • U = H – PV •

Aplicações 1) Os coeficientes de • • são avaliados a partir de dados PVT e Cp. • 2) Gás ideal: PVid = RT então • logo d. Hid = Cpidd. T e • d. Sid = Cpidd. T/T – Rd. P/P •

3) Líquidos • Obs. Como • Obs. Como β e V podem ser considerados constantes longe do ponto crítico •

G como uma Função Geradora Em particular, G está relacionada com P e T • d. G = Vd. P – Sd. T • G = G(P, T) • como P e T podem ser medidos e • controlados, G é uma propriedade • com uma utilidade potencial •

A partir da identidade • Como G = H – TS então H = G + TS , logo A vantagem é que esta equação é adimensional e tem-se H no lugar de S

As formas restritas podem ser utilizadas A energia de Gibbs quando dada como uma função de T e P serve como uma função geradora das outras propriedades TD e implicitamente representa uma informação completa das propriedades Note que d. G = Vd. P – Sd. T leva à expressões para todas as propriedades d. A = -Pd. V –Sd. T leva à equações relacionando as propriedades TD com a mecânica estatística
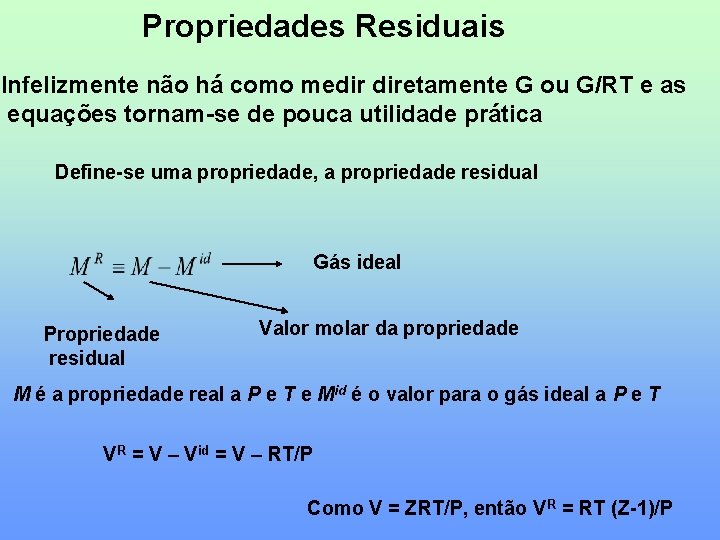
Propriedades Residuais Infelizmente não há como medir diretamente G ou G/RT e as equações tornam-se de pouca utilidade prática Define-se uma propriedade, a propriedade residual Gás ideal Propriedade residual Valor molar da propriedade M é a propriedade real a P e T e Mid é o valor para o gás ideal a P e T VR = V – Vid = V – RT/P Como V = ZRT/P, então VR = RT (Z-1)/P

Nas formas restritas

GR tem uma ligação direta com experimentos T constante Obs. : VR = RT (Z-1)/P Derivando em relação a T ,
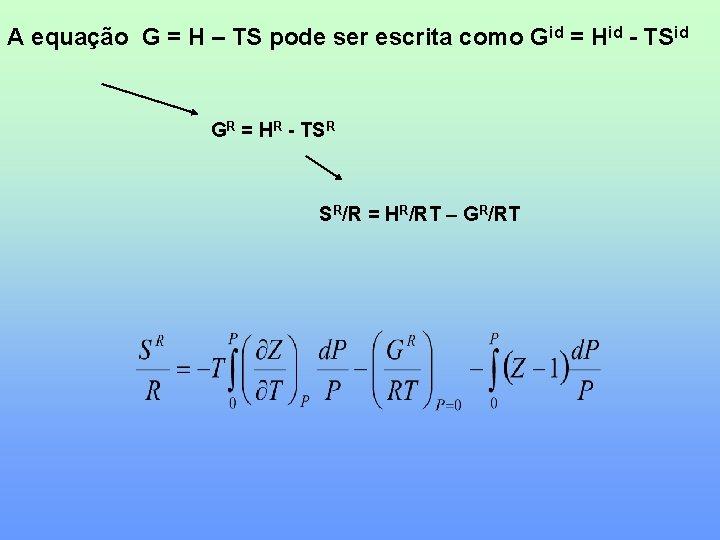
A equação G = H – TS pode ser escrita como Gid = Hid - TSid GR = HR - TSR SR/R = HR/RT – GR/RT

Considera-se zero pois calculamos sempre a diferença entre dois estados P=0 Z=PV/RT e (∂Z/∂T)P podem ser obtidos de dados experimentais PVT ou utilizando uma equação de estado

Cálculo de H e S H = Hid + HR S = S id + SR Integrando as equações Referências escolhidas por convêniencia
- Slides: 27


















































