Termodinmica Aplicada AULA 6 Fernando Luiz Pellegrini Pessoa








































- Slides: 47

Termodinâmica Aplicada AULA 6 Fernando Luiz Pellegrini Pessoa TPQBq ESCOLA DE QUÍMICA UNIVERSIDADE FEDERAL DO RIO DE JANEIRO ESCOLA DE QUIMICA / UFRJ

Termodinâmica Aplicada Entendendo o Processo de Mistura As soluções são misturas homogêneas de substâncias químicas, formadas na natureza ou em processos industriais. Quantidades específicas de substâncias não-reativas podem ser misturadas diretamente para formar soluções de composição conhecida. Cada processo de mistura, em particular, resulta numa mudança de estado, dependendo das condições inicial e final de temperatura e pressão. Para facilitar o estudo dos processos de mistura, define-se o processo padrão de mistura como aquele que ocorre a T e P constantes. Isto é, quantidades determinadas de substâncias químicas puras, todas na mesma T e P, são misturadas para formar uma solução de composição conhecida, também a T e P. Diz-se que as substâncias puras a T e P estão em seus estados padrão em relação ao processo de mistura e suas propriedades no estado padrão simplesmente as propriedades de substância pura (Vi, Hi, Si, Gi, ln fi, etc. ). ESCOLA DE QUIMICA / UFRJ

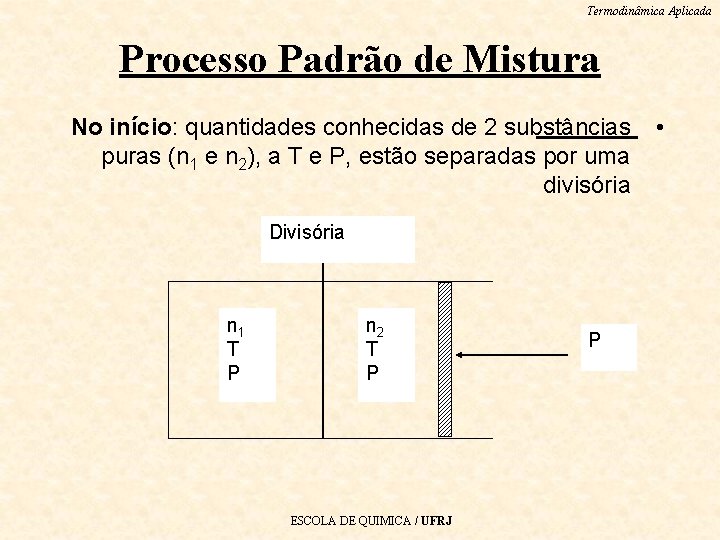
Termodinâmica Aplicada Processo Padrão de Mistura No início: quantidades conhecidas de 2 substâncias puras (n 1 e n 2), a T e P, estão separadas por uma divisória Divisória n 1 T P n 2 T P ESCOLA DE QUIMICA / UFRJ P •

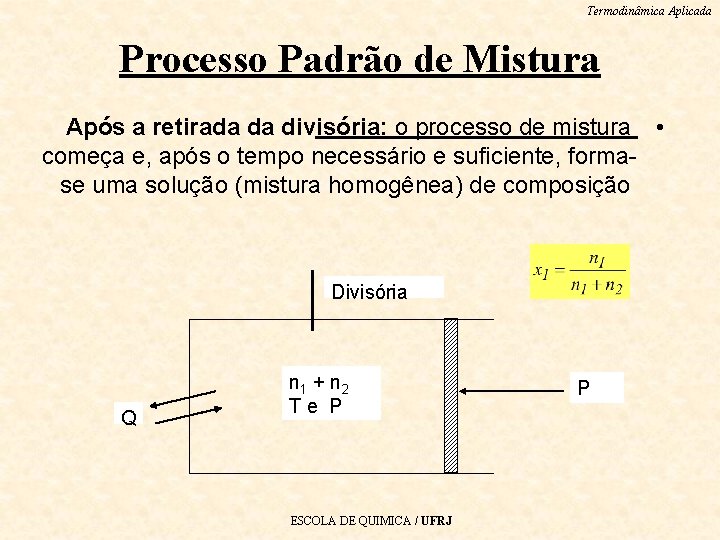
Termodinâmica Aplicada Processo Padrão de Mistura Após a retirada da divisória: o processo de mistura • começa e, após o tempo necessário e suficiente, formase uma solução (mistura homogênea) de composição Divisória Q n 1 + n 2 Te P ESCOLA DE QUIMICA / UFRJ P

Termodinâmica Aplicada Processo Padrão de Mistura A observação experimental desse processo de mistura • permite detectar dois fenômenos: Ocorre contração ou expansão do volume do sistema, o que se 4 verifica pela movimentação do pistão (para que a pressão mantenha-se constante) Ocorre transferência de calor entre o sistema e suas vizinhanças 4 ESCOLA DE QUIMICA / UFRJ

Termodinâmica Aplicada Variação do volume no processo de mistura A variação do volume total do sistema é calculada por: • V é a variação de volume por mol da solução, denominada de VARIAÇÃO DO VOLUME DE MISTURA ESCOLA DE QUIMICA / UFRJ

Termodinâmica Aplicada Variação de entalpia no processo de mistura O calor transferido de/para o sistema ao longo do • processo de mistura também pode ser medido e, como o processo ocorre a P constante, esse calor é igual à variação de entalpia do sistema. Analogamente ao volume, tem-se que onde H é a variação de entalpia de mistura, denominada simplesmente de CALOR DE MISTURA. ESCOLA DE QUIMICA / UFRJ

Termodinâmica Aplicada Variação de propriedade no processo de mistura Generalizando-se para qualquer propriedade intensiva da mistura M, tem-se onde M é denominada VARIAÇÃO DE PROPRIEDADE DE MISTURA ESCOLA DE QUIMICA / UFRJ •

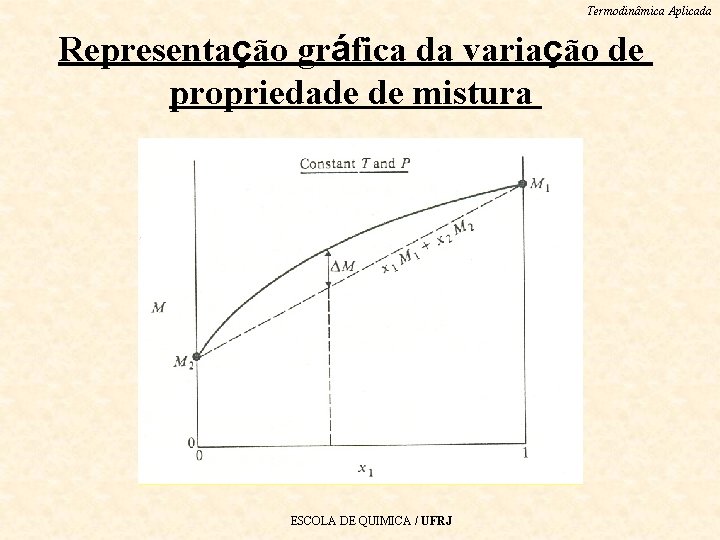
Termodinâmica Aplicada Representação gráfica da variação de propriedade de mistura ESCOLA DE QUIMICA / UFRJ

Termodinâmica Aplicada Observação Essa figura mostra que M é a diferença entre a • propriedade M da solução e uma combinação linear das propriedades dos componentes puros (x 1 M 1+x 2 M 2). Note também que, nos limites em que x 1=0 ou x 1=1, M=0, pois a propriedade M=M 2 e M=M 1, respectivamente. ESCOLA DE QUIMICA / UFRJ

Termodinâmica Aplicada Solução ideal O modelo de solução ideal serve como base para • descrever de forma aproximada o comportamento de uma solução real. O modelo de solução ideal fornece a dependência da • fugacidade dos componentes na solução com a composição. Considere o modelo representado pela regra de Lewis- • Randall: ESCOLA DE QUIMICA / UFRJ

Termodinâmica Aplicada Mistura de Gases Ideais A fugacidade de uma espécie i numa mistura de gases • ideais é dada por: Para o gás ideal puro, a T e P, tem-se: • Logo, uma mistura de gases ideais é um caso • especial de uma solução ideal. ESCOLA DE QUIMICA / UFRJ

Termodinâmica Aplicada Síntese das propriedades e suas relações para uma solução ideal (M = ln f, V, Z, H, CP, U ou CV) ESCOLA DE QUIMICA / UFRJ

Termodinâmica Aplicada Propriedades em Excesso Propriedade em excesso é a diferença entre o valor de uma propriedade para uma solução real e o valor da mesma propriedade para uma solução ideal, nas mesmas condições de T, P e x. ESCOLA DE QUIMICA / UFRJ •

Termodinâmica Aplicada Propriedades em Excesso ESCOLA DE QUIMICA / UFRJ

Termodinâmica Aplicada O termo - xi i é definido como uma propriedade de mistura e tem o símbolo = - xi i ESCOLA DE QUIMICA / UFRJ

Termodinâmica Aplicada Das quais pode-se deduzir que As propriedades de mistura foram definidas primeiro porque H e V podem ser medidas experimentalmente. Entretanto, as propriedades em excesso são melhores para análise teórica ESCOLA DE QUIMICA / UFRJ

Termodinâmica Aplicada Propriedades em Excesso Propriedade em excesso é a diferença entre o valor de uma propriedade para uma solução real e o valor da mesma propriedade para uma solução ideal, nas mesmas condições de T, P e x. ESCOLA DE QUIMICA / UFRJ •

Termodinâmica Aplicada As propriedades em excesso não • tem significado para espécies puras, somente para misturas ESCOLA DE QUIMICA / UFRJ

Termodinâmica Aplicada Propriedades em Excesso Quando M representa as propriedades U, V, H, CP, Cv, Z • e ln f, tem-se que: Essas equações mostram que e ME não representam novas funções termodinâmicas, quando M representa as propriedades U, V, H, CP, Cv, Z e ln f. ESCOLA DE QUIMICA / UFRJ •

Termodinâmica Aplicada Energia Livre de Gibbs em Excesso Quando M representar G, A ou S, surgem novas funções • termodinâmicas. ESCOLA DE QUIMICA / UFRJ

Termodinâmica Aplicada Energia Livre de Helmholtz e Entropia em Excesso As mesmas funções termodinâmicas referentes a G se • aplicam a A, bastando substituir G por A. Para entropia, tem-se as seguintes funções em excesso: • ESCOLA DE QUIMICA / UFRJ

Termodinâmica Aplicada Observação A correlação das propriedades das soluções usando as funções em excesso é de grande utilidade devido à natureza genérica de ME, que pode ser usada para todas as propriedades consideradas. A única diferença reside no fato de que para todas as propriedades , com exceção de G, A e S. ESCOLA DE QUIMICA / UFRJ

Termodinâmica Aplicada Definindo coeficiente de atividade: A energia livre de Gibbs determina quais fases são estáveis. As propriedades em excesso determinam o coeficiente de atividade, que é usado para calcular o equilíbrio químico e de fases para misturas não-ideais. Pode ser mostrado que: ESCOLA DE QUIMICA / UFRJ

Termodinâmica Aplicada Estas equações • definem o coeficiente de atividade ESCOLA DE QUIMICA / UFRJ

Termodinâmica Aplicada A relação fundamental da propriedade em excesso é A equação Gibbs- • Duhem para GE é ESCOLA DE QUIMICA / UFRJ

Termodinâmica Aplicada ESCOLA DE QUIMICA / UFRJ

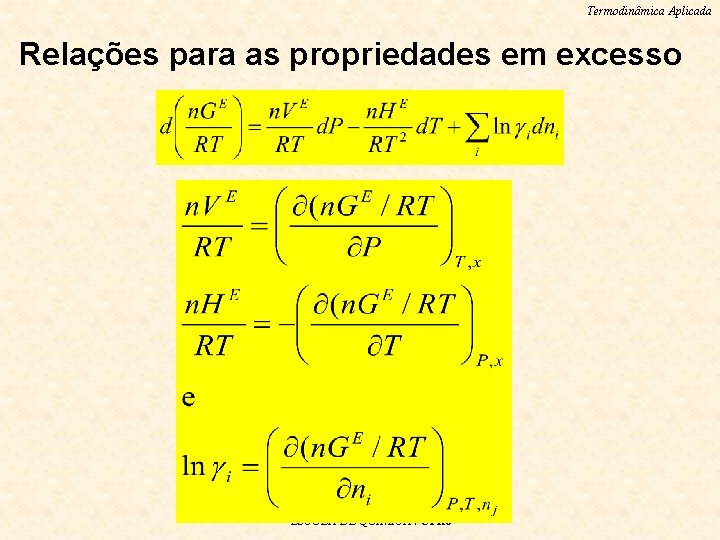
Termodinâmica Aplicada Relações para as propriedades em excesso ESCOLA DE QUIMICA / UFRJ

Termodinâmica Aplicada Exemplo: A equação de Margules pode ser usada para correlacionar energia livre de Gibbs. Para uma mistura binária a expressão de Margules fica: Encontre ln 1 e ln 2. Checar. – – Verificar se a Eq. Gibbs-Duhem é satisfeita. ESCOLA DE QUIMICA / UFRJ –

Termodinâmica Aplicada ESCOLA DE QUIMICA / UFRJ

Termodinâmica Aplicada Checar ESCOLA DE QUIMICA / UFRJ

Termodinâmica Aplicada Checar a Eq. Gibbs-Duhem: ESCOLA DE QUIMICA / UFRJ

Termodinâmica Aplicada Expressões exatas para o equilíbrio de fases Quais são as eqs para o EF? ESCOLA DE QUIMICA / UFRJ •

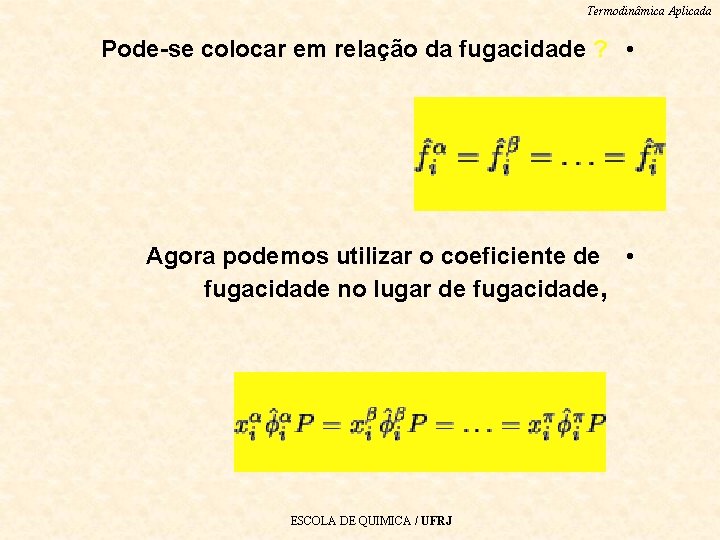
Termodinâmica Aplicada Pode-se colocar em relação da fugacidade ? • Agora podemos utilizar o coeficiente de • fugacidade no lugar de fugacidade, ESCOLA DE QUIMICA / UFRJ

Termodinâmica Aplicada Vamos levar em conta o ELV. • • é mais conveniente ser utilizado para a fase vapor onde as EEs são precisas Para fase líquida é mais convenienete utilizar os coeficientes de fugacidade, i Uma expressão exata para o ELV • ESCOLA DE QUIMICA / UFRJ • •

Termodinâmica Aplicada Simplificação das relações do EF Esta equação para ELV. É uma boa aproximação para baixas P. Pode ser simplificada considerando que a fugacidade do líquido puro é dado por • A fase vapor como gás ideal, que é boa aproximação para P baixas e T menores que a crítica). Então • ESCOLA DE QUIMICA / UFRJ •

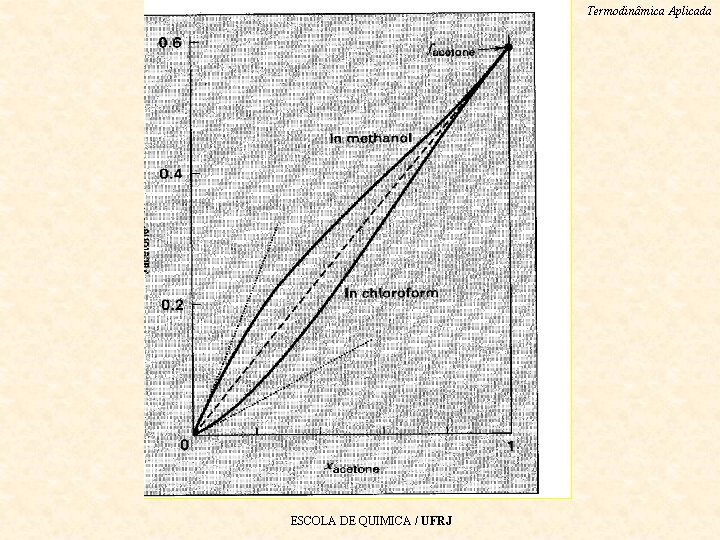
Termodinâmica Aplicada Desvios da idealidade. A definição de uma solução ideal diz que as propriedades parciais são as mesmas de um fluido puro. Então para a solução ideal, • Ou, equivalente, • Rearranjando, obtem-se a regra de • Lewis-Randall. A Figura é para uma solução ideal e com desvios positivos & negativos da idealidade. ESCOLA DE QUIMICA / UFRJ

Termodinâmica Aplicada ESCOLA DE QUIMICA / UFRJ

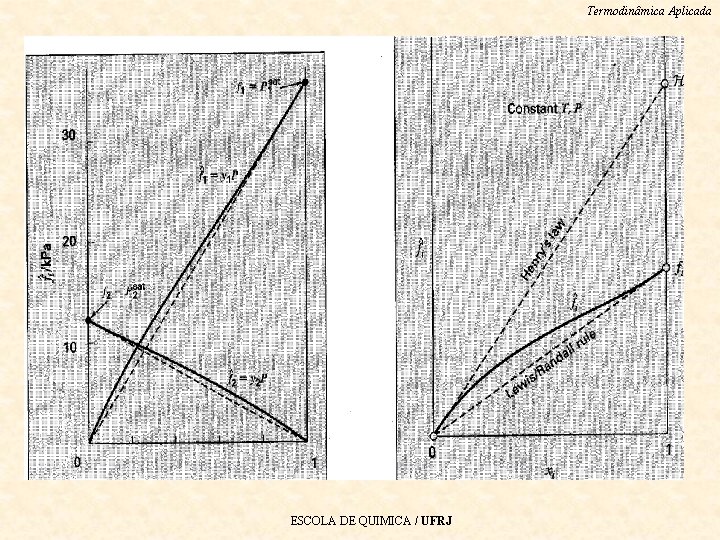
Termodinâmica Aplicada A regra de Lewis-Randall e Lei de Henry A regra de Lewis-Randall é válida para xi 1, mas não é precisa para xi 0. A Lei de Henry, é precisa para xi 0, mas não é para xi 1. • A regra de Lewis-Randall e a lei de Henry não são • independentes, mas estão diretamente relacionadas pela equação de Gibbs-Duhem. Este fato implica: Quando a lei de Henry é válida para uma – espécie em uma mistura binária, então a regra de Lewis-Randall é válida para a outra espécie. ESCOLA DE QUIMICA / UFRJ •

Termodinâmica Aplicada ESCOLA DE QUIMICA / UFRJ

Termodinâmica Aplicada A função de Gibbs e suas principais relações A razão entre as fugacidades é denominada de atividade • da espécie i na solução. ESCOLA DE QUIMICA / UFRJ

Termodinâmica Aplicada Fugacidade de Misturas Gasosas O critério de equilíbrio entre 2 fases e , na mesma • temperatura, é dado pela igualdade das fugacidades de cada componente i nessas fases: Quando uma das fases em equilíbrio é uma mistura gasosa, tem-se que • Para se calcular usando essa equação é necessário • conhecer o comportamento de com P, T e yi, ou seja, . ESCOLA DE QUIMICA / UFRJ

Termodinâmica Aplicada Fugacidade de Misturas Gasosas Considere a fase gasosa monocomponente (substância pura). A T constante, tem-se que: • Para um gás ideal, essa equação se reduz a: • Subtraindo-se a segunda equação da primeira, tem-se • Integrando-se essa eq. do estado de gás ideal (P=0) até uma pressão qualquer P, a T constante, chega-se a ESCOLA DE QUIMICA / UFRJ •

Termodinâmica Aplicada Fugacidade de Misturas Gasosas • A equação anterior pode ser escrita também como Normalmente, as funções são expressas na forma explítica em P, ou seja, . Para esses casos, essa equação pode ser modificada, passando à seguinte forma: ESCOLA DE QUIMICA / UFRJ •

Termodinâmica Aplicada Fugacidade de Misturas Gasosas Por analogia, para o componente i numa mistura, tem-se que: ESCOLA DE QUIMICA / UFRJ •

Observação Termodinâmica Aplicada não é a propriedade parcial molar de P. Trata-se apenas de uma simples derivada da função em relação a ni. ESCOLA DE QUIMICA / UFRJ

Observações Termodinâmica Aplicada As eqs. anteriores são genéricas e relativamente simples. m, obter relações do tipo e depende de modelos que consigam descrever adequadamente o comportamento PVT dos fluidos. Esses modelos são as equações de estado. Porém, não existe uma única equação de estado capaz de calcular (correlacionar e predizer) as propriedades volumétricas (PVT) das substâncias puras e das suas misturas para diversas condições. Há apenas algumas equações de estado que são boas e úteis para uma classe limitada de substâncias em certas condições. Essas equações normalmente são da forma explícita na pressão. ESCOLA DE QUIMICA / UFRJ