Kimia analisis LOGO TITRASI Affi Rusdaningrum 09303241024 Titrasi
































- Slides: 38

Kimia analisis LOGO TITRASI Affi Rusdaningrum 09303241024

“Titrasi adalah suatu metode penentuan kadar (konsentrasi) suatu larutan dengan larutan lain yang telah diketahui konsentrasinya” LOGO

Larutan yang akan ditentukan kadarnya disebut sebagai “analit” dan biasanya diletakan di dalam Erlenmeyer, sedangkan larutan yang telah diketahui konsentrasinya disebut sebagai “larutan standart atau titer” dan diletakkan di dalam buret. LOGO

www. themegallery. com PERALATAN v Buret Untuk tempat larutan standar, yang dipakai biasanya yang memiliki skala 50 m. L, skala 0 terletak diatas dan 50 dibawah, sebelum dipakai ada baiknya buret dibersihkan dengan larutan K 2 Cr 2 O 7, kemudian bilas dengan aquades. v Erlenmeyer Tempat analit diletakkan, gunakan Erlenmeyer ukuran sedang 250 m. L untuk proses titrasi sebab Erlenmeyer ukuran ini enak dipegang dang kita lebih leluasa untuk megocok Erlenmeyer. v Pipet Alat untuk mengambil indicator, ingat 1 pipet volumenya kira-kira 1 m. L v Statif Alat untuk meletakkan burette agar bisa berdiri tegak, sebelum meletakkan buret ke statis ada baiknya anda melapisi dengan kertas atau tisu agar pegangan statis tidak langsung kena dinding luar buret, Company Logo

www. themegallery. com PERALATAN v Labu Ukur Digunakan pada untuk membuat larutan standar. “ingat waktu menambahkan pelarut” v Pipet Ukur Ingat untuk mengambil larutan analit dengan volume tertentu misalnya 10 m. L, 20 m. L v Karet Penghisap Alat ini digunakan untuk menghisap larutan pada waktu kita mengambil larutan dengan menggunakan pipet ukur Company Logo

www. themegallery. com Company Logo

www. themegallery. com LARUTAN STANDAR adalah larutan yang disiapkan dengan cara menimbang secara akurat suatu zat yang memiliki kemurnian tinggi dan melarutkannya dengan sejumlah tertentu pelarut dalam labu ukur Company Logo

www. themegallery. com Syarat zat yang bisa dijadikan standart primer v Harus 100% murni v Zat tersebut harus stabil baik pada suhu kamar ataupun pada waktu dilakukan pemanasan, standart primer biasanya dikeringkan terlebih dahulu sebelum ditimbang. v Mudah diperoleh v Biasanya zat standart primer memiliki Masa molar (MR) yang besar hal ini untuk memperkecil kesalahan relative atau eror pada waktu proses penimbangan. Menimbang zat dalam jumlah besar memiliki kesalahan relative yang lebih kecil dibanding dengan menimbang zat dalam jumlah yang kecil. v Zat tersebut juga harus memenuhi persyaratan teknik titrasi Company Logo

www. themegallery. com larutan standart sekunder Adalah larutan dengan konsentrasi tertentu dan kemudian kita menitrasinya dengan larutan standart primer Contoh : Na. OH tidak bisa dipakai sebagai larutan standart primer disebabkan sifatnya yang higroskopis. Jadi Na. OH menyerap uap air dari lingkungan disekitarnya Company Logo

www. themegallery. com Syarat-syarat titrasi: v Reaksi kimia antar analit dan titrant diketahui dengan pasti dan jelas produk-produk apa yang akan dihasilkan nantinya. Mana reaktan dan produk apa yang akan dihasilkan harus jelas dan pasti v Reaksi harus berjalan dengan cepat v Harus ada sesuatu yang bisa menandakan atau mengindikasikan bahwa reaksi antara analit dengan titrant sudah equivalent secara stoikiometri, baik itu dengan perubahan warna, perubahan arus listrik, perubahan p. H, dengan penambahan indicator atau apapun yang bisa digunakan untuk mengamati perubahan tersebut. Company Logo

www. themegallery. com Syarat-syarat titrasi: v Tidak ada hal lain yang mengganggu reaksi antara analit dengan titrant v Reaksi antara analit dengan titrant harus memiliki kesetimbangan jauh kearah kanan (artinya kesetimbangannya mengarah kearah pembentukan produk) hal ini untuk memastikan secara kuantitatif reaksi bisa dihitung, dan memastikan titik akhir titrasi bisa diamati. Company Logo

www. themegallery. com titik equivalent Titik dimana titrasi mencapai setara secara stoikiometri titik akhir titrasi titik dimana proses titrasi diakhiri disebut sebagai, ditandai dengan indicator sehingga mudah dilihat secara manual. Jarak antara titik equivalent dan titik akhir titrasi tidak boleh terlalu jauh sehingga akan mempengaruhi hasil akhir titrasi. Company Logo

www. themegallery. com Titik equivalen v Adalah keadaan dimana konsentrasi titran tepat sama secara stoikiometri dengan analit v Menemukan titik equivalen adalah tujuan akhir titrasi. v Contoh : jika kita mempunyai senyawa basa yang mengandung 0, 250 mol OH- , kemudian dititrasi dengan H+, titik equivalen tercapai ketika 0, 250 mol H+ ditambahkan. Company Logo

www. themegallery. com Titik akhir titrasi v Titik akhir titrasi tercapai ketika titik equivalen telah terlewati. v Biasanya terjadi setelah terdapat sedikit titran yang tidak lagi bereaksi (berlebih). v Pada sebagian besar kasus, perbedaan antara titik akhir titrasi dan titik equivalen tidak signifikan dapat diabaikan. Company Logo

www. themegallery. com Indikator v Adalah senyawa yang sensitif (berubah warna) pada saat analit habis atau pada saat titran berlebih purple colorless Company Logo

www. themegallery. com Jenis Titrasi v Asam Basa v Pembentukan kompleks v Pengendapan (Precipitasi) v Oxidasi/reduksi Company Logo

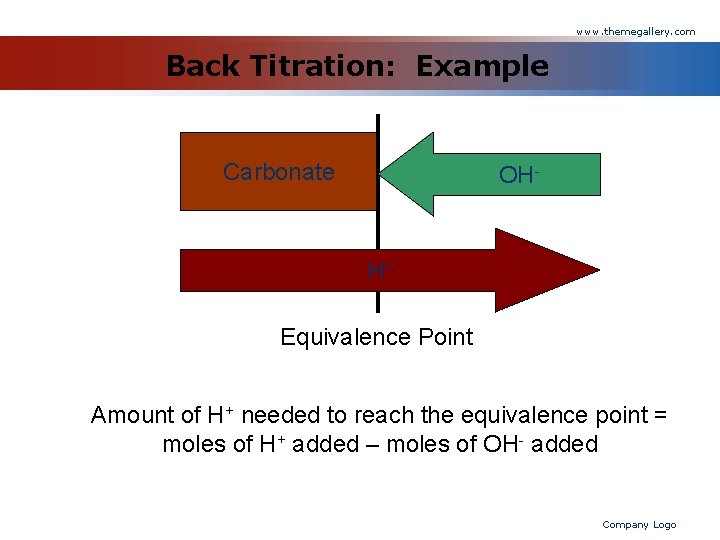
www. themegallery. com Titrasi Balik v Titrasi balik digunakan ketika reaksi anatara analit dan titran berjalan lambat, atau apabila tidak ada indikator yang cocok. v Caranya : § Tambahkan titran secara berlebih sehingga semua analit habis bereaksi dan ada sedikit titran berlebih. § Titrasi kembali kelebihan titran dengan titran kedua untuk memperoleh titik equivalen. Company Logo

www. themegallery. com Back Titration: Example Carbonate OH- H+ Equivalence Point Amount of H+ needed to reach the equivalence point = moles of H+ added – moles of OH- added Company Logo

LOGO TITRASI ASAM BASA

www. themegallery. com Titrasi asam basa adalah reaksi penetralan Jika larutan bakunya asam disebut asidimetri jika larutan bakunya basa disebut alkalimetri. Company Logo

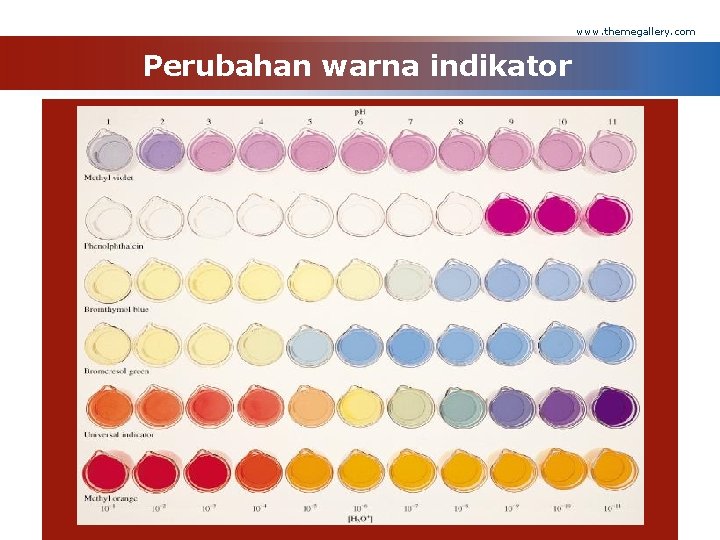
www. themegallery. com Indikator v adalah asam lemah atau basa lemah (senyawa organik) yang dalam larutannya warna molekulnya berbeda dengan warna ion-ionnya v Indikator asam-basa terletak pada titik ekivalen dan ukuran dari p. H Company Logo

www. themegallery. com Perubahan warna indikator Company Logo

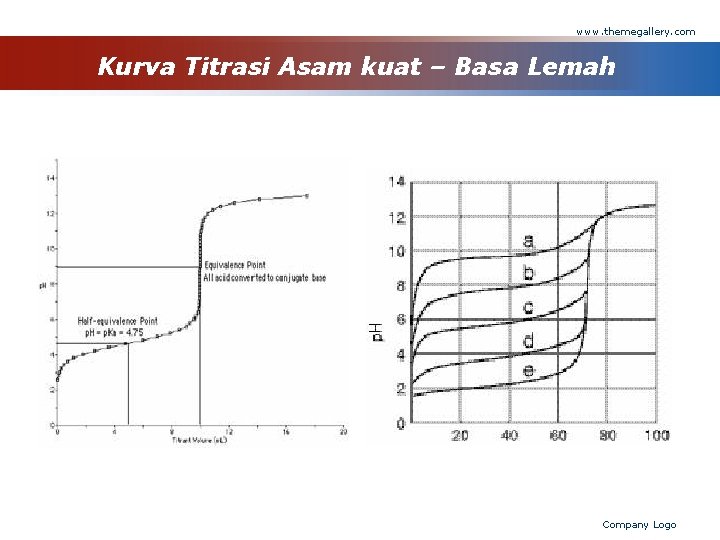
www. themegallery. com Jenis-Jenis Titrasi Asam Basa v v v Asam kuat - Basa kuat Asam kuat - Basa lemah Asam lemah - Basa kuat Asam kuat - Garam dari asam lemah Basa kuat - Garam dari basa lemah Company Logo

www. themegallery. com Remember…. ? v Apa itu asam kuat dan asam lemah? v Bagaimana cara menghitung equivalensi? v Bagaimana cara menghitung molaritas dan normalitas? “Pertanyaan yang sama untuk basa” Company Logo

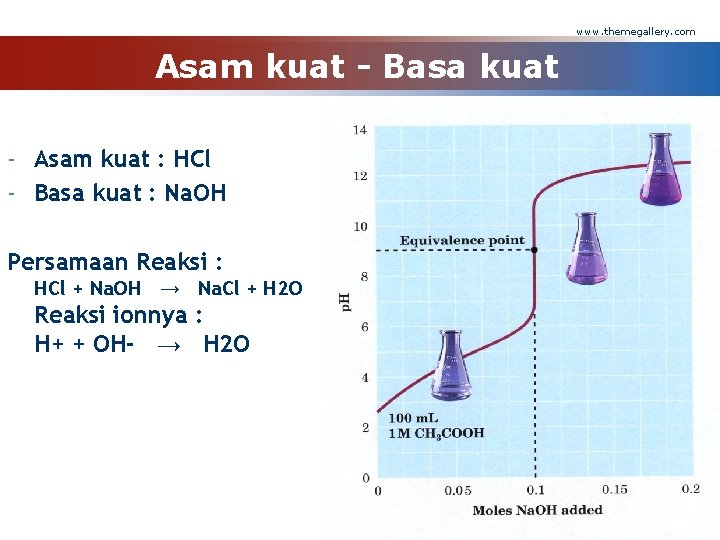
www. themegallery. com Asam kuat - Basa kuat - Asam kuat : HCl - Basa kuat : Na. OH Persamaan Reaksi : HCl + Na. OH → Na. Cl + H 2 O Reaksi ionnya : H+ + OH- → H 2 O Company Logo

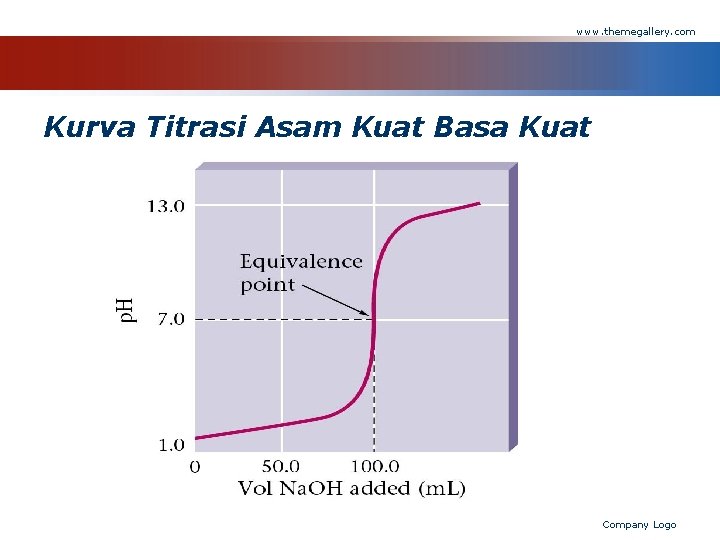
www. themegallery. com Kurva Titrasi Asam Kuat Basa Kuat Company Logo

www. themegallery. com SAMPLE PROBLEM v In an acid-base titration, 17. 45 m. L of 0. 180 M nitric acid, HNO 3, were completely neutralized by 14. 76 m. L of aluminium hydroxide, Al(OH)3. Calculate the concentration of the aluminium hydroxide. Company Logo

www. themegallery. com SAMPLE ANSWER v The balanced equation for the reaction is: 3 HNO 3(aq) + Al(OH)3(aq) → Al(NO 3)3(aq) + 3 H 2 O(l) v The number of moles of nitric acid used is: y mol = 0. 180 mol/L x 0. 01745 L = 3. 14 x 10 -3 mol HNO 3 v From the stoichiometry of the reaction, the number of moles of aluminium hydroxide reacted is: 3. 14 x 10 -3 mol HNO 3 x 1 mol Al(OH)3 = 1. 05 x 10 -3 mol HNO 3 v Therefore, the concentration of the aluminium hydroxide is: 1. 05 x 10 -3 mol Al(OH)3 = 0. 0711 M 0. 01476 L Company Logo

www. themegallery. com Contoh lain 1. Untuk mentitrasi Asam sulfat sebanyak 25, 00 m. L diperlukan titran Na. OH 0, 10 M sebanyak 26, 50 m. L. Berapakah konsentrasi asam? 2. Pada pembakuan Na. OH titrasi titik akhir titrasi diperoleh pada 20, 35 m. L. Baku primer yang dipakai asam oksalat yang dibuat dengan menimbang 1, 250 g dan dilarutkan sampai 100 m. L, indikator yang dipakai fenoftalein. Hitung konsentrasi Na. OH. Company Logo

Secara Kelompok tentukan reaksi dan kurva titrasi untuk titrasi: Asam kuat - Basa lemah Asam lemah - Basa kuat Asam kuat - Garam dari asam lemah Basa kuat - Garam dari basa lemah

www. themegallery. com Titrasi Asam Kuat - Basa Lemah contoh : Asam kuat : HCl Basa lemah : NH 4 OH Persamaan Reaksi : HCl + NH 4 OH → NH 4 Cl + H 2 O Reaksi ionnya : H+ + NH 4 OH → H 2 O + NH 4+ Company Logo

www. themegallery. com Kurva Titrasi Asam kuat – Basa Lemah Company Logo

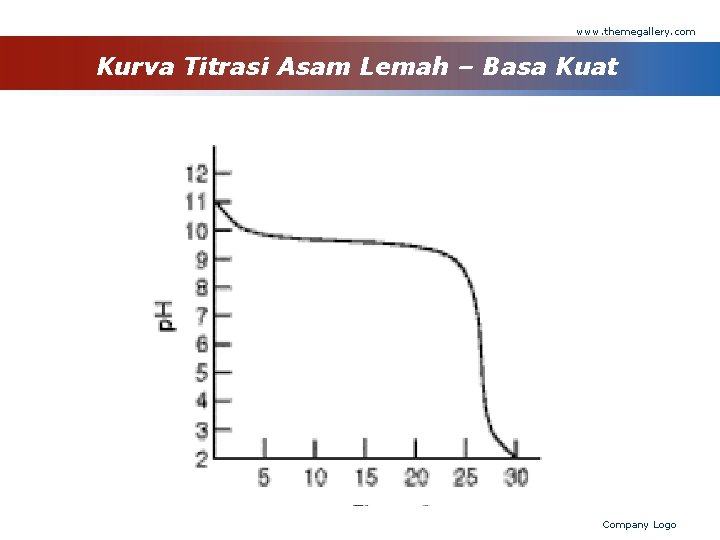
www. themegallery. com Titrasi Asam Lemah - Basa Kuat contoh : - Asam lemah : CH 3 COOH - Basa kuat : Na. OH Persamaan Reaksi : CH 3 COOH + Na. OH → Na. CH 3 COO + H 2 O Reaksi ionnya : H+ + OH- → H 2 O Company Logo

www. themegallery. com Kurva Titrasi Asam Lemah – Basa Kuat Company Logo

www. themegallery. com Titrasi Asam Kuat - Garam dari Asam Lemah contoh : - Asam kuat : HCl - Garam dari asam lemah : NH 4 BO 2 Persamaan Reaksi : HCl + NH 4 BO 2 → HBO 2 + NH 4 Cl Reaksi ionnya : H+ + BO 2 - → HBO 2 Company Logo

www. themegallery. com Titrasi Basa Kuat - Garam dari Basa Lemah contoh : - Basa kuat : Na. OH - Garam dari basa lemah : CH 3 COONH 4 Persamaan Reaksi : Na. OH + CH 3 COONH 4 → CH 3 COONa + NH 4 OH Reaksi ionnya : OH- + NH 4 - → NH 4 OH Company Logo

www. themegallery. com Cara Melakukan Titrasi Asam Basa 1. Zat penitrasi (titran) yang merupakan larutan baku dimasukkan ke dalam buret yang telah ditera 2. Zat yang dititrasi (titrat) ditempatkan pada wadah (gelas kimia atau erlenmeyer). Ditempatkan tepat dibawah buret berisi titran 3. Tambahkan indikator yang sesuai pada titrat, misalnya, indikator fenoftalien 4. Rangkai alat titrasi dengan baik. Buret harus berdiri tegak, wadah titrat tepat dibawah ujung buret, dan tempatkan sehelai kertas putih atau tissu putih di bawah wadah titrat 5. Atur titran yang keluar dari buret (titran dikeluarkan sedikit demi sedikit) sampai larutan di dalam gelas kimia menunjukkan perubahan warna dan diperoleh titik akhir titrasi. Hentikan titrasi ! Company Logo

LOGO Sampai ketemu minggu depan
 Bodor cloud
Bodor cloud 7143 stok affı
7143 stok affı Analytical chemistry statistics
Analytical chemistry statistics Errors in chemistry
Errors in chemistry Analisis cross section
Analisis cross section Contoh anjab
Contoh anjab Analisis yang mempertajam analisis rasio dengan memisahkan
Analisis yang mempertajam analisis rasio dengan memisahkan Kadar pusing ganti
Kadar pusing ganti Bab 10 analisis risiko: analisis rasio
Bab 10 analisis risiko: analisis rasio Analysis logo design
Analysis logo design Bikromatometri
Bikromatometri Indikator difenilamin
Indikator difenilamin Kurva titrasi kompleksometri
Kurva titrasi kompleksometri Titrimetri
Titrimetri Argentometri volhard
Argentometri volhard Jelaskan pengertian iodometri
Jelaskan pengertian iodometri Titrasi pengendapan
Titrasi pengendapan Kompleksometri
Kompleksometri Suksinil sulfatiazol
Suksinil sulfatiazol Pengertian asidi alkalimetri
Pengertian asidi alkalimetri Contoh senyawa basa kuat
Contoh senyawa basa kuat Iodometri adalah
Iodometri adalah Kurva titrasi asam basa
Kurva titrasi asam basa Titrasi argentometri
Titrasi argentometri Alat titrasi
Alat titrasi Gambar kimia
Gambar kimia Powerpoint erlangga
Powerpoint erlangga Bahan berasid di rumah
Bahan berasid di rumah Reaksi kimia pembusukan
Reaksi kimia pembusukan Nama senyawa
Nama senyawa Penataan alat laboratorium kimia
Penataan alat laboratorium kimia Pengertian rumus empiris
Pengertian rumus empiris Pola splitting nmr
Pola splitting nmr Neuron perantaraan
Neuron perantaraan Dapat dibedakan menjadi
Dapat dibedakan menjadi Peta konsep materi karbohidrat
Peta konsep materi karbohidrat Bab 1 pengenalan ilmu kimia
Bab 1 pengenalan ilmu kimia Karya tulis ilmiah kimia sederhana
Karya tulis ilmiah kimia sederhana Www.psb-psma.org kimia
Www.psb-psma.org kimia