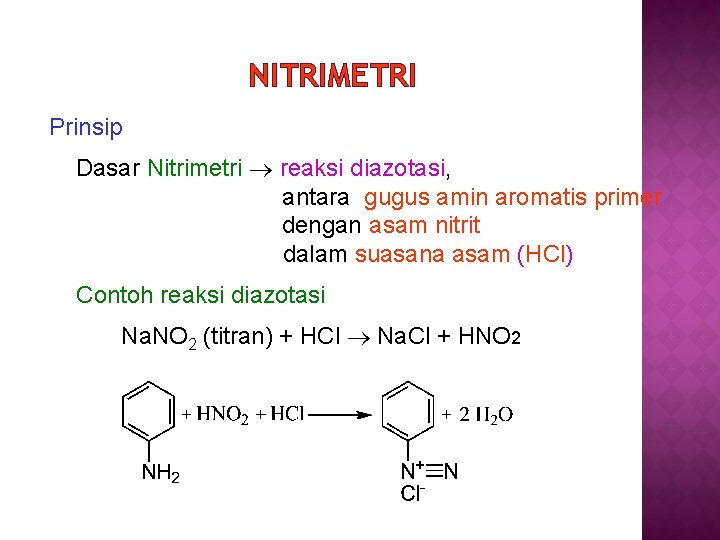
NITRIMETRI NITRIMETRI Prinsip Dasar Nitrimetri reaksi diazotasi antara








- Slides: 10

NITRIMETRI

NITRIMETRI Prinsip Dasar Nitrimetri reaksi diazotasi, antara gugus amin aromatis primer dengan asam nitrit dalam suasana asam (HCl) Contoh reaksi diazotasi Na. NO 2 (titran) + HCl Na. Cl + HNO 2

Kondisi titrasi Reaksi diazotasi ada yang berjalan lambat Diazotasi sulfonamida umumnya berjalan cepat Untuk kuantitatif, a. Suhu larutan uji harus < 15 o. C Jika > 15 o. C mengganggu pembentukan garam diazonium terbentuk senyawa fenol yang mampu bereaksi dengan asam nitrit

Cara memelihara suhu agar tetap < 15 o. C ? - Larutan uji ditambah bongkahan es batu, atau titrasi dilakukan dengan cara : bagian bawah-luar erlemeyer yang berisi larutan uji berada diantara bongkahan es batu (ditaburi garam dapur) dalam baskom kecil b. Untuk mempercepat reaksi diazotasi ditambah katalis (KBr atau Na. Br) c. Titrasi dilakukan perlahan-lahan, setetes demi setetes sambil diaduk/digojog kuat-kuat

Indikator a. Indikator luar (eksternal) pasta kanji-iodida atau kertas kanji-iodida Na NO 2 + HCl Na. Cl + HNO 2 KI + HCl KCl + HI 2 HI + 2 HNO 2 I 2 + 2 NO + 2 H 2 O I 2 + kanji iodium-kanji (biru) Reaksi : b. Indikator dalam Campuran trapeolin OO - biru metilen violet (merah) (biru) Titik akhir tercapai biru; trapeolin OO teroksidasi Kelemahan Indikator luar - harus ada orientasi Jika tidak lama - kadar jadi berkurang Indikator dalam ٠ warna TA beragam ٠ harus ada standar

Titran FI edisi IV larutan standar Na. NO 2 0, 1 M Pembuatan Larutkan 7, 5 g Na. NO 2 dalam akuades hingga 1000 ml Pembakuan sulfanilamid (500 mg) + 20 ml HCl pekat, + 50 ml air, diaduk hingga larut, didinginkan hingga suhu < 15 o. C titrasi perlahan-lahan dengan larutan Na. NO 2 0, 1 M hingga segera biru dengan pasta kanji-iodida

Penentuan titik akhir - Menggunakan indikator luar (eksternal) atau indakor dalam (internal) - Secara potensiometri menggunakan elektrode kalomel-platina atau platina-platina Aplikasi 1. Penetapan kadar (PK) senyawa dengan gugus amin aromatis primer misalnya : Sulfadiazin, Sulfaguanidin dan Sulfamerazin 2. PK senyawa dengan gugus amin aromatis non-primer misalnya : suksinil sulfatiazol, ftalil sulfatiazol

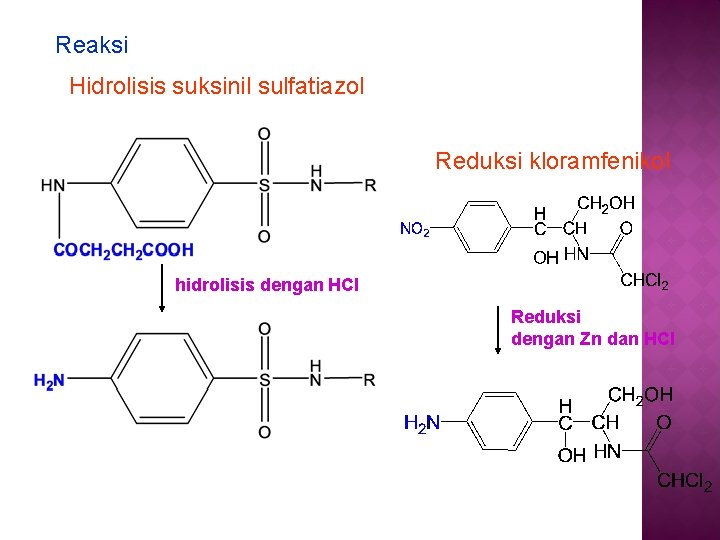
PK senyawa dengan gugus amin aromatis non-primer Cara : gugus asil-nya dihidrolisis dulu dengan asam encer atau basa encer, misalnya : a. suksinil sulfatiazol dihidrolisis dengan campuran 33 ml HCl pekat dan 66 ml air selama 1 jam, atau dengan larutan Na. OH 8% b/v di atas tangas air selama 2 jam, atau campuran HCl pekat dan air (1: 2) selama 1 jam b. Ftalil sulfatiazol dihidrolisis dengan HCl encer selama 30 menit atau dengan HCl pekat dan air (2: 1) selama 1 jam

3. PK senyawa dengan gugus nitroaromatik misalnya : kloramfenikol Cara : Gugus nitro pada kloramfenikol direduksi dengan serbuk seng dan HCl, menjadi gugus amin aromatis. Senyawa amin aromatis dititrasi dengan larutan standar Na. NO 2

Reaksi Hidrolisis suksinil sulfatiazol Reduksi kloramfenikol hidrolisis dengan HCl Reduksi dengan Zn dan HCl
 Suksinil sulfatiazol
Suksinil sulfatiazol Prinsip dasar kompetensi
Prinsip dasar kompetensi Prinsip-prinsip dasar nirmana
Prinsip-prinsip dasar nirmana Reaksi redoks adalah gabungan dari reaksi.... *
Reaksi redoks adalah gabungan dari reaksi.... * Reaksi adisi ch2 = ch2 + hcl
Reaksi adisi ch2 = ch2 + hcl Reaksi reaksi pada gas mulia
Reaksi reaksi pada gas mulia Contoh amina dalam kehidupan sehari-hari
Contoh amina dalam kehidupan sehari-hari Entalpi penguapan 1 mol air adalah
Entalpi penguapan 1 mol air adalah Prinsip interprofesional competence
Prinsip interprofesional competence Prinsip-prinsip yang digunakan dalam aplikasi siplah
Prinsip-prinsip yang digunakan dalam aplikasi siplah 4 prinsip pendidikan inklusif
4 prinsip pendidikan inklusif