Estructura de la materia Temas de Qumica y

















- Slides: 41

Estructura de la materia Temas de Química y su enseñanza III Dr. Víctor Manuel Ugalde Saldívar 1

Sesión # 3 El origen de los elementos 2

Estructura de la materia La naturaleza de los electrones 3

NATURALEZA ONDULATORIA DE LA LUZ ¿Porqué estudiar la luz?

INFORMACIÓN SOBRE LA LUZ Los elementos que existen en las estrellas pueden identificarse gracias a la luz que emiten éstos cuerpos celestes y que viaja a través del espacio hasta llegar a nuestro planeta. Para identificar a los elementos, es necesario comprender los fenómenos de emisión y de absorción de la radiación electromagnética, que es con este nombre como se conoce a la luz.

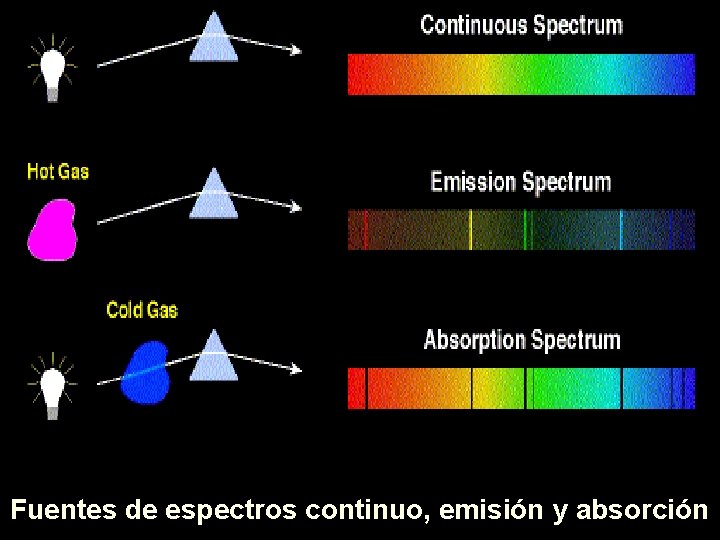
Fuentes de espectros continuo, emisión y absorción

INFORMACIÓN SOBRE LA LUZ Espectro continuo: Se llama así, a la radiación que emite un cuerpo caliente y que al difractar dicha radiación con un prisma de Nicholson*, se pueden observar TODAS las longitudes de onda que conforman la radiación. Espectro de emisión: Se llama así, a la radiación que emite un cuerpo caliente y que al difractar dicha radiación con un prisma de Nicholson*, se pueden observar las longitudes de onda que conforman la radiación, también llamadas líneas de emisión. No necesariamente, un espectro de emisión contiene TODAS las longitudes de onda de un espectro continuo. Espectro de absorción: Se llama así, a la radiación que absorbe un cuerpo frio cuando se le hace pasar a través de éste, la radiación de un espectro continuo. Al difractar la radiación resultante con un prisma de Nicholson*, se pueden observar las longitudes de onda complementarias, es decir las que no se absorben. Un espectro de absorción siempre carecerá de al menos UNA longitud de onda del espectro continuo. * La difracción también puede realizarse con una rejilla, que es un dispositivo con un ranurado muy fino, como el que se emplea para grabar discos compactos. ¿Han observados que se ven colores en un CD cuando le da la luz?

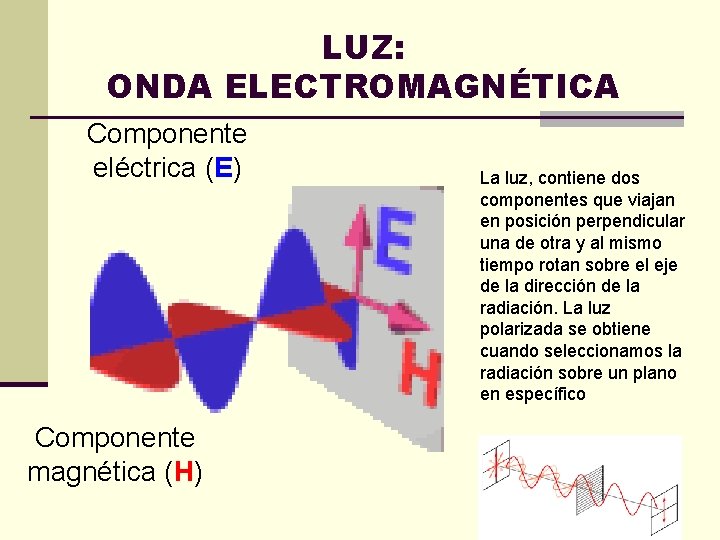
LUZ: ONDA ELECTROMAGNÉTICA Componente eléctrica (E) Componente magnética (H) La luz, contiene dos componentes que viajan en posición perpendicular una de otra y al mismo tiempo rotan sobre el eje de la dirección de la radiación. La luz polarizada se obtiene cuando seleccionamos la radiación sobre un plano en específico

Espectro electromagnético http: //www. astroseti. org/vernew. php? codigo=984


INFORMACIÓN SOBRE EL ESPECTRO ELECTROMAGNÉTICO Espectro electromagnético: Contiene desde la ondas de mayor longitud de onda como las ondas de radio (radio waves), hasta las de menor longitud de onda como los rayos gama (gamma rays). Longitud de onda: En la primera escala de la última diapositiva, se muestra la variación de la longitud de onda (wavelength) en el espectro electromagnético. Los tamaños de las onda se representan con objetos que están colocados justo debajo de la escala. Así los rayos “X” pueden tener una longitud equivalente al tamaño de una molécula de agua, los rayos ultravioleta al de un virus y las ondas de radio al de una pelota de beisbol. Fuentes: La segunda hilera de imágenes, representa las fuentes (sources), que son los instrumentos u objetos que emiten cada tipo de radiación. Frecuencia: La segunda escala, contiene los valores de frecuencia (frecuency), que representa la velocidad en ondas por segundo, que tiene cada tipo de radiación. Energía: La tercera y última escala, contiene los valores de energía en electrón volts (energy), que poseen cada tipo de radiación.

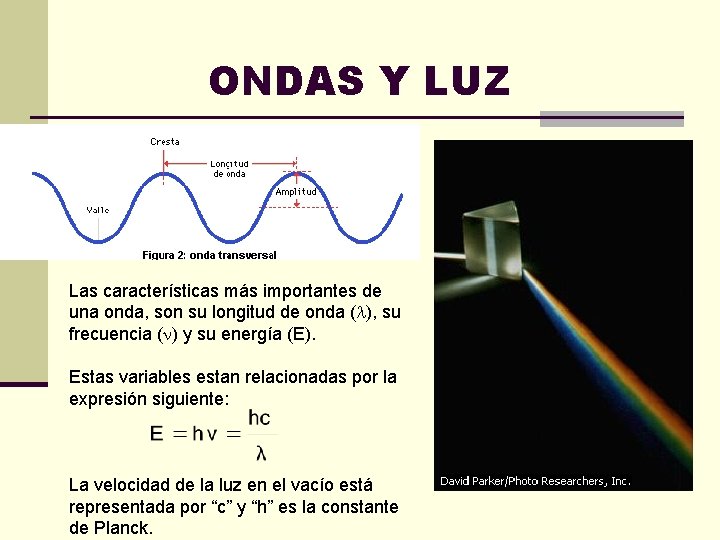
ONDAS Y LUZ Las características más importantes de una onda, son su longitud de onda ( ), su frecuencia ( ) y su energía (E). Estas variables estan relacionadas por la expresión siguiente: La velocidad de la luz en el vacío está representada por “c” y “h” es la constante de Planck.

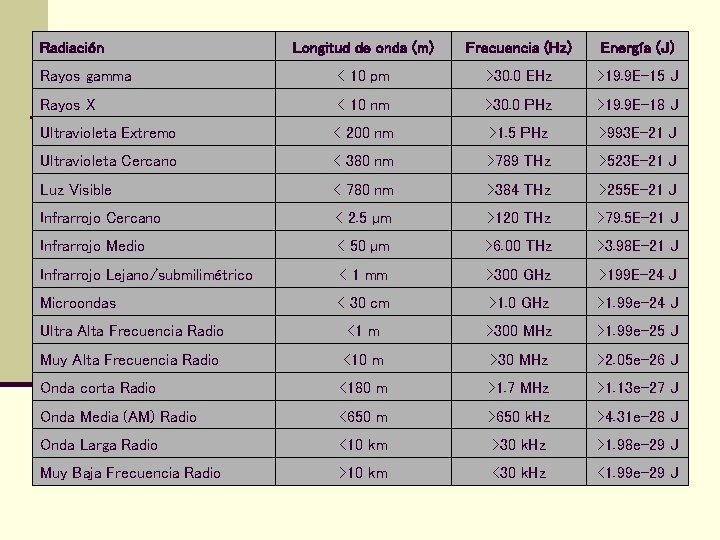
Radiación Longitud de onda (m) Frecuencia (Hz) Energía (J) Rayos gamma < 10 pm >30. 0 EHz >19. 9 E-15 J Rayos X < 10 nm >30. 0 PHz >19. 9 E-18 J Ultravioleta Extremo < 200 nm >1. 5 PHz >993 E-21 J Ultravioleta Cercano < 380 nm >789 THz >523 E-21 J Luz Visible < 780 nm >384 THz >255 E-21 J Infrarrojo Cercano < 2. 5 µm >120 THz >79. 5 E-21 J Infrarrojo Medio < 50 µm >6. 00 THz >3. 98 E-21 J Infrarrojo Lejano/submilimétrico < 1 mm >300 GHz >199 E-24 J Microondas < 30 cm >1. 0 GHz >1. 99 e-24 J Ultra Alta Frecuencia Radio <1 m >300 MHz >1. 99 e-25 J Muy Alta Frecuencia Radio <10 m >30 MHz >2. 05 e-26 J Onda corta Radio <180 m >1. 7 MHz >1. 13 e-27 J Onda Media (AM) Radio <650 m >650 k. Hz >4. 31 e-28 J Onda Larga Radio <10 km >30 k. Hz >1. 98 e-29 J Muy Baja Frecuencia Radio >10 km <30 k. Hz <1. 99 e-29 J

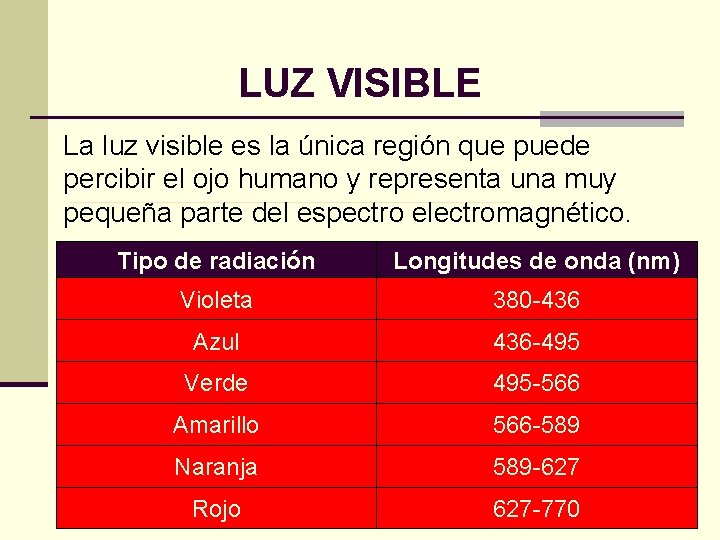
LUZ VISIBLE La luz visible es la única región que puede percibir el ojo humano y representa una muy pequeña parte del espectro electromagnético. Tipo de radiación Longitudes de onda (nm) Violeta 380 -436 Azul 436 -495 Verde 495 -566 Amarillo 566 -589 Naranja 589 -627 Rojo 627 -770

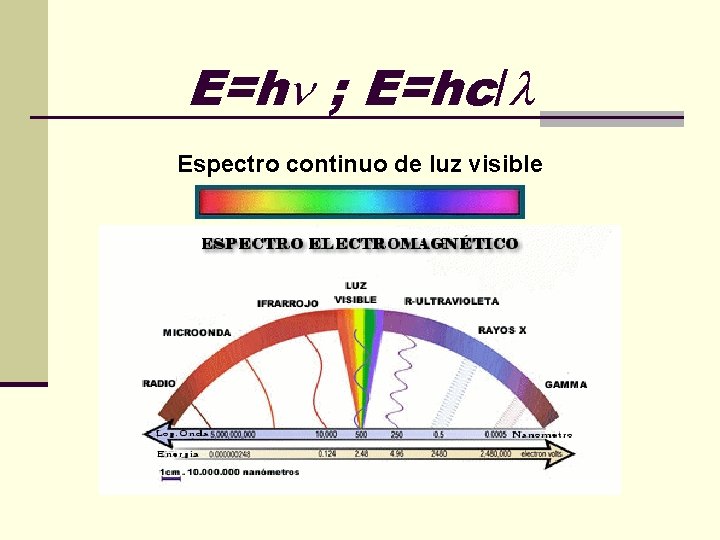
E=h ; E=hc/ Espectro continuo de luz visible

VARIABLES E = hc/ E = Energía = Longitud de onda = Frecuencia c = Velocidad de la luz = 300000 km/s h = Constante de Planck = 6, 626 × 10 -34 J·s 1 Hz = 1 ciclo/s 1 MHz = 1000000 Hz, 1 k. Hz = 1000 Hz

EJERCICIO • ¿Porqué el Fonógrafo (1150 k. Hz AM) no se escucha cuando el automóvil pasa por debajo de un puente vehicular y en cambio EXA FM 104. 9 MHz, si? • Calcule las energías asociadas a cada frecuencia y determine las longitudes de onda, para elaborar con esto sus respuestas. h = 6, 626 × 10 -34 J·s y c=300000 km/s

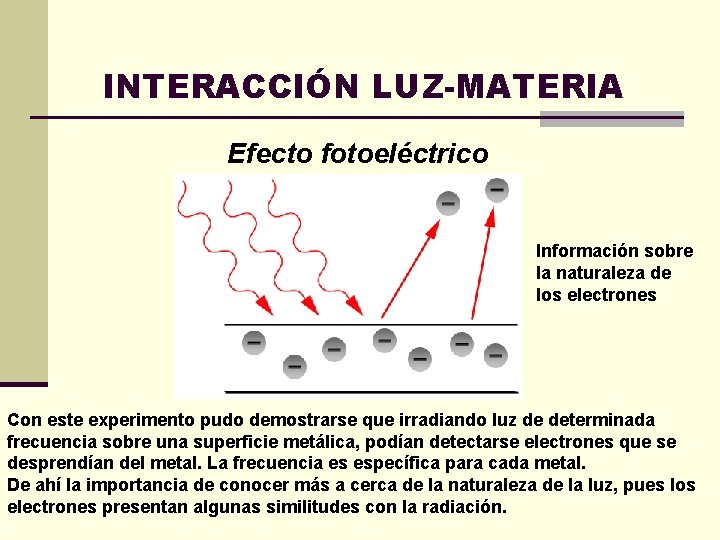
INTERACCIÓN LUZ-MATERIA Efecto fotoeléctrico Información sobre la naturaleza de los electrones Con este experimento pudo demostrarse que irradiando luz de determinada frecuencia sobre una superficie metálica, podían detectarse electrones que se desprendían del metal. La frecuencia es específica para cada metal. De ahí la importancia de conocer más a cerca de la naturaleza de la luz, pues los electrones presentan algunas similitudes con la radiación.

ESPECTROSCOPÍA ABSORCIÓN-EMISIÓN

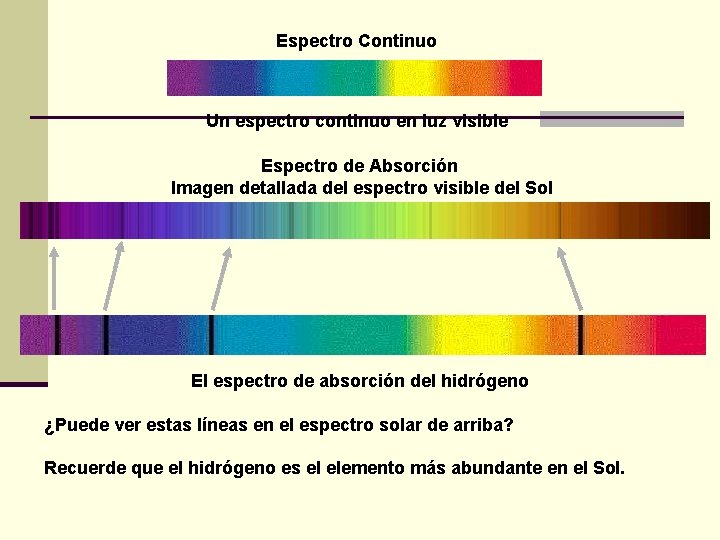
Espectro Continuo Un espectro continuo en luz visible Espectro de Absorción Imagen detallada del espectro visible del Sol El espectro de absorción del hidrógeno ¿Puede ver estas líneas en el espectro solar de arriba? Recuerde que el hidrógeno es el elemento más abundante en el Sol.

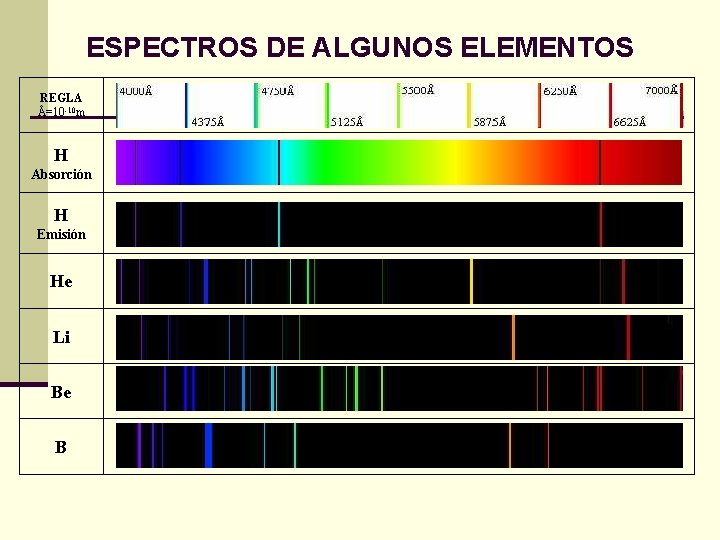
ESPECTROS DE ALGUNOS ELEMENTOS REGLA Å=10 -10 m H Absorción H Emisión He Li Be B

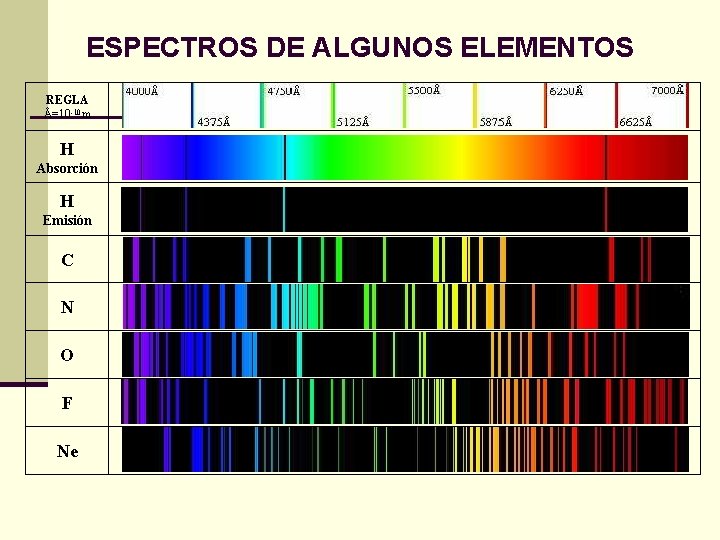
ESPECTROS DE ALGUNOS ELEMENTOS REGLA Å=10 -10 m H Absorción H Emisión C N O F Ne

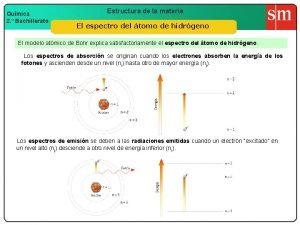
MODELO ATÓMICO DE BOHR Niels Bohr (1885 -1962), físico danés, galardonado con el premio Nobel de Física en 1922

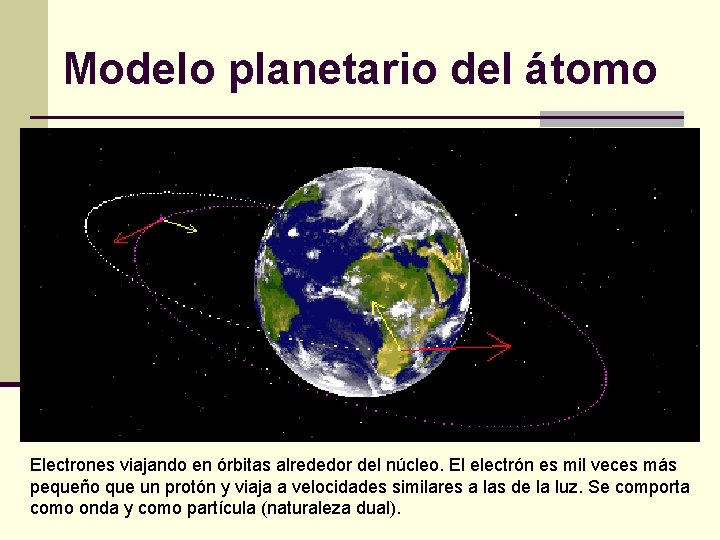
Modelo planetario del átomo Electrones viajando en órbitas alrededor del núcleo. El electrón es mil veces más pequeño que un protón y viaja a velocidades similares a las de la luz. Se comporta como onda y como partícula (naturaleza dual).

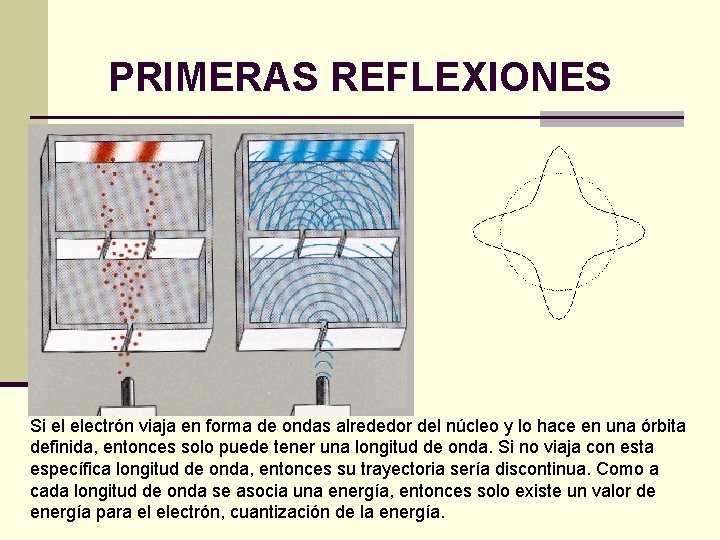
PRIMERAS REFLEXIONES Si el electrón viaja en forma de ondas alrededor del núcleo y lo hace en una órbita definida, entonces solo puede tener una longitud de onda. Si no viaja con esta específica longitud de onda, entonces su trayectoria sería discontinua. Como a cada longitud de onda se asocia una energía, entonces solo existe un valor de energía para el electrón, cuantización de la energía.

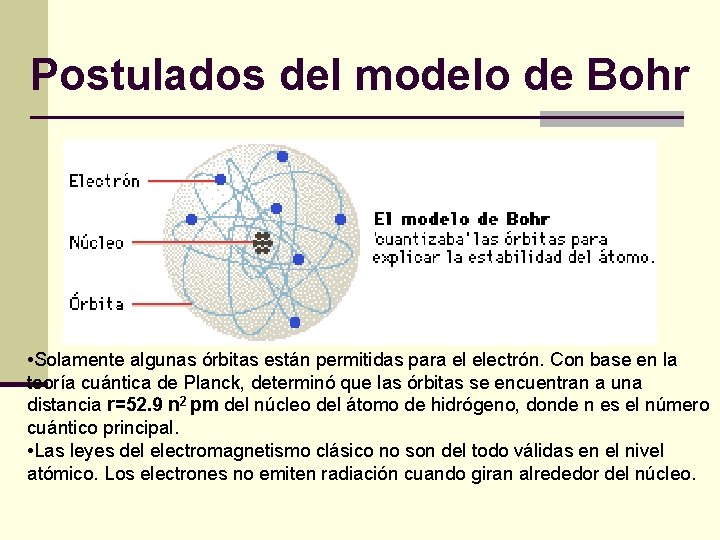
Postulados del modelo de Bohr • Solamente algunas órbitas están permitidas para el electrón. Con base en la teoría cuántica de Planck, determinó que las órbitas se encuentran a una distancia r=52. 9 n 2 pm del núcleo del átomo de hidrógeno, donde n es el número cuántico principal. • Las leyes del electromagnetismo clásico no son del todo válidas en el nivel atómico. Los electrones no emiten radiación cuando giran alrededor del núcleo.

El modelo atómico de Bohr establece: n La energía del electrón esta cuantizada, es decir, no n n puede adoptar cualquier valor. La emisión y absorción de luz por los átomos se explica por el tránsito del electrón entre dos estados energéticos permitidos. Existe un estado de mínima energía llamado estado basal. El radio de la órbita más pequeña es 52. 9 pm. El núcleo es diez mil veces más pequeño que el átomo. El número cuántico principal es suficiente para especificar la órbita del electrón y su energía. Si n crece, el electrón gira más lejos del núcleo y con mayor energía.

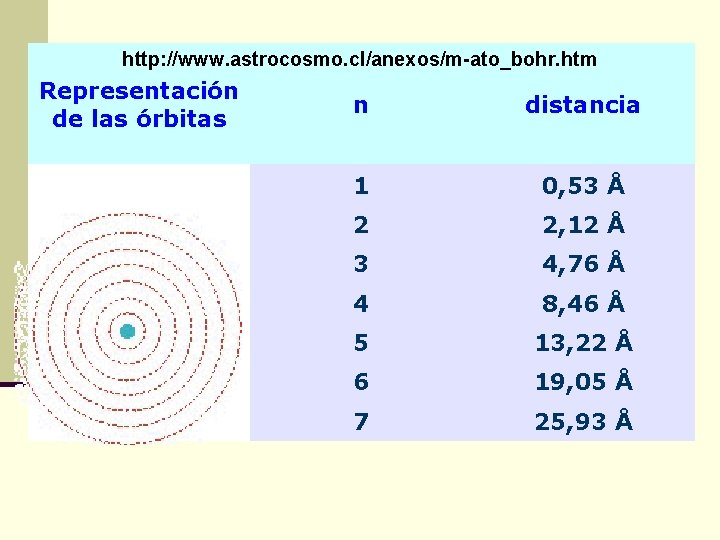
http: //www. astrocosmo. cl/anexos/m-ato_bohr. htm Representación de las órbitas n distancia 1 0, 53 Å 2 2, 12 Å 3 4, 76 Å 4 8, 46 Å 5 13, 22 Å 6 19, 05 Å 7 25, 93 Å

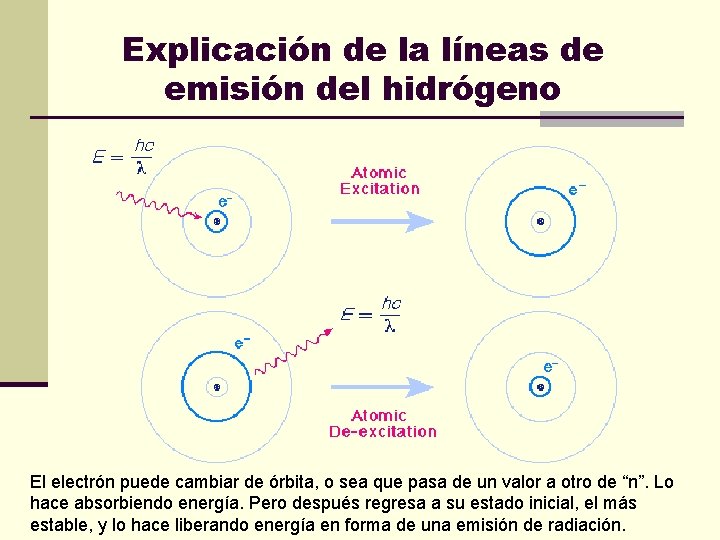
Explicación de la líneas de emisión del hidrógeno El electrón puede cambiar de órbita, o sea que pasa de un valor a otro de “n”. Lo hace absorbiendo energía. Pero después regresa a su estado inicial, el más estable, y lo hace liberando energía en forma de una emisión de radiación.

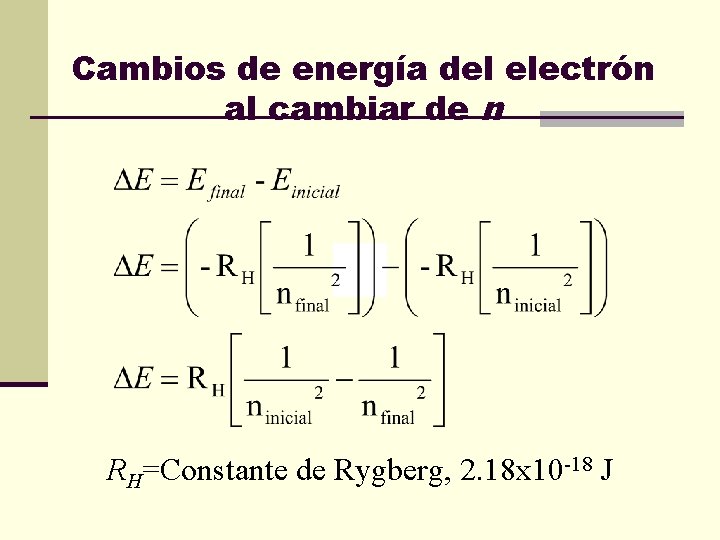
Energía del electrón en el átomo de hidrógeno RH=Constante de Rygberg, 2. 18 x 10 -18 J

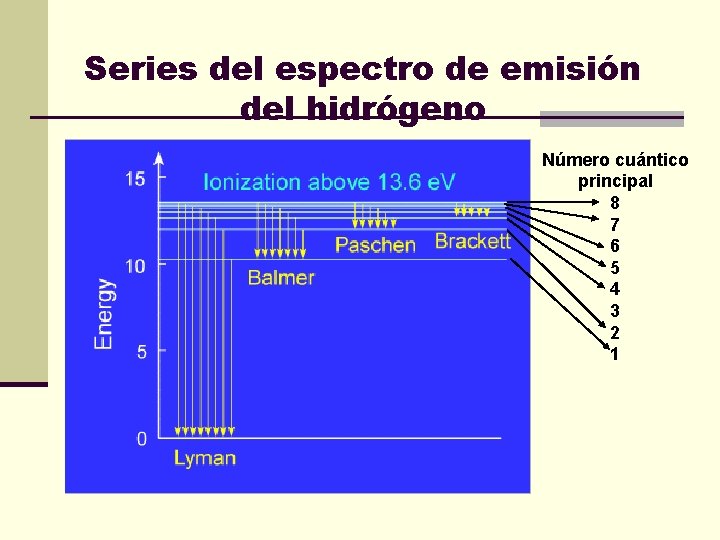
Series del espectro de emisión del hidrógeno Número cuántico principal 8 7 6 5 4 3 2 1

Cambios de energía del electrón al cambiar de n RH=Constante de Rygberg, 2. 18 x 10 -18 J

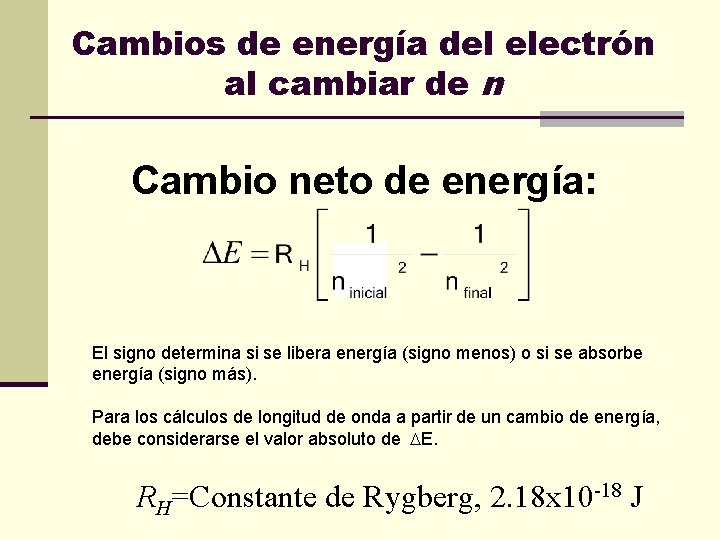
Cambios de energía del electrón al cambiar de n Cambio neto de energía: El signo determina si se libera energía (signo menos) o si se absorbe energía (signo más). Para los cálculos de longitud de onda a partir de un cambio de energía, debe considerarse el valor absoluto de E. RH=Constante de Rygberg, 2. 18 x 10 -18 J

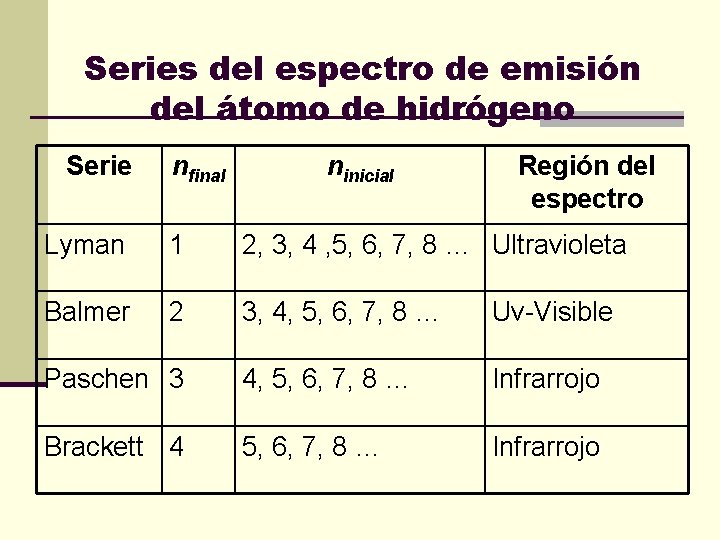
Series del espectro de emisión del átomo de hidrógeno Serie nfinal ninicial Región del espectro Lyman 1 2, 3, 4 , 5, 6, 7, 8 … Ultravioleta Balmer 2 3, 4, 5, 6, 7, 8 … Uv-Visible Paschen 3 4, 5, 6, 7, 8 … Infrarrojo Brackett 4 5, 6, 7, 8 … Infrarrojo

EJERCICIO • Determine las longitudes de onda para la emisión de n=5 a nfinal en los cuatro casos de nfinal, nfinal=1, nfinal=2, nfinal=3 y nfinal=4, para las líneas de emisión del átomo de hidrógeno. • Calcule la energía en Joules para cada caso y el valor de la longitud de onda asociada al cambio en nanómetros (nm). Recuerde que un nanometro equivale a 10 -9 m. RH=Constante de Rygberg, 2. 18 x 10 -18 J

RADIACIÓN Y MEDIO AMBIENTE

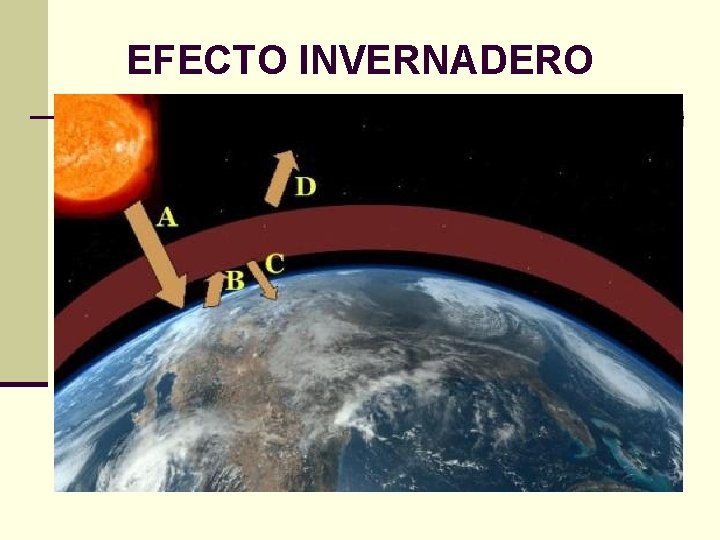
EFECTO INVERNADERO

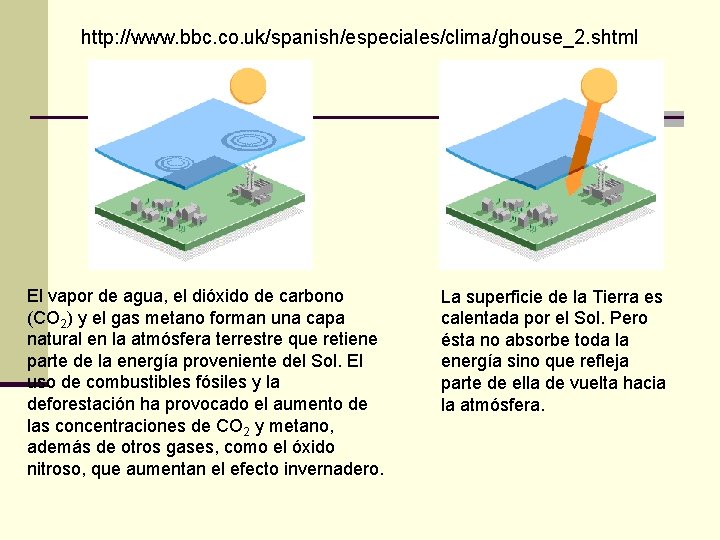
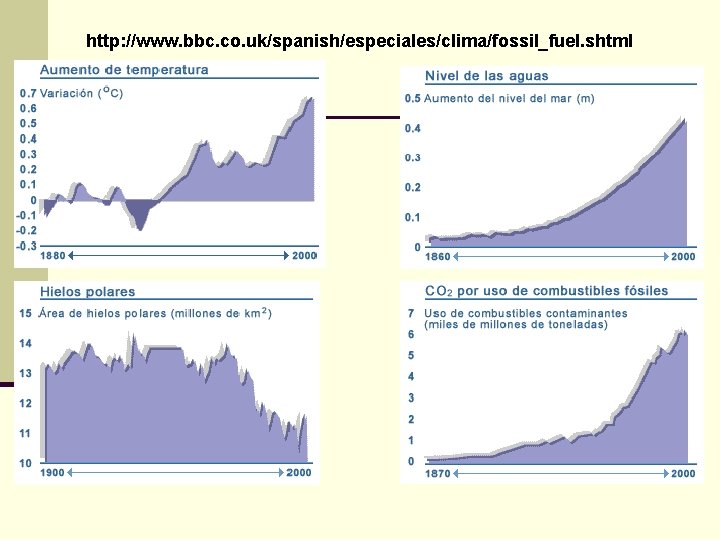
http: //www. bbc. co. uk/spanish/especiales/clima/ghouse_2. shtml El vapor de agua, el dióxido de carbono (CO 2) y el gas metano forman una capa natural en la atmósfera terrestre que retiene parte de la energía proveniente del Sol. El uso de combustibles fósiles y la deforestación ha provocado el aumento de las concentraciones de CO 2 y metano, además de otros gases, como el óxido nitroso, que aumentan el efecto invernadero. La superficie de la Tierra es calentada por el Sol. Pero ésta no absorbe toda la energía sino que refleja parte de ella de vuelta hacia la atmósfera.

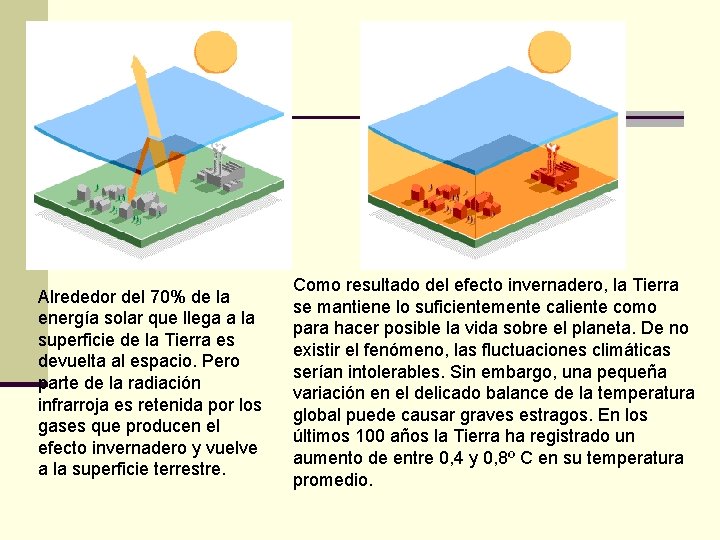
Alrededor del 70% de la energía solar que llega a la superficie de la Tierra es devuelta al espacio. Pero parte de la radiación infrarroja es retenida por los gases que producen el efecto invernadero y vuelve a la superficie terrestre. Como resultado del efecto invernadero, la Tierra se mantiene lo suficientemente caliente como para hacer posible la vida sobre el planeta. De no existir el fenómeno, las fluctuaciones climáticas serían intolerables. Sin embargo, una pequeña variación en el delicado balance de la temperatura global puede causar graves estragos. En los últimos 100 años la Tierra ha registrado un aumento de entre 0, 4 y 0, 8º C en su temperatura promedio.

http: //www. bbc. co. uk/spanish/especiales/clima/fossil_fuel. shtml

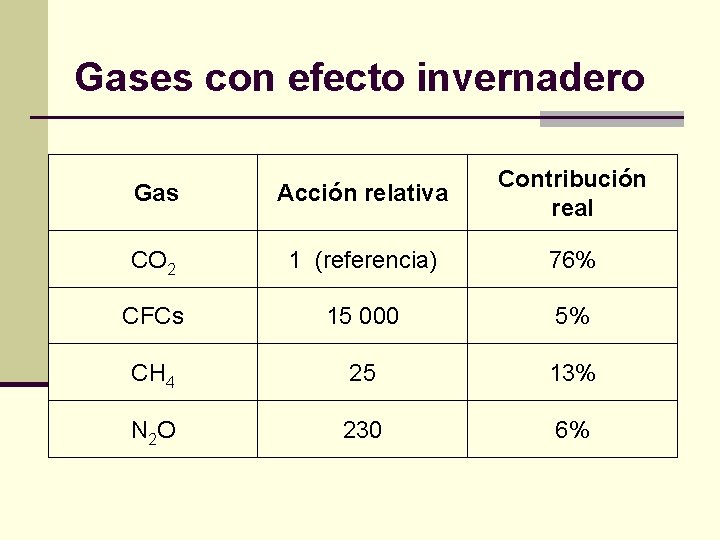
Gases con efecto invernadero Gas Acción relativa Contribución real CO 2 1 (referencia) 76% CFCs 15 000 5% CH 4 25 13% N 2 O 230 6%
 Estructura de la materia 2 bachillerato
Estructura de la materia 2 bachillerato Estructura de la materia
Estructura de la materia Contraion
Contraion Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Cicleno
Cicleno Qumica
Qumica Ionização
Ionização Quimica polar
Quimica polar Qual a sentença verdadeira
Qual a sentença verdadeira Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Lei de lavoisier
Lei de lavoisier Qumica
Qumica Constante de henry
Constante de henry Qumica
Qumica Qumica
Qumica Qumica
Qumica Entalpia
Entalpia Qumica
Qumica Qumica
Qumica Clasificacion de compuesto inorganico
Clasificacion de compuesto inorganico Oxissais
Oxissais Reaccion de condensacion
Reaccion de condensacion Biologia
Biologia Penumbra
Penumbra Qumica
Qumica Qumica
Qumica Qumica
Qumica Formula general de los eteres
Formula general de los eteres Fuerzas dipolo dipolo ejemplos
Fuerzas dipolo dipolo ejemplos Qumica
Qumica Qumica
Qumica Tabla qumica
Tabla qumica Qumica
Qumica Moléculas polares e apolares exemplos
Moléculas polares e apolares exemplos Qumica
Qumica Qumica
Qumica