Qumica Unidad 2 Materia y energa Materia Definiciones


































- Slides: 48

Química Unidad 2: Materia y energía

Materia Definiciones introductorias materia: cualquier cosa que tiene masa y volumen masa: la cantidad de materia en un objeto peso: el tirón de la gravedad en un objeto volumen: el espacio que un objeto ocupa unidades: L, dm 3, ml, cm 3 declaraciones: sólido, líquido, o gas L 3

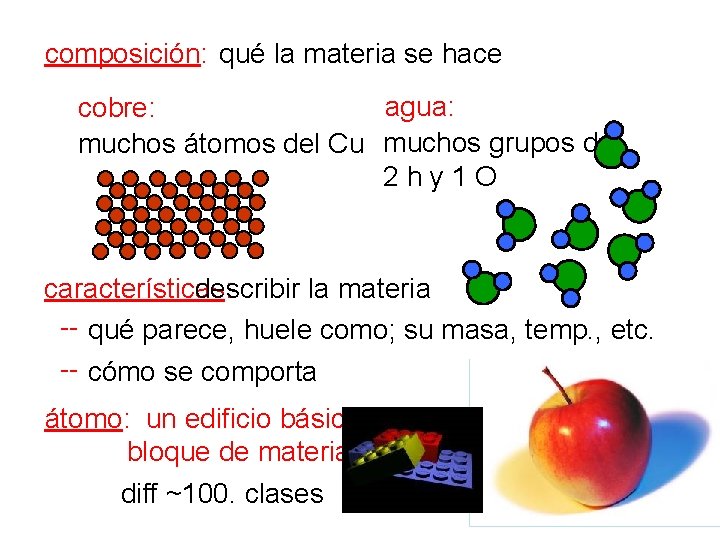
composición: qué la materia se hace agua: cobre: muchos átomos del Cu muchos grupos de 2 h y 1 O características: describir la materia -- qué parece, huele como; su masa, temp. , etc. -- cómo se comporta átomo: un edificio básico bloque de materia diff ~100. clases

Elementos contiene solamente un tipo de 1. los elementos monatomic consisten en unbonded, “como” los átomos e. g. , FE, Al, Cu, él 2. los elementos poliatómicos consisten de varios “como” los átomos enlazados junto H 2 O 2 Br 2 F 2 I 2 N 2 Cl 2 elementos diatómicos: otros: P 4 S 8 “ 7 7 7”

alótropos: diversas formas del mismo elemento adentr las mismas declaraciones CARBÓN DEL OXÍGENO oxígeno-gas(O 2) elemental carbón grafito ozono (O 3) diamante buckyball

molécula: un grupo neutral de átomos consolidado Descripción 1 átomo de oxígeno 1 molécula del oxígeno 2 unbonded átomos de oxígeno 1 fósforo átomo 1 fósforo molécula 4 unbonded Producto químico Símbolo Modelo O O 2 2 O P P 4 4 P entos pueden consistir en las moléculas o los átomos u fósforo átomos

q. Compuestos … contener tipos dos o más diversos de átomos … tener características de las cuales ser diferente los de sus elementos constitutivos sal de tabla Na (sodio): (Na. Cl) Cl 2 (clorina): estalla en agua gas venenoso

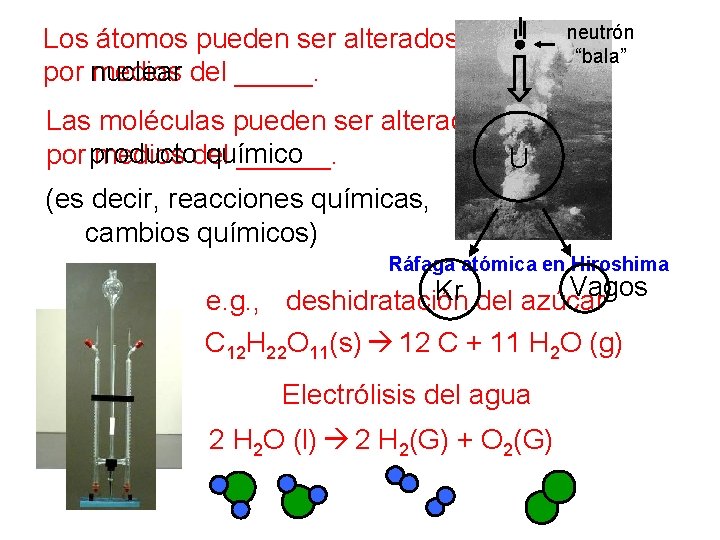
neutrón Los átomos pueden ser alterados solamente “bala” nuclear por medios del _____. Las moléculas pueden ser alteradas producto químico por medios del ______. U (es decir, reacciones químicas, cambios químicos) Ráfaga atómica en Hiroshima Vagos Kr e. g. , deshidratación del azúcar C 12 H 22 O 11(s) 12 C + 11 H 2 O (g) Electrólisis del agua 2 H 2 O (l) 2 H 2(G) + O 2(G)

Composición compuesta Todas las muestras de un compuesto dado tener la misma composición. Cada muestra de Na. Cl prueba iguales, los derretimientos en el mismo temp. , y son 39. 3% Na y Cl 60. 7% por Massachusetts.

Gas de fosgeno (COCl 2) es el carbón 12. 1%, 16. 2% oxígeno, y clorina 71. 7% cerca Massachusetts Hallazgo # de g de cada elemento aden 254 g de COCl 2. C: 254 g (0. 121) = 30. 7 g C O: 254 g (0. 162) = 41. 1 g O Cl: 254 g (0. 717) de = Cl 182. 1 g

Una muestra del butano (C 4 H 10) contiene el carbón de 2 e hidrógeno de 60 g. Hallazgo… Masa total del A. … de la muestra 288 g C + 60 g H = 348 g B. … % de cada elemento en butano % C = = 0. 828 % H = = 0. 172 82. 8% C, 17. 2% H C. … cuánto g de C y H son en una muestra de 24. 2 g C: 24. 2 g (0. 828) = g 20. 0 C H: 24. 2 g (0. 172) = 4. 2 g H

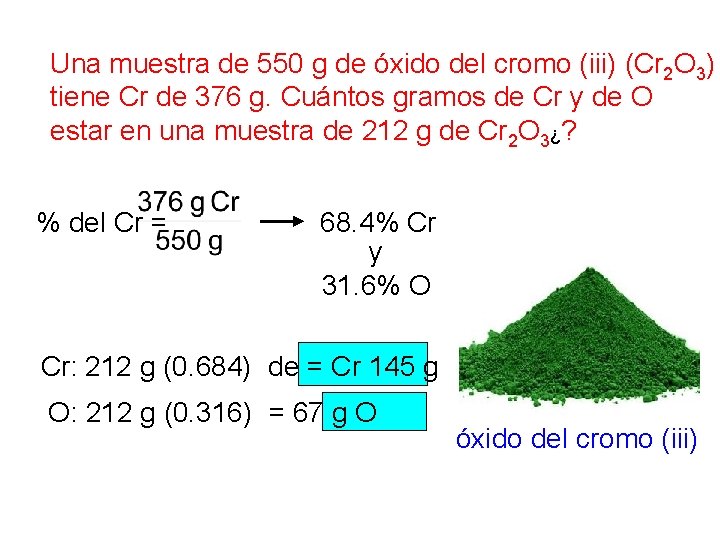
Una muestra de 550 g de óxido del cromo (iii) (Cr 2 O 3) tiene Cr de 376 g. Cuántos gramos de Cr y de O estar en una muestra de 212 g de Cr 2 O 3¿? % del Cr = 68. 4% Cr y 31. 6% O Cr: 212 g (0. 684) de = Cr 145 g O: 212 g (0. 316) = 67 g O óxido del cromo (iii)

Clasificar la materia Sustancias (puras) … tener una composición fija … tener características fijas ELEMENTOS COMPUESTOS e. g. , FE, N 2, S 8, U e. g. , H 2 O, Na. Cl, HNO 3 sulfuro (S 8) cloruro sódico (Na. Cl) Las sustancias puras tienen una fórmula química.

Mezclas dos o más sustancias mezcladas juntas … tener composición diversa … tener características diversas Las sustancias no son químicamente consolidadas, conservar sus características individuales. y ellas… Té, anaranjado jugo, océanos, y el aire es mezclas.

Dos tipos de mezclas homogéneo: (o solución) las partículas son microscópicas; la muestra tiene igu composición y características en todas partes; mezclado uniformemente e. g. , agua salada Ayuda de Kool aleación: una mezcla homogénea de metales e. g. , bronce (Cu + Sn) estaño (Pb + Sn) latón (Cu + Zn)

Dos tipos de las mezclas (cont. ) heterogéneo: diversas composición y características en la misma muestra; irregularmente mezclado ensalada sacudida e. g. , salvado de pasa suspensión: settles en un cierto plazo e. g. , pintura regalos del nevos

Contraste… ORO 24 K ORO 14 K 24/24 de los átomos es oro 14/24 de los átomos es or oro puro mezcla de oro y de cobre elemento mezcla homogénea Au + Cu Au

Carta para clasificar la materia MATERIA SUSTANCIA PURA ELEMENTO MEZCLA COMPUESTO HETEROGÉNEO HOMOGÉNEO

Una muestra de bronce contiene el cobre de 68 g y la la A. Encontrar la masa total de la muestra. = 75 g Cu de 68 g de + Sn 7 g B. Encontrar % del Cu y % del Sn. % del Cu = 90. 7% Cu y Sn 9. 3% C. Lo hacen cuántos gramos de cada elemento ¿una muestra de 346 g de bronce contiene? (El bronce es una mezcla y no está necesario siempre Sn 90. 7% Cu y 9. 3%. ) No sabemos. Sin embargo, si se asume que estos % estar correcto… Cu: 346 g (0. 907) de = Cu 314 g(y Sn de 32 g)

Separación de mezclas … implica medios físicos, o la comprobación cambia 1. clasificando: por color, forma, textura, etc. 2. filtro: tamaño de partícula es diferente

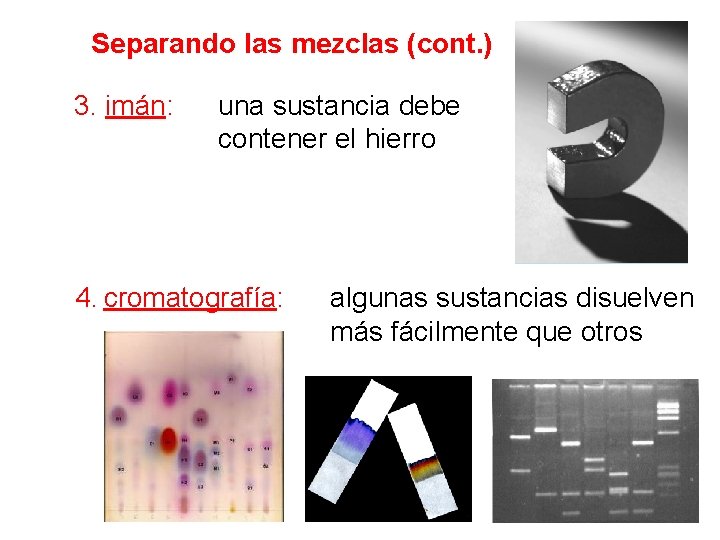
Separando las mezclas (cont. ) 3. imán: una sustancia debe contener el hierro 4. cromatografía: algunas sustancias disuelven más fácilmente que otros

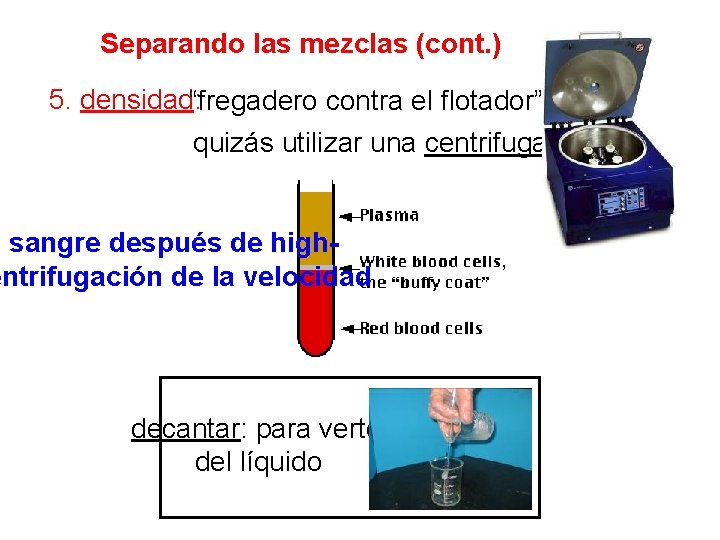
Separando las mezclas (cont. ) 5. densidad: “fregadero contra el flotador” quizás utilizar una centrifugadora sangre después de highentrifugación de la velocidad decantar: para verter del líquido

Separando las mezclas (cont. ) 6. destilación: diversos puntos de ebullición termómetro más-volátil sustancia agua hacia fuera (calentador) agua adentro (refrigerador) cond ensa (es decir, el con el más bajomezcla punto de ebullición) dor más-volátil sustancia, ahora condensado fuente de calor

Ningunas reacciones químicas ser necesario separar mezclas; as sustancias no son consolidadas amalgama dental

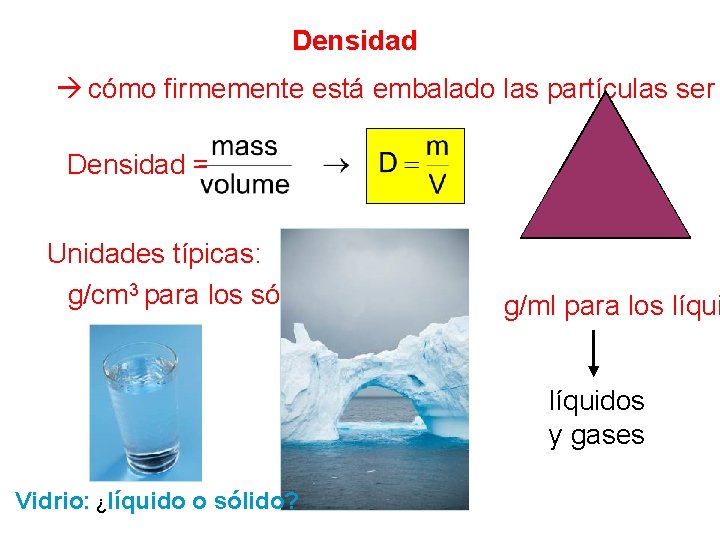
Densidad cómo firmemente está embalado las partículas ser m Densidad = D Unidades típicas: g/cm 3 para los sólidos V g/ml para los líquidos y gases Vidrio: ¿líquido o sólido?

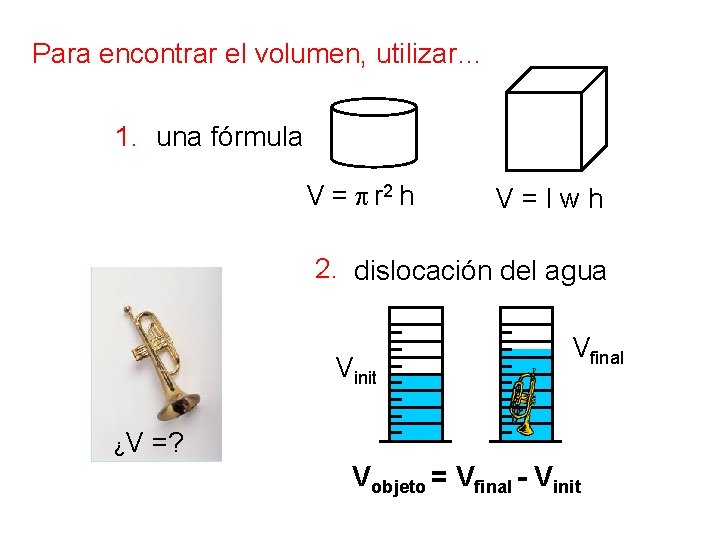
Para encontrar el volumen, utilizar… 1. una fórmula V = p r 2 h V = l w h 2. dislocación del agua Vinit Vfinal ¿V =? Vobjeto = Vfinal - Vinit

3 ** Densidad del agua = 1. 0 g/ml = 1. 0 g/cm Cosas que son flotador “menos denso” en las cosas que son “más densas. ” (Y cosas que es un fregadero “más denso” en las cosas que son “menos densas. ” D < 1 g/cm 3 D > 1 g/cm 3 D < 1 g/cm 3 La densidad de un líquido o de un sólido es casi constante, no importa qué la temperatura de la muestra. La densidad de gases es alto - dependiente en temperat

q. Problema galileo del termómetro En una mañana fría, un profesor camina en a sala de clase y avisos fríos que todos los bulbos en el termómetro galileo se amontonan en un grupo. Donde están los bulbos, en ¿tapa del termómetro o en la parte inferior? D 1 1. Los bulbos esencialmente han fijado masas D 2 y volúmenes. Por lo tanto, cada bulbo D 3 tiene una densidad relativamente fija. D 4 D 5 2. El líquido circundante tiene un fijo la masa, pero su volumen está extremadamente temperatura-dependiente.

D 1 3. La densidad del líquido se puede escribir como… D 2 tan… … si el líquido es frío: mliq Vliq = Dliq D 3 … pero si es caliente: mliq Vliq = Dliq En una mañana fría, EN LA TAPA ¿dónde están los bulbos? D 4 D 5

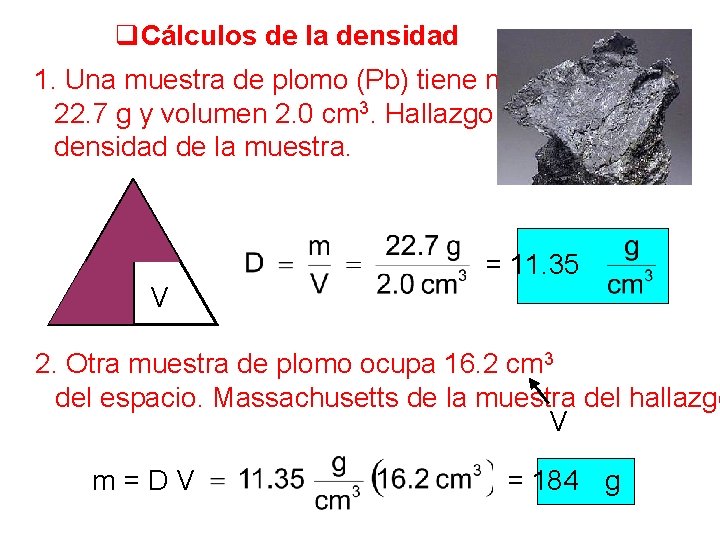
q. Cálculos de la densidad 1. Una muestra de plomo (Pb) tiene masa 22. 7 g y volumen 2. 0 cm 3. Hallazgo densidad de la muestra. m D = 11. 35 V 2. Otra muestra de plomo ocupa 16. 2 cm 3 del espacio. Massachusetts de la muestra del hallazgo V m = D V = 184 g

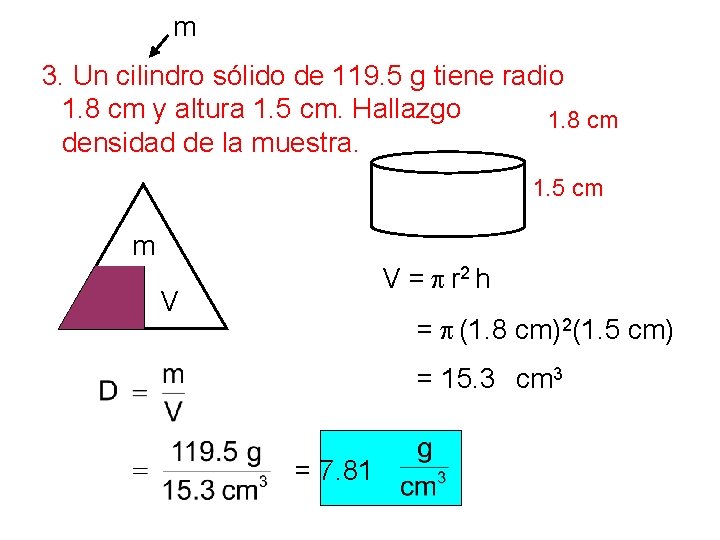
m 3. Un cilindro sólido de 119. 5 g tiene radio 1. 8 cm y altura 1. 5 cm. Hallazgo 1. 8 cm densidad de la muestra. 1. 5 cm m D V = p r 2 h V = p (1. 8 cm)2(1. 5 cm) = 15. 3 cm 3 = 7. 81

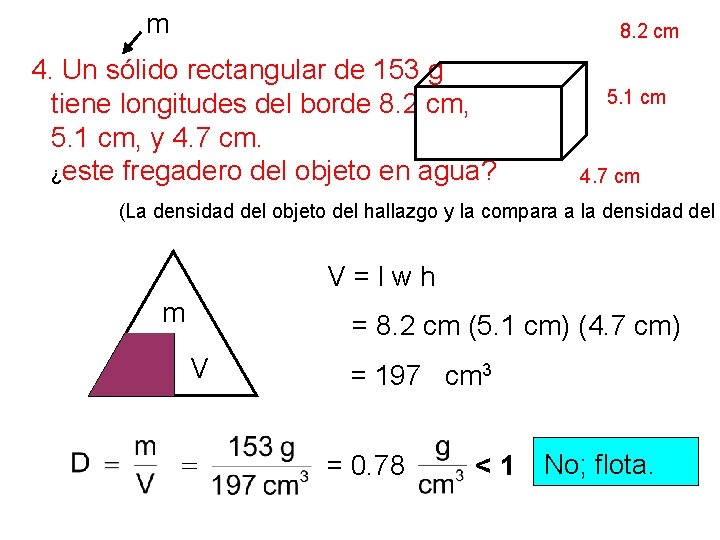
m 8. 2 cm 4. Un sólido rectangular de 153 g tiene longitudes del borde 8. 2 cm, 5. 1 cm, y 4. 7 cm. ¿este fregadero del objeto en agua? 5. 1 cm 4. 7 cm (La densidad del objeto del hallazgo y la compara a la densidad del V = l w h m D V = 8. 2 cm (5. 1 cm) (4. 7 cm) = 197 cm 3 = 0. 78 <1 No; flota.

UNO DE ÉSTOS Características de la materia Las características QUÍMICAS dicen cómo una sustancia reacciona con otras sustancias. Las características FÍSICAS se pueden observar f químicamente cambio de la sustancia. UNO DE ÉSTOS Y Las características EXTENSAS dependen de la cantidad del presente de la sustancia. Las características INTENSIVAS no dependen de cantidad de sustancia.

Ejemplos: conductividad eléctrica. . . . P, I reactividad con agua. . . . C, I P, E contenido de calor (energía total). . . . . P, I dúctil: puede ser dibujado (tirado) dentro del alambre maleable: puede ser martillado en forma…P, I frágil. . . P, I magnetismo. . . . . P, I

Estados de la materia SÓLIDO (()) (()) (()) el vibrar LÍQUIDO GAS (()) (()) el traducir; cierre junto el traducir rápidamente; lejos aparte

Cambios en estado La energía puso en sistema. sublimación fusión SÓLIDO ebullición LÍQUIDO congelacióncondensación deposición Energía quitada de sistema. GAS

Energía capacidad de hacer el traba energía potencial: energía almacenada -- almacenado en enlaces entre los átomos e. g. , en alimento, gasolina, baterías energía cinética: energía del movimiento -- el menear, traduciendo, y rotación de partículas -- movimiento “caliente” de las partículas del gas más rápidamente, tener más KE

Edespués Ley de la conservación de la energía: = Eantes 2 H 2 + O 2 2 H 2 O + + energía ! F O + ¡ O H W

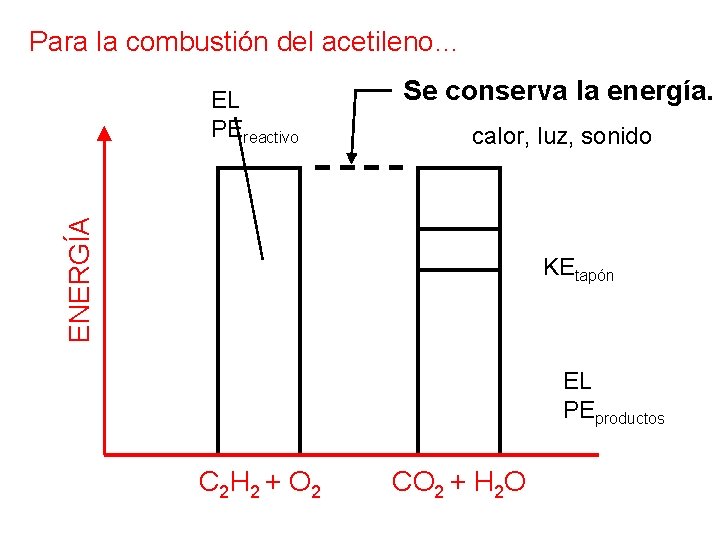
Para la combustión del acetileno… Se conserva la energía. calor, luz, sonido ENERGÍA EL PEreactivo KEtapón EL PEproductos C 2 H 2 + O 2 CO 2 + H 2 O

q. Cambios de la energía cambio endotérmico: el sistema absorbe calor -- el cubilete siente frío cambio exotérmico: el sistema lanza calor -- el cubilete siente caliente Elegir “endo” o el “exo. ” regar la ebullición ENDO empapelar el burning EXO CO 2 sublimación. ENDO congelación del agua EXO cocer la condensación al vapor EXO fusión del hielo ENDO

ACTIVACIÓN ENERGÍA R P exotérmico Energía P R endotérmico (la mayoría de las reacciones químicas) (fotosíntesis) C + O 2 CO 2 + H 2 C de O + de la luz del sol 6 H 12 O 6 + O 2

El topo es la unidad del SI para la “cantidad de sustancia. ” s átomos son así que pequeño, es imposible contarlos cerc las docenas, los millares, o aún millones. Para contar los átomos, utilizamos el concepto del topo. 1 topo de átomos = 602. 000 átomos 6. 02 x 1023 Es decir, 1 topo de átomos = de átomos del _______.

¿Cómo grande es un topo? … sobre el tamaño de un chipmunk, pesaje de cerca de 5 onzas. (140 g), y tener una longitud de cerca de 7 pulgadas (18 cm). Signifiqué, “cómo son grandes es 6. 02 x 1023? ” GRANDE 6. 02 x 1023 los mármoles cubrirían tierra entera (océanos incluyendo) … a una profundidad de 2 millas. 6. 02 x 1023 $1 cuentas apilaron cara a cara estiraría del Sun a Pluto … 7. 5 millones de veces. … y trasero Tarda a luz 9. 500 años para viajar eso lejos.

Para cualquie elemento en la tabla periódica, un topo de ese elemento (es decir, 6. 02 x 1023 átomos de ese elemento) tiene una masa en los gramos iguales al decimal número en la tabla para ese elemento. Él 2 4. 003 10 Ne 20. 180 18 AR 1 topo de (es decir, 6. 02 x 1023) átomos del helio tiene una masa de 4. 0 gramos. 39. 948 36 Kr 83. 80 1 mol Ne = g 20. 2 54 1 mol AR = 39. 9 g Xe 1 mol Kr = 83. 8 g 131. 29 1 mol de Xe = 131. 3 g 86 Rn 1 mol Rn = 222 g (222)

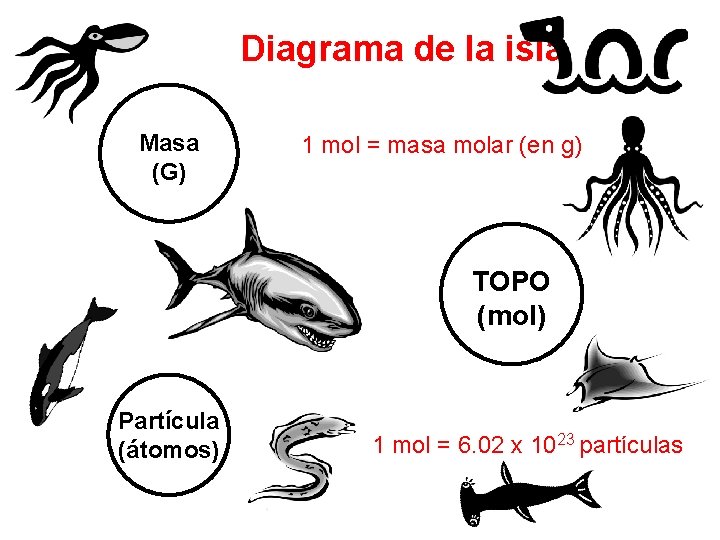
Diagrama de la isla Masa (G) 1 mol = masa molar (en g) TOPO (mol) Partícula (átomos) 1 mol = 6. 02 x 1023 partículas

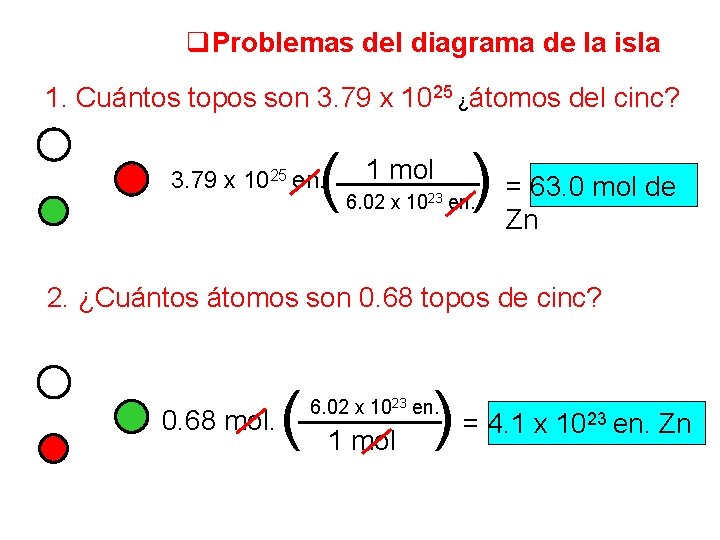
q. Problemas del diagrama de la isla 1. Cuántos topos son 3. 79 x 1025 ¿átomos del cinc? ( 3. 79 x 1025 en. 1 mol ) = 63. 0 mol de Zn 6. 02 x 1023 en. 2. ¿Cuántos átomos son 0. 68 topos de cinc? ( 0. 68 mol. ) = 4. 1 x 10 6. 02 x 1023 en. 1 mol 23 en. Zn

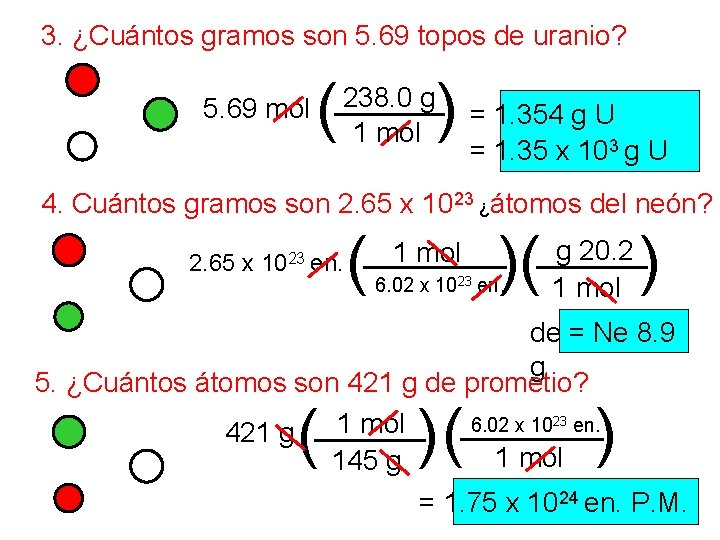
3. ¿Cuántos gramos son 5. 69 topos de uranio? 5. 69 mol ( 238. 0 g 1 mol ) = 1. 354 g U = 1. 35 x 10 g U 3 4. Cuántos gramos son 2. 65 x 1023 ¿átomos del neón? ( 2. 65 x 1023 en. 1 mol )( 6. 02 x 1023 en. g 20. 2 1 mol ) de = Ne 8. 9 g 5. ¿Cuántos átomos son 421 g de prometio? 6. 02 x 1023 en. 1 mol 421 g 1 mol 145 g ( )( ) = 1. 75 x 1024 en. P. M.

h h
 Energia potencial gravitacional
Energia potencial gravitacional Energa solar
Energa solar Sol energa
Sol energa Cuales son las centenas
Cuales son las centenas Definiciones de sociologia
Definiciones de sociologia Que es emprender acciones
Que es emprender acciones Definicion de salud vocacional
Definicion de salud vocacional Cuando se anula el coseno
Cuando se anula el coseno Tres definiciones de concepto
Tres definiciones de concepto Definiciones conceptuales
Definiciones conceptuales Definiciones de sociologia
Definiciones de sociologia Definiciones
Definiciones Definiciones de la verdad
Definiciones de la verdad Definiciones leccion 1
Definiciones leccion 1 Que es desarrollo humano
Que es desarrollo humano Voz narrativa
Voz narrativa Definiciones quimicas
Definiciones quimicas Estados financieros definición
Estados financieros definición Concepto de derecho internacional publico
Concepto de derecho internacional publico Definiciones básicas
Definiciones básicas Introducción de resiliencia
Introducción de resiliencia Michael rutter resiliencia
Michael rutter resiliencia Significado pensamiento critico
Significado pensamiento critico Cuales son los tipos de narrador
Cuales son los tipos de narrador Qumica
Qumica Qumica
Qumica Fuerzas dipolo dipolo ejemplos
Fuerzas dipolo dipolo ejemplos Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Hidrácidos
Hidrácidos Qumica
Qumica Escriba la formula de los siguientes compuestos
Escriba la formula de los siguientes compuestos Qumica
Qumica Formula de los eteres
Formula de los eteres Poluição das águas
Poluição das águas Qumica
Qumica Qumica
Qumica Qumica
Qumica Aplicaciones cloro
Aplicaciones cloro Qumica
Qumica Geometria trigonal plana
Geometria trigonal plana Qumica
Qumica Qumica
Qumica Pilha de daniell
Pilha de daniell Características de los alquinos
Características de los alquinos Qumica
Qumica








































































