En association avec lETOP European Thoracic Oncology Platform



































- Slides: 85

En association avec l’ETOP (European Thoracic Oncology Platform) IASLC 18 th World Conference on Lung Cancer 15– 18 octobre, 2017 Yokohama, Japon Avec le soutien institutionnel Lilly n’a pas influencé le contenu de cette publication

Lettre du professeur Rolf Stahel Chers collègues J’ai le plaisir de vous présenter ce diaporama de l’ETOP, qui a été conçu pour sélectionner et synthétiser les principaux résultats sur les cancers thoraciques communiqués lors des congrès de l’année 2017. Celui-ci est consacré au IASLC 18 th World Conference on Lung Cancer et il est disponible en 4 langues: anglais, français, chinois et japonais La recherche clinique en oncologie thoracique évolue dans un environnement en perpétuelle mutation, et constitue un défi permanent. Dans ce contexte, nous avons tous besoin d’avoir accès aux données scientifiques pour améliorer nos connaissances et progresser dans nos métiers de cliniciens, chercheurs et enseignants. J’espère que cette revue des derniers développement en oncologie thoracique vous apportera beaucoup et enrichira votre pratique. Si vous souhaitez partager votre avis avec nous, nous serons très heureux de recevoir vos commentaires. Vous pouvez adresser toute correspondance à l’adresse suivante: etop@etop. eu-org. Je souhaite remercier les membres de l’ETOP, Drs Solange Peters and Martin Reck pour leur rôle de rédacteurs, dans la sélection des abstracts et la revue du contenu de ce diaporama. La réalisation de ce document n’aurait pas été possible sans leur engagement et leur travail. Nous sommes également très reconnaissants à Lilly Oncologie pour leur support financier, administratif et logistique à cette activité difficile mais gratifiante Très cordialement, Rolf Stahel Président du conseil de la fondation ETOP

Diaporama oncologie médicale ETOP 2017 Focus: CBNPC avancé (stades III et IV non éligibles au traitement radical) Dr Solange Peters Centre d’oncologie multidisciplinaire, Centre anticancéreux de Lausanne, Suisse Focus: autres pathologies, CBPC, mésothéliome Dr Martin Reck Département d’oncologie thoracique, Hôpital Grosshansdorf, Allemagne

Abréviations /x. S ADNa ADNtc CBNPC CBPC CMT CT EI EIG EILI EILT EIGLT Evts ICP IHC IRM ITK MHP ML MS toutes les x semaines ADN acellulaire ADN tumoral circulant cancer bronchique non à petites cellules cancer bronchique à petites cellules charge mutationnelle tumorale chimiothérapie événement indésirable grave événement indésirable lié à l’immunité événement indésirable lié au traitement événement indésirable grave lié au traitement évènements irradiation crânienne prophylactique immunohistochimie imagerie par résonnance magnétique inhibiteur de tyrosine kinase maladie hyperprogressive métastases leptoméningées maladie stable MPM NA ND NE Qo. L RC RCT RP RT SG SGm SLT SNC SS SSM SSPm TCM TRG mésothéliome pleural malin non atteinte non déterminée non estimé qualité de vie réponse complète radiochimiothérapie réponse partielle radiothérapie survie globale médiane survivants à long terme système nerveux central soins standards survie sans maladie survie sans progression médiane taux de contrôle de la maladie (RC + RP + MS) taux de réponse globale

Sommaire • Biomarqueurs et dépistage • CBNPC stade précoce et localement avancé – Stades I, II et III • CBNPC avancé – Non éligible au traitement curatif stades III et IV – 1 e ligne – Lignes ultérieures • Autres tumeurs malignes – CBPC, mésothéliome et tumeurs épithéliales thymiques

Biomarqueurs

MA 05. 02: Les altérations génomiques perte de fonction STK 11/LKB 1 prédisent la résistance primaire au blocage de l’axe PD-1/PD-L 1 dans le CBNPC muté KRAS – Skoulidis F, et al • Objectif – Etudier l’impact des altérations génomiques de STK 11 sur l’efficacité des inhibiteurs de PD-1/ PD-L 1 chez les patients avec adénocarcinome bronchique KRAS muté ou sauvage • Méthodes – Les données ont été analysées de façon rétrospective chez des patients avec adénocarcinome bronchique traités par inhibiteurs de checkpoints immunitaires • Inclusion de 174 adénocarcinomes bronchiques KRAS muté – 146 nivolumab, 19 pembrolizumab, 9 anti-PD-1/PD-L 1 + anti-CTLA-4 – L’expression de PD-L 1 des cellules tumorales a été testée par VENTANA PD-L 1 (SP 142) et E 1 L 3 N IHC – La charge mutationnelle tumorale (CMT) a été catégorisée en élevée (CMT-E), intermédiaire (CMT-I) ou faible (CMT-F) Skoulidis F et al, J Thorac Oncol 2017; 12(suppl): Abstr MA 05. 02

MA 05. 02: Les altérations génomiques perte de fonction STK 11/LKB 1 prédisent la résistance primaire au blocage de l’axe PD-1/PD-L 1 dans le CBNPC muté KRAS – Skoulidis F, et al • Résultats – Les patients avec co-mutations KRAS/STK 11 présentaient de mauvaises réponses cliniques • TRG: KL 7, 4%, KP 35, 7% et K seul 28, 6% (p=0, 000735) – SSP et SG plus courtes dans l’adénocarcinome bronchique KL • SSP: KL 1, 8 mois, KP 3, 0 mois, K 2, 7 mois (p=0, 0018) • SG: KL 6, 4 mois, KP 16, 0 mois, K 16, 1 mois (p=0, 0045) – Les altérations génétiques STK 11 étaient nombreuses dans les adénocarcinomes bronchiques CMT-I/E avec expression de PD-L 1 négative • Conclusions – Dans le CBNPC muté KRAS, les altérations génétiques perte de fonction de STK 11 représentent un driver de résistance majeur au blocage de l’axe PD-1 – Les co-mutations TP 53 sont associées à un bénéfice clinique dans le traitement par inhibiteur de PD-1 KL, KRAS + STK 11/LKB 1; KP, KRAS + TP 53; K, KRAS seul Skoulidis F et al, J Thorac Oncol 2017; 12(suppl): Abstr MA 05. 02

MA 05. 04: Un microenvironnement immunosuppresseur distinct détermine le mauvais pronostic des patients avec CBNPC de type adénocarcinome, non fumeurs – Kinoshita T, et al • Objectif – Etudier la signification pronostique des lymphocytes infiltrant la tumeur (TILs) CD 8+ selon les types histologiques de CBNPC réséqués • Méthodes – La signification pronostique des TILs CD 8+ a été étudiée par analyse immunohistochimique et analyse de l’expression des gènes liés à l’immunité – Les patients ont été classés selon le type histologique: adénocarcinome et non adénocarcinome, et selon le tabagisme Kinoshita T et al, J Thorac Oncol 2017; 12(suppl): Abstr MA 05. 04

MA 05. 04: Un micro-environnement immunosuppresseur distinct détermine le mauvais pronostic des patients avec CBNPC de type adénocarcinome, non fumeurs – Kinoshita T, et al • Résultats – Le nombre de cellules T CD 8+ était plus élevé dans les échantillons de non adénocarcinomes • Dans les non adénocarcinomes, l’accumulation de cellules T CD 8+ était associée à un meilleur pronostic, mais l’inverse était observé dans les adénocarcinomes – Les TILs CD 8+ dans les non adénocarcinomes étaient bien activés mais ils n’étaient pas complètement activés dans les adénocarcinomes – Un micro-environnement immunosuppresseur a été établi dans les adénocarcinomes chez les non fumeurs – Les cellules T CD 8+ potentiellement immunosuppressives étaient corrélées avec les cellules T immunorégulatrices et les macrophages et étaient amassées dans les adénocarcinomes chez les non fumeurs • Conclusion – Ces résultats pourraient aider à mieux personnaliser les stratégies d’immunothérapie dans le CBNPC Kinoshita T et al, J Thorac Oncol 2017; 12(suppl): Abstr MA 05. 04

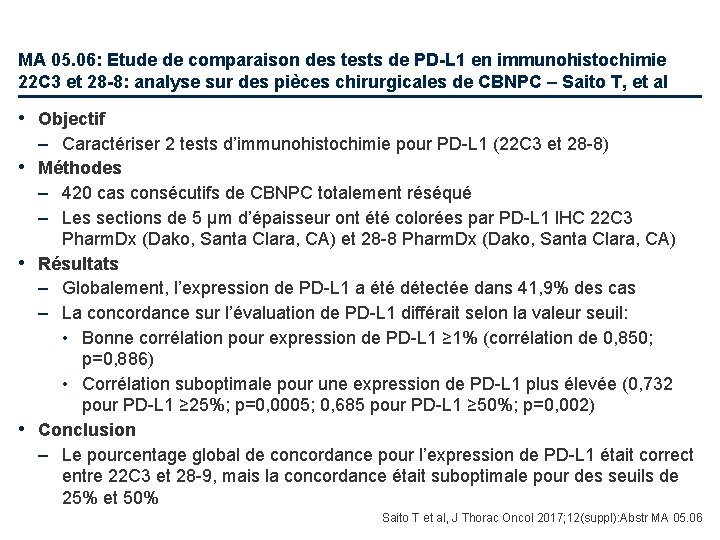
MA 05. 06: Etude de comparaison des tests de PD-L 1 en immunohistochimie 22 C 3 et 28 -8: analyse sur des pièces chirurgicales de CBNPC – Saito T, et al • Objectif – Caractériser 2 tests d’immunohistochimie pour PD-L 1 (22 C 3 et 28 -8) • Méthodes – 420 cas consécutifs de CBNPC totalement réséqué – Les sections de 5 μm d’épaisseur ont été colorées par PD-L 1 IHC 22 C 3 Pharm. Dx (Dako, Santa Clara, CA) et 28 -8 Pharm. Dx (Dako, Santa Clara, CA) • Résultats – Globalement, l’expression de PD-L 1 a été détectée dans 41, 9% des cas – La concordance sur l’évaluation de PD-L 1 différait selon la valeur seuil: • Bonne corrélation pour expression de PD-L 1 ≥ 1% (corrélation de 0, 850; p=0, 886) • Corrélation suboptimale pour une expression de PD-L 1 plus élevée (0, 732 pour PD-L 1 ≥ 25%; p=0, 0005; 0, 685 pour PD-L 1 ≥ 50%; p=0, 002) • Conclusion – Le pourcentage global de concordance pour l’expression de PD-L 1 était correct entre 22 C 3 et 28 -9, mais la concordance était suboptimale pour des seuils de 25% et 50% Saito T et al, J Thorac Oncol 2017; 12(suppl): Abstr MA 05. 06

MA 06. 08: Patients avec cancer bronchique et mutations germinales: une étude rétrospective – Shukuya T, et al • Objectif – Etudier la fréquence et les caractéristiques des cancers bronchiques chez les patients avec mutations germinales • Méthodes – Etude rétrospective et revue des échantillons de 3 869 patients avec cancer bronchique et diagnostiqués par NGS • Résultats – Sept patients avec mutations germinales ont été identifiés – Trois avaient des mutations germinales BRCA 2, deux avaient des mutations germinales TP 53 (dont un avait aussi une mutation PARK 2), un avait une mutation BRCA 1, et un avait une mutation EGFR – Trois patients ont reçu des thérapies ciblées apportant une réponse partielle (n=2) ou une stabilisation (n=1) • Conclusion – L’identification des patients avec mutations germinales par NGS et biopsies liquides offre un potentiel pour les nouvelles thérapies ciblées Shukuya T et al, J Thorac Oncol 2017; 12(suppl): Abstr MA 06. 08

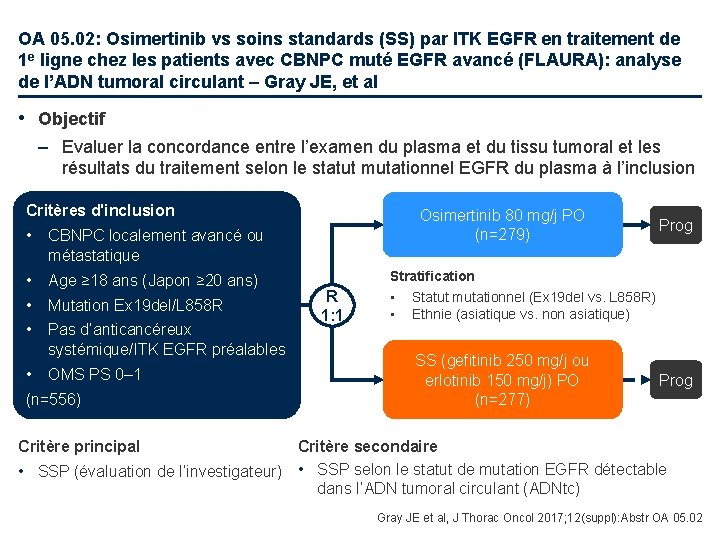
OA 05. 02: Osimertinib vs soins standards (SS) par ITK EGFR en traitement de 1 e ligne chez les patients avec CBNPC muté EGFR avancé (FLAURA): analyse de l’ADN tumoral circulant – Gray JE, et al • Objectif – Evaluer la concordance entre l’examen du plasma et du tissu tumoral et les résultats du traitement selon le statut mutationnel EGFR du plasma à l’inclusion Critères d'inclusion • CBNPC localement avancé ou métastatique • Age ≥ 18 ans (Japon ≥ 20 ans) • Mutation Ex 19 del/L 858 R • Pas d’anticancéreux systémique/ITK EGFR préalables • OMS PS 0– 1 (n=556) Osimertinib 80 mg/j PO (n=279) R 1: 1 Prog Stratification • Statut mutationnel (Ex 19 del vs. L 858 R) • Ethnie (asiatique vs. non asiatique) SS (gefitinib 250 mg/j ou erlotinib 150 mg/j) PO (n=277) Prog Critère principal Critère secondaire • SSP (évaluation de l’investigateur) • SSP selon le statut de mutation EGFR détectable dans l’ADN tumoral circulant (ADNtc) Gray JE et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 05. 02

OA 05. 02: Osimertinib vs soins standards (SS) par ITK EGFR en traitement de 1 e ligne chez les patients avec CBNPC muté EGFR avancé (FLAURA): analyse de l’ADN tumoral circulant – Gray JE, et al • Résultats % de concordance du test plasmatique cobas® avec l’examen tissulaire, % (IC 95%) Ex 19 del positif tissulaire L 858 R positif tissulaire % concordance positive (sensibilité) 79 (74 - 84) 68 (61 - 75) % concordance négative (spécificité) 99 (96 - 100) 99 (97 - 100) Concordance globale 87 (84 - 90) 88 (85 - 91) • Conclusions – Les données de concordance étaient cohérentes avec AURA 3 • Une concordance élevée a été observée entre l’examen du tissu et du plasma pour les mutations EGFR dans la population de l’étude FLAURA – Une amélioration significative de la SSP par rapport aux SS a été notée dans la population FAS (tous les patients étaient EGFRm + au niveau tissulaire) • Dans le sous-groupe EGFRm positif pour l’ADNtc plasmatique, il y avait aussi une amélioration significative de la SSP sous osimertinib par rapport aux SS – Ces données sont en faveur de l’analyse du statut mutationnel EGFR dans l’ADNtc pour sélectionner les patients éligibles à l’osimertinib en 1 e ligne Gray JE et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 05. 02

MA 11. 02: ADN tumoral circulant dans le CBNPC au stade précoce: analyse de haute sensibilité dans les formes à faible volume tumoral, données actualisées de l’étude LUCID – Ruiz-Valdepenas A, et al • Objectif – Réaliser une analyse de haute sensibilité de l’ADNtc de patients avec CBNPC au stade précoce • Méthodes – Des échantillons de plasma ont été collectés chez des patients avec CBNPC au stade précoce inclus dans l’étude LUCID (LUng cancer - CIrculating tumour DNA) – L’analyse de multiple mutations en parallèle permet la détection de taux très faibles d’ADNtc • Résultats – Les données préliminaires montrent un nombre médian de 306 mutations dans l’exome tumoral de 19 patients – Au cours d’une prochaine étape, le TAilored Panel Sequencing (TAPAS) sera utilisé pour séquencer des échantillons de plasma avec un panel spécifique, sur mesure pour le patient • Conclusions – Ces techniques vont améliorer la détection des cancers au stade précoce en détectant de faibles taux d’ATNtc, plus précocement que ce qui était possible antérieurement – Ceci pourrait aussi être utile pour identifier la présence d’une maladie résiduelle minimale après traitement radical Ruiz-Valdepenas A et al, J Thorac Oncol 2017; 12(suppl): Abstr MA 11. 02

OA 07. 03 a: Impact de la charge mutationnelle tumorale sur l’efficacité du nivolumab ou nivolumab + ipilimumab dans le cancer bronchique à petites cellules: une analyse exploratoire de Check. Mate 032 – Antonio S, et al • Objectif – Déterminer si une charge mutationnelle tumorale (CMT) élevée est associée à un bénéfice plus important du traitement par nivolumab avec ou sans ipilimumab chez les patients avec CBPC dans l’étude Check. Mate 032 • Méthodes – Les patients de l’étude Check. Mate 032 avec des échantillons de tumeur et de sang et une CMT évaluable ont été inclus (133 du bras nivolumab et 78 du bras nivolumab + ipilimumab) – Le séquençage total de l’exome a été utilisé pour déterminer la CMT, qui a été calculée comme le nombre total de mutations faux-sens dans la tumeur – Les patients ont été classés selon 3 tertiles de CMT basés sur le nombre total de mutations faux-sens : faible 0 à <143; moyenne 143 à 247; et élevée ≥ 248 Antonio S et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 07. 03 a

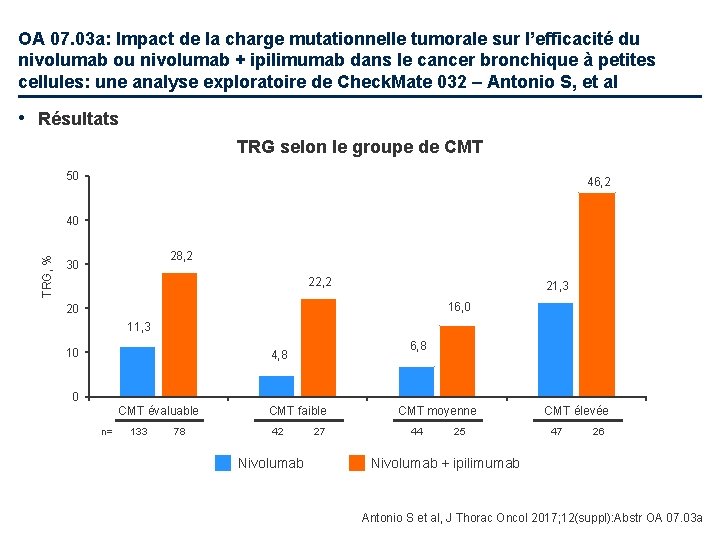
OA 07. 03 a: Impact de la charge mutationnelle tumorale sur l’efficacité du nivolumab ou nivolumab + ipilimumab dans le cancer bronchique à petites cellules: une analyse exploratoire de Check. Mate 032 – Antonio S, et al • Résultats TRG selon le groupe de CMT 50 46, 2 TRG, % 40 28, 2 30 22, 2 21, 3 16, 0 20 11, 3 10 6, 8 4, 8 0 CMT évaluable n= 133 78 CMT faible 42 Nivolumab 27 CMT moyenne 44 25 CMT élevée 47 26 Nivolumab + ipilimumab Antonio S et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 07. 03 a

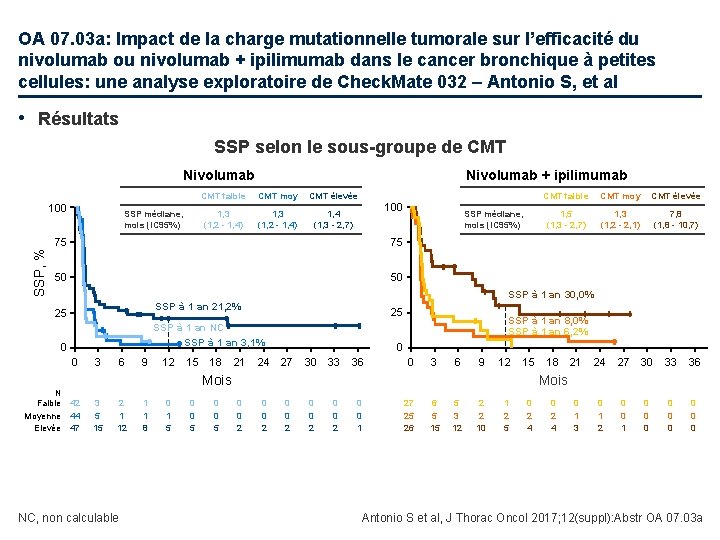
OA 07. 03 a: Impact de la charge mutationnelle tumorale sur l’efficacité du nivolumab ou nivolumab + ipilimumab dans le cancer bronchique à petites cellules: une analyse exploratoire de Check. Mate 032 – Antonio S, et al • Résultats SSP selon le sous-groupe de CMT Nivolumab SSP, % 100 SSP médiane, mois (IC 95%) Nivolumab + ipilimumab CMT faible CMT moy CMT élevée 1, 3 (1, 2 - 1, 4) 1, 4 (1, 3 - 2, 7) 100 75 75 50 50 25 SSP à 1 an NC SSP à 1 an 3, 1% 0 0 N Faible 42 Moyenne 44 Elevée 47 3 6 9 12 15 18 21 2 1 12 NC, non calculable 1 1 8 0 1 5 0 0 5 CMT élevée 1, 5 (1, 3 - 2, 7) 1, 3 (1, 2 - 2, 1) 7, 8 (1, 8 - 10, 7) 24 SSP à 1 an 8, 0% SSP à 1 an 6, 2% 0 27 30 33 36 0 3 6 9 12 15 18 21 24 27 30 33 36 0 1 3 0 1 2 0 0 1 0 0 0 0 0 Mois 3 5 15 CMT moy SSP à 1 an 30, 0% SSP à 1 an 21, 2% 25 SSP médiane, mois (IC 95%) CMT faible 0 0 2 0 0 2 0 0 1 27 25 26 6 5 15 5 3 12 2 2 10 1 2 5 0 2 4 Antonio S et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 07. 03 a

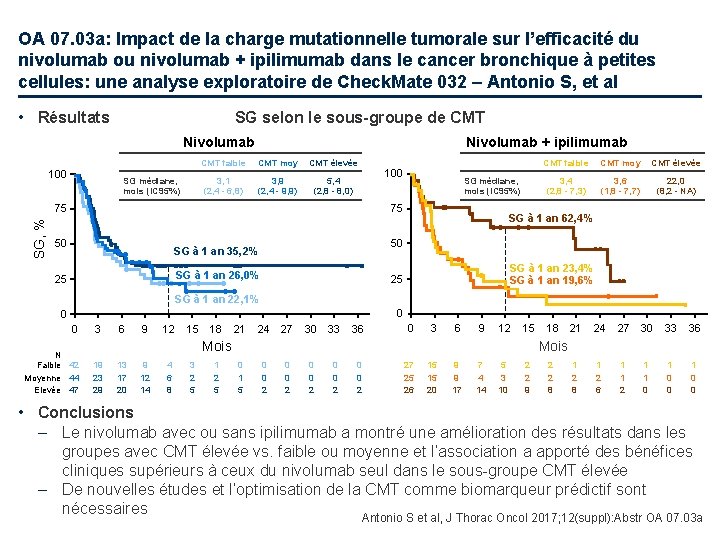
OA 07. 03 a: Impact de la charge mutationnelle tumorale sur l’efficacité du nivolumab ou nivolumab + ipilimumab dans le cancer bronchique à petites cellules: une analyse exploratoire de Check. Mate 032 – Antonio S, et al • Résultats SG selon le sous-groupe de CMT Nivolumab 100 SG médiane, mois (IC 95%) Nivolumab + ipilimumab CMT faible CMT moy CMT élevée 3, 1 (2, 4 - 6, 8) 3, 9 (2, 4 - 9, 9) 5, 4 (2, 8 - 8, 0) SG médiane, mois (IC 95%) 75 75 SG, % 100 50 CMT moy CMT élevée 3, 4 (2, 8 - 7, 3) 3, 6 (1, 8 - 7, 7) 22, 0 (8, 2 - NA) SG à 1 an 62, 4% 50 SG à 1 an 35, 2% SG à 1 an 26, 0% 25 CMT faible SG à 1 an 23, 4% SG à 1 an 19, 6% 25 SG à 1 an 22, 1% 0 0 0 N Faible 42 Moyenne 44 Elevée 47 3 6 9 12 15 18 21 24 27 30 33 36 0 3 6 9 12 15 13 17 20 9 12 14 4 6 8 3 2 5 1 2 5 21 24 27 30 33 36 1 2 8 1 2 6 1 1 2 1 1 0 0 Mois 19 23 29 18 0 1 5 0 0 2 0 0 2 27 25 26 15 15 20 9 9 17 7 4 14 5 3 10 2 2 9 2 2 8 • Conclusions – Le nivolumab avec ou sans ipilimumab a montré une amélioration des résultats dans les groupes avec CMT élevée vs. faible ou moyenne et l’association a apporté des bénéfices cliniques supérieurs à ceux du nivolumab seul dans le sous-groupe CMT élevée – De nouvelles études et l’optimisation de la CMT comme biomarqueur prédictif sont nécessaires Antonio S et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 07. 03 a

OA 09. 01: Caractérisation du paysage génomique de EGFR C 797 S dans le cancer bronchique par séquençage de nouvelle génération de l’ADN tumoral circulant – Piotrowska Z, et al • Objectif – Etudier la fréquence relative de la configuration allélique (cis vs. trans) de C 797 S pour T 790 M dans des échantillons cliniques • Méthodes – Des patients avec adénocarcinome bronchique et mutation EGFR C 797 S ont été sélectionnés de la base de données Guardant Health (n=61, échantillons=141) – Tous les patients ont eu un examen complet de l’ADNtc par séquençage de nouvelle génération (NGS) Guardant 360 – La configuration cis/trans pour T 790 M et C 797 S a été déterminée en utilisant le logiciel Integrated Genomics Viewer Piotrowska Z et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 09. 01

OA 09. 01: Caractérisation du paysage génomique de EGFR C 797 S dans le cancer bronchique par séquençage de nouvelle génération de l’ADN tumoral circulant – Piotrowska Z, et al • Résultats – C 797 S/T 790 M est apparu avec une configuration cis dans 50/61 (82%) des échantillons et trans dans 6/61 (10%) – Les mutations C 797 S peuvent être polyclonales; globalement, 26/61 (42, 6%) patients avaient ≥ 1 C 797 clone détecté – Au moment de l’émergence de EGFR C 797 S, 47/61 (77%) patients recevaient de l’osimertinib – Un mécanisme de résistance séparé est apparu de façon concomitante chez la majorité des patients avec mutations C 797 S, incluant amplification de EGFR chez 48% des patients et amplification de MET chez 16% • Conclusions – C 797 S survient le plus souvent avec T 790 M en configuration cis, ce qui est associé à la résistance à tous les ITK EGFR actuellement disponibles – La configuration trans, qui pourrait répondre à l’association d’ITK EGFR de 1 e et 3 e génération, est beaucoup moins courante – C 797 S coexiste avec d’autres mécanismes de résistance dans l’ADNtc, soulignant l’hétérogénéité des tumeurs résistantes Piotrowska Z et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 09. 01

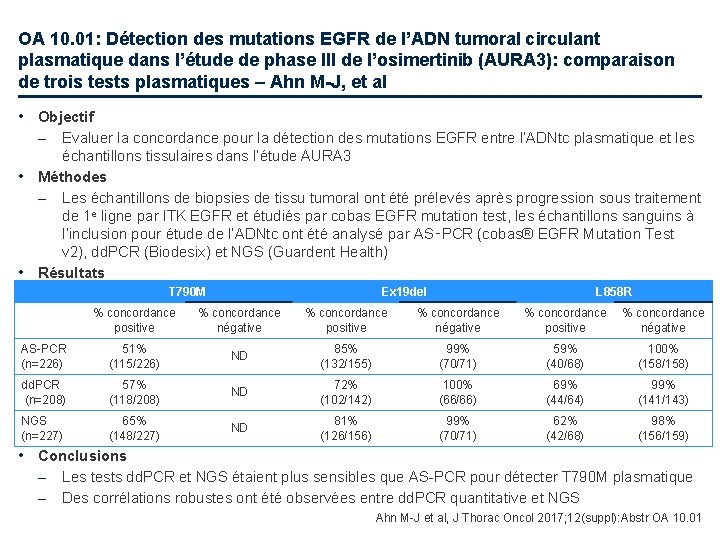
OA 10. 01: Détection des mutations EGFR de l’ADN tumoral circulant plasmatique dans l’étude de phase III de l’osimertinib (AURA 3): comparaison de trois tests plasmatiques – Ahn M-J, et al • Objectif – Evaluer la concordance pour la détection des mutations EGFR entre l’ADNtc plasmatique et les échantillons tissulaires dans l’étude AURA 3 • Méthodes – Les échantillons de biopsies de tissu tumoral ont été prélevés après progression sous traitement de 1 e ligne par ITK EGFR et étudiés par cobas EGFR mutation test, les échantillons sanguins à l’inclusion pour étude de l’ADNtc ont été analysé par AS‑PCR (cobas® EGFR Mutation Test v 2), dd. PCR (Biodesix) et NGS (Guardent Health) • Résultats T 790 M Ex 19 del L 858 R % concordance positive % concordance négative AS-PCR (n=226) 51% (115/226) ND 85% (132/155) 99% (70/71) 59% (40/68) 100% (158/158) dd. PCR (n=208) 57% (118/208) ND 72% (102/142) 100% (66/66) 69% (44/64) 99% (141/143) NGS (n=227) 65% (148/227) ND 81% (126/156) 99% (70/71) 62% (42/68) 98% (156/159) • Conclusions – – Les tests dd. PCR et NGS étaient plus sensibles que AS-PCR pour détecter T 790 M plasmatique Des corrélations robustes ont été observées entre dd. PCR quantitative et NGS Ahn M-J et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 10. 01

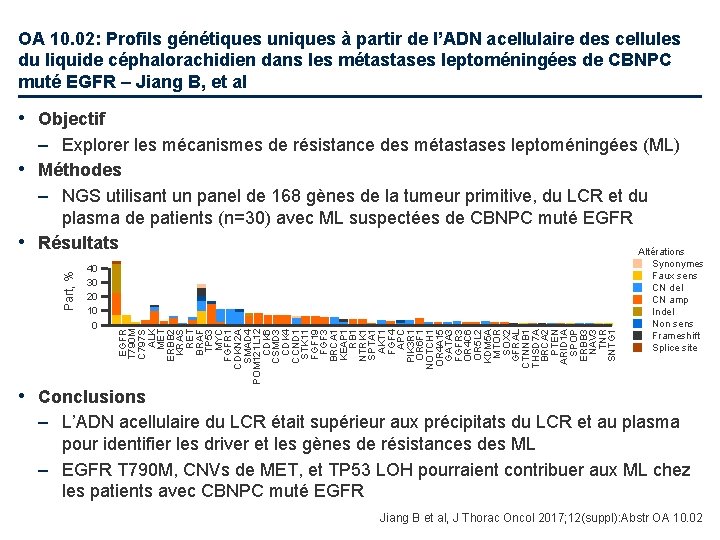
OA 10. 02: Profils génétiques uniques à partir de l’ADN acellulaire des cellules du liquide céphalorachidien dans les métastases leptoméningées de CBNPC muté EGFR – Jiang B, et al • Objectif 40 30 20 10 0 EGFR T 790 M C 797 S ALK MET ERBB 2 KRAS RET BRAF TP 53 MYC FGFR 1 CDKN 2 A SMAD 4 POM 121 L 12 CDK 6 CSMD 3 CDK 4 CCND 1 STK 11 FGF 19 FGF 3 BRCA 1 KEAP 1 RB 1 NTRK 1 SPTA 1 AKT 1 FGF 4 APC PIK 3 R 1 OR 6 F 1 NOTCH 1 OR 4 A 15 GATA 3 FGFR 3 OR 4 C 6 OR 5 L 2 KDM 5 A MTOR SOX 2 GFRAL CTNNB 1 THSD 7 A BRCA 2 PTEN ARID 1 A SPOP ERBB 3 NAV 3 TNR SNTG 1 Part, % – Explorer les mécanismes de résistance des métastases leptoméningées (ML) • Méthodes – NGS utilisant un panel de 168 gènes de la tumeur primitive, du LCR et du plasma de patients (n=30) avec ML suspectées de CBNPC muté EGFR • Résultats Altérations Synonymes Faux sens CN del CN amp Indel Non sens Frameshift Splice site • Conclusions – L’ADN acellulaire du LCR était supérieur aux précipitats du LCR et au plasma pour identifier les driver et les gènes de résistances des ML – EGFR T 790 M, CNVs de MET, et TP 53 LOH pourraient contribuer aux ML chez les patients avec CBNPC muté EGFR Jiang B et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 10. 02

OA 10. 05: Profil moléculaire obtenu de façon non invasive dans le CBNPC par séquençage d’exome total et ciblé de l’ADN acellulaire (ADNa) plasmatique – Cheng ML, et al • Objectif – Développer une stratégie d’analyse pour permettre la sélection efficace d’échantillons tumoraux pour le séquençage ciblé et total de l’exome à partir de l’ADNa • Méthodes – Des échantillons de plasma ont été collectés chez des patients avec CBNPC (n=20) qui avaient reçu un traitement par chimiothérapie, thérapie ciblée ou immunothérapie • La majorité des patients (>70%) avaient une maladie stade III ou IV – L’ADNa a été extrait du plasma et une analyse a été réalisée en utilisant lowpass shallow whole genome sequencing (s. WGS) et MSK-IMPACT (ciblant plus de 400 gènes liés au cancer) – L’analyse d’échantillons appariés normaux a été réalisée pour les variants somatiques Cheng ML et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 10. 05

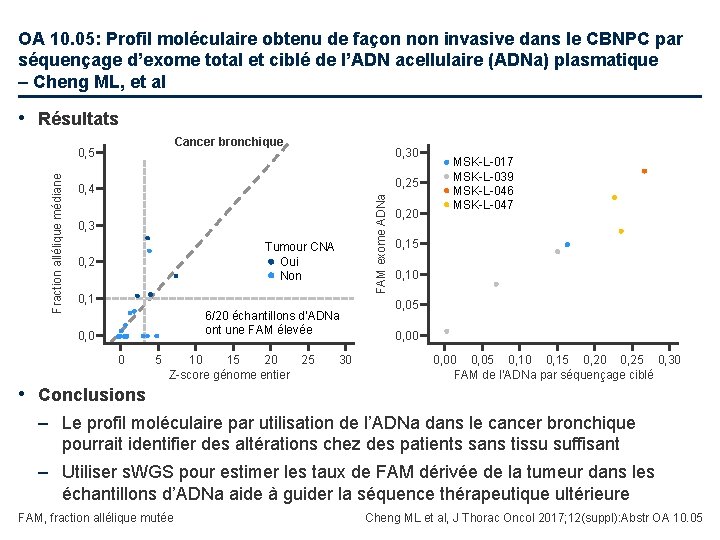
OA 10. 05: Profil moléculaire obtenu de façon non invasive dans le CBNPC par séquençage d’exome total et ciblé de l’ADN acellulaire (ADNa) plasmatique – Cheng ML, et al • Résultats Cancer bronchique 0, 30 0, 25 0, 4 FAM exome ADNa Fraction allélique médiane 0, 5 0, 3 Tumour CNA Oui Non 0, 2 0, 1 6/20 échantillons d’ADNa ont une FAM élevée 0, 0 0 5 10 15 20 25 Z-score génome entier 30 0, 20 MSK-L-017 MSK-L-039 MSK-L-046 MSK-L-047 0, 15 0, 10 0, 05 0, 00 0, 05 0, 10 0, 15 0, 20 0, 25 0, 30 FAM de l’ADNa par séquençage ciblé • Conclusions – Le profil moléculaire par utilisation de l’ADNa dans le cancer bronchique pourrait identifier des altérations chez des patients sans tissu suffisant – Utiliser s. WGS pour estimer les taux de FAM dérivée de la tumeur dans les échantillons d’ADNa aide à guider la séquence thérapeutique ultérieure FAM, fraction allélique mutée Cheng ML et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 10. 05

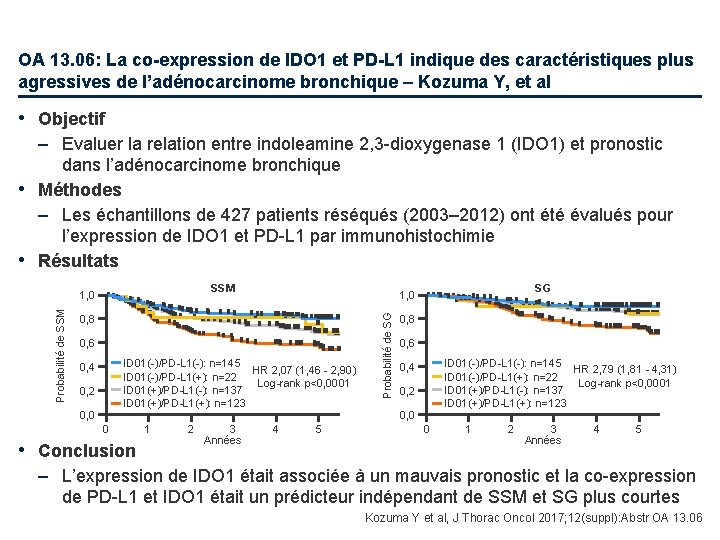
OA 13. 06: La co-expression de IDO 1 et PD-L 1 indique des caractéristiques plus agressives de l’adénocarcinome bronchique – Kozuma Y, et al • Objectif – Evaluer la relation entre indoleamine 2, 3 -dioxygenase 1 (IDO 1) et pronostic dans l’adénocarcinome bronchique • Méthodes – Les échantillons de 427 patients réséqués (2003– 2012) ont été évalués pour l’expression de IDO 1 et PD-L 1 par immunohistochimie • Résultats SSM 0, 8 0, 6 ID 01(-)/PD-L 1(-): n=145 HR 2, 07 (1, 46 - 2, 90) ID 01(-)/PD-L 1(+): n=22 Log-rank p<0, 0001 ID 01(+)/PD-L 1(-): n=137 ID 01(+)/PD-L 1(+): n=123 0, 4 0, 2 0, 0 0 • Conclusion 1 2 3 Années SG 1, 0 4 5 Probabilité de SG Probabilité de SSM 1, 0 0, 8 0, 6 ID 01(-)/PD-L 1(-): n=145 HR 2, 79 (1, 81 - 4, 31) ID 01(-)/PD-L 1(+): n=22 Log-rank p<0, 0001 ID 01(+)/PD-L 1(-): n=137 ID 01(+)/PD-L 1(+): n=123 0, 4 0, 2 0, 0 0 1 2 3 Années 4 5 – L’expression de IDO 1 était associée à un mauvais pronostic et la co-expression de PD-L 1 et IDO 1 était un prédicteur indépendant de SSM et SG plus courtes Kozuma Y et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 13. 06

CBNPC précoce et localement avancé Stades I, II et III

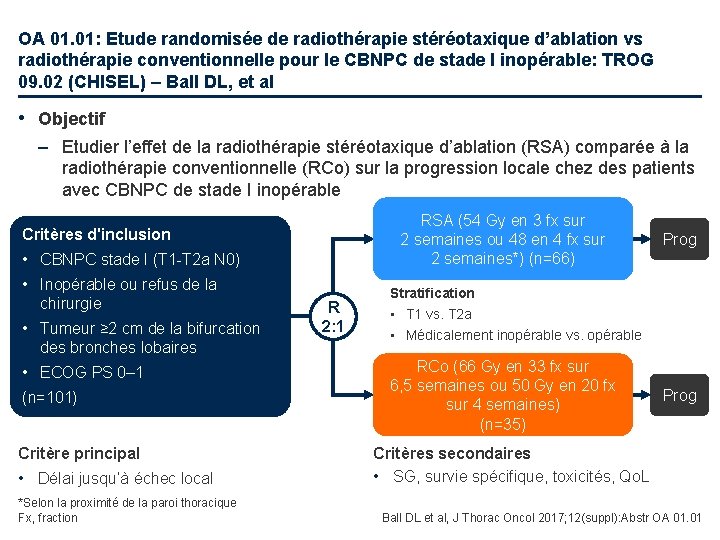
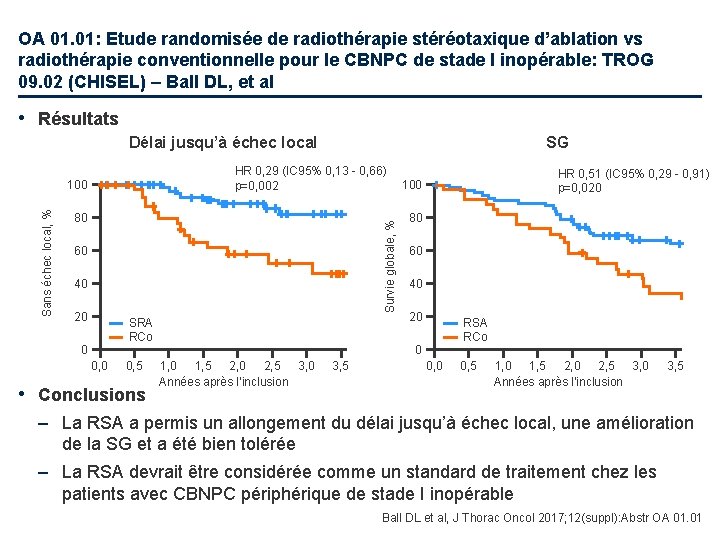
OA 01. 01: Etude randomisée de radiothérapie stéréotaxique d’ablation vs radiothérapie conventionnelle pour le CBNPC de stade I inopérable: TROG 09. 02 (CHISEL) – Ball DL, et al • Objectif – Etudier l’effet de la radiothérapie stéréotaxique d’ablation (RSA) comparée à la radiothérapie conventionnelle (RCo) sur la progression locale chez des patients avec CBNPC de stade I inopérable RSA (54 Gy en 3 fx sur 2 semaines ou 48 en 4 fx sur 2 semaines*) (n=66) Critères d'inclusion • CBNPC stade I (T 1 -T 2 a N 0) • Inopérable ou refus de la chirurgie • Tumeur ≥ 2 cm de la bifurcation des bronches lobaires • ECOG PS 0– 1 (n=101) Critère principal • Délai jusqu’à échec local *Selon la proximité de la paroi thoracique Fx, fraction R 2: 1 Prog Stratification • T 1 vs. T 2 a • Médicalement inopérable vs. opérable RCo (66 Gy en 33 fx sur 6, 5 semaines ou 50 Gy en 20 fx sur 4 semaines) (n=35) Prog Critères secondaires • SG, survie spécifique, toxicités, Qo. L Ball DL et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 01. 01

OA 01. 01: Etude randomisée de radiothérapie stéréotaxique d’ablation vs radiothérapie conventionnelle pour le CBNPC de stade I inopérable: TROG 09. 02 (CHISEL) – Ball DL, et al • Résultats Délai jusqu’à échec local HR 0, 29 (IC 95% 0, 13 - 0, 66) p=0, 002 100 80 Survie globale, % Sans échec local, % SG 60 40 20 SRA RCo 0 0, 5 • Conclusions HR 0, 51 (IC 95% 0, 29 - 0, 91) p=0, 020 100 80 60 40 20 RSA RCo 0 1, 5 2, 0 2, 5 3, 0 Années après l’inclusion 3, 5 0, 0 0, 5 1, 0 1, 5 2, 0 2, 5 3, 0 Années après l’inclusion 3, 5 – La RSA a permis un allongement du délai jusqu’à échec local, une amélioration de la SG et a été bien tolérée – La RSA devrait être considérée comme un standard de traitement chez les patients avec CBNPC périphérique de stade I inopérable Ball DL et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 01. 01

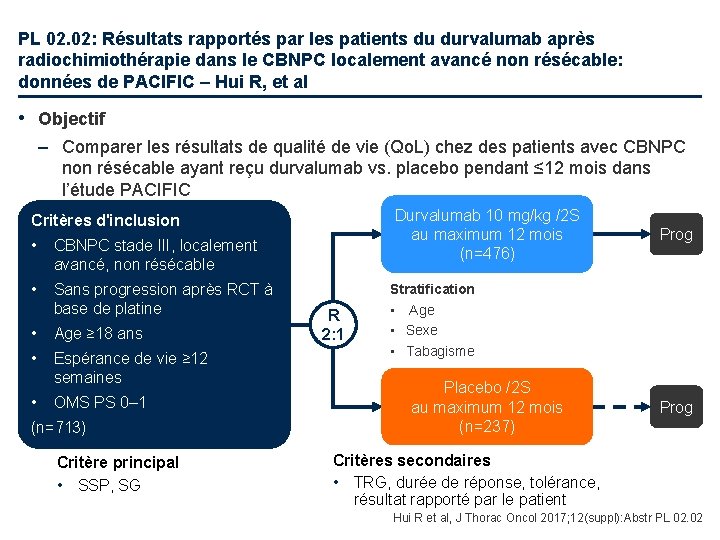
PL 02. 02: Résultats rapportés par les patients du durvalumab après radiochimiothérapie dans le CBNPC localement avancé non résécable: données de PACIFIC – Hui R, et al • Objectif – Comparer les résultats de qualité de vie (Qo. L) chez des patients avec CBNPC non résécable ayant reçu durvalumab vs. placebo pendant ≤ 12 mois dans l’étude PACIFIC Durvalumab 10 mg/kg /2 S au maximum 12 mois (n=476) Critères d'inclusion • CBNPC stade III, localement avancé, non résécable • Sans progression après RCT à base de platine • Age ≥ 18 ans • Espérance de vie ≥ 12 semaines • OMS PS 0– 1 (n=713) Critère principal • SSP, SG R 2: 1 Prog Stratification • Age • Sexe • Tabagisme Placebo /2 S au maximum 12 mois (n=237) Prog Critères secondaires • TRG, durée de réponse, tolérance, résultat rapporté par le patient Hui R et al, J Thorac Oncol 2017; 12(suppl): Abstr PL 02. 02

PL 02. 02: Résultats rapportés par les patients du durvalumab après radiochimiothérapie dans le CBNPC localement avancé non résécable: données de PACIFIC – Hui R, et al • Résultats – Il n’y avait pas de différences notables entre les bras de traitement pour le statut de santé global/Qo. L, les symptômes principaux ou le fonctionnement physique à l’inclusion • Les scores de symptômes sont restés stables tout au long de l’étude dans les deux bras, sans changements significatifs par rapport à l’inclusion – Des améliorations cliniquement pertinentes par rapport à l’inclusion ont été observées pour la dysphagie et l’alopécie à la semaine 48 quel que soit le traitement – L’amélioration de la « perte d’appétit » dans le groupe durvalumab était supérieure à celle du groupe placebo (OR 1, 72; IC 95% 1, 04 - 2, 85) • Conclusions – Le traitement par durvalumab après RCT était associé au maintien du fonctionnement et du statut de santé global/Qo. L chez ces patients avec CBNPC localement avancé, non résécable – Les profils satisfaisants d’efficacité et tolérance du durvalumab, ajoutés aux résultats de Qo. L observés dans l’étude PACIFIC confirment sa valeur clinique dans cette indication Hui R et al, J Thorac Oncol 2017; 12(suppl): Abstr PL 02. 02

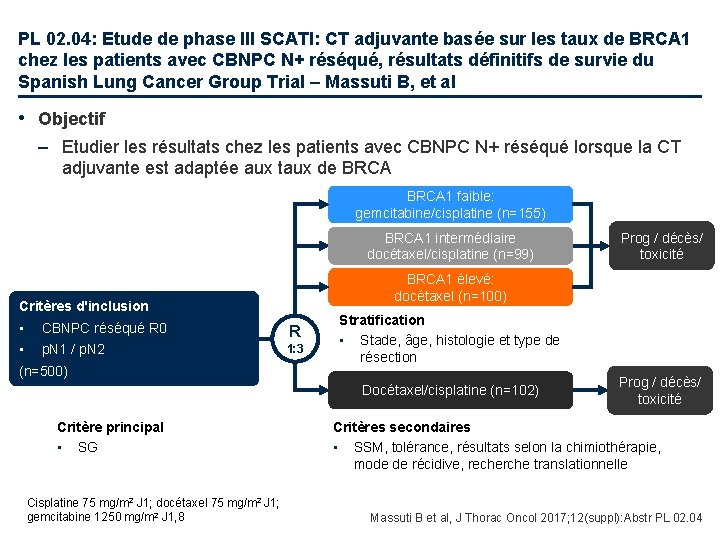
PL 02. 04: Etude de phase III SCATl: CT adjuvante basée sur les taux de BRCA 1 chez les patients avec CBNPC N+ réséqué, résultats définitifs de survie du Spanish Lung Cancer Group Trial – Massuti B, et al • Objectif – Etudier les résultats chez les patients avec CBNPC N+ réséqué lorsque la CT adjuvante est adaptée aux taux de BRCA 1 faible: gemcitabine/cisplatine (n=155) BRCA 1 intermédiaire docétaxel/cisplatine (n=99) BRCA 1 élevé: docétaxel (n=100) Critères d'inclusion • CBNPC réséqué R 0 R • p. N 1 / p. N 2 1: 3 (n=500) Stratification • Stade, âge, histologie et type de résection Docétaxel/cisplatine (n=102) Critère principal • SG Cisplatine 75 mg/m 2 J 1; docétaxel 75 mg/m 2 J 1; gemcitabine 1250 mg/m 2 J 1, 8 Prog / décès/ toxicité Critères secondaires • SSM, tolérance, résultats selon la chimiothérapie, mode de récidive, recherche translationnelle Massuti B et al, J Thorac Oncol 2017; 12(suppl): Abstr PL 02. 04

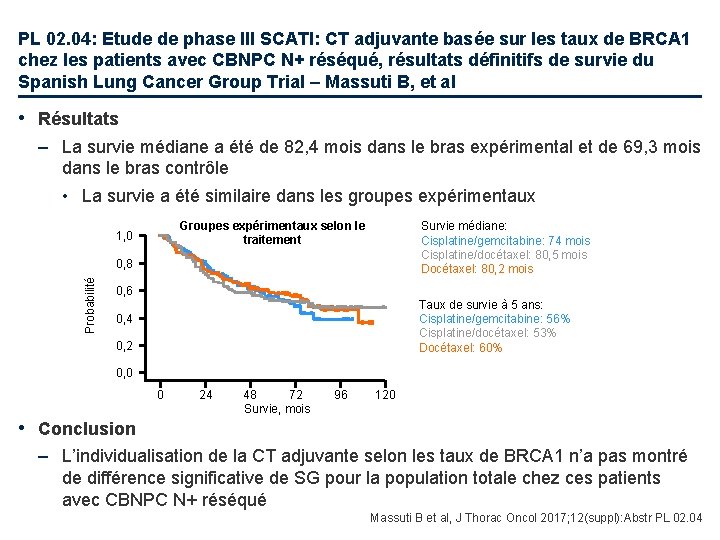
PL 02. 04: Etude de phase III SCATl: CT adjuvante basée sur les taux de BRCA 1 chez les patients avec CBNPC N+ réséqué, résultats définitifs de survie du Spanish Lung Cancer Group Trial – Massuti B, et al • Résultats – La survie médiane a été de 82, 4 mois dans le bras expérimental et de 69, 3 mois dans le bras contrôle • La survie a été similaire dans les groupes expérimentaux Groupes expérimentaux selon le traitement 1, 0 Survie médiane: Cisplatine/gemcitabine: 74 mois Cisplatine/docétaxel: 80, 5 mois Docétaxel: 80, 2 mois Probabilité 0, 8 0, 6 Taux de survie à 5 ans: Cisplatine/gemcitabine: 56% Cisplatine/docétaxel: 53% Docétaxel: 60% 0, 4 0, 2 0, 0 0 24 48 72 Survie, mois 96 120 • Conclusion – L’individualisation de la CT adjuvante selon les taux de BRCA 1 n’a pas montré de différence significative de SG pour la population totale chez ces patients avec CBNPC N+ réséqué Massuti B et al, J Thorac Oncol 2017; 12(suppl): Abstr PL 02. 04

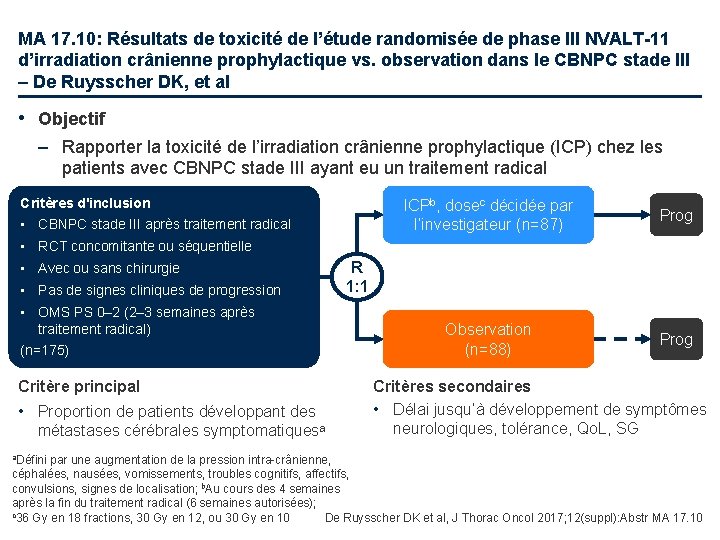
MA 17. 10: Résultats de toxicité de l’étude randomisée de phase III NVALT-11 d’irradiation crânienne prophylactique vs. observation dans le CBNPC stade III – De Ruysscher DK, et al • Objectif – Rapporter la toxicité de l’irradiation crânienne prophylactique (ICP) chez les patients avec CBNPC stade III ayant eu un traitement radical Critères d'inclusion • CBNPC stade III après traitement radical ICPb, dosec décidée par l’investigateur (n=87) Prog Observation (n=88) Prog • RCT concomitante ou séquentielle • Avec ou sans chirurgie • Pas de signes cliniques de progression • OMS PS 0– 2 (2– 3 semaines après traitement radical) (n=175) Critère principal • Proportion de patients développant des métastases cérébrales symptomatiquesa R 1: 1 Critères secondaires • Délai jusqu’à développement de symptômes neurologiques, tolérance, Qo. L, SG a. Défini par une augmentation de la pression intra-crânienne, céphalées, nausées, vomissements, troubles cognitifs, affectifs, convulsions, signes de localisation; b. Au cours des 4 semaines après la fin du traitement radical (6 semaines autorisées); c 36 Gy en 18 fractions, 30 Gy en 12, ou 30 Gy en 10 De Ruysscher DK et al, J Thorac Oncol 2017; 12(suppl): Abstr MA 17. 10

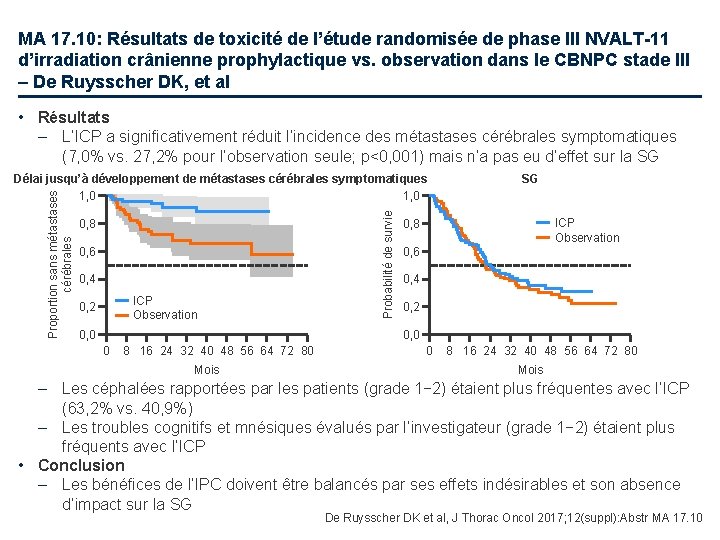
MA 17. 10: Résultats de toxicité de l’étude randomisée de phase III NVALT-11 d’irradiation crânienne prophylactique vs. observation dans le CBNPC stade III – De Ruysscher DK, et al • Résultats – L’ICP a significativement réduit l’incidence des métastases cérébrales symptomatiques (7, 0% vs. 27, 2% pour l’observation seule; p<0, 001) mais n’a pas eu d’effet sur la SG 0, 8 0, 6 0, 4 ICP Observation 0, 2 0, 0 Probabilité de survie Proportion sans métastases cérébrales Délai jusqu’à développement de métastases cérébrales symptomatiques 1, 0 SG ICP Observation 0, 8 0, 6 0, 4 0, 2 0, 0 0 8 16 24 32 40 48 56 64 72 80 Mois – Les céphalées rapportées par les patients (grade 1− 2) étaient plus fréquentes avec l’ICP (63, 2% vs. 40, 9%) – Les troubles cognitifs et mnésiques évalués par l’investigateur (grade 1− 2) étaient plus fréquents avec l’ICP • Conclusion – Les bénéfices de l’IPC doivent être balancés par ses effets indésirables et son absence d’impact sur la SG De Ruysscher DK et al, J Thorac Oncol 2017; 12(suppl): Abstr MA 17. 10

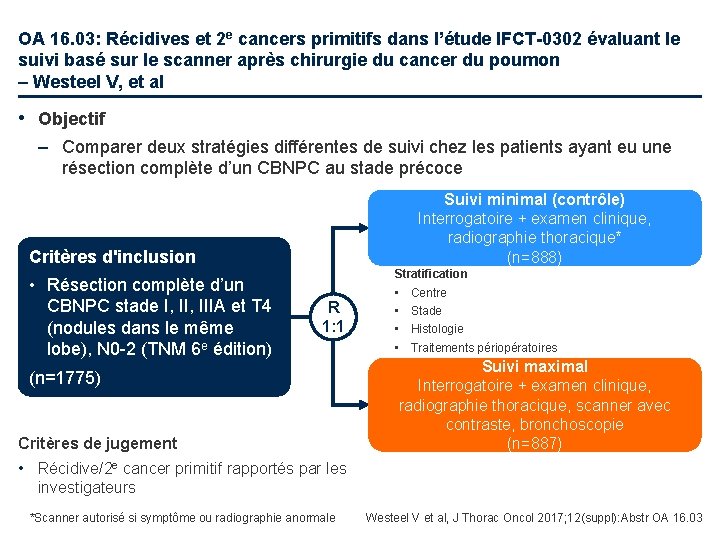
OA 16. 03: Récidives et 2 e cancers primitifs dans l’étude IFCT-0302 évaluant le suivi basé sur le scanner après chirurgie du cancer du poumon – Westeel V, et al • Objectif – Comparer deux stratégies différentes de suivi chez les patients ayant eu une résection complète d’un CBNPC au stade précoce Suivi minimal (contrôle) Interrogatoire + examen clinique, radiographie thoracique* (n=888) Critères d'inclusion • Résection complète d’un CBNPC stade I, IIIA et T 4 (nodules dans le même lobe), N 0 -2 (TNM 6 e édition) Stratification R 1: 1 (n=1775) Critères de jugement • • Centre Stade Histologie Traitements périopératoires Suivi maximal Interrogatoire + examen clinique, radiographie thoracique, scanner avec contraste, bronchoscopie (n=887) • Récidive/2 e cancer primitif rapportés par les investigateurs *Scanner autorisé si symptôme ou radiographie anormale Westeel V et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 16. 03

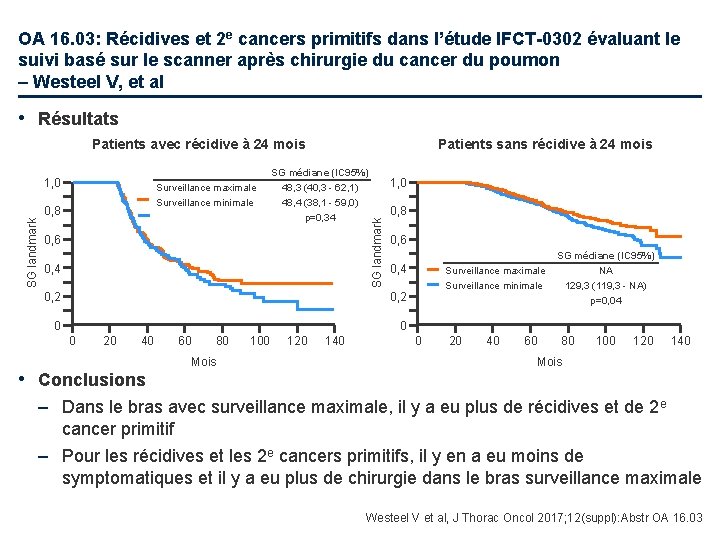
OA 16. 03: Récidives et 2 e cancers primitifs dans l’étude IFCT-0302 évaluant le suivi basé sur le scanner après chirurgie du cancer du poumon – Westeel V, et al • Résultats Patients avec récidive à 24 mois Surveillance maximale Surveillance minimale SG landmark 0, 8 SG médiane (IC 95%) 48, 3 (40, 3 - 62, 1) 48, 4 (38, 1 - 59, 0) p=0, 34 0, 6 0, 4 1, 0 0, 8 SG landmark 1, 0 Patients sans récidive à 24 mois 0, 6 0, 4 0, 2 0 0 0 20 40 • Conclusions 60 80 Mois 100 120 140 Surveillance maximale Surveillance minimale 0 20 40 60 SG médiane (IC 95%) NA 129, 3 (119, 3 - NA) p=0, 04 80 100 120 140 Mois – Dans le bras avec surveillance maximale, il y a eu plus de récidives et de 2 e cancer primitif – Pour les récidives et les 2 e cancers primitifs, il y en a eu moins de symptomatiques et il y a eu plus de chirurgie dans le bras surveillance maximale Westeel V et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 16. 03

OA 16. 04: Efficacité et tolérance de l’erlotinib vs vinorelbine/cisplatine en traitement adjuvant pour le CBNPC stade IIIA muté EGFR – Yue D, et al • Objectif – Evaluer l’efficacité et la tolérance en adjuvant de l’erlotinib vs. vinorelbine + cisplatine chez des patients naïfs de traitement avec CBNPC stade IIIA muté EGFR totalement réséqué • Méthodes – Essai randomisé contrôlé sur 102 patients ayant reçu erlotinib 150 mg/j pendant 2 ans (n=51) ou vinorelbine 25 mg/m 2 J 1, 8 + cisplatine 75 mg/m 2 J 1, 21 pour 4 cycles (n=51) – Le critère principal était le taux de SSM à 2 ans; les critères secondaires étaient SSM, SG, tolérance, Qo. L et biomarqueurs • Résultats – Dans le groupe erlotinib, le taux de SSM à 2 ans était significativement plus élevé (81, 35%) que sous CT (44, 62%; p<0, 001) et la SSM médiane était plus longue (42, 41 mois) que sous CT (20, 96 mois; p<0, 001) – L’erlotinib a montré un profil de tolérance plus favorable que la CT • Conclusions – Chez ces patients avec CBNPC stade IIIA muté EGFR réséqué R 0, l’erlotinib a démontré une activité intéressante – Un suivi plus long dans ce contexte curatif est nécessaire et le rôle de la chimiothérapie dans cette situation devra être défini Yue D et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 16. 04

CBNPC avancé Non éligible au traitement radical, stades III et IV Première ligne

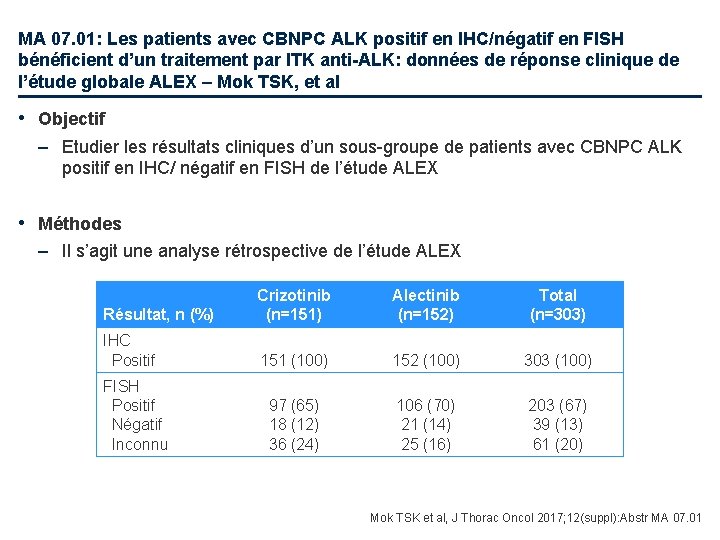
MA 07. 01: Les patients avec CBNPC ALK positif en IHC/négatif en FISH bénéficient d’un traitement par ITK anti-ALK: données de réponse clinique de l’étude globale ALEX – Mok TSK, et al • Objectif – Etudier les résultats cliniques d’un sous-groupe de patients avec CBNPC ALK positif en IHC/ négatif en FISH de l’étude ALEX • Méthodes – Il s’agit une analyse rétrospective de l’étude ALEX Résultat, n (%) Crizotinib (n=151) Alectinib (n=152) Total (n=303) IHC Positif 151 (100) 152 (100) 303 (100) 97 (65) 18 (12) 36 (24) 106 (70) 21 (14) 25 (16) 203 (67) 39 (13) 61 (20) FISH Positif Négatif Inconnu Mok TSK et al, J Thorac Oncol 2017; 12(suppl): Abstr MA 07. 01

MA 07. 01: Les patients avec CBNPC ALK positif en IHC/négatif en FISH bénéficient d’un traitement par ITK anti-ALK: données de réponse clinique de l’étude globale ALEX – Mok TSK, et al • Résultats ALK IHC + / FISH + Crizotinib (n=97) SSP médiane, mois (IC 95%) HR (IC 95%) p Répondeurs, % (IC 95%) 12, 7 (9, 2 - 14, 9) Alectinib (n=106) NA 0, 40 (0, 27 - 0, 61) p<0, 0001 81 (72 - 89) 91 (83 - 95) ALK IHC + / FISH Crizotinib (n=18) Alectinib (n=21) 7, 4 (2, 7 - NA) 3, 8 (1, 9 - NA) 1, 45 (0, 59 - 3, 53) p=0, 41 44 (22 - 69) 29 (11 - 52) – Un statut FISH inconnu a été attribué à 36 patients sous crizotinib et 25 patients sous alectinib, 75% et 96% respectivement ont été répondeurs • Conclusions – La survie et les réponses pour les patients avec CBNPC ALK IHC +/FISH + étaient similaires aux résultats de l’analyse principale – La plupart des patients avec CBNPC ALK IHC + / FISH – tiraient aussi un bénéfice clinique des inhibiteurs de ALK mais dans une moindre mesure, ceci devant être interprété avec prudence en raison du faible nombre de patient – Le bénéfice clinique dans le groupe ALK IHC + / FISH inconnu était similaire à celui de la population ITT Mok TSK et al, J Thorac Oncol 2017; 12(suppl): Abstr MA 07. 01

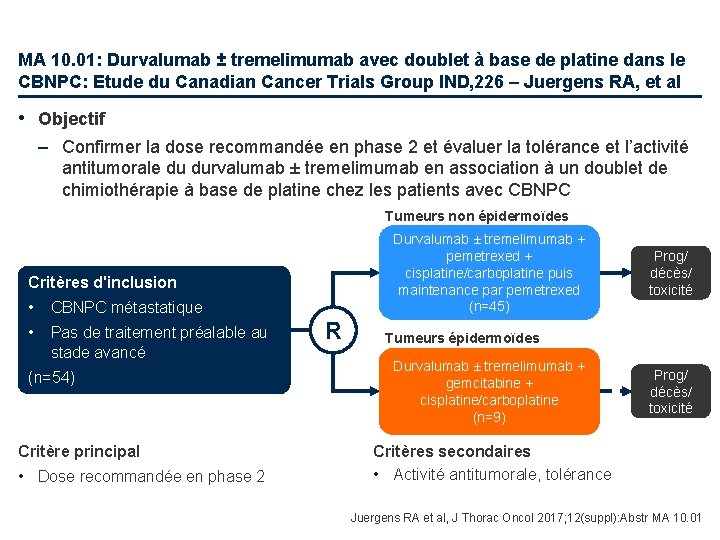
MA 10. 01: Durvalumab ± tremelimumab avec doublet à base de platine dans le CBNPC: Etude du Canadian Cancer Trials Group IND, 226 – Juergens RA, et al • Objectif – Confirmer la dose recommandée en phase 2 et évaluer la tolérance et l’activité antitumorale du durvalumab ± tremelimumab en association à un doublet de chimiothérapie à base de platine chez les patients avec CBNPC Tumeurs non épidermoïdes Durvalumab ± tremelimumab + pemetrexed + cisplatine/carboplatine puis maintenance par pemetrexed (n=45) Critères d'inclusion • CBNPC métastatique • Pas de traitement préalable au stade avancé (n=54) Critère principal • Dose recommandée en phase 2 R Prog/ décès/ toxicité Tumeurs épidermoïdes Durvalumab ± tremelimumab + gemcitabine + cisplatine/carboplatine (n=9) Prog/ décès/ toxicité Critères secondaires • Activité antitumorale, tolérance Juergens RA et al, J Thorac Oncol 2017; 12(suppl): Abstr MA 10. 01

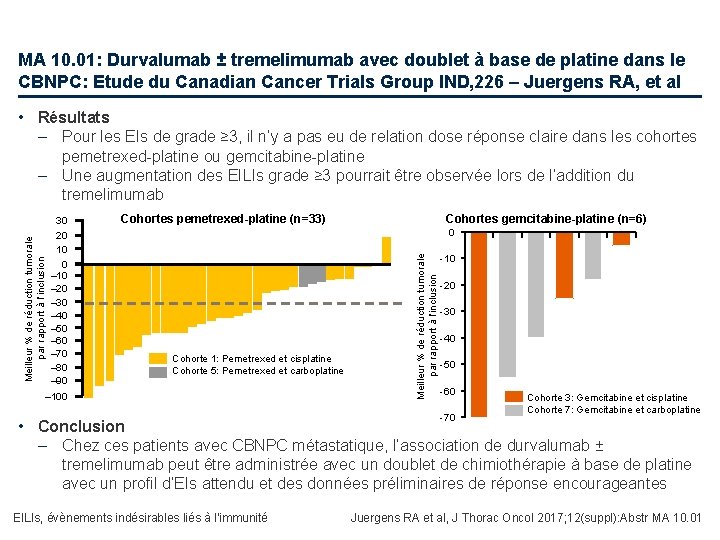
MA 10. 01: Durvalumab ± tremelimumab avec doublet à base de platine dans le CBNPC: Etude du Canadian Cancer Trials Group IND, 226 – Juergens RA, et al • Résultats 30 20 10 0 – 10 – 20 – 30 – 40 – 50 – 60 – 70 – 80 – 90 Cohortes pemetrexed-platine (n=33) Cohortes gemcitabine-platine (n=6) 0 Cohorte 1: Pemetrexed et cisplatine Cohorte 5: Pemetrexed et carboplatine – 100 • Conclusion Meilleur % de réduction tumorale par rapport à l’inclusion – Pour les EIs de grade ≥ 3, il n’y a pas eu de relation dose réponse claire dans les cohortes pemetrexed-platine ou gemcitabine-platine – Une augmentation des EILIs grade ≥ 3 pourrait être observée lors de l’addition du tremelimumab -10 -20 -30 -40 -50 -60 -70 Cohorte 3: Gemcitabine et cisplatine Cohorte 7: Gemcitabine et carboplatine – Chez ces patients avec CBNPC métastatique, l’association de durvalumab ± tremelimumab peut être administrée avec un doublet de chimiothérapie à base de platine avec un profil d’EIs attendu et des données préliminaires de réponse encourageantes EILIs, évènements indésirables liés à l’immunité Juergens RA et al, J Thorac Oncol 2017; 12(suppl): Abstr MA 10. 01

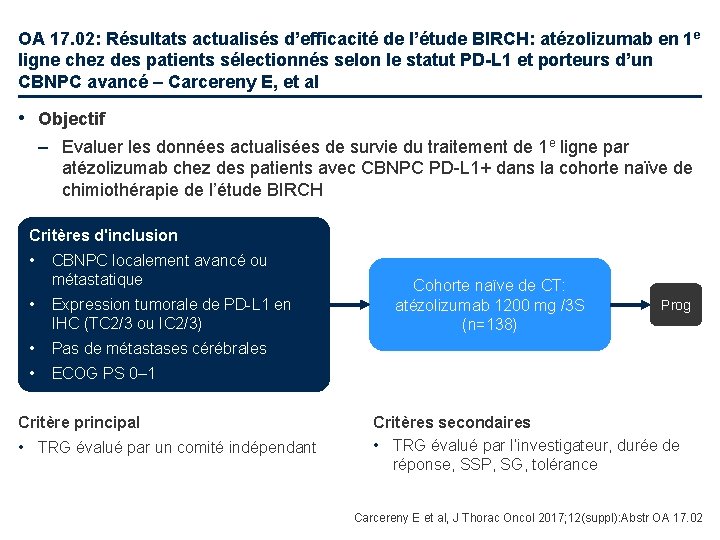
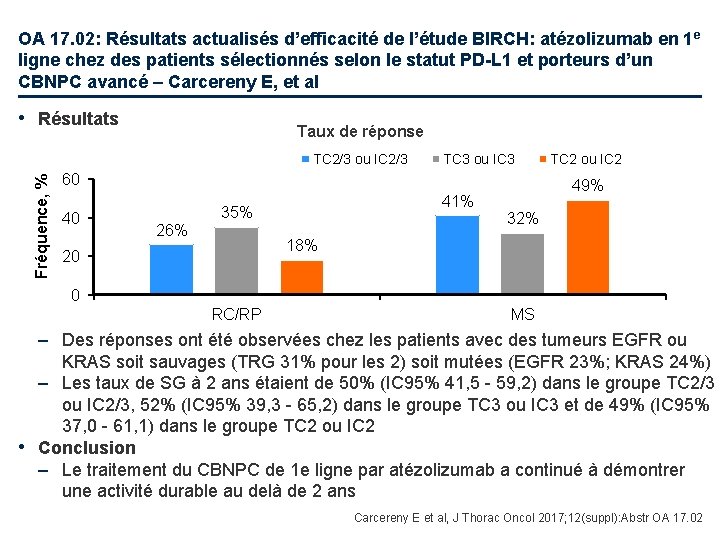
OA 17. 02: Résultats actualisés d’efficacité de l’étude BIRCH: atézolizumab en 1 e ligne chez des patients sélectionnés selon le statut PD-L 1 et porteurs d’un CBNPC avancé – Carcereny E, et al • Objectif – Evaluer les données actualisées de survie du traitement de 1 e ligne par atézolizumab chez des patients avec CBNPC PD-L 1+ dans la cohorte naïve de chimiothérapie de l’étude BIRCH Critères d'inclusion • CBNPC localement avancé ou métastatique • Expression tumorale de PD-L 1 en IHC (TC 2/3 ou IC 2/3) • Pas de métastases cérébrales • ECOG PS 0– 1 Critère principal • TRG évalué par un comité indépendant Cohorte naïve de CT: atézolizumab 1200 mg /3 S (n=138) Prog Critères secondaires • TRG évalué par l’investigateur, durée de réponse, SSP, SG, tolérance Carcereny E et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 17. 02

OA 17. 02: Résultats actualisés d’efficacité de l’étude BIRCH: atézolizumab en 1 e ligne chez des patients sélectionnés selon le statut PD-L 1 et porteurs d’un CBNPC avancé – Carcereny E, et al • Résultats Taux de réponse Fréquence, % TC 2/3 ou IC 2/3 TC 3 ou IC 3 60 40 26% 41% 35% TC 2 ou IC 2 49% 32% 18% 20 0 RC/RP MS – Des réponses ont été observées chez les patients avec des tumeurs EGFR ou KRAS soit sauvages (TRG 31% pour les 2) soit mutées (EGFR 23%; KRAS 24%) – Les taux de SG à 2 ans étaient de 50% (IC 95% 41, 5 - 59, 2) dans le groupe TC 2/3 ou IC 2/3, 52% (IC 95% 39, 3 - 65, 2) dans le groupe TC 3 ou IC 3 et de 49% (IC 95% 37, 0 - 61, 1) dans le groupe TC 2 ou IC 2 • Conclusion – Le traitement du CBNPC de 1 e ligne par atézolizumab a continué à démontrer une activité durable au delà de 2 ans Carcereny E et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 17. 02

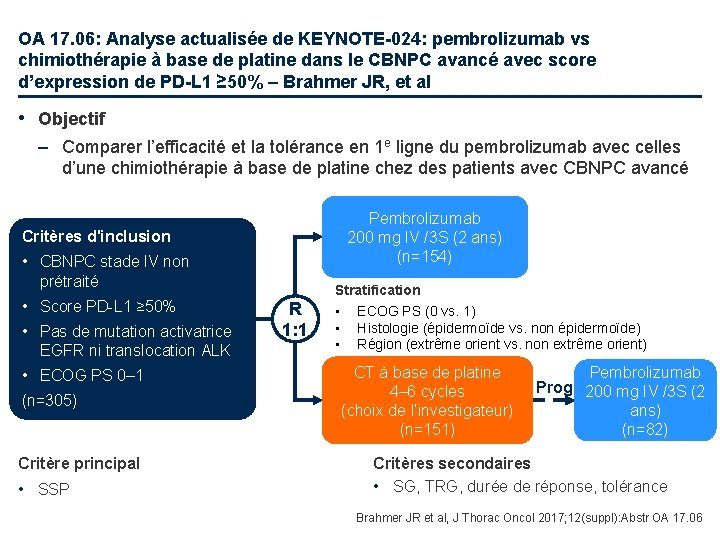
OA 17. 06: Analyse actualisée de KEYNOTE-024: pembrolizumab vs chimiothérapie à base de platine dans le CBNPC avancé avec score d’expression de PD-L 1 ≥ 50% – Brahmer JR, et al • Objectif – Comparer l’efficacité et la tolérance en 1 e ligne du pembrolizumab avec celles d’une chimiothérapie à base de platine chez des patients avec CBNPC avancé Pembrolizumab 200 mg IV /3 S (2 ans) (n=154) Critères d'inclusion • CBNPC stade IV non prétraité • Score PD-L 1 ≥ 50% • Pas de mutation activatrice EGFR ni translocation ALK • ECOG PS 0– 1 (n=305) Critère principal • SSP R 1: 1 Stratification • ECOG PS (0 vs. 1) • Histologie (épidermoïde vs. non épidermoïde) • Région (extrême orient vs. non extrême orient) CT à base de platine 4– 6 cycles (choix de l’investigateur) (n=151) Pembrolizumab Prog 200 mg IV /3 S (2 ans) (n=82) Critères secondaires • SG, TRG, durée de réponse, tolérance Brahmer JR et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 17. 06

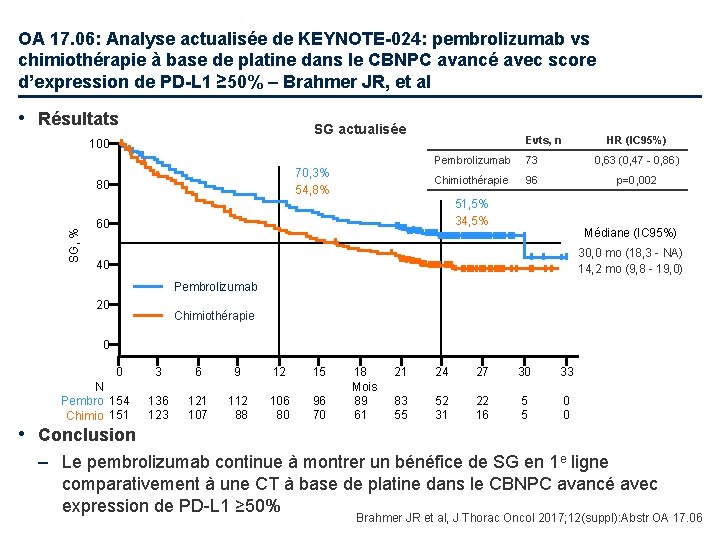
OA 17. 06: Analyse actualisée de KEYNOTE-024: pembrolizumab vs chimiothérapie à base de platine dans le CBNPC avancé avec score d’expression de PD-L 1 ≥ 50% – Brahmer JR, et al • Résultats SG actualisée 100 70, 3% 54, 8% SG, % 80 Evts, n HR (IC 95%) Pembrolizumab 73 0, 63 (0, 47 - 0, 86) Chimiothérapie 96 p=0, 002 51, 5% 34, 5% 60 Médiane (IC 95%) 30, 0 mo (18, 3 - NA) 14, 2 mo (9, 8 - 19, 0) 40 Pembrolizumab 20 Chimiothérapie 0 0 N Pembro 154 Chimio 151 3 6 9 12 15 136 123 121 107 112 88 106 80 96 70 18 Mois 89 61 21 24 27 30 33 83 55 52 31 22 16 5 5 0 0 • Conclusion – Le pembrolizumab continue à montrer un bénéfice de SG en 1 e ligne comparativement à une CT à base de platine dans le CBNPC avancé avec expression de PD-L 1 ≥ 50% Brahmer JR et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 17. 06

CBNPC avancé Non éligible au traitement radical, stade III et IV Lignes ultérieures

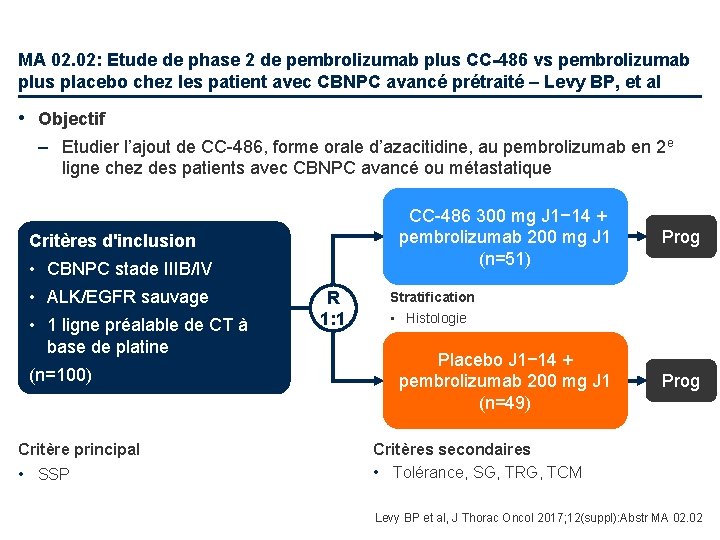
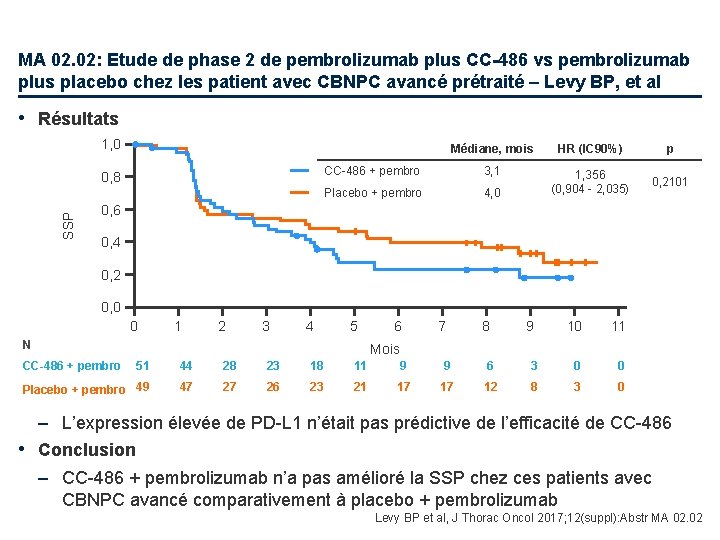
MA 02. 02: Etude de phase 2 de pembrolizumab plus CC-486 vs pembrolizumab plus placebo chez les patient avec CBNPC avancé prétraité – Levy BP, et al • Objectif – Etudier l’ajout de CC-486, forme orale d’azacitidine, au pembrolizumab en 2 e ligne chez des patients avec CBNPC avancé ou métastatique CC-486 300 mg J 1− 14 + pembrolizumab 200 mg J 1 (n=51) Critères d'inclusion • CBNPC stade IIIB/IV • ALK/EGFR sauvage • 1 ligne préalable de CT à base de platine (n=100) Critère principal • SSP R 1: 1 Prog Stratification • Histologie Placebo J 1− 14 + pembrolizumab 200 mg J 1 (n=49) Prog Critères secondaires • Tolérance, SG, TRG, TCM Levy BP et al, J Thorac Oncol 2017; 12(suppl): Abstr MA 02. 02

MA 02. 02: Etude de phase 2 de pembrolizumab plus CC-486 vs pembrolizumab plus placebo chez les patient avec CBNPC avancé prétraité – Levy BP, et al • Résultats 1, 0 SSP 0, 8 Médiane, mois HR (IC 90%) p CC-486 + pembro 3, 1 Placebo + pembro 4, 0 1, 356 (0, 904 - 2, 035) 0, 2101 0, 6 0, 4 0, 2 0, 0 0 1 2 3 4 5 N CC-486 + pembro 6 7 8 9 10 11 Mois 51 44 28 23 18 11 9 9 6 3 0 0 Placebo + pembro 49 47 27 26 23 21 17 17 12 8 3 0 – L’expression élevée de PD-L 1 n’était pas prédictive de l’efficacité de CC-486 • Conclusion – CC-486 + pembrolizumab n’a pas amélioré la SSP chez ces patients avec CBNPC avancé comparativement à placebo + pembrolizumab Levy BP et al, J Thorac Oncol 2017; 12(suppl): Abstr MA 02. 02

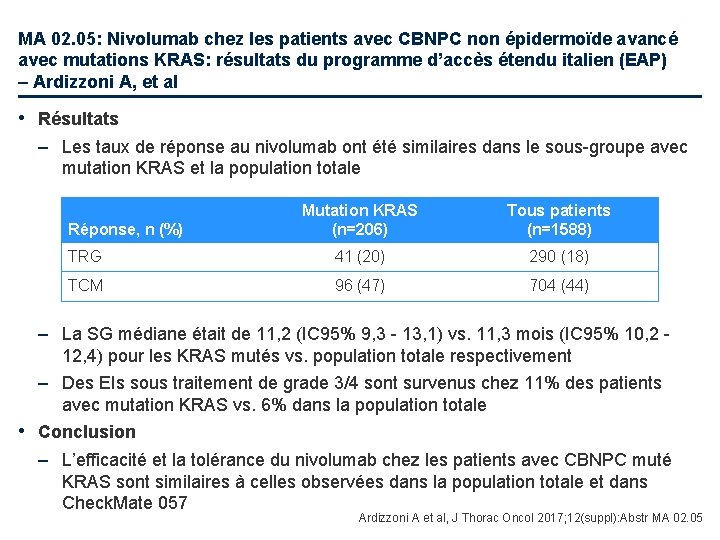
MA 02. 05: Nivolumab chez les patients avec CBNPC non épidermoïde avancé avec mutations KRAS: résultats du programme d’accès étendu italien (EAP) – Ardizzoni A, et al • Objectif – Etudier l’efficacité du nivolumab chez des patients avec CBNPC non épidermoïde avancé avec mutations KRAS dans le programme compassionnel italien Critères d'inclusion • CBNPC stade IIIB/IV non épidermoïde • ≥ 1 traitement systémique préalable Nivolumab 3 mg/kg IV /2 S pendant au maximum 24 mois Prog • KRAS muté (n=206) Critères de jugement • TRG, TCM, SSP, SG Ardizzoni A et al, J Thorac Oncol 2017; 12(suppl): Abstr MA 02. 05

MA 02. 05: Nivolumab chez les patients avec CBNPC non épidermoïde avancé avec mutations KRAS: résultats du programme d’accès étendu italien (EAP) – Ardizzoni A, et al • Résultats – Les taux de réponse au nivolumab ont été similaires dans le sous-groupe avec mutation KRAS et la population totale Mutation KRAS (n=206) Tous patients (n=1588) TRG 41 (20) 290 (18) TCM 96 (47) 704 (44) Réponse, n (%) – La SG médiane était de 11, 2 (IC 95% 9, 3 - 13, 1) vs. 11, 3 mois (IC 95% 10, 2 - 12, 4) pour les KRAS mutés vs. population totale respectivement – Des EIs sous traitement de grade 3/4 sont survenus chez 11% des patients avec mutation KRAS vs. 6% dans la population totale • Conclusion – L’efficacité et la tolérance du nivolumab chez les patients avec CBNPC muté KRAS sont similaires à celles observées dans la population totale et dans Check. Mate 057 Ardizzoni A et al, J Thorac Oncol 2017; 12(suppl): Abstr MA 02. 05

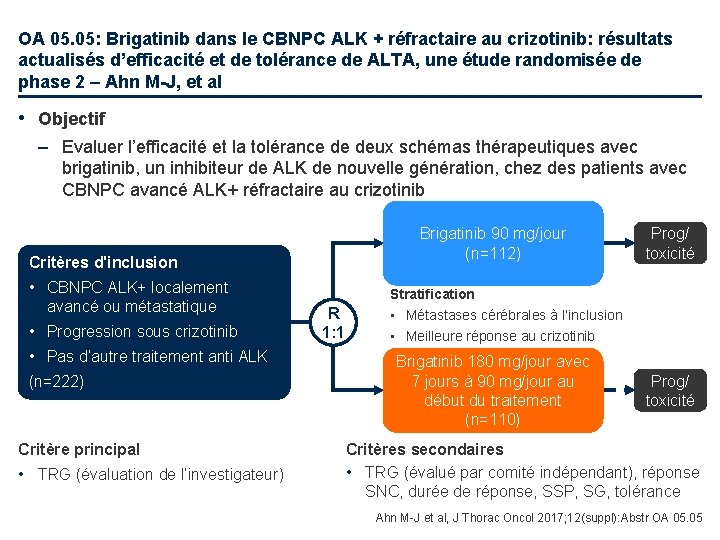
OA 05. 05: Brigatinib dans le CBNPC ALK + réfractaire au crizotinib: résultats actualisés d’efficacité et de tolérance de ALTA, une étude randomisée de phase 2 – Ahn M-J, et al • Objectif – Evaluer l’efficacité et la tolérance de deux schémas thérapeutiques avec brigatinib, un inhibiteur de ALK de nouvelle génération, chez des patients avec CBNPC avancé ALK+ réfractaire au crizotinib Brigatinib 90 mg/jour (n=112) Critères d'inclusion • CBNPC ALK+ localement avancé ou métastatique • Progression sous crizotinib • Pas d’autre traitement anti ALK (n=222) Critère principal • TRG (évaluation de l’investigateur) R 1: 1 Prog/ toxicité Stratification • Métastases cérébrales à l’inclusion • Meilleure réponse au crizotinib Brigatinib 180 mg/jour avec 7 jours à 90 mg/jour au début du traitement (n=110) Prog/ toxicité Critères secondaires • TRG (évalué par comité indépendant), réponse SNC, durée de réponse, SSP, SG, tolérance Ahn M-J et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 05. 05

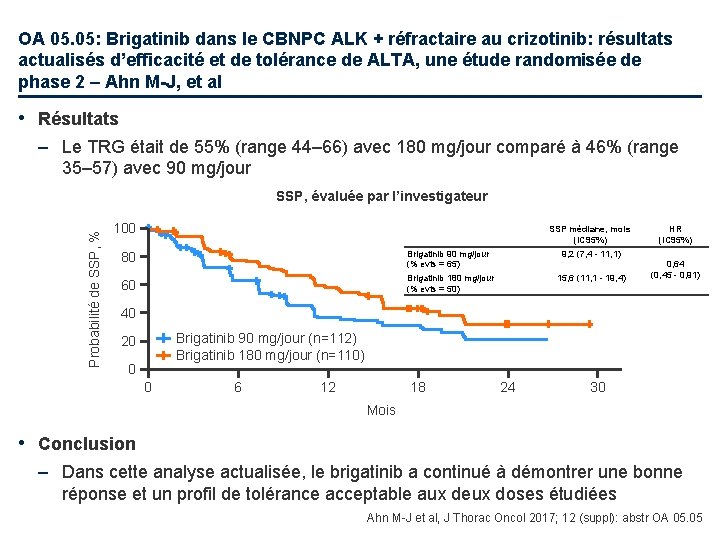
OA 05. 05: Brigatinib dans le CBNPC ALK + réfractaire au crizotinib: résultats actualisés d’efficacité et de tolérance de ALTA, une étude randomisée de phase 2 – Ahn M-J, et al • Résultats – Le TRG était de 55% (range 44– 66) avec 180 mg/jour comparé à 46% (range 35– 57) avec 90 mg/jour Probabilité de SSP, % SSP, évaluée par l’investigateur 100 SSP médiane, mois (IC 95%) 80 Brigatinib 90 mg/jour (% evts = 65) 9, 2 (7, 4 - 11, 1) 60 Brigatinib 180 mg/jour (% evts = 50) 15, 6 (11, 1 - 19, 4) HR (IC 95%) 0, 64 (0, 45 - 0, 91) 40 Brigatinib 90 mg/jour (n=112) Brigatinib 180 mg/jour (n=110) 20 0 0 6 12 18 24 30 Mois • Conclusion – Dans cette analyse actualisée, le brigatinib a continué à démontrer une bonne réponse et un profil de tolérance acceptable aux deux doses étudiées Ahn M-J et al, J Thorac Oncol 2017; 12 (suppl): abstr OA 05. 05

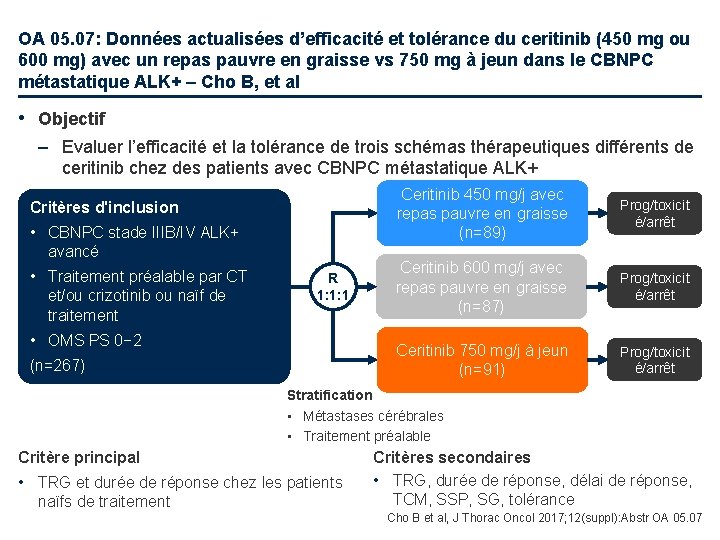
OA 05. 07: Données actualisées d’efficacité et tolérance du ceritinib (450 mg ou 600 mg) avec un repas pauvre en graisse vs 750 mg à jeun dans le CBNPC métastatique ALK+ – Cho B, et al • Objectif – Evaluer l’efficacité et la tolérance de trois schémas thérapeutiques différents de ceritinib chez des patients avec CBNPC métastatique ALK+ Critères d'inclusion • CBNPC stade IIIB/IV ALK+ avancé • Traitement préalable par CT et/ou crizotinib ou naïf de traitement R 1: 1: 1 • OMS PS 0− 2 (n=267) Ceritinib 450 mg/j avec repas pauvre en graisse (n=89) Prog/toxicit é/arrêt Ceritinib 600 mg/j avec repas pauvre en graisse (n=87) Prog/toxicit é/arrêt Ceritinib 750 mg/j à jeun (n=91) Prog/toxicit é/arrêt Stratification • Métastases cérébrales • Traitement préalable Critère principal • TRG et durée de réponse chez les patients naïfs de traitement Critères secondaires • TRG, durée de réponse, délai de réponse, TCM, SSP, SG, tolérance Cho B et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 05. 07

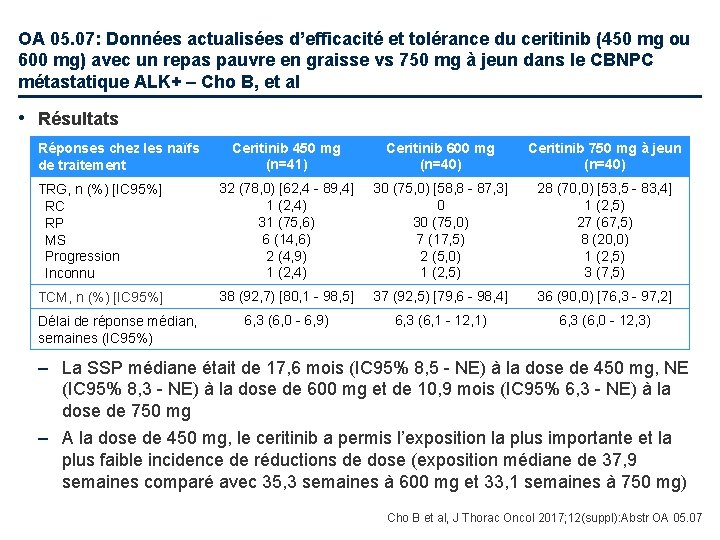
OA 05. 07: Données actualisées d’efficacité et tolérance du ceritinib (450 mg ou 600 mg) avec un repas pauvre en graisse vs 750 mg à jeun dans le CBNPC métastatique ALK+ – Cho B, et al • Résultats Ceritinib 450 mg (n=41) Ceritinib 600 mg (n=40) Ceritinib 750 mg à jeun (n=40) TRG, n (%) [IC 95%] RC RP MS Progression Inconnu 32 (78, 0) [62, 4 - 89, 4] 1 (2, 4) 31 (75, 6) 6 (14, 6) 2 (4, 9) 1 (2, 4) 30 (75, 0) [58, 8 - 87, 3] 0 30 (75, 0) 7 (17, 5) 2 (5, 0) 1 (2, 5) 28 (70, 0) [53, 5 - 83, 4] 1 (2, 5) 27 (67, 5) 8 (20, 0) 1 (2, 5) 3 (7, 5) TCM, n (%) [IC 95%] 38 (92, 7) [80, 1 - 98, 5] 37 (92, 5) [79, 6 - 98, 4] 36 (90, 0) [76, 3 - 97, 2] 6, 3 (6, 0 - 6, 9) 6, 3 (6, 1 - 12, 1) 6, 3 (6, 0 - 12, 3) Réponses chez les naïfs de traitement Délai de réponse médian, semaines (IC 95%) – La SSP médiane était de 17, 6 mois (IC 95% 8, 5 - NE) à la dose de 450 mg, NE (IC 95% 8, 3 - NE) à la dose de 600 mg et de 10, 9 mois (IC 95% 6, 3 - NE) à la dose de 750 mg – A la dose de 450 mg, le ceritinib a permis l’exposition la plus importante et la plus faible incidence de réductions de dose (exposition médiane de 37, 9 semaines comparé avec 35, 3 semaines à 600 mg et 33, 1 semaines à 750 mg) Cho B et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 05. 07

OA 05. 07: Données actualisées d’efficacité et tolérance du ceritinib (450 mg ou 600 mg) avec un repas pauvre en graisse vs 750 mg à jeun dans le CBNPC métastatique ALK+ – Cho B, et al • Résultats – Sur la base de tous les patients traités (n=265), le profil d’EI global était similaire pour les 3 bras sauf pour une proportion plus faible de toxicité gastro-intestinale dans le bras 450 mg Ceritinib 450 mg (n=89) Ceritinib 600 mg (n=86) Ceritinib 750 mg à jeun (n=90) EIs gastrointestinaux provoquant l’arrêt, n (%) Nausées Vomissements Diarrhée 0 0 0 1 (1, 2) 0 0 EIs gastrointestinaux nécessitant ajustement de dose, n (%) Nausées Diarrhée Vomissements 0 0 0 6 (7, 0) 3 (3, 5) 4 (4, 4) 6 (6, 7) 1 (1, 1) 0 9 (10, 5) 11 (12, 8) 10 (11, 6) 16 (17, 8) 11 (12, 2) 10 (11, 1) EIs GI nécessitant ajustement de dose/interruption, n (%) Diarrhée Nausées Vomissements • Conclusion – Le ceritinib administré à la dose de 450 mg avec un repas pourrait présenter une efficacité similaire à celle de 750 mg à jeun avec une meilleure tolérance digestive Cho B et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 05. 07

MA 10. 03: Survie à 3 ans et durée de réponse dans une étude randomisée de phase II comparant atézolizumab vs docétaxel en 2 e ou 3 e ligne dans le CBNPC (POPLAR) – Park K, et al • Objectif – Rapporter les données de survie à 3 ans de l’étude POPLAR comparant atézolizumab vs. docétaxel chez des patients avec CBNPC avancé • Méthodes – Les patients avec CBNPC métastatique ou localement avancé (2 e ou 3 e ligne) (n=287) ont été randomisés 1: 1 entre atézolizumab (1200 mg /3 S) ou docétaxel (75 mg/m 2 /3 S) – Date de clôture 7 avril 2017; suivi minimum 3 ans • Résultats – La SG à 3 ans était de 19% sous atézolizumab vs. 10% sous docétaxel – Le TRG était de 15% pour les 2 bras • Conclusions – A tous les temps d’analyse, la SG était supérieure avec atézolizumab vs. docétaxel – L’amélioration de la SG à 3 ans sous atézolizumab a été observée pour tous les sous-groupes définis par l’histologie ou le niveaux d’expression de PD-L 1 Park K et al, J Thorac Oncol 2017; 12(suppl): Abstr MA 10. 03

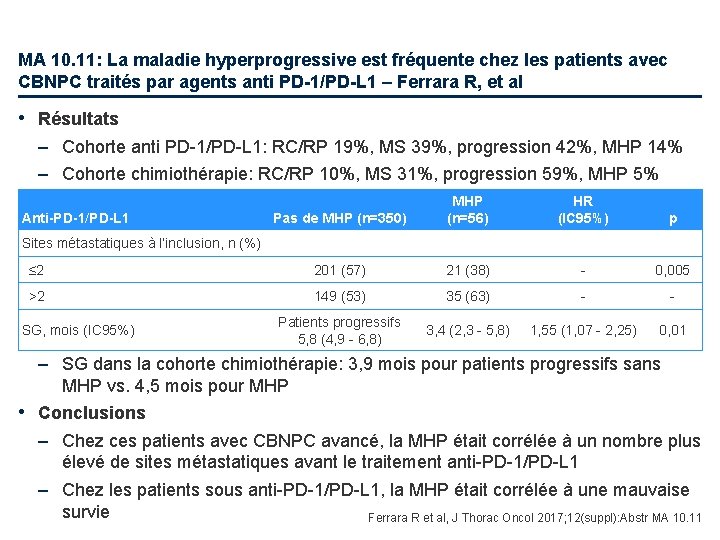
MA 10. 11: La maladie hyperprogressive est fréquente chez les patients avec CBNPC traités par agents anti PD-1/PD-L 1 – Ferrara R, et al • Objectif – Explorer le taux et la valeur pronostique de la maladie hyperprogressive (MHP) dans une large cohorte de patients avec CBNPC avancé traité par agents anti PD-1/PD-L 1 ou chimiothérapie • Méthodes – Analyse multicentrique rétrospective de patients avec CBNPC avancé traités par agents anti-PD-1/PD-L 1 (n=406) ou chimiothérapie (n=59) – Le taux de croissance tumorale (TCT) a été calculé avant et pendant le traitement – La MHP a été définie par une augmentation ≥ 2 fois du TCT vs. avant traitement et une progression au premier scanner pendant le traitement Ferrara R et al, J Thorac Oncol 2017; 12(suppl): Abstr MA 10. 11

MA 10. 11: La maladie hyperprogressive est fréquente chez les patients avec CBNPC traités par agents anti PD-1/PD-L 1 – Ferrara R, et al • Résultats – Cohorte anti PD-1/PD-L 1: RC/RP 19%, MS 39%, progression 42%, MHP 14% – Cohorte chimiothérapie: RC/RP 10%, MS 31%, progression 59%, MHP 5% Pas de MHP (n=350) MHP (n=56) HR (IC 95%) p ≤ 2 201 (57) 21 (38) - 0, 005 >2 149 (53) 35 (63) - - Patients progressifs 5, 8 (4, 9 - 6, 8) 3, 4 (2, 3 - 5, 8) 1, 55 (1, 07 - 2, 25) 0, 01 Anti-PD-1/PD-L 1 Sites métastatiques à l’inclusion, n (%) SG, mois (IC 95%) – SG dans la cohorte chimiothérapie: 3, 9 mois pour patients progressifs sans MHP vs. 4, 5 mois pour MHP • Conclusions – Chez ces patients avec CBNPC avancé, la MHP était corrélée à un nombre plus élevé de sites métastatiques avant le traitement anti-PD-1/PD-L 1 – Chez les patients sous anti-PD-1/PD-L 1, la MHP était corrélée à une mauvaise survie Ferrara R et al, J Thorac Oncol 2017; 12(suppl): Abstr MA 10. 11

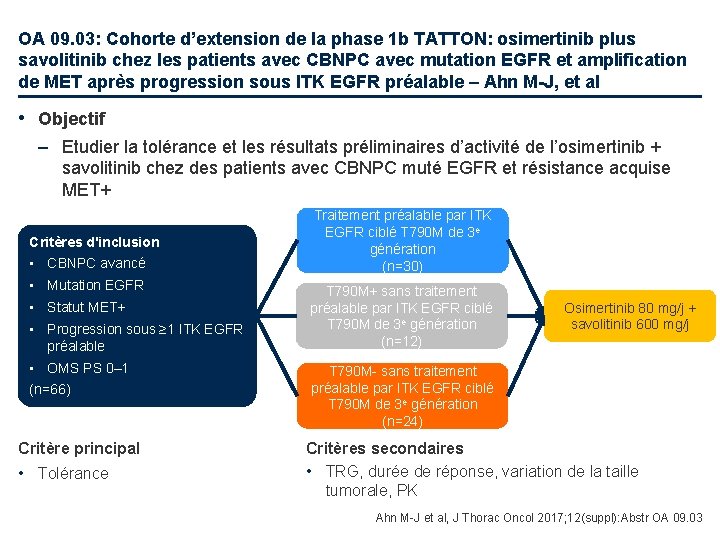
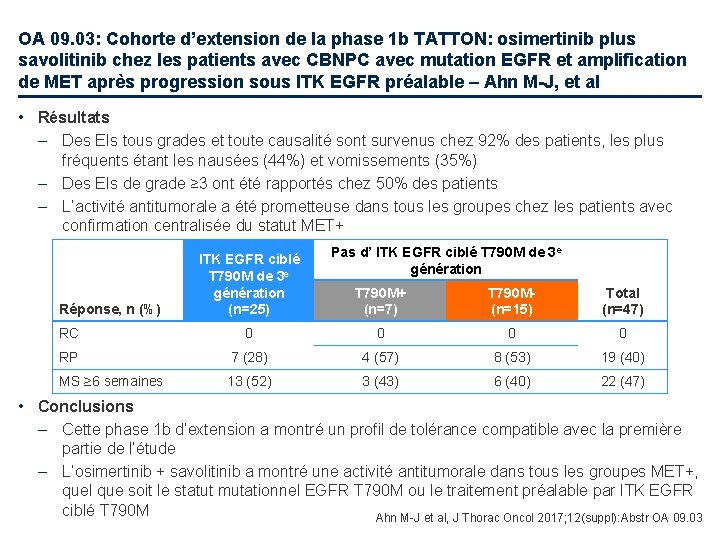
OA 09. 03: Cohorte d’extension de la phase 1 b TATTON: osimertinib plus savolitinib chez les patients avec CBNPC avec mutation EGFR et amplification de MET après progression sous ITK EGFR préalable – Ahn M-J, et al • Objectif – Etudier la tolérance et les résultats préliminaires d’activité de l’osimertinib + savolitinib chez des patients avec CBNPC muté EGFR et résistance acquise MET+ Critères d'inclusion • CBNPC avancé • Mutation EGFR • Statut MET+ • Progression sous ≥ 1 ITK EGFR préalable • OMS PS 0– 1 (n=66) Critère principal • Tolérance Traitement préalable par ITK EGFR ciblé T 790 M de 3 e génération (n=30) T 790 M+ sans traitement préalable par ITK EGFR ciblé T 790 M de 3 e génération (n=12) Osimertinib 80 mg/j + savolitinib 600 mg/j T 790 M- sans traitement préalable par ITK EGFR ciblé T 790 M de 3 e génération (n=24) Critères secondaires • TRG, durée de réponse, variation de la taille tumorale, PK Ahn M-J et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 09. 03

OA 09. 03: Cohorte d’extension de la phase 1 b TATTON: osimertinib plus savolitinib chez les patients avec CBNPC avec mutation EGFR et amplification de MET après progression sous ITK EGFR préalable – Ahn M-J, et al • Résultats – Des EIs tous grades et toute causalité sont survenus chez 92% des patients, les plus fréquents étant les nausées (44%) et vomissements (35%) – Des EIs de grade ≥ 3 ont été rapportés chez 50% des patients – L’activité antitumorale a été prometteuse dans tous les groupes chez les patients avec confirmation centralisée du statut MET+ Réponse, n (%) ITK EGFR ciblé T 790 M de 3 e génération (n=25) Pas d’ ITK EGFR ciblé T 790 M de 3 e génération T 790 M+ (n=7) T 790 M(n=15) Total (n=47) RC 0 0 RP 7 (28) 4 (57) 8 (53) 19 (40) MS ≥ 6 semaines 13 (52) 3 (43) 6 (40) 22 (47) • Conclusions – Cette phase 1 b d’extension a montré un profil de tolérance compatible avec la première partie de l’étude – L’osimertinib + savolitinib a montré une activité antitumorale dans tous les groupes MET+, quel que soit le statut mutationnel EGFR T 790 M ou le traitement préalable par ITK EGFR ciblé T 790 M Ahn M-J et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 09. 03

OA 17. 07: Survie à long terme des patients traités par atézolizumab en 2 e ligne ou au delà pour un CBNPC dans l’étude de phase III randomisée OAK – Satouchi M, et al • Objectif – Evaluer les caractéristiques des survivants à long terme (SLT) porteurs d’un CBNPC recevant une immunothérapie anticancéreuse dans l’étude OAK • Méthodes – Etude randomisée contrôlée de phase 3 comparant atézolizumab 1200 mg /3 S vs. docétaxel 75 mg/m 2 chez des patients avec CBNPC localement avancé ou métastatique ayant reçu 1− 2 lignes préalables de CT (au moins 1 à base de platine) – Les SLT étaient les patients ayant vécu ≥ 24 mois à partir de la randomisation • Résultats – La SG à 2 ans était de 31% sous atézolizumab vs. 21% sous docétaxel – Les SLT sous atézolizumab n’étaient pas limités aux répondeurs en imagerie; 21% des SLT atézolizumab vs. 9% des SLT docétaxel avaient une progression comme meilleure réponse • Conclusions – La survie à long terme des patients avec CBNPC est meilleure sous atézolizumab que sous docétaxel – Ce bénéfice était observé dans les différents sous-groupes définis par l’histologie (épidermoïde/non épidermoïde) et l’expression de PD-L 1 Satouchi M et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 17. 07

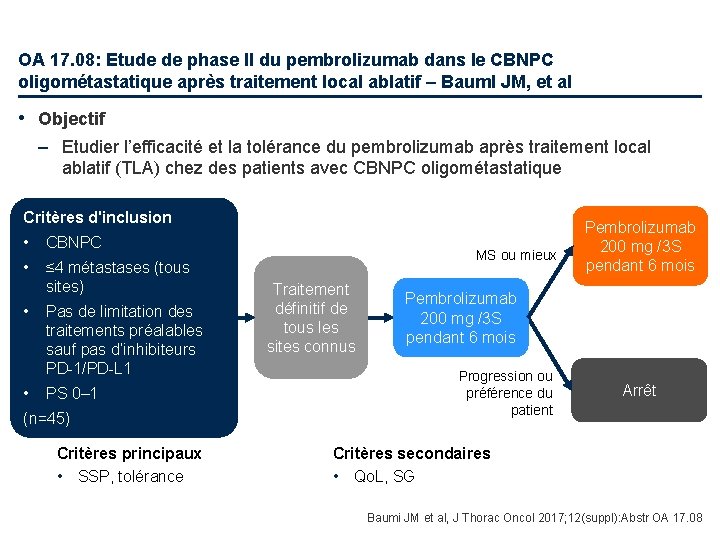
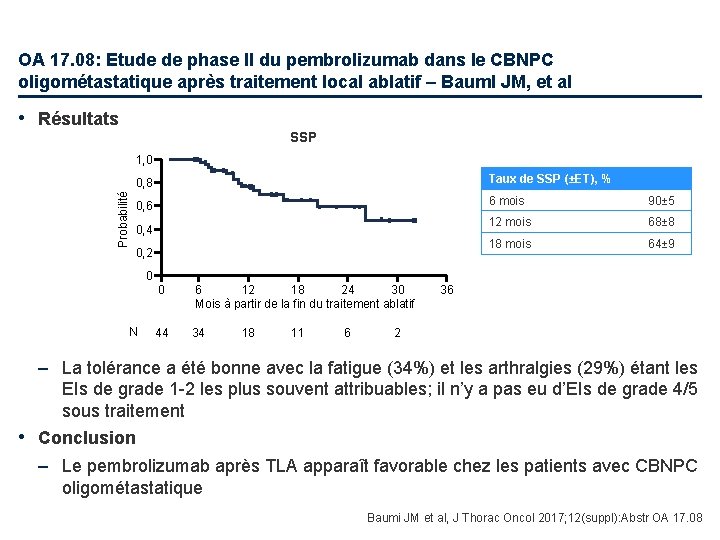
OA 17. 08: Etude de phase II du pembrolizumab dans le CBNPC oligométastatique après traitement local ablatif – Bauml JM, et al • Objectif – Etudier l’efficacité et la tolérance du pembrolizumab après traitement local ablatif (TLA) chez des patients avec CBNPC oligométastatique Critères d'inclusion • CBNPC • ≤ 4 métastases (tous sites) • • Pas de limitation des traitements préalables sauf pas d’inhibiteurs PD-1/PD-L 1 PS 0– 1 (n=45) Critères principaux • SSP, tolérance MS ou mieux Traitement définitif de tous les sites connus Pembrolizumab 200 mg /3 S pendant 6 mois Progression ou préférence du patient Arrêt Critères secondaires • Qo. L, SG Baumi JM et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 17. 08

OA 17. 08: Etude de phase II du pembrolizumab dans le CBNPC oligométastatique après traitement local ablatif – Bauml JM, et al • Résultats SSP Probabilité 1, 0 0, 8 Taux de SSP (±ET), % 0, 6 6 mois 90± 5 12 mois 68± 8 18 mois 64± 9 0, 4 0, 2 0 N 0 6 12 18 24 30 Mois à partir de la fin du traitement ablatif 44 34 18 11 6 36 2 – La tolérance a été bonne avec la fatigue (34%) et les arthralgies (29%) étant les EIs de grade 1 -2 les plus souvent attribuables; il n’y a pas eu d’EIs de grade 4/5 sous traitement • Conclusion – Le pembrolizumab après TLA apparaît favorable chez les patients avec CBNPC oligométastatique Baumi JM et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 17. 08

Autres tumeurs malignes CBPC, mésothéliome et tumeurs épithéliales thymiques

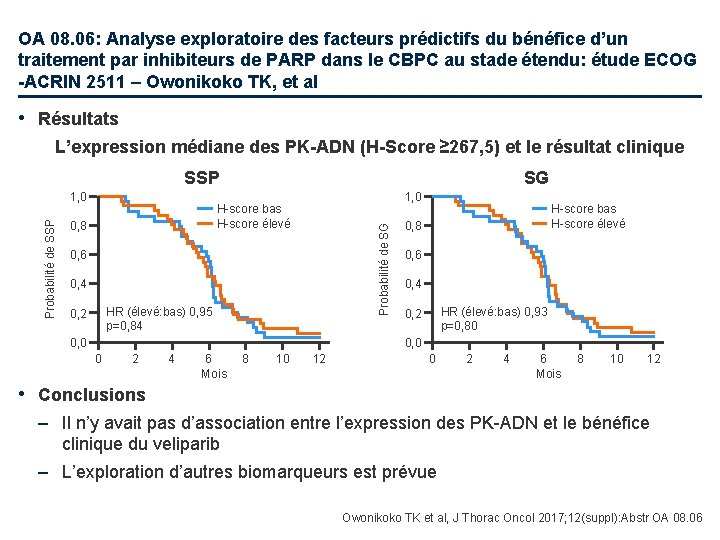
OA 08. 06: Analyse exploratoire des facteurs prédictifs du bénéfice d’un traitement par inhibiteurs de PARP dans le CBPC au stade étendu: étude ECOG -ACRIN 2511 – Owonikoko TK, et al • Objectif – Explorer si l’expression tissulaire des protéines kinases dépendantes de l’ADN (PK-ADN) est associée à un bénéfice clinique du veliparib en traitement de 1 e ligne des patients avec CBPC au stade étendu • Méthodes – Analyse post hoc d’échantillons tissulaires archivés de l’étude E 2511 qui a inclus des patients avec CBPC au stade étendu non prétraités • 63/147 (51%) des cas avaient des échantillons disponibles et ont été inclus dans l’analyse – L’immunohistochimie a été utilisée pour déterminer l’expression des PK-ADN; l’association avec les résultats cliniques, la SSP et la SG a été évaluée – L’étude avait une puissance de 82% pour détecter un HR de SSP de 0, 5 en comparant les patients avec biomarqueur positif vs. négatif par un test du logrank unilatéral au seuil de significativité de 0, 05 Owonikoko TK et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 08. 06

OA 08. 06: Analyse exploratoire des facteurs prédictifs du bénéfice d’un traitement par inhibiteurs de PARP dans le CBPC au stade étendu: étude ECOG -ACRIN 2511 – Owonikoko TK, et al • Résultats L’expression médiane des PK-ADN (H-Score ≥ 267, 5) et le résultat clinique SSP 1, 0 H-score bas H-score élevé 0, 8 Probabilité de SG Probabilité de SSP 1, 0 SG 0, 6 0, 4 HR (élevé: bas) 0, 95 p=0, 84 0, 2 0, 0 H-score bas H-score élevé 0, 8 0, 6 0, 4 HR (élevé: bas) 0, 93 p=0, 80 0, 2 0, 0 0 2 4 6 Mois 8 10 12 • Conclusions – Il n’y avait pas d’association entre l’expression des PK-ADN et le bénéfice clinique du veliparib – L’exploration d’autres biomarqueurs est prévue Owonikoko TK et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 08. 06

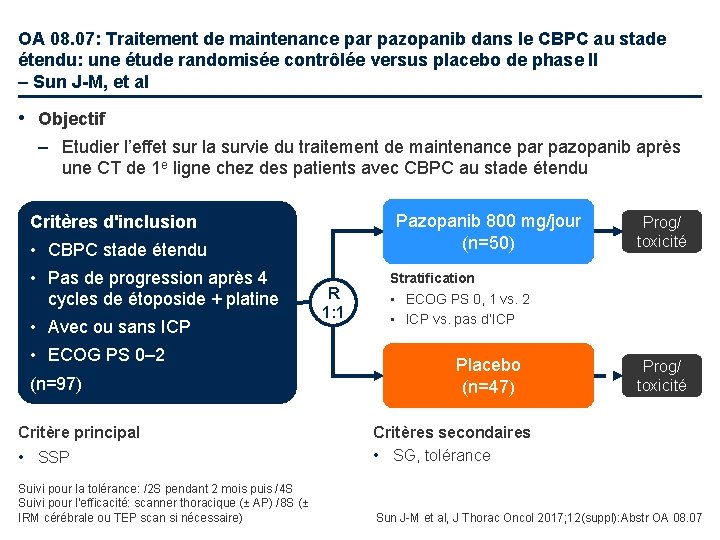
OA 08. 07: Traitement de maintenance par pazopanib dans le CBPC au stade étendu: une étude randomisée contrôlée versus placebo de phase II – Sun J-M, et al • Objectif – Etudier l’effet sur la survie du traitement de maintenance par pazopanib après une CT de 1 e ligne chez des patients avec CBPC au stade étendu Pazopanib 800 mg/jour (n=50) Critères d'inclusion • CBPC stade étendu • Pas de progression après 4 cycles de étoposide + platine • Avec ou sans ICP • ECOG PS 0– 2 (n=97) Critère principal R 1: 1 Prog/ toxicité Stratification • ECOG PS 0, 1 vs. 2 • ICP vs. pas d’ICP Placebo (n=47) Prog/ toxicité • SSP Critères secondaires • SG, tolérance Suivi pour la tolérance: /2 S pendant 2 mois puis /4 S Suivi pour l’efficacité: scanner thoracique (± AP) /8 S (± IRM cérébrale ou TEP scan si nécessaire) Sun J-M et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 08. 07

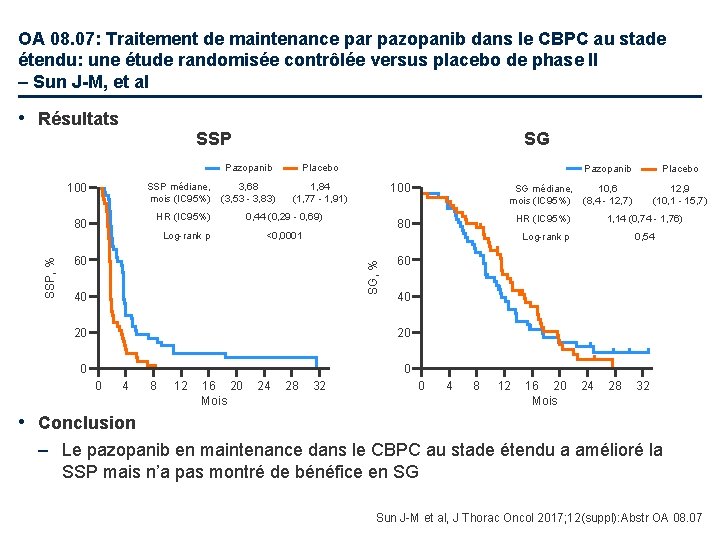
OA 08. 07: Traitement de maintenance par pazopanib dans le CBPC au stade étendu: une étude randomisée contrôlée versus placebo de phase II – Sun J-M, et al • Résultats SSP SG Pazopanib SSP médiane, 3, 68 mois (IC 95%) (3, 53 - 3, 83) 100 HR (IC 95%) Log-rank p 1, 84 (1, 77 - 1, 91) 100 0, 44 (0, 29 - 0, 69) <0, 0001 40 0 0 12 16 20 Mois 24 28 10, 6 (8, 4 - 12, 7) 12, 9 (10, 1 - 15, 7) HR (IC 95%) 1, 14 (0, 74 - 1, 76) 32 0, 54 40 20 8 Placebo 60 20 4 Pazopanib Log-rank p 60 0 SG médiane, mois (IC 95%) 80 SG, % SSP, % 80 Placebo 0 4 8 12 16 20 Mois 24 28 32 • Conclusion – Le pazopanib en maintenance dans le CBPC au stade étendu a amélioré la SSP mais n’a pas montré de bénéfice en SG Sun J-M et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 08. 07

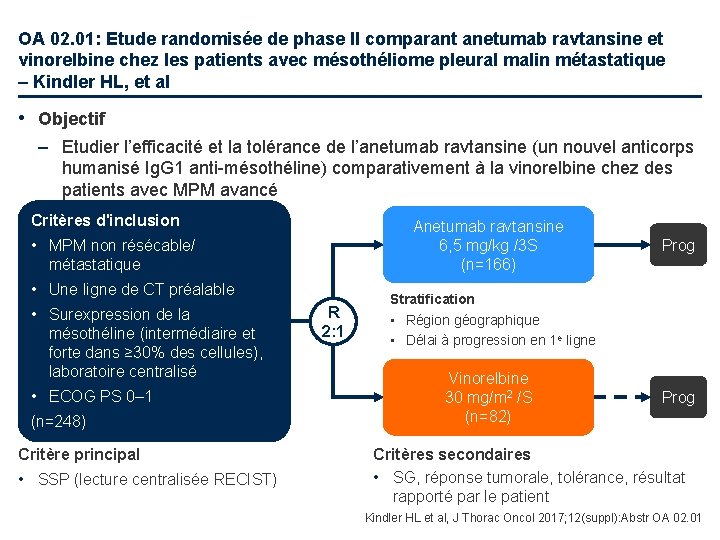
OA 02. 01: Etude randomisée de phase II comparant anetumab ravtansine et vinorelbine chez les patients avec mésothéliome pleural malin métastatique – Kindler HL, et al • Objectif – Etudier l’efficacité et la tolérance de l’anetumab ravtansine (un nouvel anticorps humanisé Ig. G 1 anti-mésothéline) comparativement à la vinorelbine chez des patients avec MPM avancé Critères d'inclusion Anetumab ravtansine 6, 5 mg/kg /3 S (n=166) • MPM non résécable/ métastatique • Une ligne de CT préalable • Surexpression de la mésothéline (intermédiaire et forte dans ≥ 30% des cellules), laboratoire centralisé • ECOG PS 0– 1 (n=248) Critère principal • SSP (lecture centralisée RECIST) R 2: 1 Prog Stratification • Région géographique • Délai à progression en 1 e ligne Vinorelbine 30 mg/m 2 /S (n=82) Prog Critères secondaires • SG, réponse tumorale, tolérance, résultat rapporté par le patient Kindler HL et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 02. 01

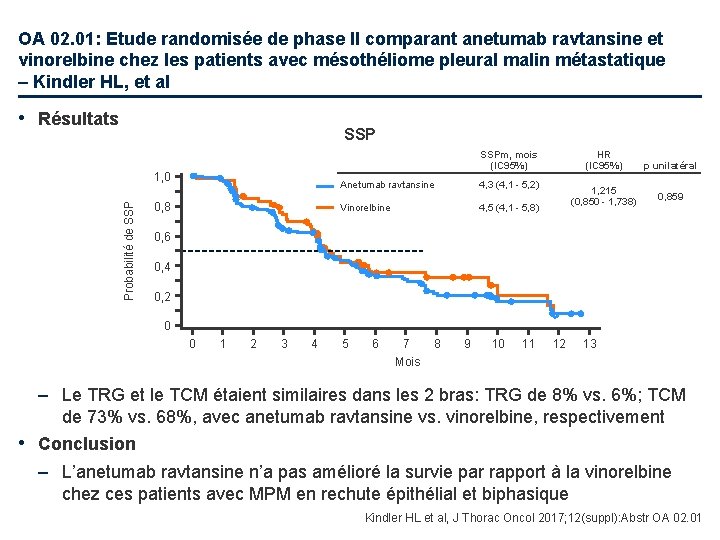
OA 02. 01: Etude randomisée de phase II comparant anetumab ravtansine et vinorelbine chez les patients avec mésothéliome pleural malin métastatique – Kindler HL, et al • Résultats SSPm, mois (IC 95%) Probabilité de SSP 1, 0 0, 8 Anetumab ravtansine 4, 3 (4, 1 - 5, 2) Vinorelbine 4, 5 (4, 1 - 5, 8) HR (IC 95%) 1, 215 (0, 850 - 1, 738) p unilatéral 0, 859 0, 6 0, 4 0, 2 0 0 1 2 3 4 5 6 7 Mois 8 9 10 11 12 13 – Le TRG et le TCM étaient similaires dans les 2 bras: TRG de 8% vs. 6%; TCM de 73% vs. 68%, avec anetumab ravtansine vs. vinorelbine, respectivement • Conclusion – L’anetumab ravtansine n’a pas amélioré la survie par rapport à la vinorelbine chez ces patients avec MPM en rechute épithélial et biphasique Kindler HL et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 02. 01

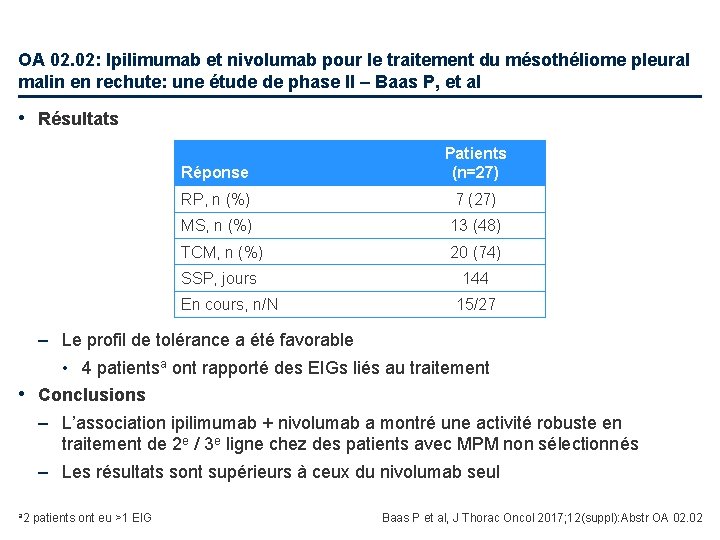
OA 02. 02: Ipilimumab et nivolumab pour le traitement du mésothéliome pleural malin en rechute: une étude de phase II – Baas P, et al • Objectif – Etudier l’association de nivolumab + ipilimumab chez des patients avec MPM en rechute Critères d'inclusion • MPM confirmé histologiquement • Progression sous ou après 1 ou 2 lignes incluant pemetrexed + platine Ipilimumab 1 mg/kg /6 S + nivolumab 240 mg /2 S Prog/ toxicité • PS 0− 1 (n=38) Critère principal • TCM à 12 semaines Critères secondaires • Tolérance, SSP, SG, TRG Baas P et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 02. 02

OA 02. 02: Ipilimumab et nivolumab pour le traitement du mésothéliome pleural malin en rechute: une étude de phase II – Baas P, et al • Résultats Réponse Patients (n=27) RP, n (%) 7 (27) MS, n (%) 13 (48) TCM, n (%) 20 (74) SSP, jours 144 En cours, n/N 15/27 – Le profil de tolérance a été favorable • 4 patientsa ont rapporté des EIGs liés au traitement • Conclusions – L’association ipilimumab + nivolumab a montré une activité robuste en traitement de 2 e / 3 e ligne chez des patients avec MPM non sélectionnés – Les résultats sont supérieurs à ceux du nivolumab seul a 2 patients ont eu >1 EIG Baas P et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 02. 02

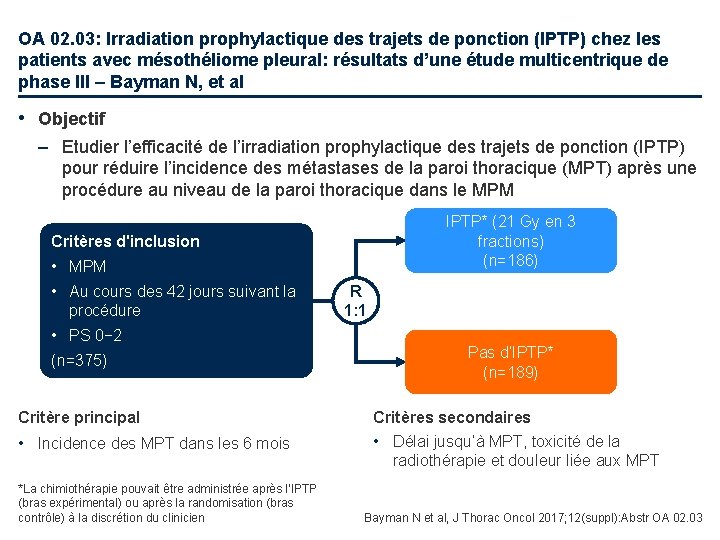
OA 02. 03: Irradiation prophylactique des trajets de ponction (IPTP) chez les patients avec mésothéliome pleural: résultats d’une étude multicentrique de phase III – Bayman N, et al • Objectif – Etudier l’efficacité de l’irradiation prophylactique des trajets de ponction (IPTP) pour réduire l’incidence des métastases de la paroi thoracique (MPT) après une procédure au niveau de la paroi thoracique dans le MPM IPTP* (21 Gy en 3 fractions) (n=186) Critères d'inclusion • MPM • Au cours des 42 jours suivant la procédure • PS 0− 2 (n=375) Critère principal • Incidence des MPT dans les 6 mois *La chimiothérapie pouvait être administrée après l’IPTP (bras expérimental) ou après la randomisation (bras contrôle) à la discrétion du clinicien R 1: 1 Pas d’IPTP* (n=189) Critères secondaires • Délai jusqu’à MPT, toxicité de la radiothérapie et douleur liée aux MPT Bayman N et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 02. 03

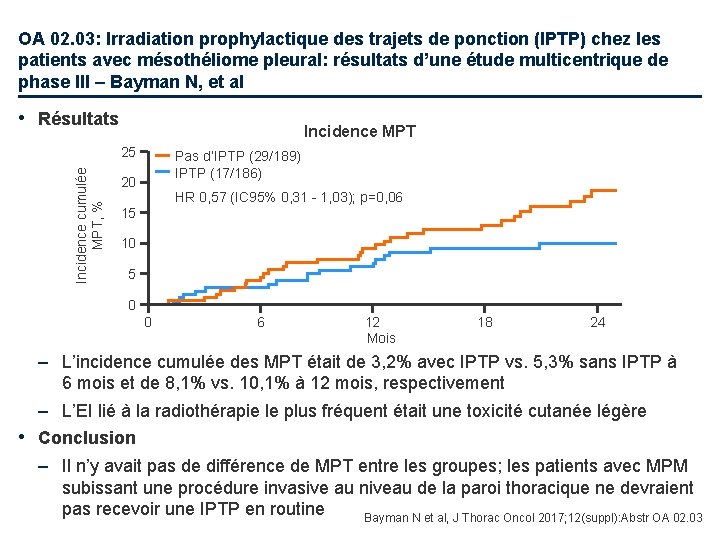
OA 02. 03: Irradiation prophylactique des trajets de ponction (IPTP) chez les patients avec mésothéliome pleural: résultats d’une étude multicentrique de phase III – Bayman N, et al • Résultats Incidence MPT Incidence cumulée MPT, % 25 Pas d’IPTP (29/189) IPTP (17/186) 20 HR 0, 57 (IC 95% 0, 31 - 1, 03); p=0, 06 15 10 5 0 0 6 12 Mois 18 24 – L’incidence cumulée des MPT était de 3, 2% avec IPTP vs. 5, 3% sans IPTP à 6 mois et de 8, 1% vs. 10, 1% à 12 mois, respectivement – L’EI lié à la radiothérapie le plus fréquent était une toxicité cutanée légère • Conclusion – Il n’y avait pas de différence de MPT entre les groupes; les patients avec MPM subissant une procédure invasive au niveau de la paroi thoracique ne devraient pas recevoir une IPTP en routine Bayman N et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 02. 03

MA 19. 01: Etude de phase II du nivolumab: un essai multicentrique en ouvert à un bras dans le mésothéliome pleural malin (MERIT) – Goto Y, et al • Objectif – Etudier l’efficacité et la tolérance du nivolumab chez des patients japonais avec MPM prétraités Critères d'inclusion • MPM avancé ou métastatique en 2 e ou 3 e ligne • Résistant ou intolérant à une association platine pemetrexed Nivolumab 240 mg /2 S Prog (n=34) Critère principal • TRG (évaluation centralisée sur critères m. RECIST) Critères secondaires • TCM, durée de réponse, SSP, SG, tolérance Goto Y et al, J Thorac Oncol 2017; 12(suppl): Abstr MA 19. 01

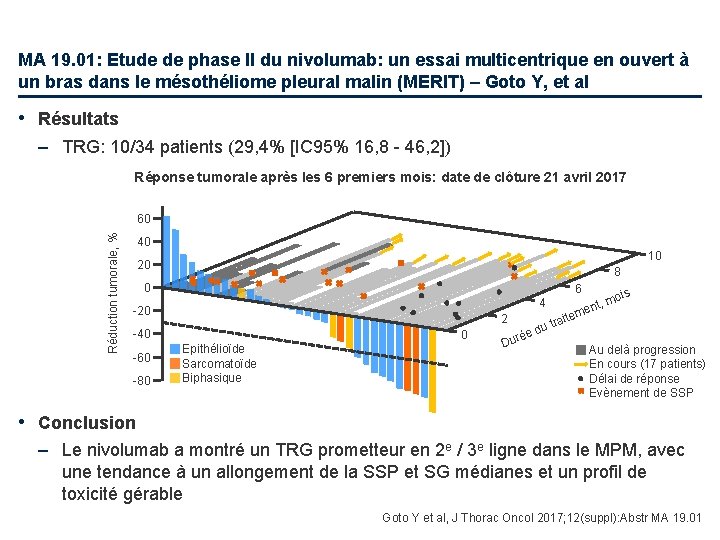
MA 19. 01: Etude de phase II du nivolumab: un essai multicentrique en ouvert à un bras dans le mésothéliome pleural malin (MERIT) – Goto Y, et al • Résultats – TRG: 10/34 patients (29, 4% [IC 95% 16, 8 - 46, 2]) Réponse tumorale après les 6 premiers mois: date de clôture 21 avril 2017 Réduction tumorale, % 60 40 10 20 8 0 6 4 -20 2 -40 -60 -80 0 Epithélioïde Sarcomatoïde Biphasique Dur is o , m ent item tra du e é Au delà progression En cours (17 patients) Délai de réponse Evènement de SSP • Conclusion – Le nivolumab a montré un TRG prometteur en 2 e / 3 e ligne dans le MPM, avec une tendance à un allongement de la SSP et SG médianes et un profil de toxicité gérable Goto Y et al, J Thorac Oncol 2017; 12(suppl): Abstr MA 19. 01

MA 19. 02: Tremelimumab plus durvalumab en 1 e ou 2 e ligne de traitement du mésothéliome: analyse finale de l’étude NIBIT-MESO-1 – Calabro L, et al • Objectif – Etudier l’efficacité et la tolérance du tremelimumab + durvalumab chez les patients avec mésothéliome malin Critères d'inclusion • Mésothéliome malin • Refus d’une 1 e ligne de CT • Réfractaire / rechute 1 e ligne de CT • Espérance de vie >12 semaines Tremelimumab 1 mg/kg /4 S pour 4 doses + durvalumab 20 mg/kg /4 S pour 13 doses • ECOG PS 0– 1 (n=40) Critère principal • TRG lié à l’immunité (TRGi) Critères secondaires • TCM lié à l’immunité, SSP liée à l’immunité, SG, tolérance Calabro L et al, J Thorac Oncol 2017; 12(suppl): Abstr MA 19. 02

MA 19. 02: Tremelimumab plus durvalumab en 1 e ou 2 e ligne de traitement du mésothéliome: analyse finale de l’étude NIBIT-MESO-1 – Calabro L, et al • Résultats Patients (n=40) TRGi, % (IC 95%) 27, 5 (14, 6 - 43, 9) RCi, % RPi, % MSi, % Progression liée à l’immunité, % 0 27, 5 35, 0 TCMi, % (IC 95%) 65, 0 (48, 3 - 79, 4) Durée médiane de la réponse globale NA Durée médiane du contrôle de la maladie, mois (IC 95%) 14, 1 (12, 1 - 16, 1) • Conclusions – L’étude NIBIT-MESO-1 a rempli son critère principal, des EIs liés à l’immunité de tous grades sont survenus chez 75% des patients et les EIs étaient habituellement gérables – L’association tremelimumab + durvalumab dans le mésothéliome malin mérite des études ultérieures Calabro L et al, J Thorac Oncol 2017; 12(suppl): Abstr MA 19. 02

MA 19. 03: Nintedanib + pemetrexed/cisplatine dans le mésothéliome pleural malin: données des biomarqueurs de l’étude de phase II LUME‑Meso – Nowak A, et al • Objectif – Etudier le potentiel pronostique des facteurs angiogéniques et des marqueurs génomiques plasmatiques dans la population avec MPM épithélioïde de l’étude LUME-meso • Méthodes – Des échantillons sanguins prélevés à l’inclusion, au cycle 3 et à progression ont été analysés pour 58 facteurs angiogéniques et SNPs de gènes impliqués dans la synthèse de la mésothéline • Résultats – Il n’y avait pas d’association claire entre les biomarqueurs et les bénéfices du traitement – Un signal potentiel de bénéfice a été observé pour la SG chez les patients avec faibles taux plasmatiques d’endogline et les génotypes homozygotes de VEGFR 3 • Conclusions – Il n’y a pas eu d’association entre les biomarqueurs et les bénéfices du traitement – Ces analyses étaient limitées par le faible nombre de patients et seront évaluées à nouveau dans une étude de phase 3 SNP, polymorphisme d’un seul nucléotide Nowak A et al, J Thorac Oncol 2017; 12(suppl): Abstr MA 19. 03

OA 03. 02: Caractérisation exhaustive des sous-types de tumeur épithéliale thymique par analyse des mutations somatiques et des altérations du nombre de copies – Gennatas S, et al • Objectif – Identifier les mutations dans les tumeurs épithéliales thymiques (TET) au delà de la seule mutation récurrente connue de GTF 21 • Méthodes – Le séquençage de Sanger a été utilisé pour déterminer la fréquence de la mutation GTF 2 I sur l’ADN de 144 TET de tous sous-types – Un séquençage total d’exome a été réalisé sur 17 TETs de différents soustypes (2 AB, 1 B 1, 3 B 2, 2 B 3, 6 CA et 3 NETT) avec appariement avec du tissu normal – Un génotypage SNP a été réalisé sur 100 TET de tous sous-types avec tissu normal apparié pour détecter des altérations du nombre de copies Gennatas S et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 03. 02

OA 03. 02: Caractérisation exhaustive des sous-types de tumeur épithéliale thymique par analyse des mutations somatiques et des altérations du nombre de copies – Gennatas S, et al • Résultats – La mutation GTF 2 I était prévalente dans tous les sous-types de TET • Elle est apparue dans 337/820 (41%) de tous les échantillons évaluables – Très faible charge mutationnelle pour les TET, médiane 67 (range 8– 162) – Des mutations hotspot de NRAS (sous-type AB), KRAS (sous-type NETT) et TP 53 (sous-type NETT) ont été observées – Des mutations oncogéniques affectant la voie de la MAP kinase ont été détectées dans un quart des thymomes A et AB avec mutation GTF 21 – L’analyse du nombre de copies a montré: • Le gain le plus fréquent dans le gène MKI 67 (chromosome 10 q) • Pas de driver oncogénique évident • Conclusions – La mutation sur GTF 21 reste la mutation récurrente la plus fréquente dans les TET – Bien que la charge mutationnelle soit faible, des mutations somatiques et germinales ont été détectées dans des gènes liés au cancer connus Gennatas S et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 03. 02

OA 03. 04: Une étude de phase II du pembrolizumab chez les patients avec tumeur épithéliale thymique réfractaire ou en rechute – Cho J, et al • Objectif – Etudier l’efficacité et la tolérance du pembrolizumab chez les patients avec TET réfractaire ou en rechute Critères d'inclusion • TET confirmée histologiquement • Progression après ≥ 1 CT à base de platine • Pas de maladie autoimmune active au cours de l’année ni d’antécédent de maladie sévère Pembrolizumab 200 mg IV /3 S Prog/ toxicité • ECOG PS ≤ 2 (n=33) Critère principal • Réponse au traitement Critères secondaires • SSP, SG Cho J et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 03. 04

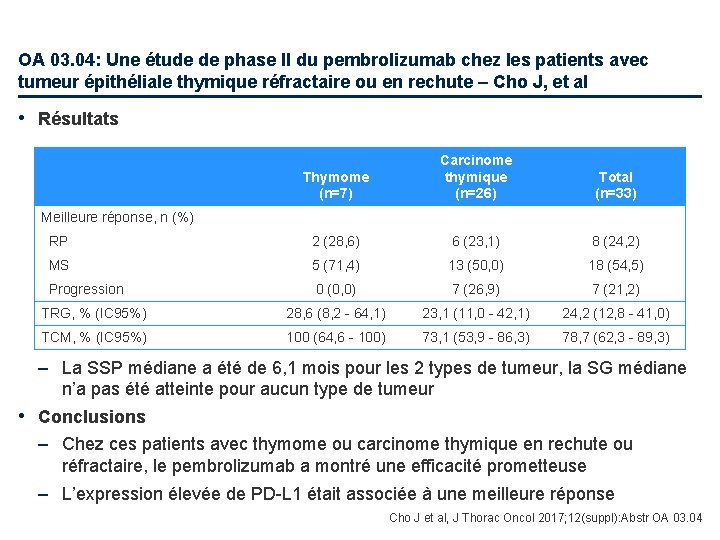
OA 03. 04: Une étude de phase II du pembrolizumab chez les patients avec tumeur épithéliale thymique réfractaire ou en rechute – Cho J, et al • Résultats Thymome (n=7) Carcinome thymique (n=26) Total (n=33) RP 2 (28, 6) 6 (23, 1) 8 (24, 2) MS 5 (71, 4) 13 (50, 0) 18 (54, 5) Progression 0 (0, 0) 7 (26, 9) 7 (21, 2) TRG, % (IC 95%) 28, 6 (8, 2 - 64, 1) 23, 1 (11, 0 - 42, 1) 24, 2 (12, 8 - 41, 0) TCM, % (IC 95%) 100 (64, 6 - 100) 73, 1 (53, 9 - 86, 3) 78, 7 (62, 3 - 89, 3) Meilleure réponse, n (%) – La SSP médiane a été de 6, 1 mois pour les 2 types de tumeur, la SG médiane n’a pas été atteinte pour aucun type de tumeur • Conclusions – Chez ces patients avec thymome ou carcinome thymique en rechute ou réfractaire, le pembrolizumab a montré une efficacité prometteuse – L’expression élevée de PD-L 1 était associée à une meilleure réponse Cho J et al, J Thorac Oncol 2017; 12(suppl): Abstr OA 03. 04
 Jesus soit avec vous a jamais
Jesus soit avec vous a jamais European construction technology platform
European construction technology platform European platform on sustainable urban mobility plans
European platform on sustainable urban mobility plans European magnetism association
European magnetism association European biomass industry association
European biomass industry association European diy retail association
European diy retail association Driver diagram palliative care
Driver diagram palliative care European diagnostic manufacturers association
European diagnostic manufacturers association European parents association
European parents association European university association
European university association Cervical lateral flexion
Cervical lateral flexion Colispasm
Colispasm Thoracic cage anterior view
Thoracic cage anterior view Level of the sternal angle
Level of the sternal angle Thoracic membranes
Thoracic membranes Abdominopelvic cavity regions
Abdominopelvic cavity regions Arteria femoralis palpation
Arteria femoralis palpation Pig thoracic cavity diagram
Pig thoracic cavity diagram Soft, spongy, cone-shaped organs in the thoracic cavity.
Soft, spongy, cone-shaped organs in the thoracic cavity. Thoracic cavity
Thoracic cavity Ischial spine
Ischial spine Muscles of thoracic spine
Muscles of thoracic spine Arteries of thoracic wall
Arteries of thoracic wall Thoracic vertebrae not labeled
Thoracic vertebrae not labeled Thoracic nerves
Thoracic nerves Thoracic kyphosis
Thoracic kyphosis Portal and caval venous system
Portal and caval venous system Anastomosis around scapula
Anastomosis around scapula Goblet cells of respiratory epithelium
Goblet cells of respiratory epithelium Thoracic outlet wedge pillow
Thoracic outlet wedge pillow British thoracic society guidelines oxygen
British thoracic society guidelines oxygen Plumb line posture
Plumb line posture Arteries of thoracic wall
Arteries of thoracic wall Difference between cervical thoracic and lumbar vertebrae
Difference between cervical thoracic and lumbar vertebrae Sternocostalis muscle origin and insertion
Sternocostalis muscle origin and insertion Arteria
Arteria Plexus thoracolumbalis
Plexus thoracolumbalis Rib tubercle
Rib tubercle Thoracic cavity labeled
Thoracic cavity labeled Vena caval opening
Vena caval opening Thalasemia
Thalasemia Horizontal fissure of right lung
Horizontal fissure of right lung Jugular notches
Jugular notches Surface anatomy of breast
Surface anatomy of breast Atheromatous thoracic aorta
Atheromatous thoracic aorta Lumbar vertebrae superior view
Lumbar vertebrae superior view Neurogeen thoracic outlet syndroom
Neurogeen thoracic outlet syndroom Normal ap diameter of chest 2:1
Normal ap diameter of chest 2:1 Arterial supply of thorax
Arterial supply of thorax Identify
Identify Thoracic inlet x ray
Thoracic inlet x ray Orbital cavity nasal cavity ventral cavity oral cavity
Orbital cavity nasal cavity ventral cavity oral cavity Thoracic wall
Thoracic wall Thoracic duct
Thoracic duct Lat dorsi innervation
Lat dorsi innervation Intercostal muscles
Intercostal muscles Branches of aorta
Branches of aorta Dorsal and ventral body cavities
Dorsal and ventral body cavities Thoracic facet joint pain referral patterns
Thoracic facet joint pain referral patterns Thoracic surgeon
Thoracic surgeon Corpus callosum anatomy radiology
Corpus callosum anatomy radiology Thoracic duct
Thoracic duct Rajesh shah thoracic surgeon
Rajesh shah thoracic surgeon Fascia superficialis thorax
Fascia superficialis thorax The purified lymph with lymphocytes and antibodies added
The purified lymph with lymphocytes and antibodies added Thoracic surgery
Thoracic surgery Cupola of the diaphragm
Cupola of the diaphragm Protocole antagoniste avec minidril
Protocole antagoniste avec minidril Le complément d'objet direct
Le complément d'objet direct Autoportrait de salvador dali
Autoportrait de salvador dali Rencontre avec un renard
Rencontre avec un renard Le passé composé
Le passé composé Camping baie d authie
Camping baie d authie Symbole fusible percuteur
Symbole fusible percuteur Couché avec mes soeurs j'ai la tete rouge
Couché avec mes soeurs j'ai la tete rouge Une paire de cotes paralleles
Une paire de cotes paralleles Slidetodoc
Slidetodoc Travaille avec ton voisin
Travaille avec ton voisin Rime croisé
Rime croisé Compteur synchrone modulo 7 bascule jk
Compteur synchrone modulo 7 bascule jk Sjf sans préemption
Sjf sans préemption Viens mélanger tes couleurs
Viens mélanger tes couleurs Le complément de nom
Le complément de nom Expressions avec avoir
Expressions avec avoir Ordonnancement des processus
Ordonnancement des processus Accord du verbe avec un nom collectif
Accord du verbe avec un nom collectif