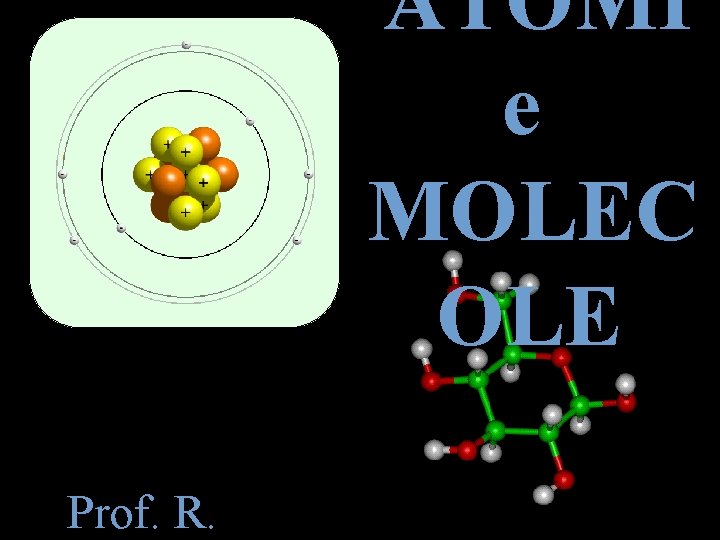
ATOMI e MOLEC OLE Prof R Sommario Gli
























































- Slides: 64

ATOMI e MOLEC OLE Prof. R.

Sommario Gli elementi I simboli chimici L’atomo Le particelle elementari La disposizione degli elettroni Il numero atomico (Z) Il peso atomico (A) La tavola periodica degli elementi La rappresentazione degli elementi Gli elementi e i composti chimici

Gli elementi In natura esistono, in tutto, 92 elementi naturali, individuati, in genere, con l’iniziale maiuscola del loro

Sono GLI STESSI 92 in tutto l’universo!

Ecco i principali (molti li conosci già): H idrogeno (dal francese hydrogène) C carbonio N azoto (dal latino nitrogenum) O ossigeno F fluoro P fosforo (dal latino

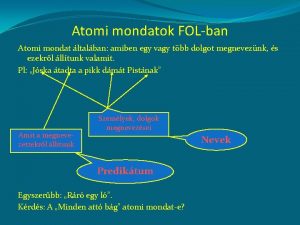
Questi elementi naturali sono fatti da atomi , che possiamo immaginare come minuscole palline cosa li distingue o. Che come bolle. uno dall’altro? Le particelle di cui

Le particelle elementari Ogni atomo è una particella costituita da un nucleo e dagli elettroni che si muovono intorno ad esso. Il nucleo è a sua volta formato da particelle chiamate protoni e neutroni.

elettr oni nucle o Clicca e guarda l’animazione di un

In questo atomo si vede che gli elettroni non si trovano tutti alla stessa distanza dal nucleo

I livelli energetici Gli elettroni si dispongono a distanze precise dal nucleo, chiamate livelli energetici o gusci energetici , che possiamo immaginare come superfici di sfere; gli elettroni che hanno più energia riescono a stare a

I livelli energetici

I livelli energetici sono sette e contengono un numero massimo e preciso di elettroni: Il 1° ne contiene al massimo 2 Il 2° e il 3° al massimo 8 ciascuno

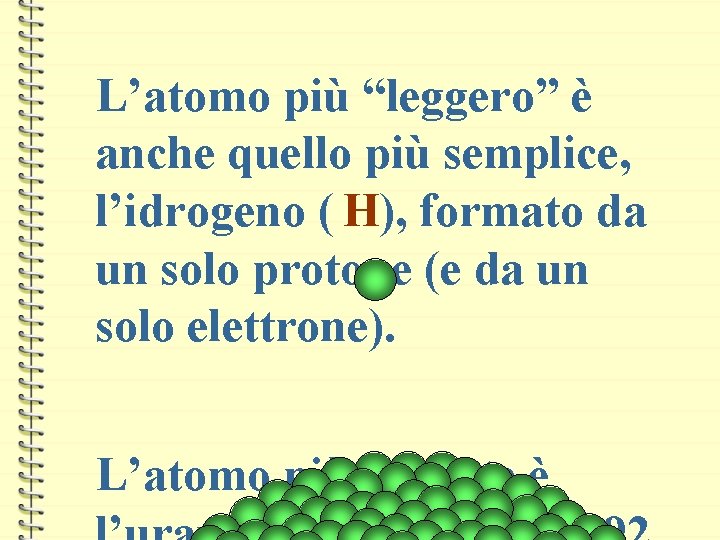
L’atomo più “leggero” è anche quello più semplice, l’idrogeno ( H), formato da un solo protone (e da un solo elettrone). L’atomo più pesante è

Gli atomi sono quindi formati dalle seguenti particelle subatomiche: particel simb carica massa la olo elettrica elettr one proto ne e - trascura bile + p + 1

L’atomo di idrogeno H 1 1 Z=1 A=1

L’atomo di elio Z=2 A=4 He 2 4

L’atomo di carbonio C 6 12 Z=6 A = 12 Nel nucleo dell’atomo di carbonio ci sono 6 protoni e 6 neutroni ed intorno ad esso si muovono 6 elettroni.

Numero atomico (Z) I diversi atomi sono caratterizzati dal numero di protoni che possiedono, detto numero atomico (Z). Gli elettroni sono nello stesso numero dei protoni, nell’atomo neutro. In genere nel nucleo ci sono tanti neutroni quanti

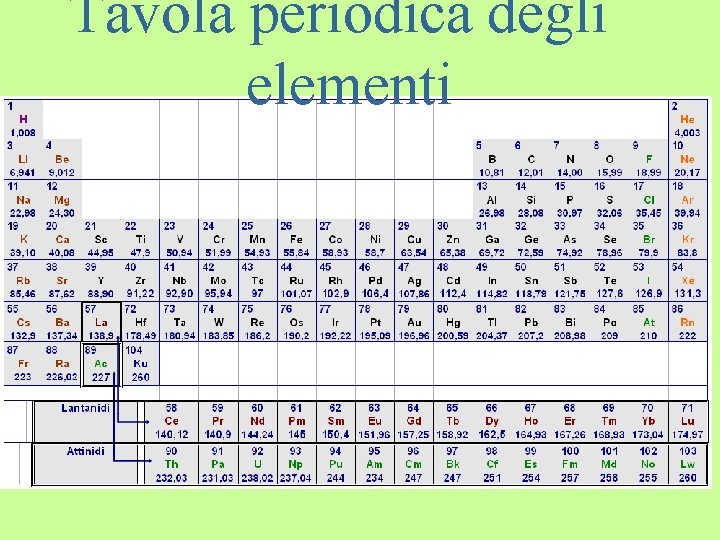
Gli elementi sono stati ordinati, secondo il numero di protoni (Z) crescente, in una speciale tabella, detta TAVOLA PERIODICA DEGLI ELEMENTI. (va letta seguendo le righe) come si vede, il carbonio occupa la posizione

Clicca sul pulsante e guarda una tavola periodica interattiva

Tavola periodica degli elementi

Perché gli atomi sono diversi tra loro Osserva le prossime rappresentazioni degli atomi, in cui è rappresentato il nucleo con un pallino al centro e sono stati messi in evidenza solo gli elettroni. Che cosa noti?

numero di elettroni = 1

numero di elettroni = 2

numero di elettroni = 3

numero di elettroni = 4

numero di elettroni = 5

numero di elettroni = 6

numero di elettroni = 7

numero di elettroni = 8

numero di elettroni = 9

numero di elettroni = 10

numero di elettroni = 11

numero di elettroni = 12

numero di elettroni = 13

numero di elettroni = 14

numero di elettroni = 15

numero di elettroni = 16

numero di elettroni = 17

numero di elettroni = 18

numero di elettroni = 19

numero di elettroni = 20

numero di elettroni = 26 !

numero di elettroni = 92 !!!

Si vede che: - il numero di elettroni cresce di uno alla volta, come i protoni; - gli elettroni si dispongono a distanze via crescenti dal nucleo, su “gusci sferici” chiamati livelli energetici; - gli elettroni aggiuntivi occupano via il livello energetico più esterno.

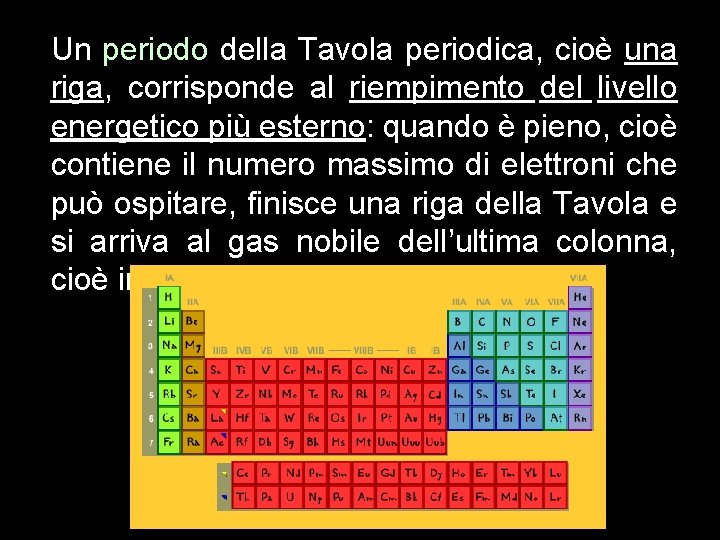
Un periodo della Tavola periodica, cioè una riga, corrisponde al riempimento del livello energetico più esterno: quando è pieno, cioè contiene il numero massimo di elettroni che può ospitare, finisce una riga della Tavola e si arriva al gas nobile dell’ultima colonna, cioè in fin di riga.

Peso atomico (A) La massa di un atomo, cioè la sua quantità di materia, non si può misurare certo in chili, ma neppure in grammi, che sono quantità enormi. Come unità di misura viene utilizzata la massa stessa del protone, che vale 1: massa del protone = 1 massa del neutrone = 1 massa dell’elettrone =

Peso atomico (A) La massa di un atomo, quindi, è praticamente tutta concentrata nel suo nucleo ed è data solo dalla somma delle masse di protoni e + neutroni: A = p + n simbol Numero atomico e peso numero o atomico si indicano a Z dell’at peso sinistra del simbolo omo A dell’atomo, atomico con piccoli A

Quindi, ad esempio: il carbonio ha 6 protoni nel nucleo, per cui: il suo numero atomico è 6 ha anche 6 elettroni ha 6 neutroni nel nucleo (tanti quanti i protoni), quindi il peso atomico è 12, cioè la Z numero 6 atomico massa dei protoni più quella A peso 12 dei neutroni. atomico C

Come si rappresentano gli Gli atomi si atomi rappresent idrog fosfor ano mediante delle palline; quelli più utilizzati hanno dei P H eno o C carbo nio S zolfo O ossig eno N azoto

Elementi chimici Gli elementi idrog eno ossigen o elio atmosf erico azot chimici sono formati da uno o più atomi dello stesso tipo. zolf o

Legami chimici Gli atomi hanno la capacità di legarsi fra loro, grazie a legami chimici , formando così le molecole. Questa capacità è dovuta al fatto di mettere in comune gli elettroni presenti sul livello energetico più

Le molecole I legami chimici vengono rappresentati da barrette che uniscono i pallini fra loro. Ogni volta che due o più atomi si legano fra loro, si forma una molecola …

Le molecole …come l’acqua, formata da due atomi di idrogeno ed uno di ossigeno, secondo la Inota formula legami possono chimica Hanche 2 O. essere sottintesi, per cui si rappresen-tano solo gli atomi, vicini fra

Formule chimiche La formula chimica indica il tipo ed il numero di atomi 2 presenti: H (si indica con un H 2 O numero piccolo, in basso, (1) O (l’ 1 è detto indice ) sottinteso)

Composti I composti chimici sono formati da acqua atomi di tipo H 2 O diverso, e perciò sono tutti molecole. biossido di metano carbonio (anidride ammoni aca NH

Composti Gli elementi di partenza possono chimici essere anche molto diversi. + Na sodio metallo tenero = Cl cloro gas verdastro, velenoso Na. Cl sale da cucina solido

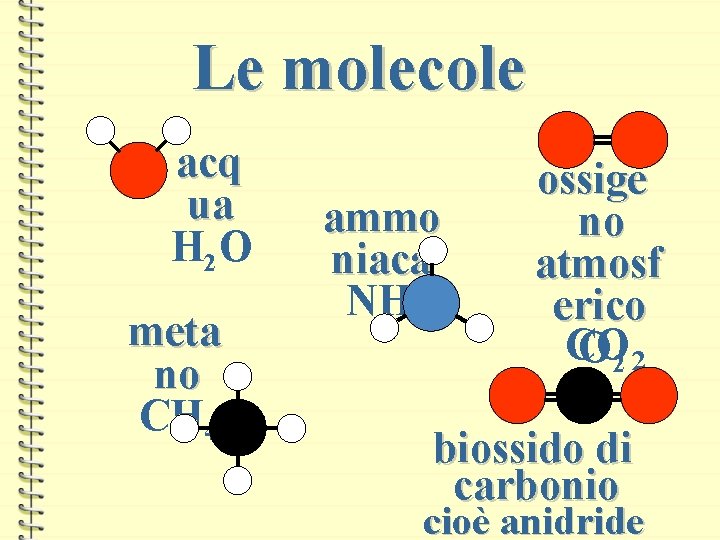
Le molecole acq ua H 2 O meta no CH 4 ammo niaca NH 3 ossige no atmosf erico CO O 2 2 biossido di carbonio cioè anidride

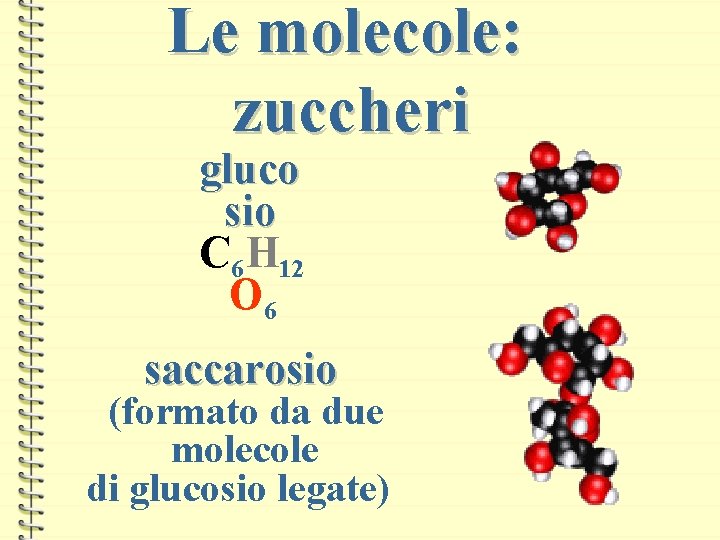
Le molecole: zuccheri gluco sio C 6 H 12 O 6 saccarosio (formato da due molecole di glucosio legate)

Le molecole alcool etilico C 2 H 5 OH cloroformio (contiene cloro, in verde) CHCl 3

Atomi e molecole, elementi e composti compost elementi i atomi (raccolti nella Tavola periodica) moleco le He, Ne, Ar… (gas nobili: atomi “solitari”) H 2 , O 2 , N 2 , S 8 … H 2 O, CH 4 , CO , H O ,

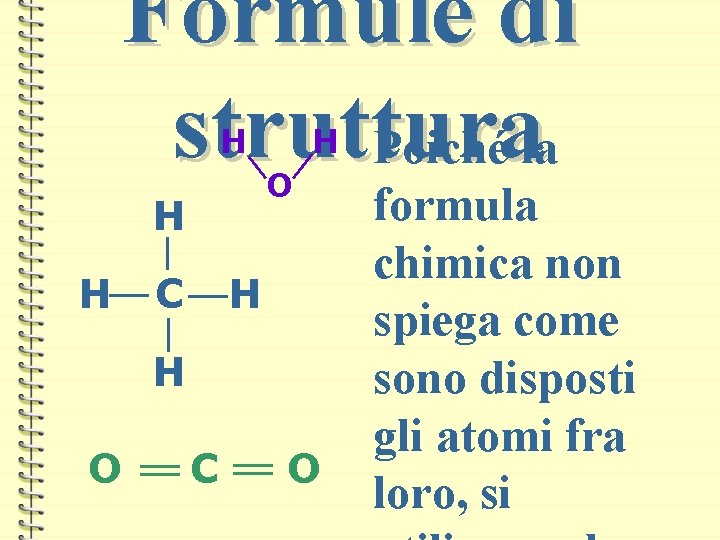
Formule di struttura Poiché la H O H H H C H H O C O formula chimica non spiega come sono disposti gli atomi fra loro, si

Riassumend o il discorso…

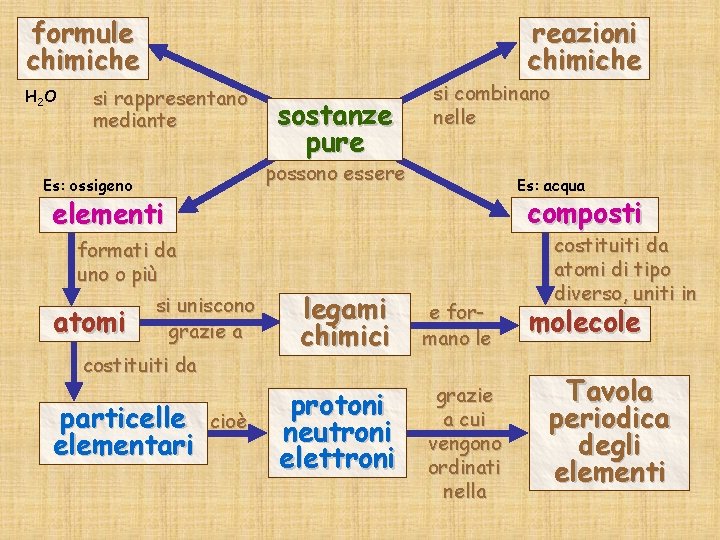
formule chimiche H 2 O reazioni chimiche si rappresentano mediante sostanze pure si combinano nelle possono essere Es: ossigeno Es: acqua composti elementi formati da uno o più si uniscono atomi grazie a costituiti da particelle elementari cioè legami chimici protoni neutroni elettroni e formano le grazie a cui vengono ordinati nella costituiti da atomi di tipo diverso, uniti in molecole Tavola periodica degli elementi
 Formula risolutiva equazione spuria
Formula risolutiva equazione spuria Sommario excel
Sommario excel Kovkost
Kovkost Masa atomica
Masa atomica Aldopentosi
Aldopentosi Atomi tömegegység jele
Atomi tömegegység jele Atomi studio youtube
Atomi studio youtube Kemija 7 razred ponavljanje
Kemija 7 razred ponavljanje S2p6d10f14
S2p6d10f14 Denumirea oxizilor
Denumirea oxizilor Geometria triangolare planare
Geometria triangolare planare Hidrogeniranje etena
Hidrogeniranje etena Ole
Ole Valvet revolver
Valvet revolver Ole michael jensen
Ole michael jensen Infoready uark
Infoready uark Ole cross method
Ole cross method Ole db to opc
Ole db to opc Scenariusz imprezy
Scenariusz imprezy Ole blackboard bristol
Ole blackboard bristol Ole e andersen
Ole e andersen Akkurativ
Akkurativ Define object linking and embedding (ole).
Define object linking and embedding (ole). Ole damsgaard
Ole damsgaard Kerneprocesser
Kerneprocesser Slp dse
Slp dse Lernsax.dde
Lernsax.dde Flux ole
Flux ole /watch?v=-e74r4-lupk
/watch?v=-e74r4-lupk Young living öle starterset
Young living öle starterset Ole
Ole Ole hampenberg andersen
Ole hampenberg andersen Ole christian lingjærde
Ole christian lingjærde Jason hale ole miss
Jason hale ole miss Ole henrik magga
Ole henrik magga Chun swaw
Chun swaw Jupas ole sample
Jupas ole sample Lars ole jensen advokat
Lars ole jensen advokat Flemming ole nielsen
Flemming ole nielsen Plakkruptur
Plakkruptur Havebruser med solceller
Havebruser med solceller Ole michael jensen
Ole michael jensen Driftsydelser
Driftsydelser Bpgsa
Bpgsa Ole petter askheim
Ole petter askheim Uniknæ
Uniknæ Dolinski
Dolinski Afuaga ole gagana samoa
Afuaga ole gagana samoa Ole henrik magga
Ole henrik magga Ole tipis girls
Ole tipis girls Harry s murphy ole miss
Harry s murphy ole miss Ole jonny klakegg
Ole jonny klakegg Oea jupas sample
Oea jupas sample Alagaupu fa'asamoa ma uiga
Alagaupu fa'asamoa ma uiga Epsco host
Epsco host Ole john østenstad
Ole john østenstad Ole henrik hansen
Ole henrik hansen Ole orm
Ole orm Kuali ole
Kuali ole Ole i trufa analiza
Ole i trufa analiza Gli angeli che ci proteggono
Gli angeli che ci proteggono Gli oggetti ci appaiono colorati perché
Gli oggetti ci appaiono colorati perché Il girotondo delle piccole bretoni
Il girotondo delle piccole bretoni Organi di senso mappa concettuale
Organi di senso mappa concettuale La struttura del testo narrativo
La struttura del testo narrativo