AMNO ASTLERN ZELLKLER Prof Dr Kader KSE KRAL




















![İyonizasyonun p. H ve p. K ile İlişkisi p. H = -log[H+] = log(1/[H+]) İyonizasyonun p. H ve p. K ile İlişkisi p. H = -log[H+] = log(1/[H+])](https://slidetodoc.com/presentation_image_h/9ecaa6f4736ff782b09c13dc62f87323/image-31.jpg)

![K = [H+][A-]/[HA] p. K = - log. K p. H = p. K = [H+][A-]/[HA] p. K = - log. K p. H = p.](https://slidetodoc.com/presentation_image_h/9ecaa6f4736ff782b09c13dc62f87323/image-33.jpg)











![0. 1 M Na. OH ile 0. 1 M Glutamatın Titrasyonu G -] = 0. 1 M Na. OH ile 0. 1 M Glutamatın Titrasyonu G -] =](https://slidetodoc.com/presentation_image_h/9ecaa6f4736ff782b09c13dc62f87323/image-51.jpg)
















- Slides: 76

AMİNO ASİTLERİN ÖZELLİKLERİ Prof. Dr. Kader KÖSE

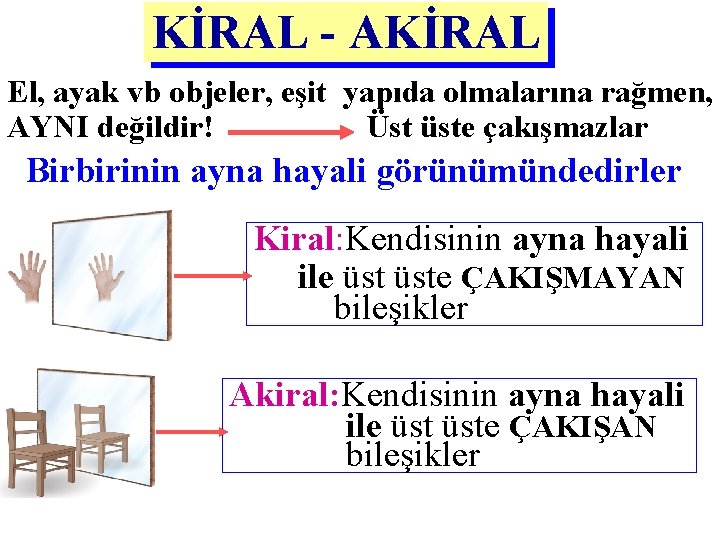
KİRAL - AKİRAL El, ayak vb objeler, eşit yapıda olmalarına rağmen, AYNI değildir! Üst üste çakışmazlar Birbirinin ayna hayali görünümündedirler Kiral: Kendisinin ayna hayali ile üste ÇAKIŞMAYAN bileşikler Akiral: Kendisinin ayna hayali ile üste ÇAKIŞAN bileşikler

KİRAL - KARBON Kiral Karbon Atomu (kiralite merkezi) Birbirinden farklı 4 atom, atom grubu veya fonksiyonel grup bağlı karbon atomu Asimetrik karbon atomu (C ) Kiral karbon içeren organik bileşiğin ayna hayali kendisi ile üste ÇAKIŞMAZ

STEREOİZOMER Asimetrik karbon atomu (C )’nun varlığı, o organik bileşiğin stereoizomerlerinin oluşmasını sağlar bağlar Kimyasal formül Aynı Stereoizomer Atomların boşluktaki Farklı düzenlenişi

ENANTİOMER Birbirinin ayna hayali görünümünde olan izomer çifti (Stereoizomerlerin alt grubu) ENANTİOMER = ANTİMER OPTİK İZOMER

STEOİZOMERLER n İzomer sayısı = 2 (n: C sayısı) n =1 2 izomer (C etrafındaki 4 farklı grup, boşlukta iki farklı şekilde düzenlenebilir)

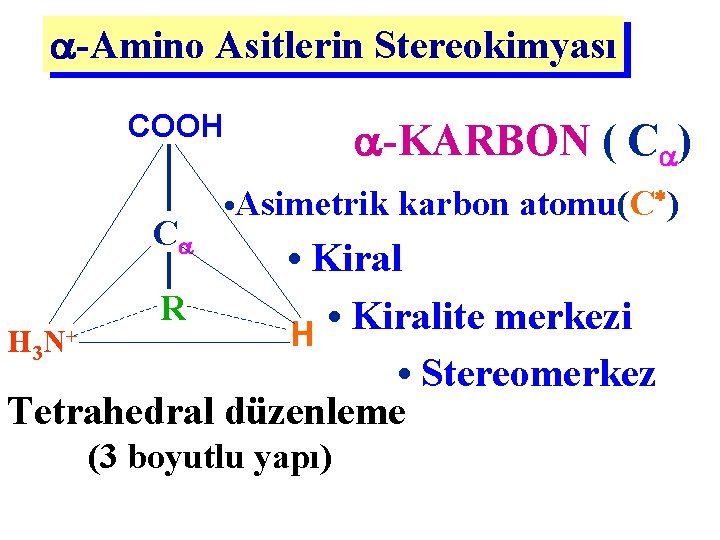
-Amino Asitlerin Stereokimyası COOH C -KARBON ( C ) ) • Asimetrik karbon atomu(C • Kiral R • Kiralite merkezi H H 3 N+ • Stereomerkez Tetrahedral düzenleme (3 boyutlu yapı)

Kiral karbon atom -Karbon atomu taşıyan tüm AA lerde (Glisin dışında), en az bir tane C* vardır • Protein yapısındaki 19 standart AA KİRAL Glisin Kiral değil Yan zincir: H atomu

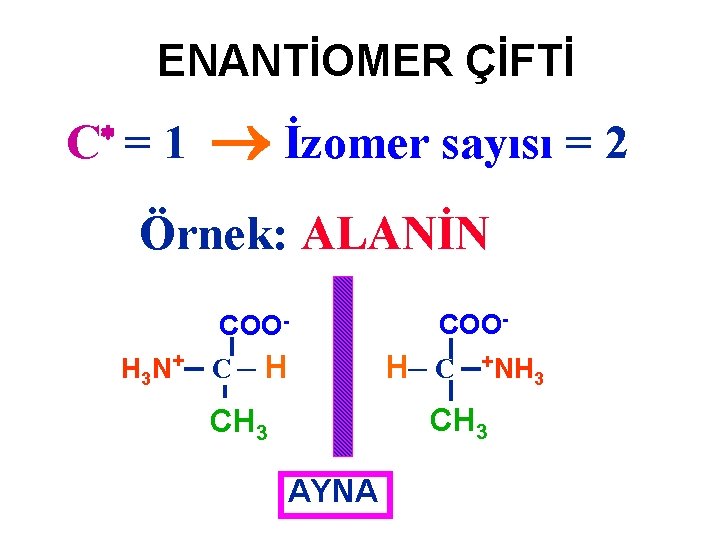
ENANTİOMER ÇİFTİ İzomer sayısı = 2 C = 1 Örnek: ALANİN COO- COOH 3 N+– C – H CH 3 H– C –+NH 3 CH 3 AYNA

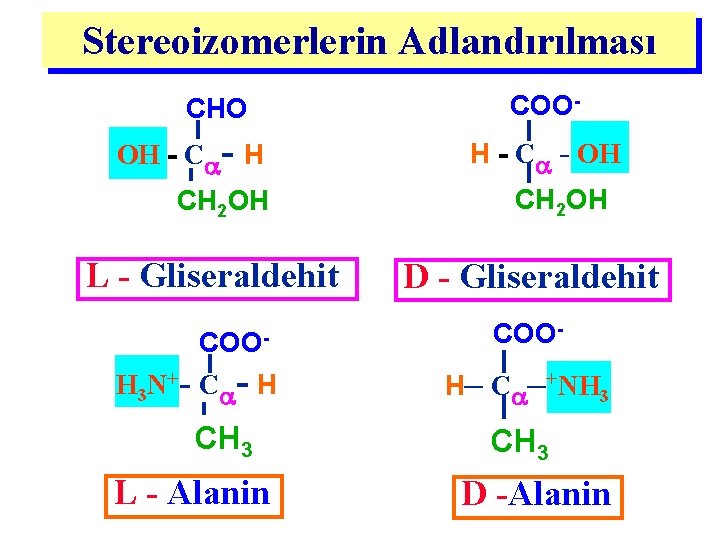
Stereoizomerlerin Adlandırılması : GLİSERALDEHİT( Referans birleşik ) (C içeren en küçük yapılı monosakkarid) C etrafındaki absolu konformasyon, gliseraldehit ile ilişkilendirilir L-Gliseraldehit D-Gliseraldehit D ve L Asimetrik karbon etrafındaki 4 Grubun konformasyonunu gösterir

Stereoizomerlerin Adlandırılması CHO OH - C - H CH 2 OH L - Gliseraldehit COO H 3 N+- C - H CH 3 L - Alanin COOH - C - OH CH 2 OH D - Gliseraldehit COOH– C –+NH 3 CH 3 D -Alanin

STEREOİZOMERLER n =2 4 stereoizomer (C etrafındaki 4 farklı grup, boşlukta 4 farklı şekilde düzenlenebilir) 2 izomer enantiomer 2 izomer diastereomer enantiomer diastereomer (birbirinin ayna hayali görünümünde olmayıp, farklı kimyasal özelliklere sahip izomerler)

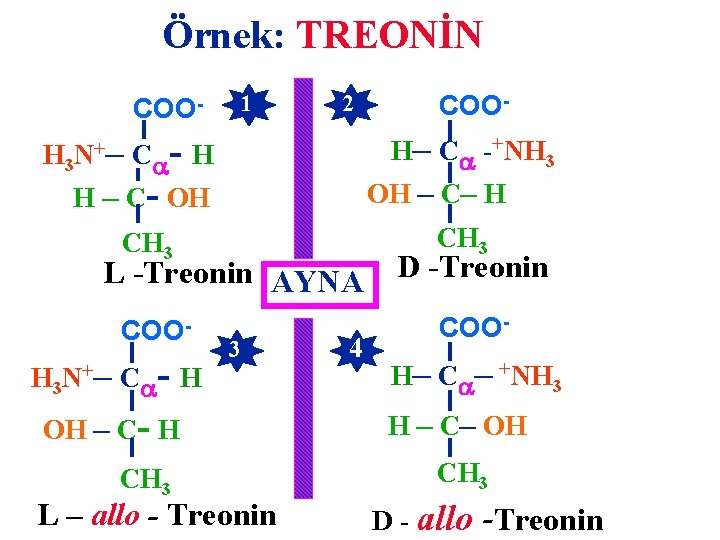
n=2 C içeren AAler • Treonin • İzolösin • Sistin • 4 - OH - Prolin • 5 - OH - Lizin 4 stereoizomer

Örnek: TREONİN 1 COON+ H 3 2 COOH– C -+NH 3 – C - H H – C- OH – C– H CH 3 L -Treonin AYNA COO- H 3 N+– C - H 3 4 D -Treonin COO- H– C – +NH 3 OH – C- H H – C– OH CH 3 L – allo - Treonin D - allo -Treonin

D ve L - İZOMERLER Kiral karbon içeren tüm biyomoleküller, doğal olarak sadece bir stereomerik formda bulunurlar: D veya L Doğal amino asitlerin büyük bir kısmı, -karbon atomu etrafında aynı düzenlemeye sahiptir Standart AAler (protein yapısı) } L - konfigürasyon

D – konfigürasyon Doğal D-amino asitler: • Protein yapısında bulunmazlar • Bazı peptid yapılarında bulunurlar - antibiyotikler - bakteri hücre duvarı Sentetik AAler } D – konfigürasyon

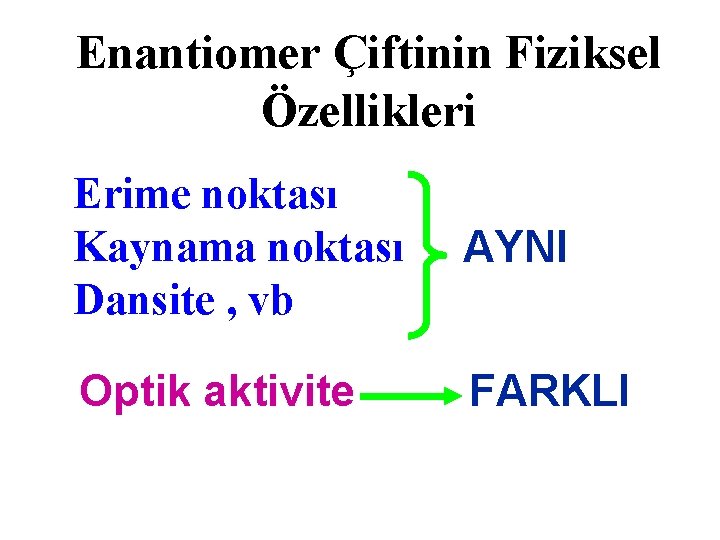
Enantiomer Çiftinin Fiziksel Özellikleri Erime noktası Kaynama noktası Dansite , vb AYNI Optik aktivite FARKLI

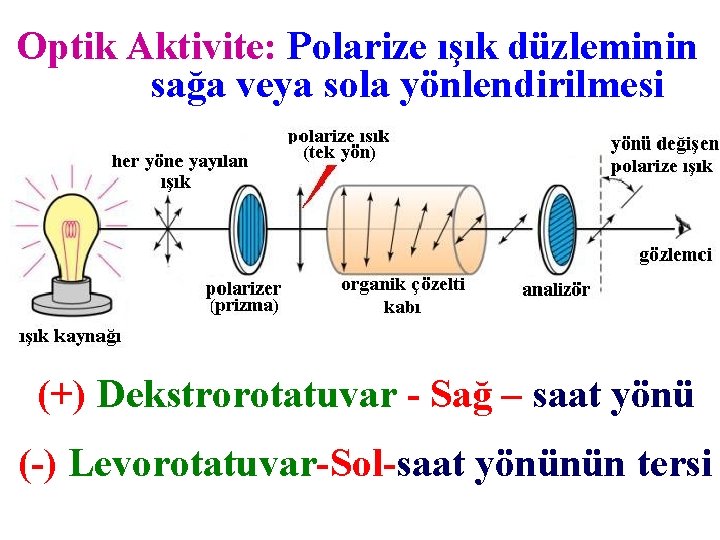
Optik Aktivite: Polarize ışık düzleminin sağa veya sola yönlendirilmesi (+) Dekstrorotatuvar - Sağ – saat yönü (-) Levorotatuvar-Sol-saat yönünün tersi

Optik Aktivite Enantiomerler: Optikçe aktif Antimer çiftini oluşturan D ve L izomerler polarize ışık düzlemini, birbirine eşit fakat zıt yönde çevirirler D ve L: Optik aktivitenin yönünü göstermez

Optik Aktivite RASEMİK KARIŞIMLAR: optikçe aktif değil Kimyasal sentezle oluşan kiral bileşikler (eşit miktarda D ve L izomer karışımı) (Örnek: DL – Alanin) C içermeyen bileşikler: Optikçe aktif değil

Amino Asitlerin İyonizasyonu Amino Asitler, sulu çözeltilerinde iyonize olurlar İyonize AAler, ortam p. H’sına göre • Asidik • Bazik • Nötral özellik kazanırlar

Amino Asitlerin İyonizasyon davranışlarına göre sınıflandırılması • Nötral: monoamino-monokarboksilik AAler - Noniyonize yan zincir - Polar yan zincir • Asidik: monoamino-dikarboksilik AAler • Bazik: diamino-monokarboksilik AAler

Monoamino-monokarboksilik AAler • Nötral sulu ortamlarda COOH H 2 N – C – H COO H 3 N+ – C – H intramoleküler asit-baz reak. u R Non- iyonik form (önemsiz) Net yük: 0 R Zwitteriyon form (dipolar iyon) Net yük: 0

Dipolar Amino asit (zwitteriyon) • Asidik ortamda COO- H 3 N+ – C – H + + H R dipolar iyon net yük: 0 COOH H 3 N+ – C – H R diprotik iyon net yük: +1 Dipolar AA, asidik ortamda BAZ gibi davranır (proton alır: akseptör)

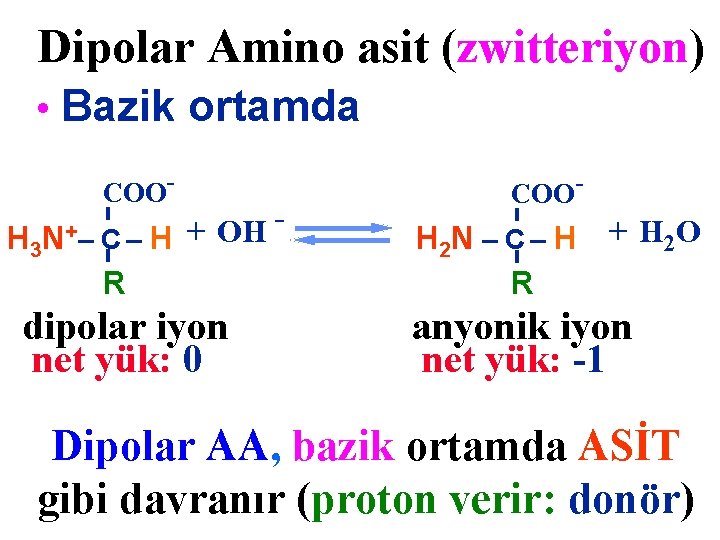
Dipolar Amino asit (zwitteriyon) • Bazik ortamda COO- H 3 N+ – C– H + OH R dipolar iyon net yük: 0 COO- H 2 N – C – H R + H 2 O anyonik iyon net yük: -1 Dipolar AA, bazik ortamda ASİT gibi davranır (proton verir: donör)

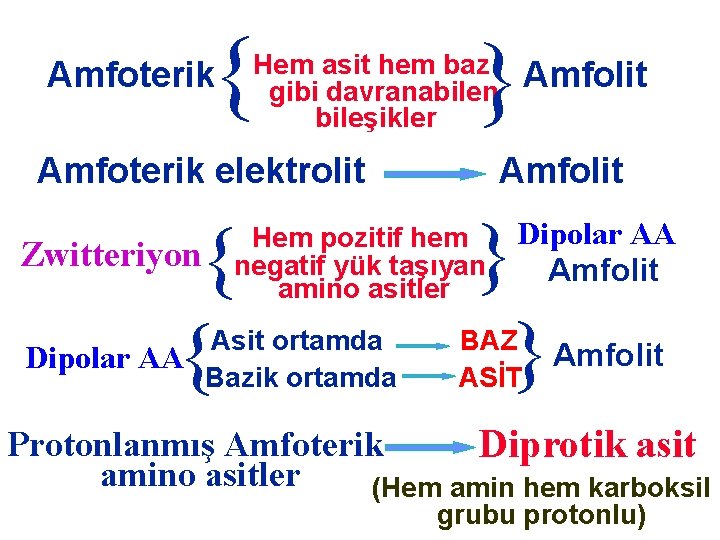
} } Hem asit hem baz gibi davranabilen bileşikler Amfoterik elektrolit Amfolit } } Hem pozitif hem negatif yük taşıyan amino asitler } } Zwitteriyon Asit ortamda Dipolar AA Bazik ortamda Amfolit Dipolar AA Amfolit BAZ ASİT Amfolit Protonlanmış Amfoterik Diprotik asit amino asitler (Hem amin hem karboksil grubu protonlu)

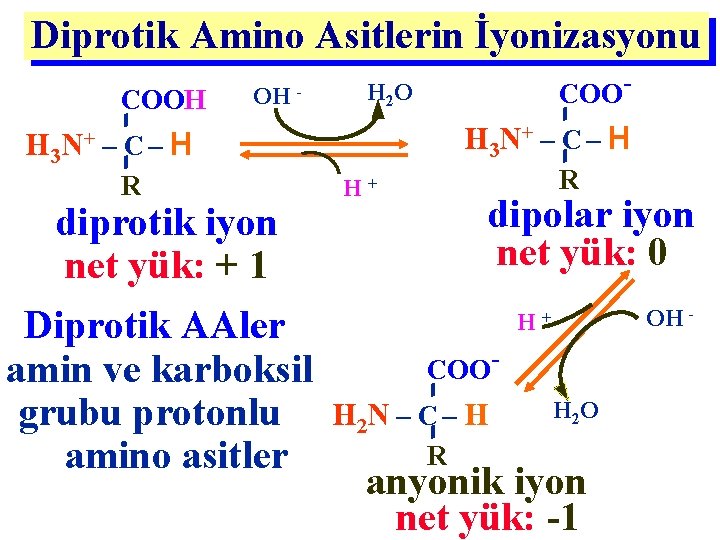
Diprotik Amino Asitlerin İyonizasyonu COOH OH - COO- H 2 O H 3 N+ – C – H R diprotik iyon net yük: + 1 Diprotik AAler amin ve karboksil grubu protonlu amino asitler R H + dipolar iyon net yük: 0 OH - H + COO- H 2 N – C – H R H 2 O anyonik iyon net yük: -1

Diprotik Amino Asitlerin İyonizasyonu Diprotik/katyonik Tamamen protonlu Dipolar/Zwitteriyon yarıya protonlu Anyonik Tamamen protonsuz Amin ve karboksil grubu protonlanmış diprotik AAler ortama 2 proton verirler

Diprotik Amino Asitlerin İyonizasyonu Ortam p. H’sına bağımlı k o n s a n t r a s y o n Zwitteriyon form (Dipolar iyon) Diprotik form Anyonik form

Amino Asitlerin İyonizasyonu Amino Asitler • Zayıf poliprotik asitlerdir • Her biri dissosiye olabilen protonlar içerir • Protonların dissosiyasyon derecesi ortamın p. H’sına bağlıdır
![İyonizasyonun p H ve p K ile İlişkisi p H logH log1H İyonizasyonun p. H ve p. K ile İlişkisi p. H = -log[H+] = log(1/[H+])](https://slidetodoc.com/presentation_image_h/9ecaa6f4736ff782b09c13dc62f87323/image-31.jpg)
İyonizasyonun p. H ve p. K ile İlişkisi p. H = -log[H+] = log(1/[H+]) Zayıf bir asit : HA H+ + A K = [H+][A-]/[HA] K: dissosiyasyon sabiti (Asitin iyonize olma eğilimi) p. K = - log. K p. K: İyonizasyon için denge sabiti (Proton verme eğiliminin ölçüsü)

İyonizasyonun p. H ve p. K ile İlişkisi Zayıf bir asit : HA H+ + A- p. K = p. H + log ([HA]/[A-]) Asit % 50 iyonize olduğunda, [HA] = [A -] p. K = p. H Bir asit grubunun p. K’sı: Protonlu ve protonsuz türlerin eşit konsantrasyonda olduğu p. H değeri
![K HAHA p K log K p H p K = [H+][A-]/[HA] p. K = - log. K p. H = p.](https://slidetodoc.com/presentation_image_h/9ecaa6f4736ff782b09c13dc62f87323/image-33.jpg)
K = [H+][A-]/[HA] p. K = - log. K p. H = p. K + log ([A-] / [HA]) p. K: Asitin iyonize olma eğilimi • K: 10 kat arttığında • K: 10 kat azaldığında p. K - 1 p. K + 1

Amino Asitlerin Titrasyon Eğrileri Titrasyon: Protonların dereceli olarak ortama ilave edilmesi veya ortamdan uzaklaştırılması Eşdeğer gram asit = Eşdeğer gram baz

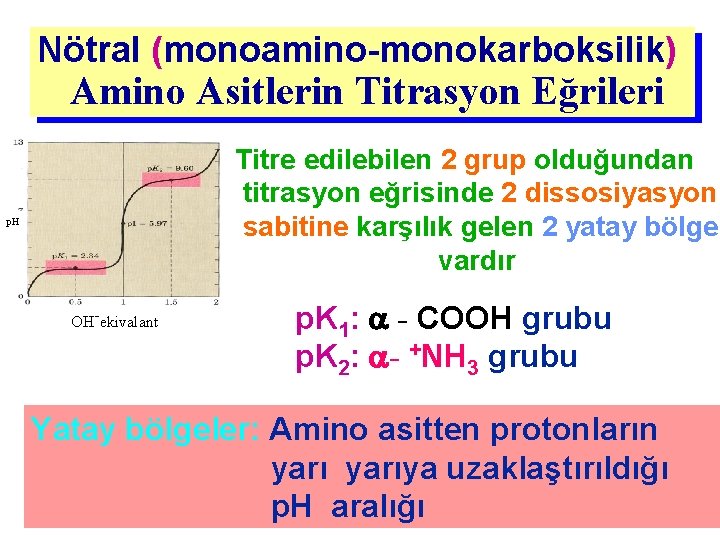
Nötral (monoamino-monokarboksilik) Amino Asitlerin Titrasyon Eğrileri Titre edilebilen 2 grup olduğundan titrasyon eğrisinde 2 dissosiyasyon sabitine karşılık gelen 2 yatay bölge vardır p. H OH-ekivalant p. K 1: - COOH grubu p. K 2: - +NH 3 grubu Yatay bölgeler: Amino asitten protonların yarıya uzaklaştırıldığı p. H aralığı

Nötral (monoamino-monokarboksilik) Amino Asitlerin Titrasyon Eğrileri Titre edilebilen gruplar • - Amino ( +NH 3 ) • - Karboksil (COOH) Örnek: Glisin (Gly)

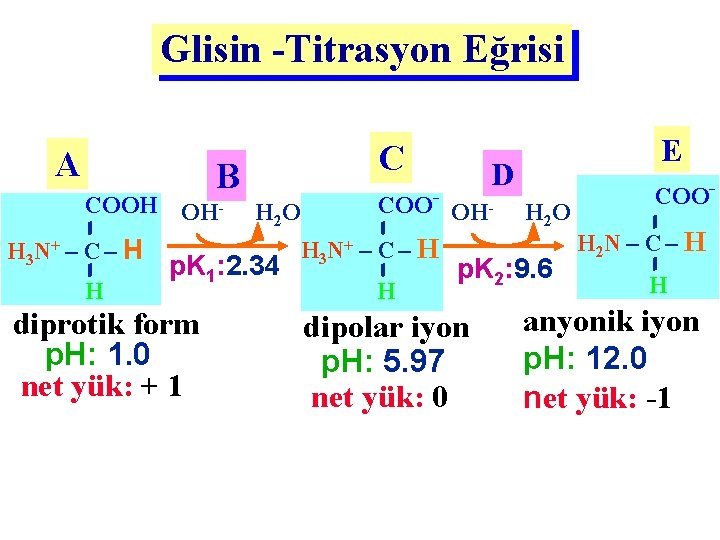
Glisin -Titrasyon Eğrisi A B COOH OH- H O 2 H 3 N+ – C – H H C COO- D E COO- OH- H 2 O H 2 N – C – H H 3 N+ – C – H p. K 1: 2. 34 p. K 2: 9. 6 H diprotik form p. H: 1. 0 net yük: + 1 dipolar iyon p. H: 5. 97 net yük: 0 anyonik iyon p. H: 12. 0 net yük: -1

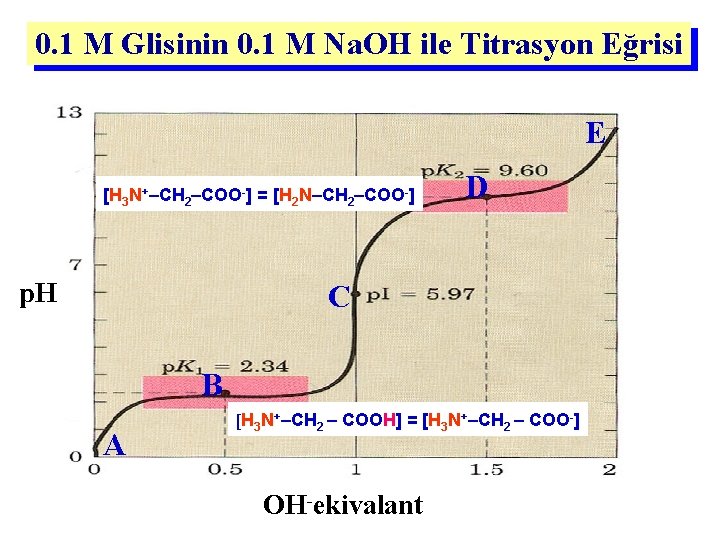
0. 1 M Glisinin 0. 1 M Na. OH ile Titrasyon Eğrisi E [H 3 N+–CH 2–COO-] = [H 2 N–CH 2–COO-] p. H D C B A [H 3 N+–CH 2 – COOH] = [H 3 N+–CH 2 – COO-] OH-ekivalant

Titrasyon eğrisinden elde edilen bilgiler • İyonize grupların p. K değerleri kantitatif olarak elde edilir Glisin için: p. K 1 ( - COOH) 2. 34 p. K 2 ( - NH 3) 9. 60

Monoamino-monokarboksilik (noniyonize R grubu içeren) tüm - amino asitler için Sınır Ortalama p. K 1 ( - COOH) : 1. 8 - 2. 4 2. 0 p. K 2 ( - NH 3) : 8. 8 - 11. 0 10. 0

• AAlerin tampon özelliğine sahip olduğu p. H değerlerini (p. H aralığı) gösterir Tamponlama + Ortamdaki [ H ]’nın sabit tutulması Tamponlama kapasitesi p. H= (p. K 1 )

Glisin için tamponlama p. K değerlerinin civarı p. H = (2. 34 1 ) 1. 34 – 3. 34 p. H = (9. 60 1 ) 8. 6 – 10. 6 Glisin vb nötral AAler İntraselüler sıvı/kan gibi fizyolojik ortamlar ( p. H 7. 0)’ da TAMPONLAMA YAPAMAZLAR !!!

• AAlerin izoelektrik nokta(p. I)’sını gösterir İzoelektrik nokta (p. I): Amino asitin üzerindeki pozitif yükün negatif yüke eşit olduğu ( net yük: 0) p. H değeri

Monoamino-monokarboksilik (noniyonize R grubu içeren) tüm amino asitlerde: p. I=(p. K 1 + p. K 2) / 2 Glisin için p. I = (2. 34 + 9. 60) / 2 = 5. 97 p. H 5. 97’de Glisin (dipolar form): yüksüz

• AAlerin elektrik yükleri ile ortam p. H’sı arasındaki ilişkiyi gösterir p. H Net Yük 1. 0 p. K 1 p. I p. K 2 12. 0 +1 +0. 5 0 -0. 5 -1 p. H p. I Net yük daima pozitif ( katyonik form) p. H p. I Net yük daima negatif ( anyonik form)

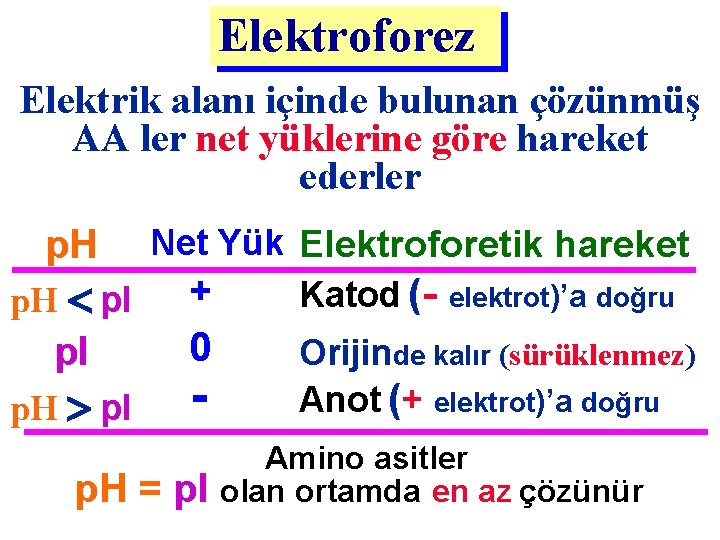
Elektroforez Elektrik alanı içinde bulunan çözünmüş AA ler net yüklerine göre hareket ederler Net Yük Elektroforetik hareket Katod (- elektrot)’a doğru p. H p. I + 0 Orijinde kalır (sürüklenmez) p. I Anot (+ elektrot)’a doğru p. H p. I - p. H = p. I Amino asitler olan ortamda en az çözünür

İyonize Yan Zincir Taşıyan AAlerin Titrasyon Eğrileri • Daha komplekstir • 3 Farklı iyonizasyon basamağına karşılık gelen 3 bölge vardır • 3 farklı p. K değerleri vardır • p. H’a bağımlı 4 farklı iyonize formları vardır

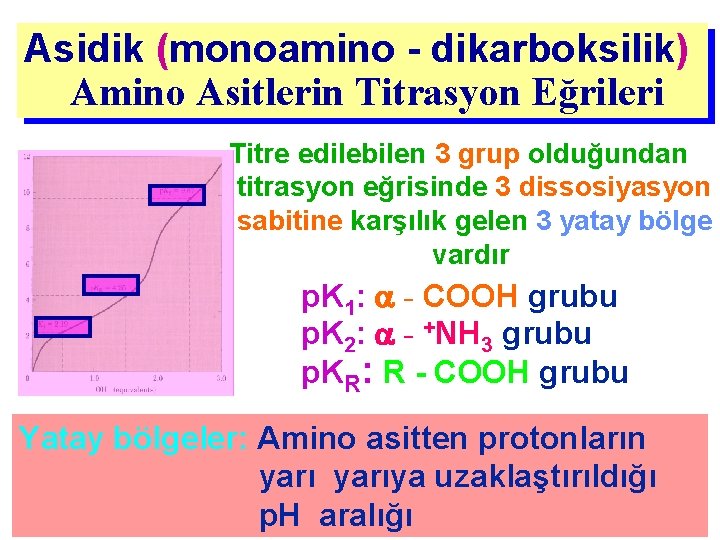
Asidik (monoamino - dikarboksilik) Amino Asitlerin Titrasyon Eğrileri Titre edilebilen 3 grup olduğundan titrasyon eğrisinde 3 dissosiyasyon sabitine karşılık gelen 3 yatay bölge vardır p. K 1: - COOH grubu p. K 2: - +NH 3 grubu p. KR: R - COOH grubu Yatay bölgeler: Amino asitten protonların yarıya uzaklaştırıldığı p. H aralığı

Asidik ( monoamino - dikarboksilik) Amino Asitlerin Titrasyon Eğrileri Titre edilebilen gruplar • - Amino (+NH 3 ) • - Karboksil (COOH) • Yan zincir (COOH) Örnek: Glutamat (Glu)

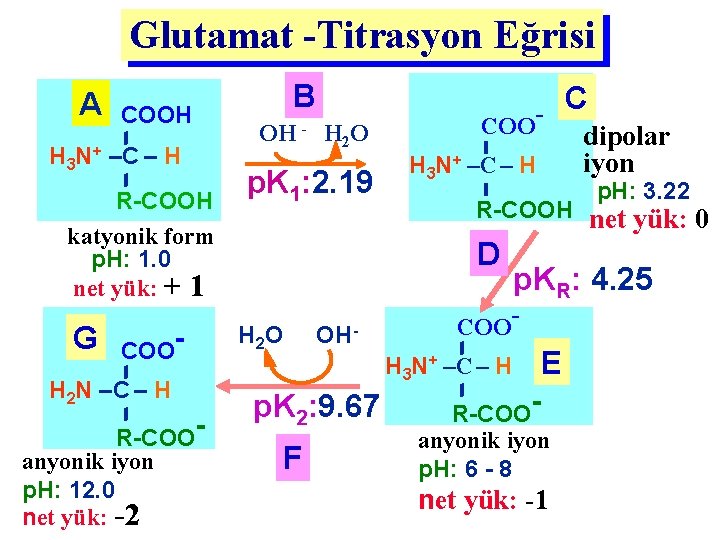
Glutamat -Titrasyon Eğrisi A H 3 N+ B COOH OH - H 2 O –C – H p. K 1: 2. 19 R-COOH katyonik form p. H: 1. 0 net yük: + 1 G COO- H 2 N –C – H R-COO- anyonik iyon p. H: 12. 0 net yük: -2 COOH 3 N+ –C – H R-COOH D H 2 O OH- p. K 2: 9. 67 F C dipolar iyon p. H: 3. 22 net yük: 0 p. KR: 4. 25 COOH 3 N+ –C – H E R-COO- anyonik iyon p. H: 6 - 8 net yük: -1
![0 1 M Na OH ile 0 1 M Glutamatın Titrasyonu G 0. 1 M Na. OH ile 0. 1 M Glutamatın Titrasyonu G -] =](https://slidetodoc.com/presentation_image_h/9ecaa6f4736ff782b09c13dc62f87323/image-51.jpg)
0. 1 M Na. OH ile 0. 1 M Glutamatın Titrasyonu G -] = [H N–CH – COO-] [H 3 N+–CH – COO 2 R-COO p. K 2 = 9. 67 [H 3 N+–CH – COO-] = [H 3 N+–CH – COO-] R-COOH R-COO p. H p. KR: 4. 25 p. K 1: 2. 19 B A p. I: 3. 22 C F E D [H 3 N+–CH – COOH] = [H 3 N+–CH – COO-] R-COOH OH- ekivalent

Asidik (monoamino - dikarboksilik) Amino Asitlerin p. I değeri p. I: Net yükün “O” olduğu p. H’nın, bir önceki (p. K 1)ve bir sonraki p. K(p. KR ) değerlerinin aritmetik ortalaması ) Glutamat için p. I = (p. K 1 + p. KR ) / 2 p. I = (2. 19 + 4. 25) / 2 = 3. 22 p. H 3. 22’de: Glutamat (dipolar form): yüksüz

Glutamat için tamponlama p. K değerlerinin civarı p. H = (2. 19 1 ) 1. 19 – 3. 19 p. H = (4. 25 1 ) p. H = (9. 67 1 ) 3. 25 – 5. 25 8. 67 – 10. 67 Glutamat vb asidik AAler İntraselüler sıvı/kan gibi fizyolojik ortamlar ( p. H 7. 0)’ da TAMPONLAMA YAPAMAZLAR !!!

Bazik (diamino - monokarboksilik) Amino Asitlerin Titrasyon Eğrileri Titre edilebilen 3 grup olduğundan titrasyon eğrisinde 3 dissosiyasyon sabitine karşılık gelen 3 yatay bölge vardır p. H OH- ekivalent p. K 1: - COOH grubu p. K 2: - +NH 3 grubu p. KR: R - +NH 3 grubu Yatay bölgeler: Amino asitten protonların yarıya uzaklaştırıldığı p. H aralığı

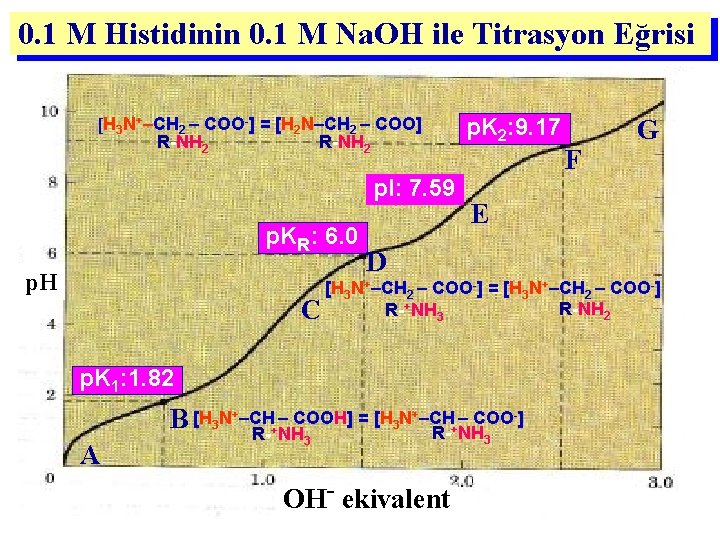
Bazik (diamino - monokarboksilik) Amino Asitlerin Titrasyon Eğrileri Titre edilebilen gruplar • - Amino( +NH 3 ) • - Karboksil (COOH) • Yan zincir ( +NH 3 ) Örnek: Histidin (His)

Histidin -Titrasyon Eğrisi A COOH OH - H H H 3 N+ –C – R-+NH C B 2 O p. K 1: 1. 82 p. H: 3 - 5 H net yük: + 1 R-+NH 3 OH D p. KR: 6. 0 H 3 N+ –C – 3 katyonik form p. H: 1. 0 net yük: + 2 G COO- COO katyonik form H 2 O OH- H 2 O COO- E +–C–H H N 3 H 2 N –C – H R-NH 2 R-NH p. K : 9. 17 2 2 dipolar iyon F anyonik iyon p. H: 7. 59 net yük: 0 p. H: 12. 0 net yük: -1

0. 1 M Histidinin 0. 1 M Na. OH ile Titrasyon Eğrisi [H 3 N+–CH 2 – COO-] = [H 2 N–CH 2 – COO] R-NH 2 p. I: 7. 59 p. KR: 6. 0 p. H p. K 2: 9. 17 F G E D [H 3 N+–CH 2 – COO-] = [H 3 N+–CH 2 – COO-] R-NH 2 R-+NH 3 C p. K 1: 1. 82 A – COOH] = [H 3 N+–CH – COO-] B [H 3 N+–CH R-+NH 3 OH- ekivalent 3

Bazik (diamino - monokarboksilik) Amino Asitlerin p. I değeri p. I: Net yükün “O” olduğu p. H’nın, bir önceki(p. KR) ve bir sonraki p. K(p. K 2) değerlerinin aritmetik ortalaması ) Histidin için p. I = ( p. KR + p. K 2 ) / 2 p. I = (6. 0 + 9. 17) / 2 = 7. 59 p. H 7. 59’da Histidin (dipolar form): yüksüz

Histidin için tamponlama p. K değerlerinin civarı p. H = (1. 82 1 ) 0. 82 – 2. 82 p. H = (6. 0 1 ) 5. 0 – 7. 0 p. H = (9. 17 1 ) 8. 17 – 10. 17 AAler içerisinde sadece Histidin (p. KR nedeniyle), intraselüler sıvı/kan gibi fizyolojik ortamlar (p. H 7. 0)’da tamponlama gücüne sahiptir!!!

Amino Asitlerin Titre edilebilen Grupları grup - COOH R - COOH - +NH 3 R - +NH 3 İmidazol Guanido Tiyol Fenol p. K p. H 7’de yük 1. 8 - 2. 4 3. 9 - 4. 3 8. 8 -11 + + 10. 5 6. 0 + 12. 5 + 8. 3 0 10. 1 0

Aynı Karboksil Grubunun Farklı p. K değerlerine Sahip Olması? p. K Asitlik gücü Amino asit( -COOH) 1. 8 - 2. 4 100 Asetik asit(CH 3 COOH) 4. 76 1 - Karbon atomu üzerinde bulunan +NH grubu, - COOH’ in 3 iyonizasyonunu kolaylaştırır

Amino Asitlerin Fiziksel Özellikleri • Çözünürlük AAler içerdikleri iyonize gruplar nedeniyle: Çözücü • Su • Polar (etanol vb) • Dilüe asit ve baz • Nonpolar (benzen, hekzan, eter , vb) Çözünürlük

Amino Asitlerin Fiziksel Özellikleri • Erime Noktası Amino asitler • Ortalama molekül ağırlığı: 110 • Oda sıcaklığında: Katı-kristal • Erime ve bozunma: 200 º C form • İyonize-zıt yüklü gruplar arasındaki elektrostatik bağların oluşturduğu kafes yapı, dayanıklılığı artırır • Aynı büyüklükteki diğer organik bileşiklere göre, erime noktaları daha yüksektir

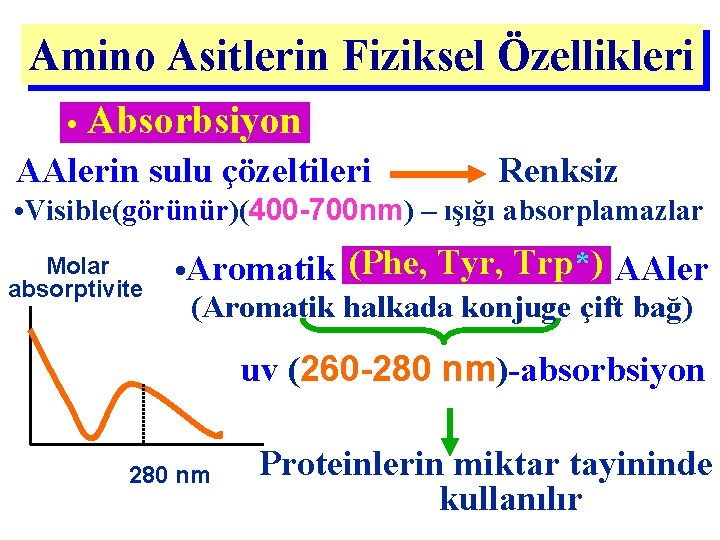
Amino Asitlerin Fiziksel Özellikleri • Absorbsiyon AAlerin sulu çözeltileri Renksiz • Visible(görünür)(400 -700 nm) – ışığı absorplamazlar Molar absorptivite (Phe, Tyr, Trp*) • Aromatik AAler (Aromatik halkada konjuge çift bağ) uv (260 -280 nm)-absorbsiyon 280 nm Proteinlerin miktar tayininde kullanılır

Amino Asitlerin Kimyasal Reaksiyonları • Karboksil grubu - Ester ve amid oluşumu - Dekarboksilasyon • Amino Grubu - Teşhis(Edman ve Sanger reaksiyonları) - Miktar tayini (Ninhidrin, Şelat oluşumu) • Fonksiyonel gruplar • Karboksil ve Amino grubu* - Peptid bağı oluşumu PROTEİN

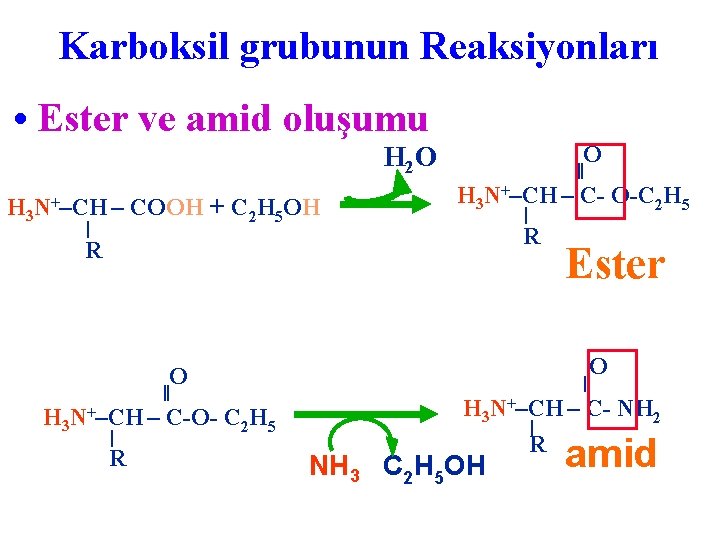
Karboksil grubunun Reaksiyonları • Ester ve amid oluşumu H 2 O ‖ + C 2 H 5 OH H 3 N+–CH – COOH R H 3 N+–CH – C- O-C 2 H 5 R Ester O ‖ +–CH – C- NH H N + 3 2 H 3 N –CH – C-O- C 2 H 5 R NH 3 C 2 H 5 OH amid

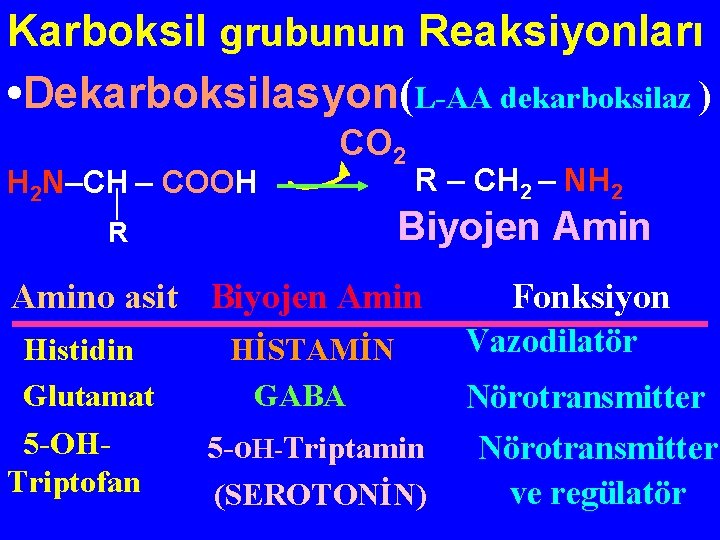
Karboksil grubunun Reaksiyonları • Dekarboksilasyon(L-AA dekarboksilaz ) H 2 N–CH – COOH CO 2 R R – CH 2 – NH 2 Biyojen Amino asit Biyojen Amin Histidin Glutamat HİSTAMİN GABA 5 -OHTriptofan 5 -o. H-Triptamin (SEROTONİN) Fonksiyon Vazodilatör Nörotransmitter ve regülatör

HİSTAMİN • Akc’in plevra zarı, damar cidarı ve mide mukozasında bulunan MAST hücrelerinde sentezlenir H 1 Reseptörü ile, • Damarları genişletir kan basıncı • Kapiller damarların permeabilitesini artırır (damardan çevre dokulara antibody geçişi) • Bağırsak / bronş düz kaslarını kastırır H 2 Reseptörü ile, • Mide salgısını artırır Aşırı salınımı, allerjik reaksiyonlarla sonuçlanır

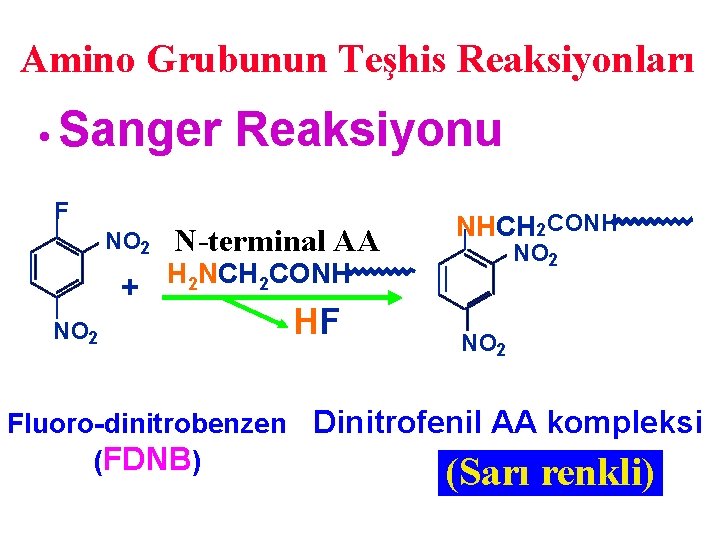
Amino Grubunun Teşhis Reaksiyonları • Sanger F NO 2 + NO 2 Reaksiyonu N-terminal AA NHCH 2 CONH NO 2 H 2 NCH 2 CONH HF NO 2 Fluoro-dinitrobenzen Dinitrofenil AA kompleksi (FDNB) (Sarı renkli)

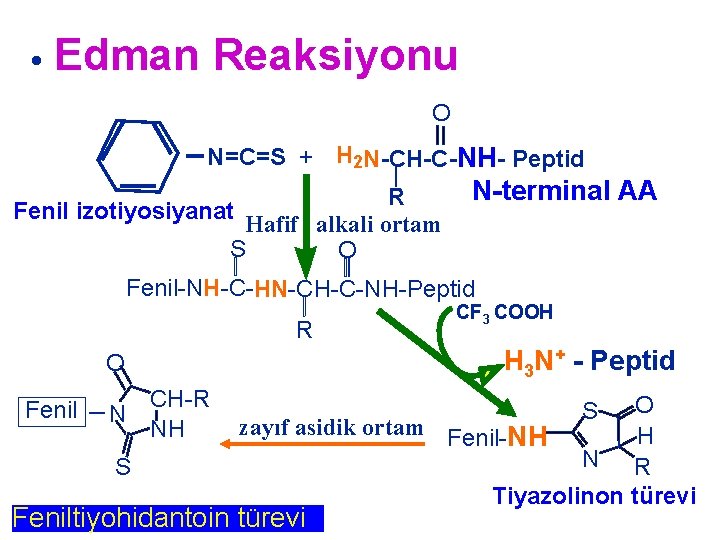
Reaksiyonu • Edman O N=C=S + H 2 N-CH-C-NH- Peptid R Fenil izotiyosiyanat Hafif alkali ortam S O N-terminal AA Fenil-NH-C-HN-CH-C-NH-Peptid R H 3 N+ - Peptid O Fenil N S CF 3 COOH CH-R NH O zayıf asidik ortam Fenil-NH H N R Tiyazolinon türevi Feniltiyohidantoin türevi S

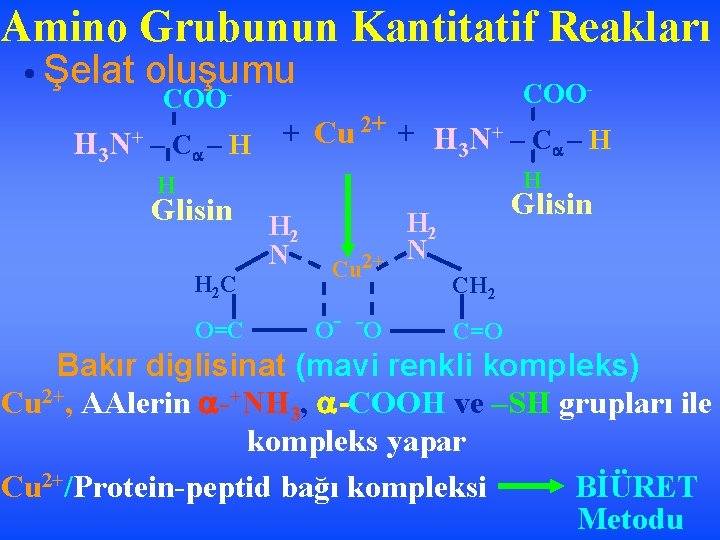
Amino Grubunun Kantitatif Reakları • Şelat oluşumu COO- + Cu 2+ + H 3 N+ – C – H H Glisin H 2 N H 2 C O=C Glisin H 2 N 2+ Cu O- -O CH 2 C=O Bakır diglisinat (mavi renkli kompleks) Cu 2+, AAlerin -+NH 3, -COOH ve –SH grupları ile kompleks yapar Cu 2+/Protein-peptid bağı kompleksi BİÜRET Metodu

BİÜRET METODU

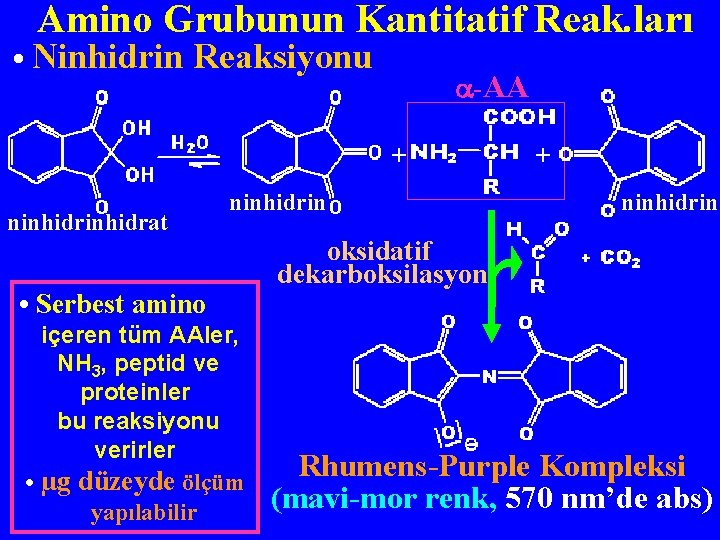
Amino Grubunun Kantitatif Reak. ları • Ninhidrin Reaksiyonu -AA + ninhidrat ninhidrin • Serbest amino tüm AAler, NH 3, peptid ve proteinler bu reaksiyonu verirler • µg düzeyde ölçüm yapılabilir + ninhidrin oksidatif dekarboksilasyon içeren Rhumens-Purple Kompleksi (mavi-mor renk, 570 nm’de abs)

Ninhidrin Reaksiyonu

Fonksiyonel Grupların Reaksiyonları Genel Asit/Baz Nükleofilik Kovalent Araürün Aspartat Sistein Serin Glutamat Serin Lizin Histidin Lizin Sistein (? ) Sistin Radikal kimya Tirozin Sistein Glisin Disülfid Bağı Sistein

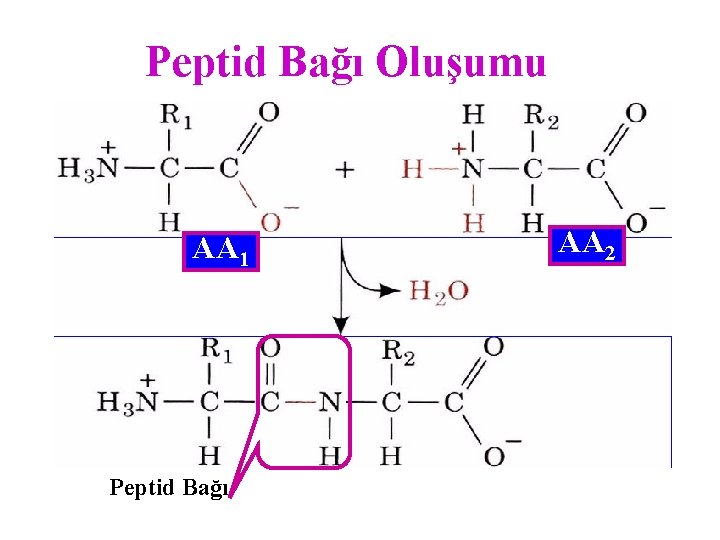
Peptid Bağı Oluşumu AA 1 Peptid Bağı AA 2
 Dhl market update
Dhl market update Recompostion
Recompostion Kse 2013 ehdot
Kse 2013 ehdot Kse 1995
Kse 1995 Kse hesaplama
Kse hesaplama Kader
Kader Cara cetak id kader dasawisma
Cara cetak id kader dasawisma Evrendeki yasalar
Evrendeki yasalar Tugas kpm dalam rembuk stunting
Tugas kpm dalam rembuk stunting Werkalliantie
Werkalliantie Tugas kader posyandu lansia
Tugas kader posyandu lansia Halise kader zengin
Halise kader zengin Syarat menjadi kader kesehatan
Syarat menjadi kader kesehatan Aalst vrijwilligt
Aalst vrijwilligt Referentiekader onderwijskwaliteit
Referentiekader onderwijskwaliteit Halise kader zengin
Halise kader zengin Orientasi carik jakarta kader dasawisma
Orientasi carik jakarta kader dasawisma Kader i
Kader i Kral s havranom v erbe wikipedia
Kral s havranom v erbe wikipedia Norsko zaujimavosti
Norsko zaujimavosti Král lávra veršová výstavba
Král lávra veršová výstavba Hamza yerlikaya nationality
Hamza yerlikaya nationality Náramsinova stéla
Náramsinova stéla Kráľ s havranom v erbe
Kráľ s havranom v erbe Ty jsi náš král a my jsme tvoji páni
Ty jsi náš král a my jsme tvoji páni Král karel s buškem z velhartic text
Král karel s buškem z velhartic text Matej kráľ a bača
Matej kráľ a bača český král
český král Rekruterka
Rekruterka Pankuş ve tapates nedir
Pankuş ve tapates nedir Vladimír všeslav kráľ
Vladimír všeslav kráľ Kral bene
Kral bene Matej kral a baca hlavna myslienka
Matej kral a baca hlavna myslienka Uhersky kral
Uhersky kral Ponáška na ľudovú pieseň
Ponáška na ľudovú pieseň Elvis presley prezentace
Elvis presley prezentace Kral yolu güzergahı
Kral yolu güzergahı Matej korvin reformy
Matej korvin reformy Prof anna piekarska
Prof anna piekarska Assis. prof.
Assis. prof. Texte argumentatif exemple introduction
Texte argumentatif exemple introduction Structural ambiguity exercises
Structural ambiguity exercises Prof. dr. günter kampf
Prof. dr. günter kampf Prof dr mualla polat
Prof dr mualla polat Dr parul jahan
Dr parul jahan Ali kemal göğüş
Ali kemal göğüş Science prof online
Science prof online Prof azhar kasim
Prof azhar kasim Prof dr suganda tanuwidjaja
Prof dr suganda tanuwidjaja Prof blumsohn
Prof blumsohn Bekir kocazeybek
Bekir kocazeybek Itü eut
Itü eut Prof dr bülent erbay trafik kazası
Prof dr bülent erbay trafik kazası Oil rig biology
Oil rig biology Prof dr hab. n.med. małgorzata wisłowska
Prof dr hab. n.med. małgorzata wisłowska Sulfosalazin
Sulfosalazin Prof hadi pratomo
Prof hadi pratomo Prof. onur mutlu
Prof. onur mutlu Madorosis
Madorosis Emmisitivity
Emmisitivity Lehrstuhl gröpl
Lehrstuhl gröpl Prof agamenon roberto
Prof agamenon roberto Prof bart
Prof bart Remerciements dans un rapport de stage
Remerciements dans un rapport de stage Prof. paris tekkis
Prof. paris tekkis Shock prof
Shock prof Risiko
Risiko Tr prof software
Tr prof software Gradation alloprof
Gradation alloprof Karaciğer segmentleri
Karaciğer segmentleri Gordana ostojic
Gordana ostojic Jawahir thontowi
Jawahir thontowi Ponce prof de math
Ponce prof de math Leddo vacaro
Leddo vacaro Ernesto antonini
Ernesto antonini Esterel iprof
Esterel iprof Prof. dr. mustafa serdar genç
Prof. dr. mustafa serdar genç

































































































