PEPTDLER Prof Dr Kader KSE PEPTDLER Lineer amino


































- Slides: 48

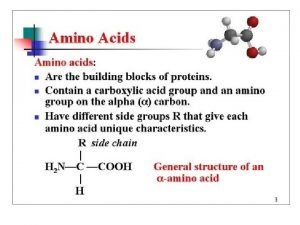
PEPTİDLER Prof. Dr. Kader KÖSE

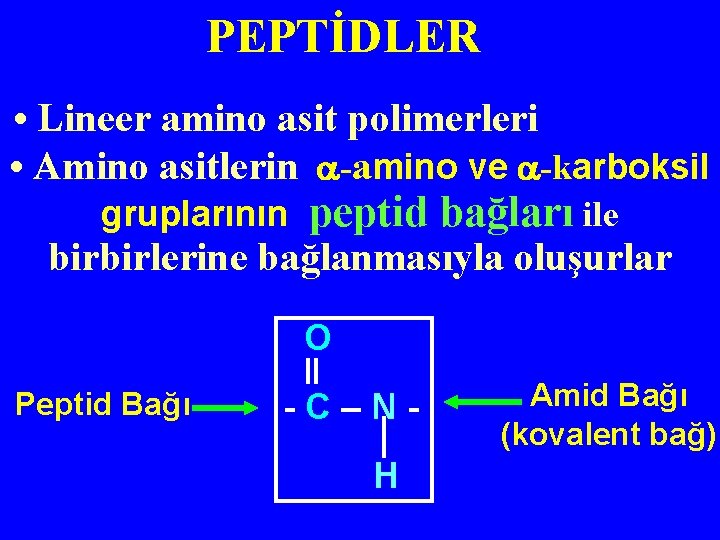
PEPTİDLER • Lineer amino asit polimerleri • Amino asitlerin -amino ve -karboksil gruplarının peptid bağları ile birbirlerine bağlanmasıyla oluşurlar O Peptid Bağı ‖ - C – N H Amid Bağı (kovalent bağ)

Peptid Bağı Oluşumu R 1 Karboksil grup Amino grup R 2 R 1 Peptid Bağı R 2

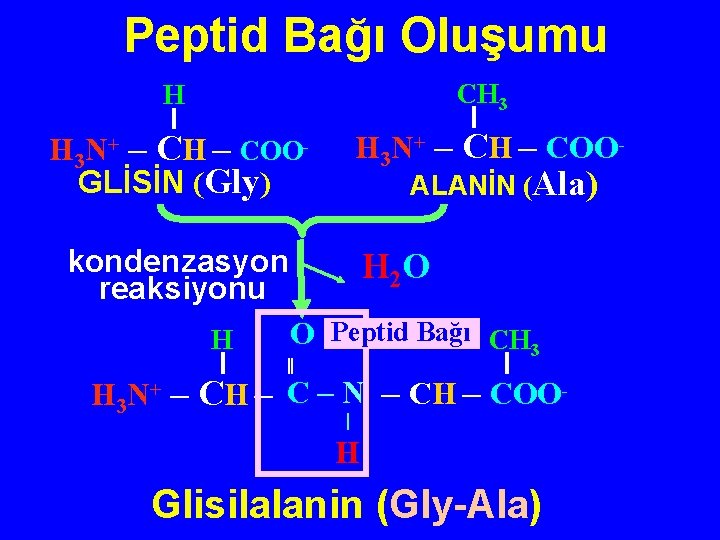
Peptid Bağı Oluşumu H CH 3 H 3 N+ – CH – COOGLİSİN (Gly) H 3 N+ – CH – COO- kondenzasyon reaksiyonu ALANİN (Ala) H 2 O H O Peptid Bağı CH 3 ‖ _ C N – CH – COOH 3 N+ – CH – H Glisilalanin (Gly-Ala)

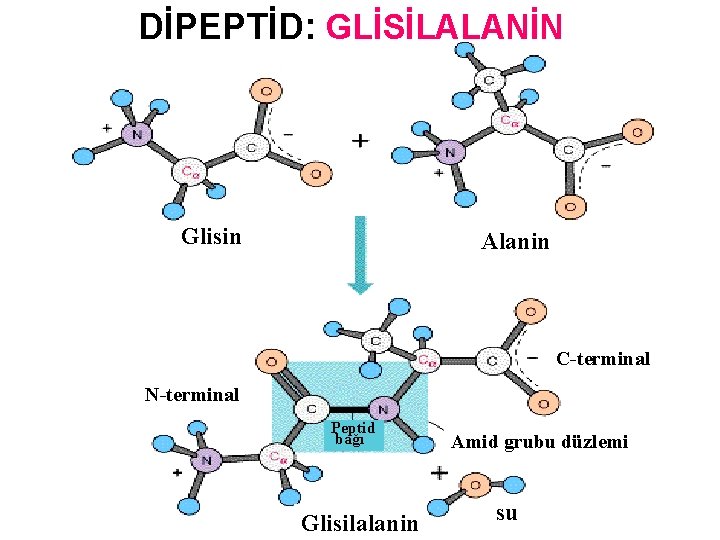
DİPEPTİD: GLİSİLALANİN Glisin Alanin C-terminal N-terminal Peptid bağı Glisilalanin Amid grubu düzlemi su

Peptidlerin Sınıflandırılması AA sayısı Bağ sayısı 2 3 4 5 1 2 3 4 Peptid dipeptid tripeptid tetrapeptid pentapeptid n n-1 polipeptid PEPTİDLER, peptid bağı sayısına göre değil, AA sayısına göre sınıflandırılırlar

Peptidlerin Sınıflandırılması OLİGOPEPTİD: Birkaç AA(AA sayısı 10) POLİPEPTİD: Birçok AA(AA sayısı 10 - 12) PROTEİN: AA sayısı 40 (mol. Ağ: ~5000) Proteinler bir ya da daha çok polipeptid zincirinden oluşabilirler

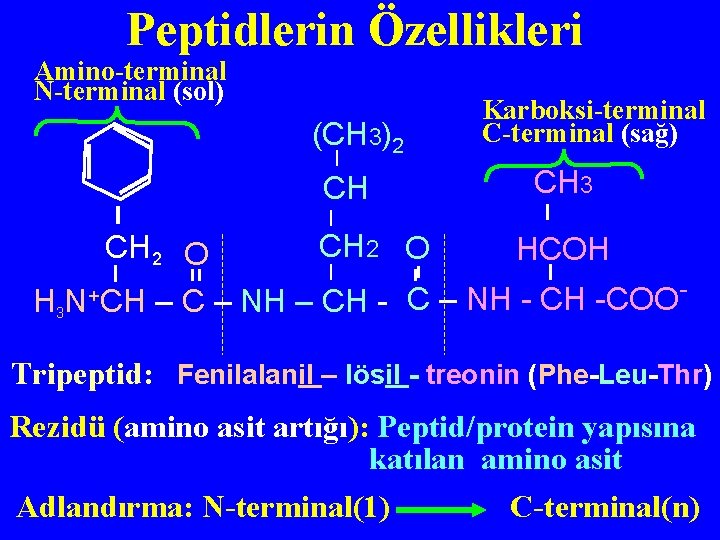
Peptidlerin Özellikleri Amino-terminal N-terminal (sol) (CH 3)2 CH Karboksi-terminal C-terminal (sağ) CH 3 CH 2 O HCOH + C – NH CH -COO H 3 N CH – C – NH – CH - Tripeptid: Fenilalanil – lösil - treonin (Phe-Leu-Thr) Rezidü (amino asit artığı): Peptid/protein yapısına katılan amino asit Adlandırma: N-terminal(1) C-terminal(n)

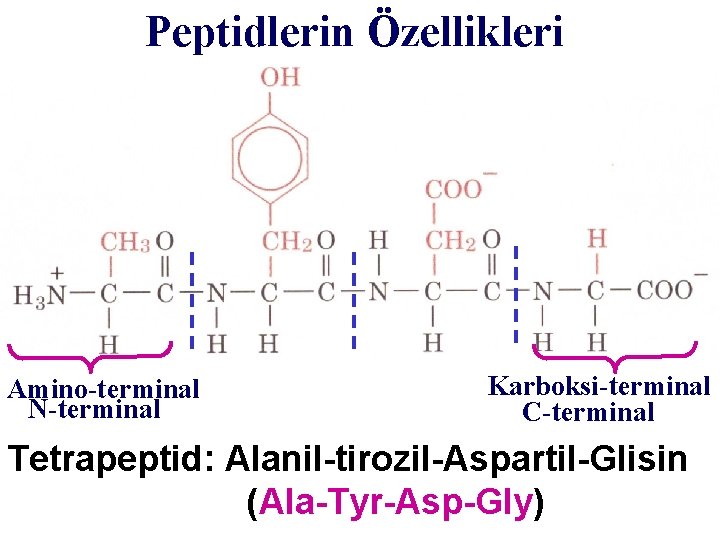
Peptidlerin Özellikleri Amino-terminal N-terminal Karboksi-terminal C-terminal Tetrapeptid: Alanil-tirozil-Aspartil-Glisin (Ala-Tyr-Asp-Gly)

Peptidlerin İyonizasyon Davranışları Fizyolojik p. H’da, • Peptid (amid) bağı: yüksüz • Peptidler: yüklü Peptid bağını oluşturan amino ve karboksil grupları, peptidlerin asit-baz özelliklerine katkıda bulunamazlar Peptidlerin asit-baz özelliği: -Amino ve karboksi terminaller -İyonize yan zincirlerin sayısı ve cinsi

Peptidlerde N- ve C-terminal gruplar, aynı -karbon atomu üzerinde bulunmadıkları için: • C-terminal COO- grupları, türedikleri amino asidin karboksil grubuna göre, daha zayıf asittir (p. K ) • N-terminal +NH 3 grupları, türedikleri amino asidin amino grubuna göre, daha güçlü asittir (p. K )

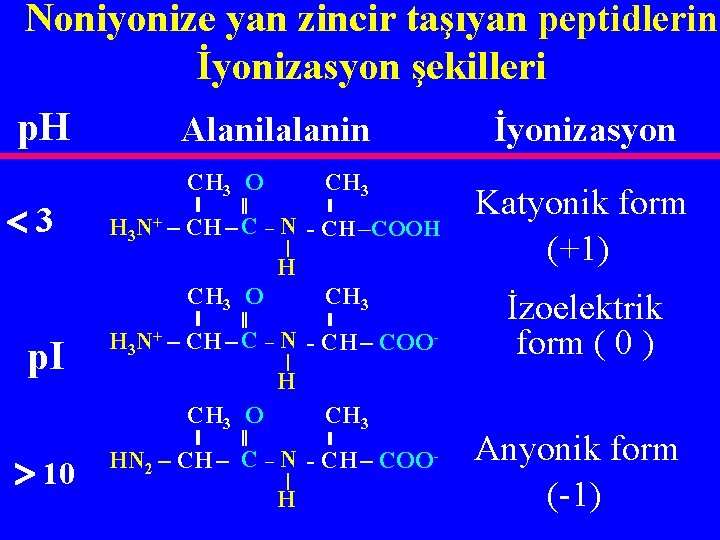
Noniyonize yan zincir taşıyan peptidlerin İyonizasyon şekilleri p. H 3 p. I 10 Alanilalanin CH CH 3 3 O ‖ _ N + H 3 N – CH C – - CH –COOH H CH CH 3 3 O ‖ _ N H 3 N+ – CH C – - CH – COO H CH CH 3 3 O ‖ C _ N - CH – COOHN 2 – CH – H İyonizasyon Katyonik form (+1) İzoelektrik form ( 0 ) Anyonik form (-1)

İyonize yan zincir taşıyan peptidlerin İyonizasyonu COOH CH 3 O (CH 2)2 O +NH 3 (CH 2)4 O CH 2 SH H 3 N+CH – C – N – CH – COOH H Alanil - glutamil - lizil - sistein p. H Net yük 3 +2 10 - 3 7. 4 0

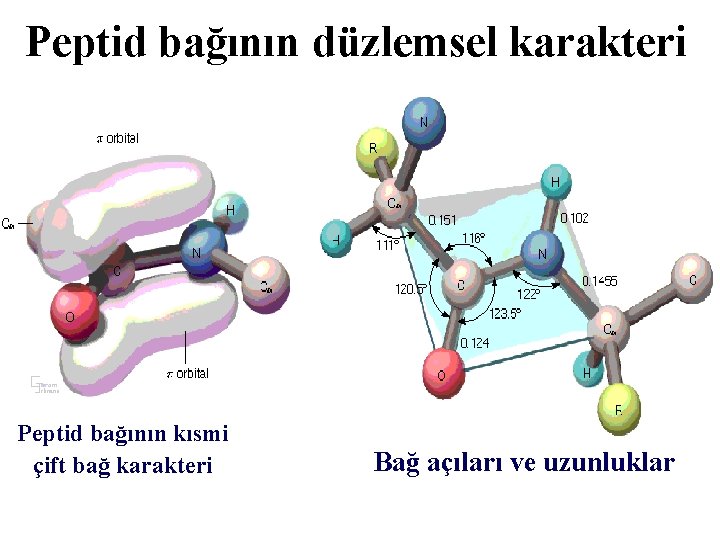
Peptid bağının çift bağ karakteri O O C N H Rezonans yapıları C +N H Kısmi çift bağ karakterine sahip olan peptid bağı düzlemseldir H Ca C O N H H Ca Ca C N OH Ca Ca C N Ca O Peptid bağı ve -C atomları aynı düzlemde bulunur

Peptid bağının düzlemsel karakteri Peptid bağları nedeniyle, polipeptid zincirin 2/3’ ü sabit bir düzlem içinde tutulur Yarı-katı (sert) yapı Protein yapısının düzenlenmesi

Peptid bağının düzlemsel karakteri Peptid bağının kısmi çift bağ karakteri Bağ açıları ve uzunluklar

Düzlemsel (hareketsiz) peptid bağının etrafındaki atom grupları cis/trans izomerizm gösterirler, C H C O N C C Trans (Tercih edilen konfigürasyon) C N O H C Cis (x-pro sıralanışı) Komşu -C atomları arasındaki uzaklık: 0. 3 nm

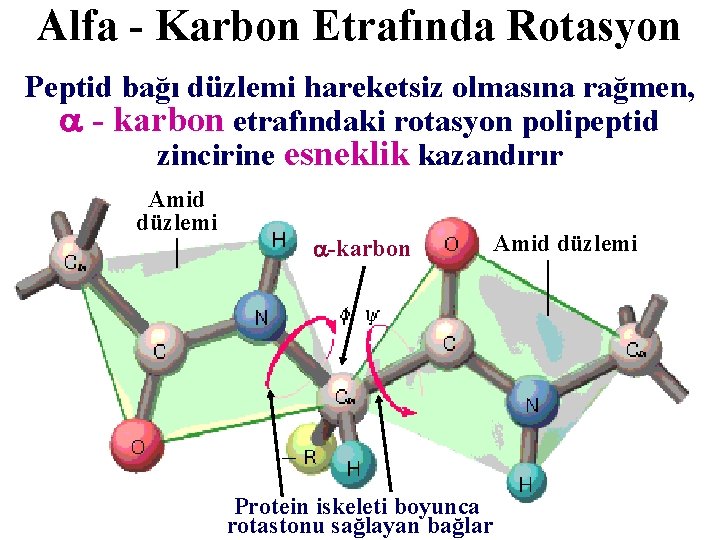
Alfa - Karbon Etrafında Rotasyon Peptid bağı düzlemi hareketsiz olmasına rağmen, - karbon etrafındaki rotasyon polipeptid zincirine esneklik kazandırır Amid düzlemi -karbon Amid düzlemi Protein iskeleti boyunca rotastonu sağlayan bağlar

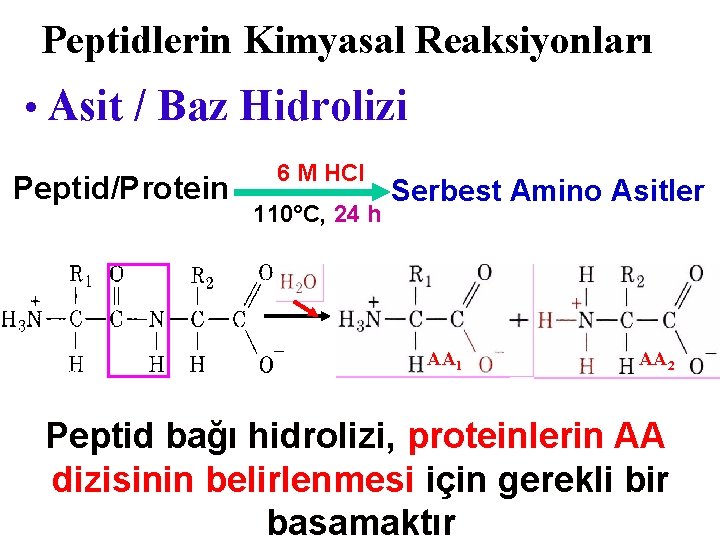
Peptidlerin Kimyasal Reaksiyonları • Asit / Baz Hidrolizi Peptid/Protein 6 M HCl 110°C, 24 h Serbest Amino Asitler AA 1 AA 2 Peptid bağı hidrolizi, proteinlerin AA dizisinin belirlenmesi için gerekli bir basamaktır

Peptidlerin Kimyasal Reaksiyonları • Enzim Hidrolizi: Proteazlar -Endoproteazlar Tripsin, Kimotripsin, pepsin -Ekzoproteazlar Aminopeptidaz, Karboksipeptidaz -Papain (in vitro şartlar)

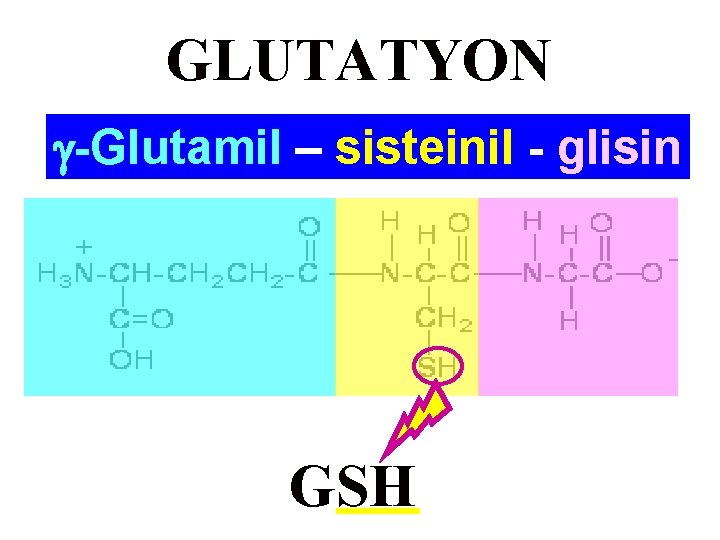
Fizyolojik Olarak Aktif Peptidler Peptid Karnozin Anserin Glutatyon (GSH) AA sayısı AA Dizisi dipeptid Histidil-ß-alanin Kas Metilhistidil-ß-alanin yapısı tripeptid -Glutamil-sisteinil-glisin nanopeptid Plazma proteinlerinin hidrolizi ile açığa çıkarlar dekapeptid -Düz kasları gevşetir (Lizil-bradikinin) Bradikinin Kallidin -Antienflamatuvar

GLUTATYON -Glutamil – sisteinil - glisin GSH

PEPTİD YAPILI HORMONLAR HORMON TRH PEPTİD Tripeptid Enkefalinler Pentapeptid AA Sayısı 3 AA 5 AA Glukagon Polipeptid 29 AA ACTH Polipeptid 39 AA İnsülin Polipeptid A zinciri: 21 AA B zinciri: 30 AA

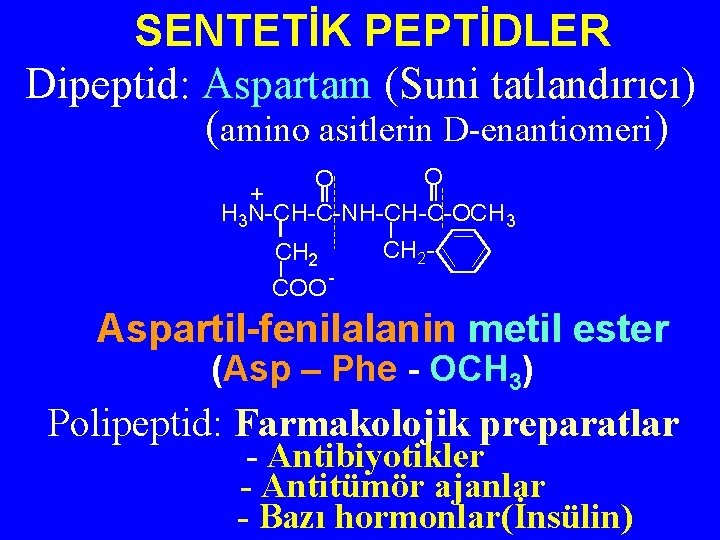
SENTETİK PEPTİDLER Dipeptid: Aspartam (Suni tatlandırıcı) (amino asitlerin D-enantiomeri) O O + H 3 N-CH-C-NH-CH-C-OCH 3 CH 2 - COO - Aspartil-fenilalanin metil ester (Asp – Phe - OCH 3) Polipeptid: Farmakolojik preparatlar - Antibiyotikler - Antitümör ajanlar - Bazı hormonlar(İnsülin)

PROTEİNLER

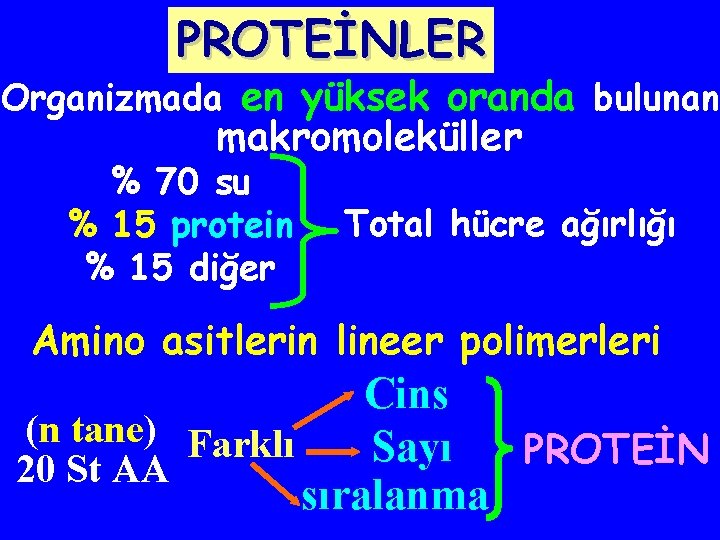
PROTEİNLER Organizmada en yüksek oranda bulunan makromoleküller % 70 su % 15 protein % 15 diğer Total hücre ağırlığı Amino asitlerin lineer polimerleri Cins (n tane) Farklı Sayı PROTEİN 20 St AA sıralanma

Standart AAlerin peptid bağı aracılığıyla lineer dizilişi Birbirinden farklı cok sayıda peptid zincirleri Dipeptid: AA 1 AA 2 20 x 20 400 farklı molekül Tripeptid: AA 1 AA 2 AA 3 20 x 20 Protein (100 AA) Evrendeki total atom sayısı 8000 farklı molekül

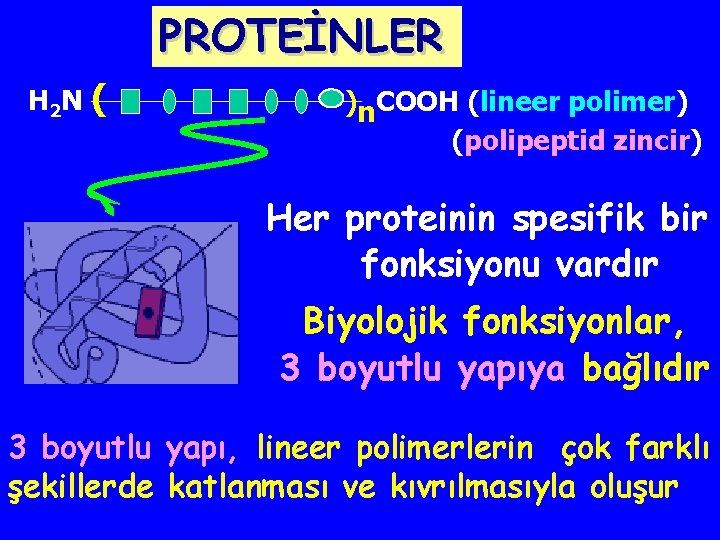
PROTEİNLER lineer polimerler: . H 2 N ( Amino asitler )n. COOH Sınırsız sayıda farklı AA sekansı: 20 n protein yapıları AA sayısı: n

PROTEİNLER H 2 N ( )n. COOH (lineer polimer) (polipeptid zincir) Her proteinin spesifik bir fonksiyonu vardır Biyolojik fonksiyonlar, 3 boyutlu yapıya bağlıdır 3 boyutlu yapı, lineer polimerlerin çok farklı şekillerde katlanması ve kıvrılmasıyla oluşur

3 boyutlu protein yapıları • Kompleks • Molekül ağırlığı büyük • Birden çok polipeptid zincir içerebilir • Nitrojen miktarı (amino asitlerin NH 2 grupları) sabit (Proteinin%17’si)

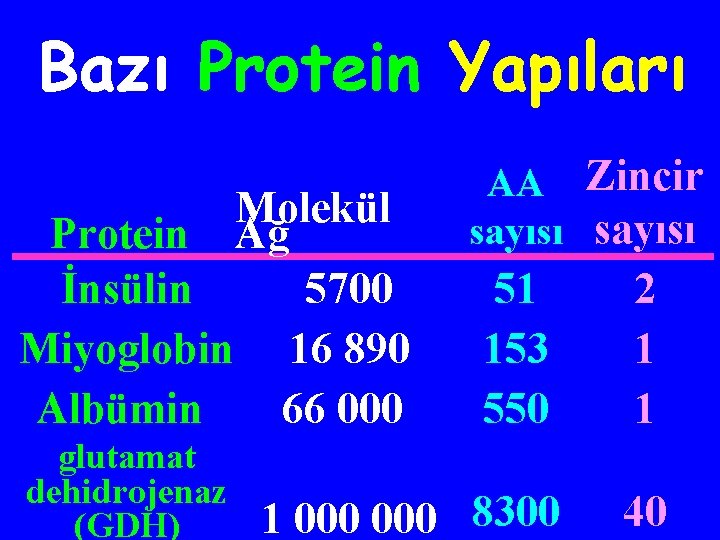
Bazı Protein Yapıları Molekül Protein Ağ İnsülin 5700 Miyoglobin 16 890 Albümin 66 000 glutamat dehidrojenaz (GDH) AA Zincir sayısı 51 153 550 2 1 1 1 000 8300 40

Protein yapısına katılan AAlerin Ortalama Molekül Ağırlığı AAlerin ortalama mol ağ : 128 Peptid bağı için su çıkışı : 18 Protein - AA mol ağ: 110 H 2 O mw: 18 protein AA sayısı = protein mol Ağırlığı 110

Proteinlerin Sınıflandırılması Sınıflandırmada kullanılan özellikler -Şekil -Yapı -Çözünürlük -Biyolojik fonksiyon

Proteinlerin Şekli Proteinler, eksen oranları(uzunluğun göre, 2 grubu ayrılırlar: genişliğe oranı)’na • Globuler proteinler: Eksen oranı 10 ; genelde: 3 -4 • Fibröz Proteinler: Eksen oranı 10

Globüler proteinler: Sıkıca katlanmış helezon şeklinde polipeptid zincirlerden oluşur Örnek: Albumin, Miyoglobin (Proteinlerin büyük kısmı, bu gruptadır)

Fibröz Proteinler: • Spiral veya heliks şeklinde kıvrılmış, (kovalent ve H bağlarıyla çapraz bağlanmış) zincirlerden oluşurlar • Bitkilerde bulunmazlar. Örnek: Bağ dokusu proteinleri: Kollajen, Elastin, Keratin Miyozin: Kas proteini Fibrinojen: pıhtılaşma proteini

Kollajen: Birbirine sarılmış 3 polipeptid zinciri (üçlü heliks)’nden oluşur Memelilerde total proteinin %30’unu teşkil eder Gly, Ala, Pro, Lys’den zengindir B Proteolitik enzimlere karşı dirençlidir A C

Proteinlerin Yapısı Proteinler yapılarına göre, 3 grupta toplanırlar • Basit proteinler • Konjuge proteinler • Türev proteinler

Basit proteinler Hidroliz edildiklerinde sadece L- amino asitleri veren, saf proteinler Ör: Albümin Türev proteinler Isıtma, hidroliz, asidifikasyon, vb işlemlerle modifiye olan proteinler Ör: bazı pepton ve peptidler

Konjuge proteinler L- -amino asitlerin yanı sıra, başka kimyasal grupları (prostetik grup)da içerirler • Glikoproteinler: protein + COH grup Karbohidrat(oligosakkarit) ünitelerini içerirler Örnek: membran proteinleri plazma proteinleri(globulinler), • Nükleoproteinler: protein+nükleik asit (histonlar) (DNA, RNA)

Konjuge proteinler • Lipoproteinler: protein + lipid Protein: Apo(lipo)protein (Apo A, B, C. . . ) Lipid: Kolesterol, fosfolipid, gliserid Örnek: Plazma Lp. leri ( HDL, LDL, VLDL) • Fosfoproteinler: Fosfatlarla ester yapmış AAleri içeren proteinler örnek: Kazein-süt Vitellin-yumurta sarısı)

Konjuge proteinler • Hemoproteinler: protein+hem (ferroporfirin) Ör: hemoglobin, miyoglobin, katalaz • Metalloproteinler: protein + metal Cu- seruloplazmin Fe-transferrin, ferritin Ca-kalmodulin Zn-karbonik anhidraz

Proteinlerin Çözünürlüğü Proteinler Çözünürlük Fibröz Globüler Albüminler Su ve tuz çözeltileri Globulinler Su: sınırlı çözünürlük Dilüe tuz çözeltileri Doymuş tuz çözeltileri: (Salting-out) Histonlar Su ve tuz çözeltileri

Proteinlerin Biyolojik Fonksiyonu Enzimler: Metabolizmayı düzenleyen ve etkileyen globuler proteinler( geniş bir protein sınıfı) Biyokimyasal reaksiyonları katalizlerler Substrat spesifiteleri vardır. . . az şeklinde adlandırılır Eksiklikleri pek çok metabolik hastalıkla sonuçlanır

Proteinlerin Biyolojik Fonksiyonu Düzenleyici proteinler: Fizyolojik aktivitenin düzenlenmesinden sorumludurlar Ör: Hormonlar (insülin eksiklliği diabet) G-proteinler Hücre içi haberleşme Yapısal proteinler: Kas, bağ dokusu proteinleri, membran proteinleri Ör: Kollajen (tendon and ligamentlerde) keratin (saç ve tırnakta)

Proteinlerin Biyolojik Fonksiyonu Transport proteinleri: Plazmada ve membranlarda spesifik maddelerin veya iyonların taşıyıcısıdırlar Ör: Hb-O 2, miyoglobin-O 2 Lipoprotein-lipid, Transferrin-Fe Seruloplazmin-Cu, vb Besin ve Depo proteinler: Ovalbumin, laktalbumin, kazein, ferritin

Proteinlerin Biyolojik Fonksiyonu Kontraktil proteinler: Kasılmayı ve hareketi sağlayan proteinler Ör: Miyozin - kalın filament Aktin - İnce filament Tübilin - membran iskeleti

Proteinlerin Biyolojik Fonksiyonu Reseptörler: Hücre içi haberleşmede rol oynarlar Ör: adrenalin için ß-adrenerjik reseptor Savunma proteinleri: Ör: İmmünoglobülinler: Patojenlere karşı organizmayı korurlar Fibrinojen: (Pıhtılaşma mekanizması)
 Kse 95
Kse 95 Kse 2013
Kse 2013 Hiperkani
Hiperkani Recomposition of kse 100 index
Recomposition of kse 100 index Evrendeki yasalar örnekler
Evrendeki yasalar örnekler Kader
Kader Dasawisma id card
Dasawisma id card Lingkup tugas kpm
Lingkup tugas kpm Werkalliantie
Werkalliantie Halise kader zengin
Halise kader zengin Tugas kader posyandu lansia
Tugas kader posyandu lansia Syarat menjadi kader kesehatan
Syarat menjadi kader kesehatan Kader
Kader Halise kader zengin
Halise kader zengin Rok kader
Rok kader Orientasi carik jakarta kader dasawisma
Orientasi carik jakarta kader dasawisma Kader i
Kader i Normlu uzay örnekleri
Normlu uzay örnekleri Fazör
Fazör Lineer momentum
Lineer momentum Lineer kriptanaliz
Lineer kriptanaliz Lineer
Lineer Sol sıfır uzayı
Sol sıfır uzayı Döner mafsal
Döner mafsal Lineer
Lineer Lineer salpingostomi
Lineer salpingostomi Lineer kuadratik model
Lineer kuadratik model Soğurulan doz ile kalite faktörünün çarpımı
Soğurulan doz ile kalite faktörünün çarpımı Lineer
Lineer Lineer
Lineer Lineer kuadratik model
Lineer kuadratik model B-pleated sheet
B-pleated sheet Ketogenic amino acid
Ketogenic amino acid Lizin ve hidroksilizin metabolizmasi bozukluklari
Lizin ve hidroksilizin metabolizmasi bozukluklari Section 12-1 dna
Section 12-1 dna Pam scoring
Pam scoring Amino urea
Amino urea Early man
Early man Ketogenic amino acids
Ketogenic amino acids Amino frequency therapy
Amino frequency therapy Wikipedia amino acids
Wikipedia amino acids Role of glycine
Role of glycine Biomedical importance of amino acids
Biomedical importance of amino acids Materialet termostabile
Materialet termostabile Physical properties of amines
Physical properties of amines Difference between glycolysis and pentose phosphate pathway
Difference between glycolysis and pentose phosphate pathway Dehydration synthesis of amino acids
Dehydration synthesis of amino acids Amino acid structure
Amino acid structure Ketogenic amino acids
Ketogenic amino acids