ALKENI Ugljovodonici sa dvostrukom vezom CC Opta formula

























- Slides: 69

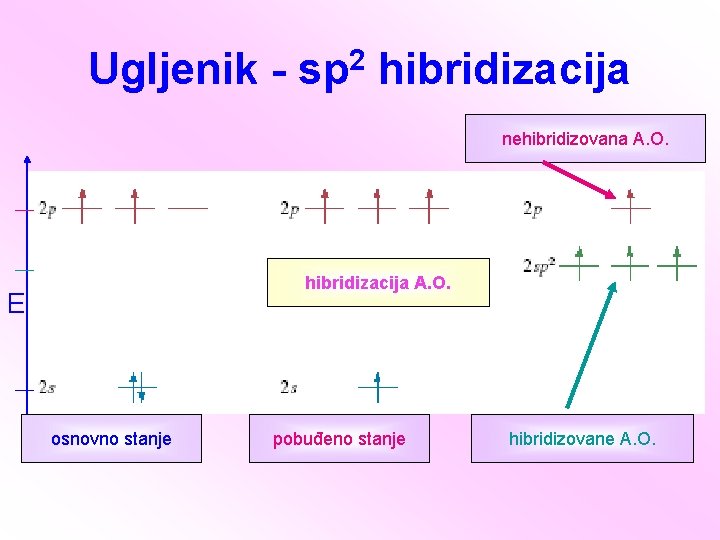
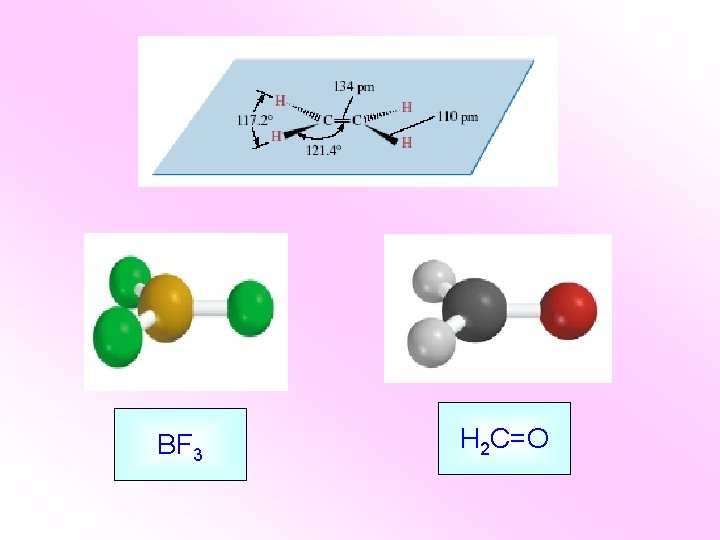
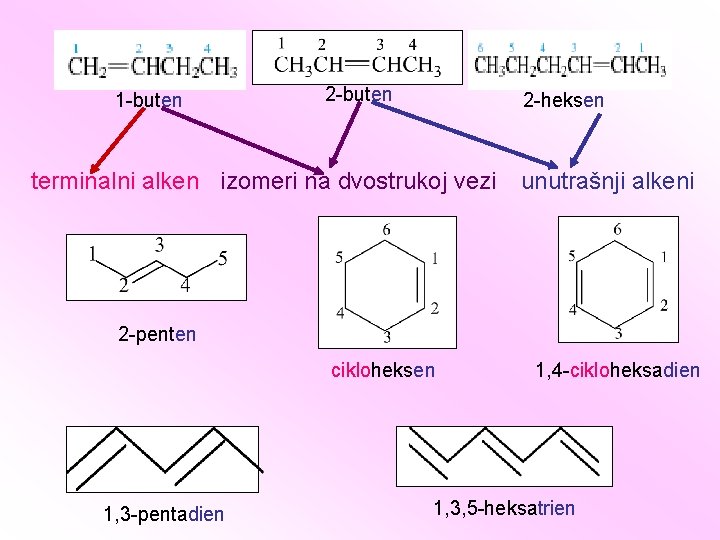
ALKENI Ugljovodonici sa dvostrukom vezom C=C Opšta formula alkena: Cn. H 2 n Ugljenikovi atomi povezani dvogubom vezom su sp 2 hibridizovani.

Ugljenik - sp 2 hibridizacija nehibridizovana A. O. hibridizacija A. O. E osnovno stanje pobuđeno stanje hibridizovane A. O.



BF 3 H 2 C=O

Imenovanje (nomenklatura) alkena • Imena alkena i cikloalkena završavaju se nastavkom –en • Kod cikloalkena se ispred imena dodaje i prefiks ciklo • Kod alkena sa više dvostrukih veza ispred nastavka –en, dodaju se odgovarajući prefiksi di, tri, tetra itd. • Alkeni sa dve dvostruke veze su dieni, sa tri - trieni. . .

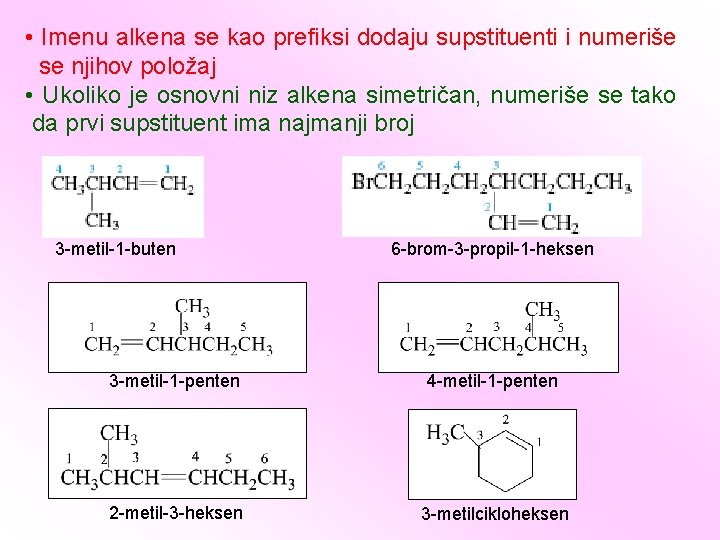
IUPAC-ova pravila • Odredi se najduži niz koji sadrži dva ugljenika povezana dvostrukom vezom • Označi se mesto dvostruke veze u glavnom nizu, polazeći sa najbližeg kraja dvostruke veze, odnosno, ugljenikovom atomu dvostruke veze se pripisuje što manji broj. • Kod cikloalkena nije neophodan numerički prefiks, ali ugljenici 1 i 2 su po definiciji delovi dvostruke veze. • Alkeni koji se razlikuju samo po položaju dvostruke veze zovu se izomeri na dvostrukoj vezi. 1 -alkeni zovu se terminalni alkeni; ostali su unutrašnji alkeni.

1 -buten 2 -heksen terminalni alken izomeri na dvostrukoj vezi unutrašnji alkeni 2 -penten cikloheksen 1, 3 -pentadien 1, 4 -cikloheksadien 1, 3, 5 -heksatrien

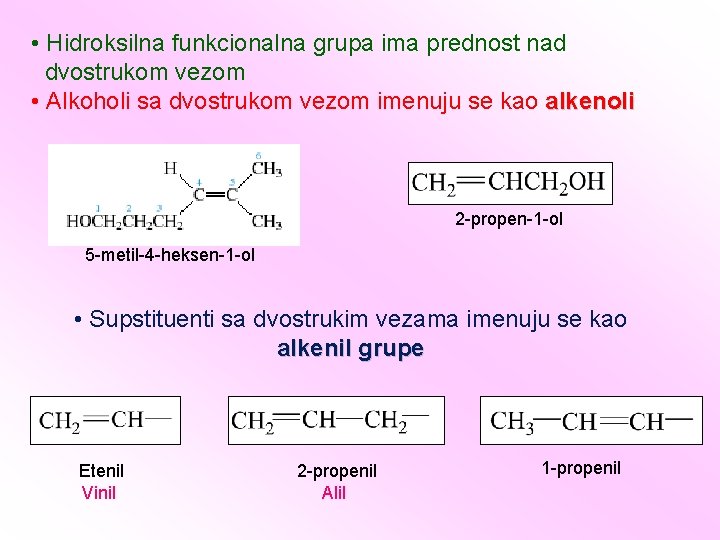
• Imenu alkena se kao prefiksi dodaju supstituenti i numeriše se njihov položaj • Ukoliko je osnovni niz alkena simetričan, numeriše se tako da prvi supstituent ima najmanji broj 3 -metil-1 -buten 6 -brom-3 -propil-1 -heksen 3 -metil-1 -penten 4 -metil-1 -penten 2 -metil-3 -heksen 3 -metilcikloheksen

• Hidroksilna funkcionalna grupa ima prednost nad dvostrukom vezom • Alkoholi sa dvostrukom vezom imenuju se kao alkenoli 2 -propen-1 -ol 5 -metil-4 -heksen-1 -ol • Supstituenti sa dvostrukim vezama imenuju se kao alkenil grupe Etenil Vinil 2 -propenil Alil 1 -propenil

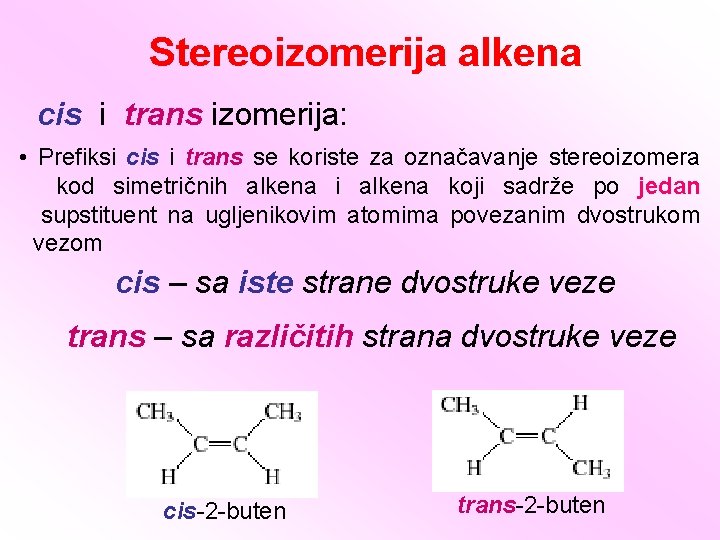
Stereoizomerija alkena cis i trans izomerija: • Prefiksi cis i trans se koriste za označavanje stereoizomera kod simetričnih alkena i alkena koji sadrže po jedan supstituent na ugljenikovim atomima povezanim dvostrukom vezom cis – sa iste strane dvostruke veze trans – sa različitih strana dvostruke veze cis-2 -buten trans-2 -buten

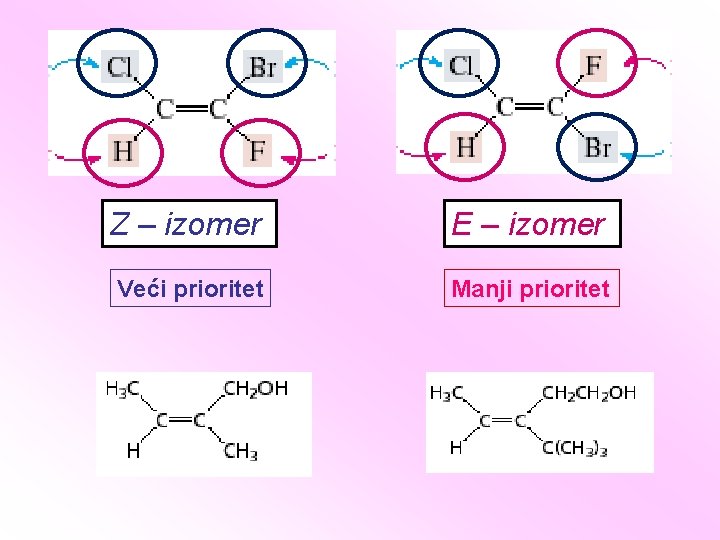
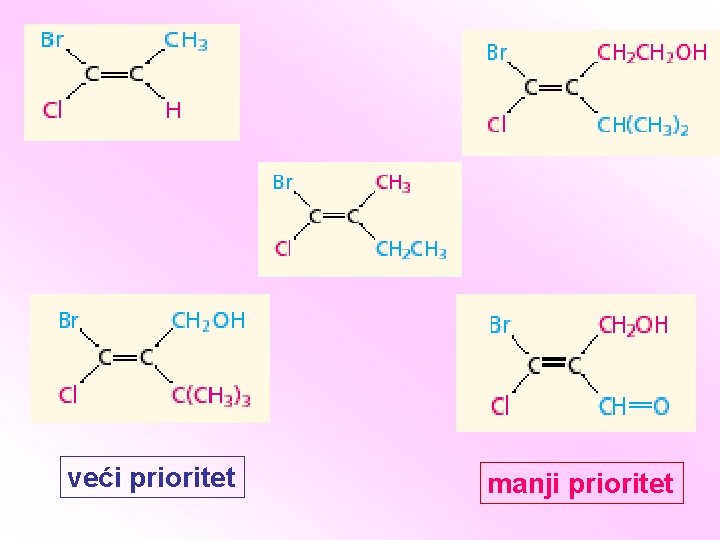
Z i E sistem obeležavanja stereoizomera: • Prefiksi cis i trans ne mogu se primeniti kada je tri ili više različitih supstituenata vezano za dvostruku vezu. • Primenjuju se sekvencionalna pravila za određivanje prioriteta odvojeno na dve grupe svakog ugljenika dvostruke veze (grupe na istom C-atomu su geminalne grupe). Z – kada se dva supstituenta sa najvećim prioritetom nalaze sa iste strane dvostruke veze E – kada se dva supstituenta sa najvećim prioritetom nalaze sa različitih strana dvostruke veze


Z – izomer E – izomer Veći prioritet Manji prioritet

veći prioritet manji prioritet

Dobijanje alkena I Industrijsko dobijanje: • U većim količinama alkeni se dobijaju preradom (kreking) i destilacijom nafte. • Terminalni (1 -alkeni), koji su važna sirovina u industriji deterdženata, dobijaju se kontrolisanom polimerizacijom etena Ziegler – Natta – postupkom.

Piroliza nafte • Piroliza je zagrevanje alkana na visoku temperaturu, pri čemu dolazi do raskidanja C-H i C-C veza: Dobijeni radikali se mogu kombinovati i graditi više i/ili niže alkane:

Takođe, radikali mogu da oduzmu vodonikov atom sa ugljenikovog atoma drugog radikala i da nagrade alkene apstrakcija vodonika :

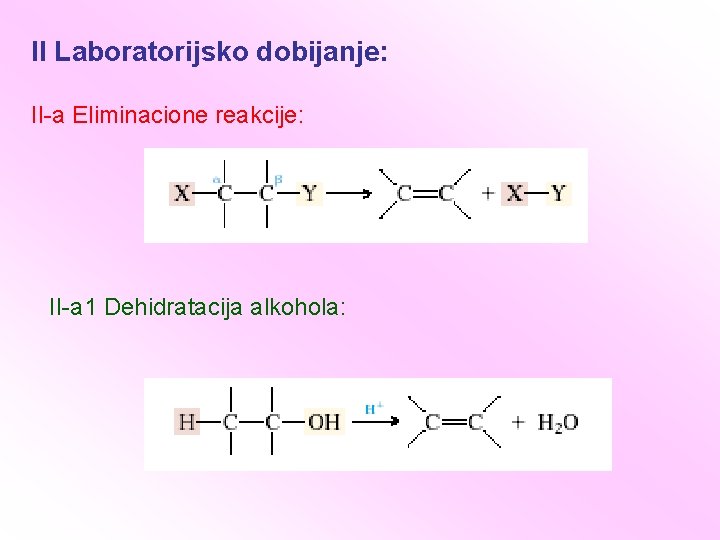
II Laboratorijsko dobijanje: II-a Eliminacione reakcije: II-a 1 Dehidratacija alkohola:

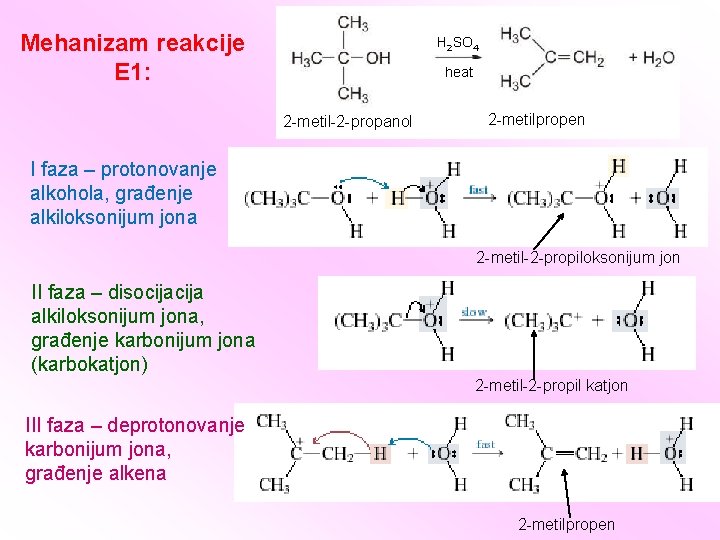
Mehanizam reakcije E 1: H 2 SO 4 heat 2 -metil-2 -propanol 2 -metilpropen I faza – protonovanje alkohola, građenje alkiloksonijum jona 2 -metil-2 -propiloksonijum jon II faza – disocija alkiloksonijum jona, građenje karbonijum jona (karbokatjon) 2 -metil-2 -propil katjon III faza – deprotonovanje karbonijum jona, građenje alkena 2 -metilpropen

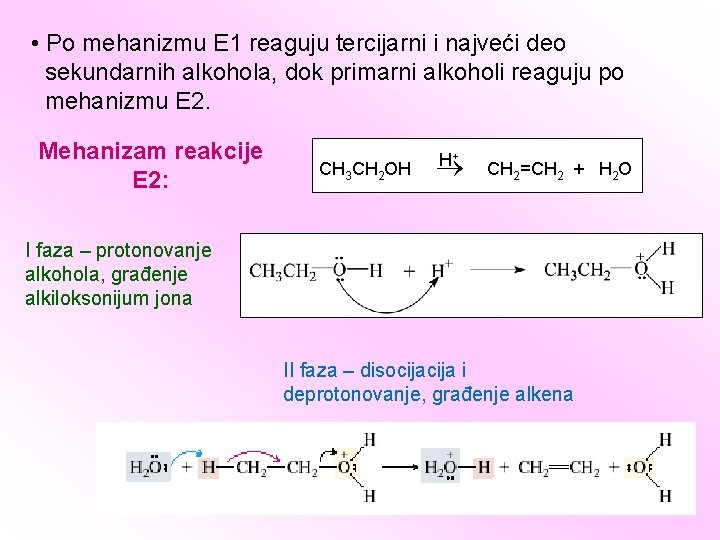
• Po mehanizmu E 1 reaguju tercijarni i najveći deo sekundarnih alkohola, dok primarni alkoholi reaguju po mehanizmu E 2. Mehanizam reakcije E 2: CH 3 CH 2 OH H + CH 2=CH 2 + H 2 O I faza – protonovanje alkohola, građenje alkiloksonijum jona II faza – disocija i deprotonovanje, građenje alkena

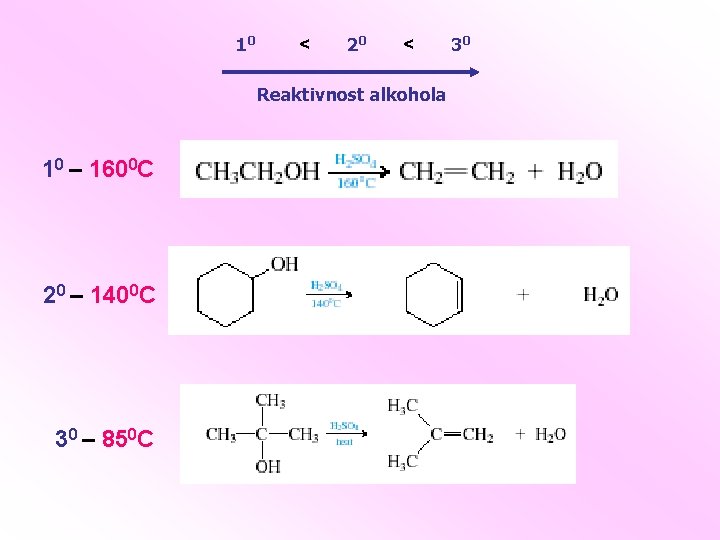
10 < 20 < Reaktivnost alkohola 10 – 1600 C 20 – 1400 C 30 – 850 C 30

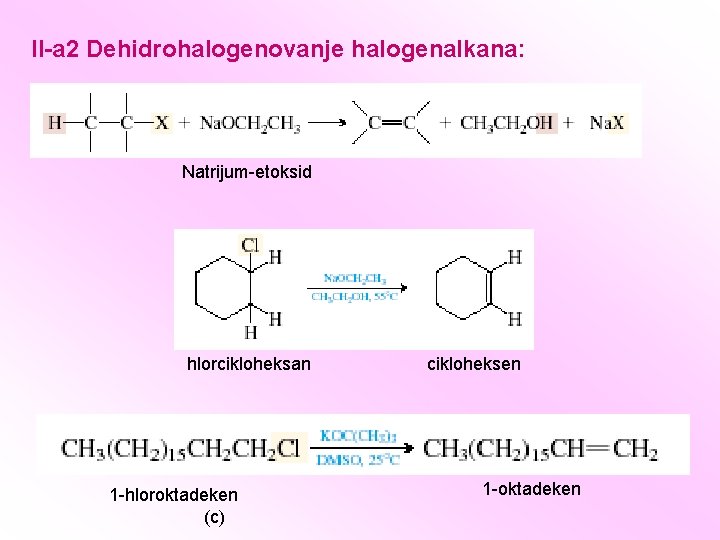
II-a 2 Dehidrohalogenovanje halogenalkana: Natrijum-etoksid hlorcikloheksan 1 -hloroktadeken (c) cikloheksen 1 -oktadeken

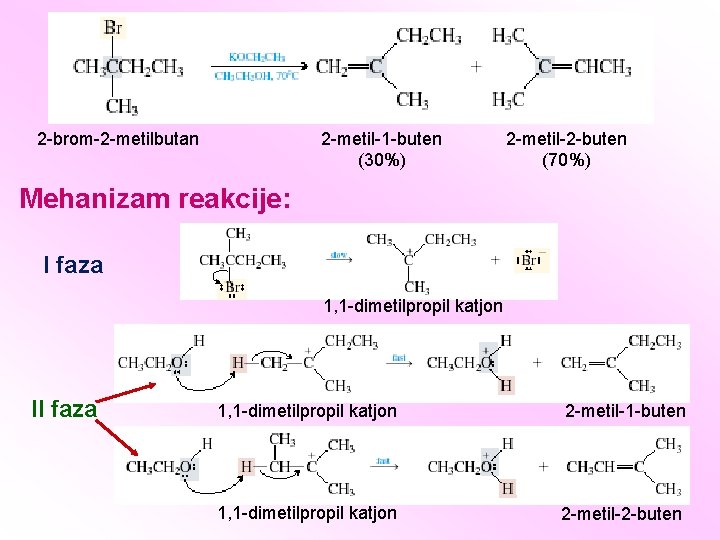
2 -metil-1 -buten (30%) 2 -brom-2 -metilbutan 2 -metil-2 -buten (70%) Mehanizam reakcije: I faza 1, 1 -dimetilpropil katjon II faza 1, 1 -dimetilpropil katjon 2 -metil-1 -buten 1, 1 -dimetilpropil katjon 2 -metil-2 -buten

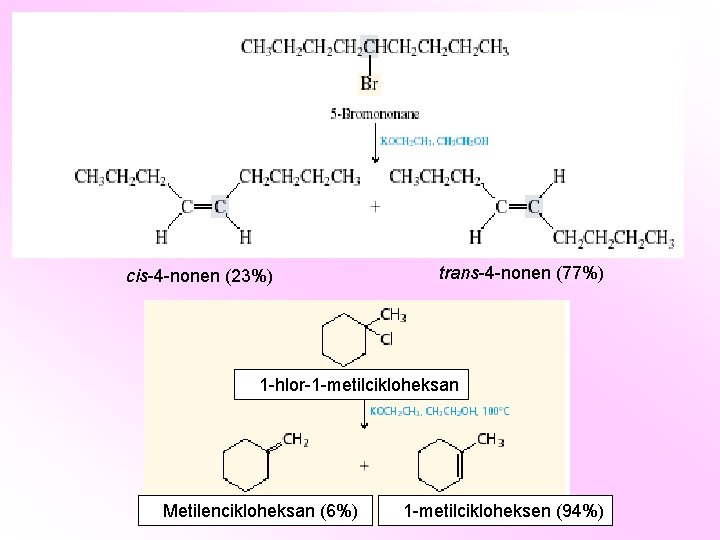
cis-4 -nonen (23%) trans-4 -nonen (77%) 1 -hlor-1 -metilcikloheksan Metilencikloheksan (6%) 1 -metilcikloheksen (94%)

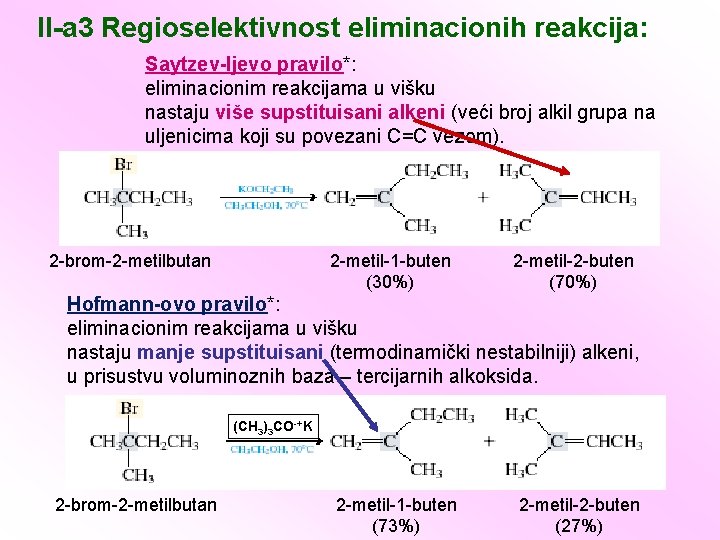
II-a 3 Regioselektivnost eliminacionih reakcija: Saytzev-ljevo pravilo*: eliminacionim reakcijama u višku nastaju više supstituisani alkeni (veći broj alkil grupa na uljenicima koji su povezani C=C vezom). (termodinamički stabilniji) alkeni. 2 -brom-2 -metilbutan 2 -metil-1 -buten (30%) 2 -metil-2 -buten (70%) Hofmann-ovo pravilo*: eliminacionim reakcijama u višku nastaju manje supstituisani (termodinamički nestabilniji) alkeni, u prisustvu voluminoznih baza – tercijarnih alkoksida. (CH 3)3 CO-+K 2 -brom-2 -metilbutan 2 -metil-1 -buten (73%) 2 -metil-2 -buten (27%)

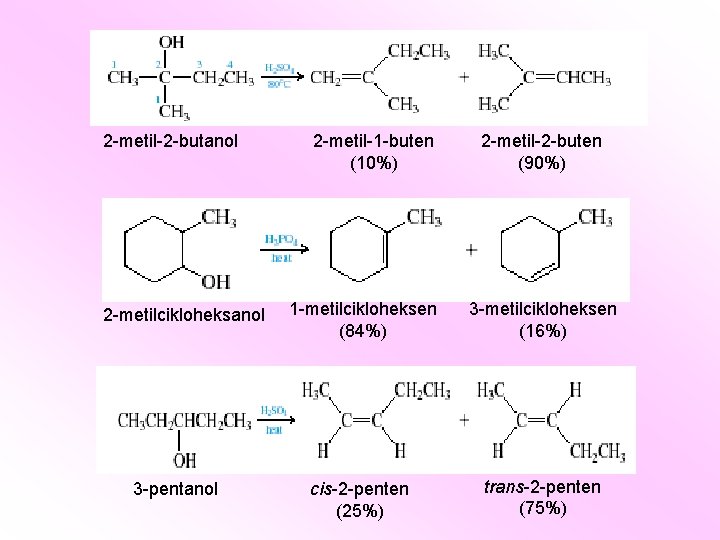
2 -metil-2 -butanol 2 -metilcikloheksanol 3 -pentanol 2 -metil-1 -buten (10%) 2 -metil-2 -buten (90%) 1 -metilcikloheksen (84%) 3 -metilcikloheksen (16%) cis-2 -penten (25%) trans-2 -penten (75%)

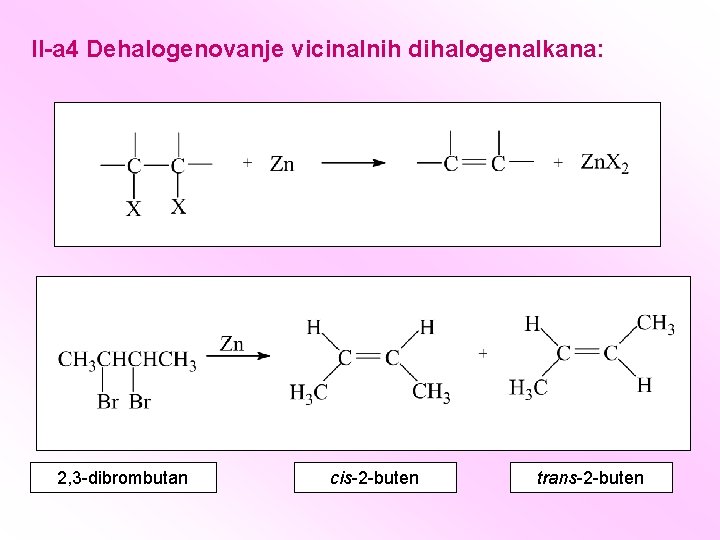
II-a 4 Dehalogenovanje vicinalnih dihalogenalkana: 2, 3 -dibrombutan cis-2 -buten trans-2 -buten

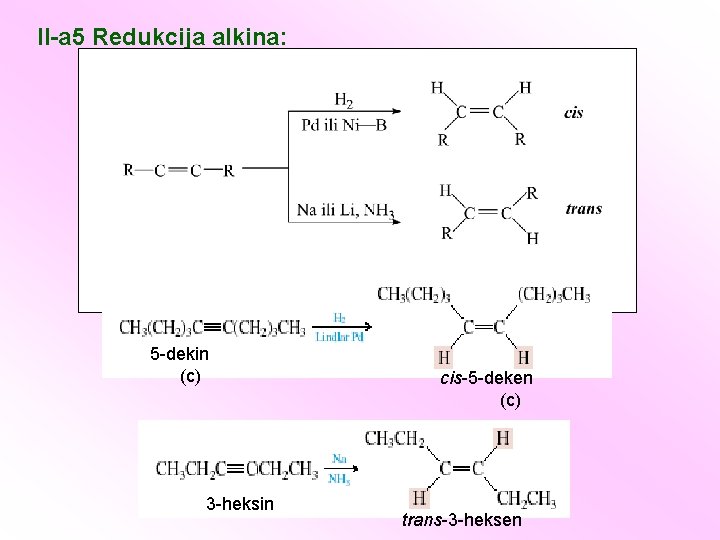
II-a 5 Redukcija alkina: 5 -dekin (c) 3 -heksin cis-5 -deken (c) trans-3 -heksen

Fizičke osobine alkena • Vrlo slične fizičkim osobinama alkana • U vodi nerastvorni, ali dobro rastvorni u nepolarnim rastvaračima. • cis izomeri su polarniji od trans izomera. • Zbog veće polarnosti cis izomeri imaju veće tačke ključanja. • Zbog manje simetrije cis izomeri imaju niže tačke topljenja.

Kovalentna veza i polarnost Kada dva atoma dele jedan elektronski par, oni grade prostu kovalentnu vezu, koja se predstavlja jednom crticom. Kada dva atoma dele dva elektronska para, oni grade dvostruku kovalentnu vezu, koja se predstavlja sa dve crtice. Dvostruka veza je jača Kada dva atoma dele tri elektronska para, od proste veze oni grade trostruku kovalentnu vezu, a trostruka veza je jača koja se predstavlja sa tri crtice. i od dvostruke i od proste!

Između atoma različitih elemenata Između atoma istog elementa Elektronegativnost je sposobnost atoma da u molekulu privuče zajednički elektronski par.

Razlika između elektronegativnosti fluora i vodonika – polarna veza. Zajednički elektronski par je pomeran ka atomu fluora, tj. elektronska gustina oko fluora je veća. Raspodela naelektrisanja – simboli + i - predstavljaju parcijalno pozitivno i parcijalno negativno naelektrisanje. Pošto molekul HF ima pozitivan i negativan kraj, za njega kažemo da je polaran molekul. Kako se može izraziti polarnost i odrediti da li je neki molekuli polarniji od drugog?

POLARNOST SE KVANTITATIVNO IZRAŽAVA PREKO DIPOLNOG MOMENTA. Svaki polarni molekul ima svoj dipolni momenat, . Dipolni momenat je vektorska veličina. Jedinjenje Dužina veze (A) Dvoatomni molekul: veća razlika elektronegativnosti atoma – veći dipolni momenat molekula. Razlika elektroneg. Dipolni momenat (D)

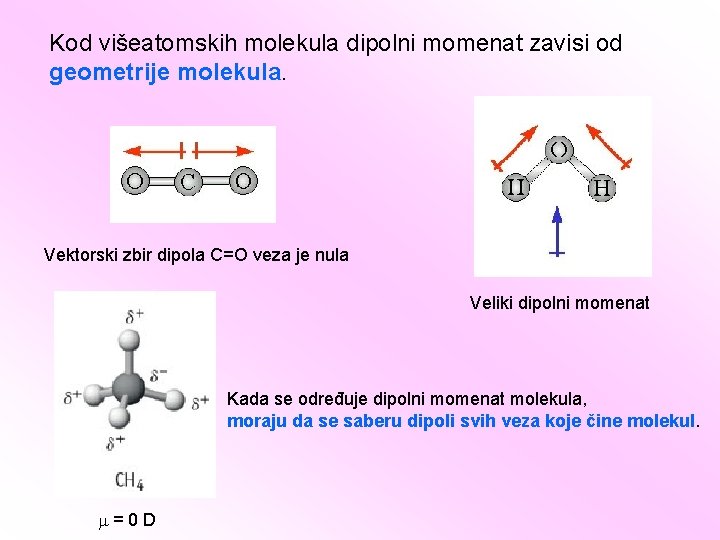
Kod višeatomskih molekula dipolni momenat zavisi od geometrije molekula. Vektorski zbir dipola C=O veza je nula Veliki dipolni momenat Kada se određuje dipolni momenat molekula, moraju da se saberu dipoli svih veza koje čine molekul. =0 D


Hemijske osobine alkena • Hemija alkena je hemija dvostruke (dvogube) veze • Dvostruku vezu karakterišu reakcije adicije • Reakcije adicije na π vezu su uglavnom egzotermne • Karakteristična reakcija alkena je elektrofilna adicija • Takođe podležu i adiciji preko slobodnih radikala

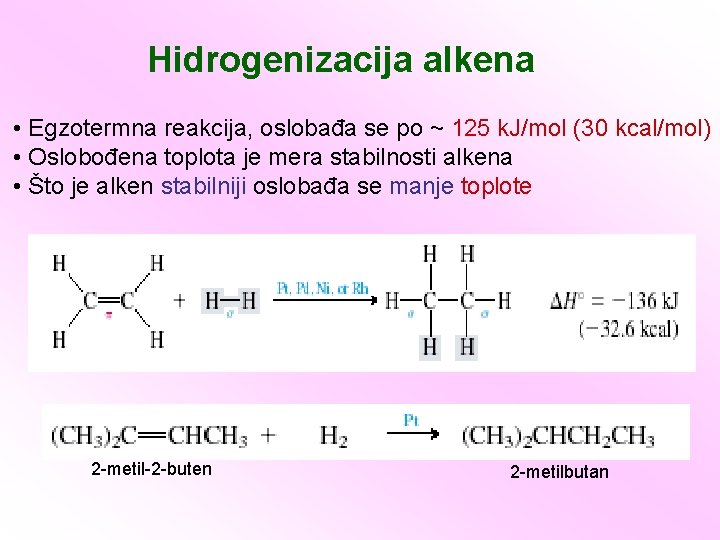
Hidrogenizacija alkena • Egzotermna reakcija, oslobađa se po ~ 125 k. J/mol (30 kcal/mol) • Oslobođena toplota je mera stabilnosti alkena • Što je alken stabilniji oslobađa se manje toplote 2 -metil-2 -buten 2 -metilbutan




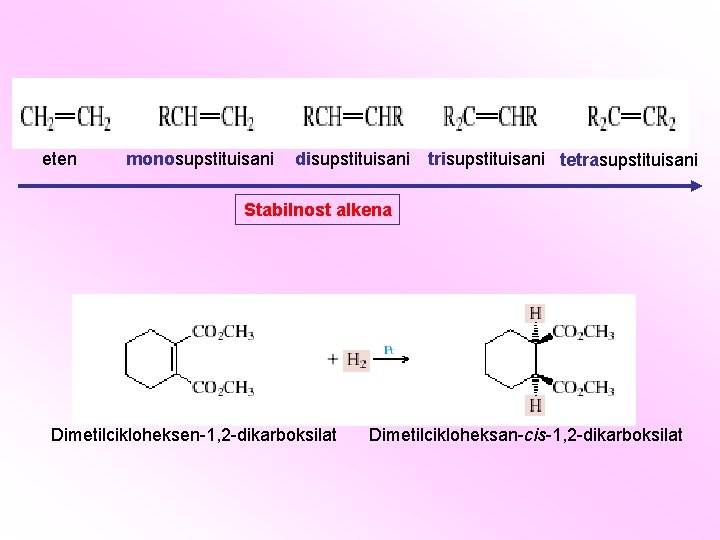
eten monosupstituisani disupstituisani trisupstituisani tetrasupstituisani Stabilnost alkena Dimetilcikloheksen-1, 2 -dikarboksilat Dimetilcikloheksan-cis-1, 2 -dikarboksilat

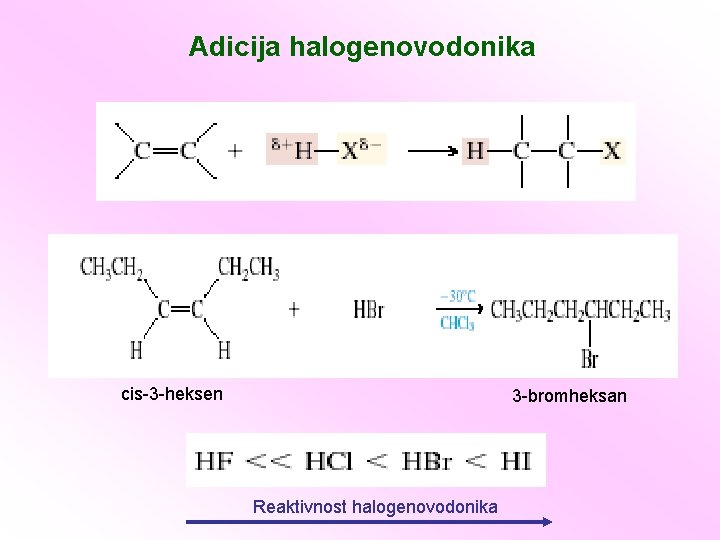
Adicija halogenovodonika cis-3 -heksen 3 -bromheksan Reaktivnost halogenovodonika

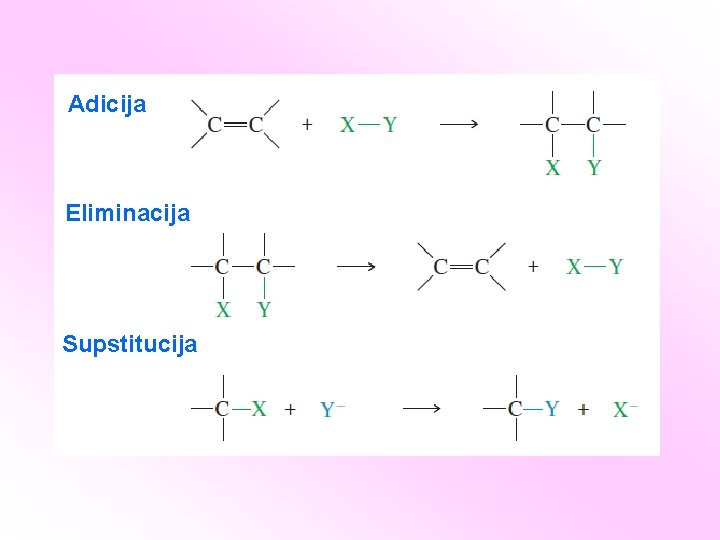
Adicija Eliminacija Supstitucija

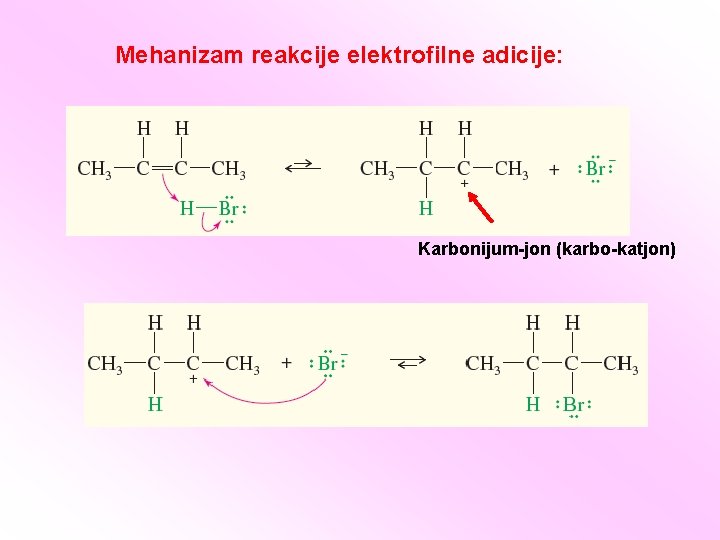
Mehanizam reakcije elektrofilne adicije: Karbonijum-jon (karbo-katjon)

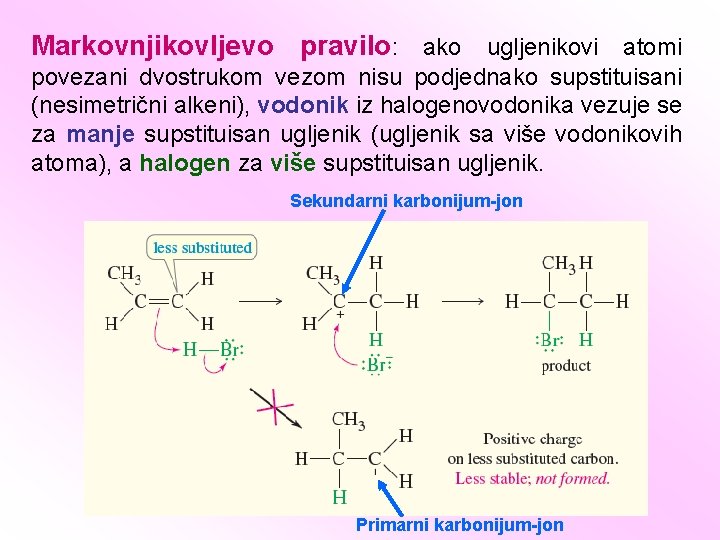
Markovnjikovljevo pravilo: ako ugljenikovi atomi povezani dvostrukom vezom nisu podjednako supstituisani (nesimetrični alkeni), vodonik iz halogenovodonika vezuje se za manje supstituisan ugljenik (ugljenik sa više vodonikovih atoma), a halogen za više supstituisan ugljenik. Sekundarni karbonijum-jon Primarni karbonijum-jon

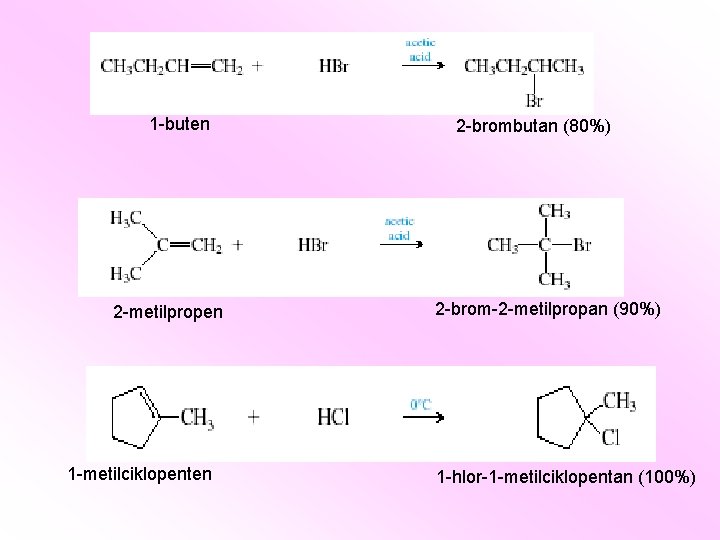
1 -buten 2 -metilpropen 1 -metilciklopenten 2 -brombutan (80%) 2 -brom-2 -metilpropan (90%) 1 -hlor-1 -metilciklopentan (100%)

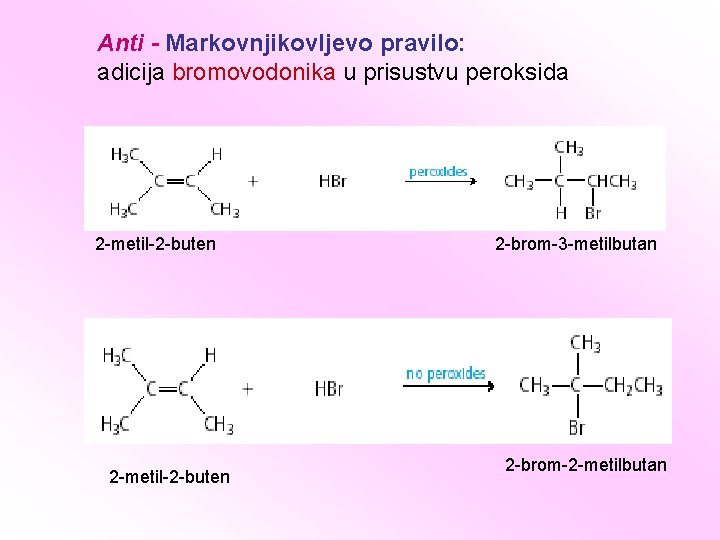
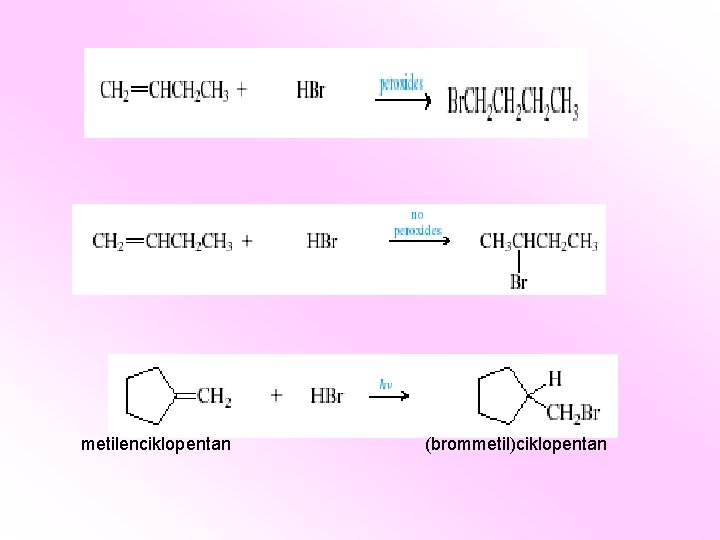
Anti - Markovnjikovljevo pravilo: adicija bromovodonika u prisustvu peroksida 2 -metil-2 -buten 2 -brom-3 -metilbutan 2 -brom-2 -metilbutan

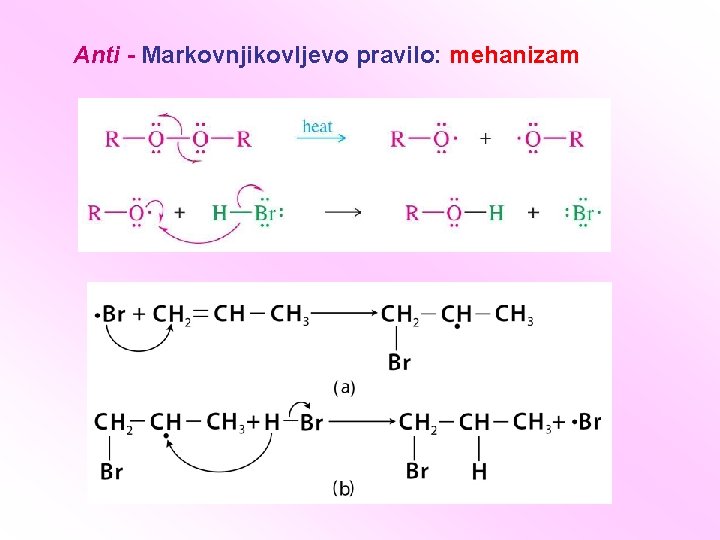
Anti - Markovnjikovljevo pravilo: mehanizam

metilenciklopentan (brommetil)ciklopentan

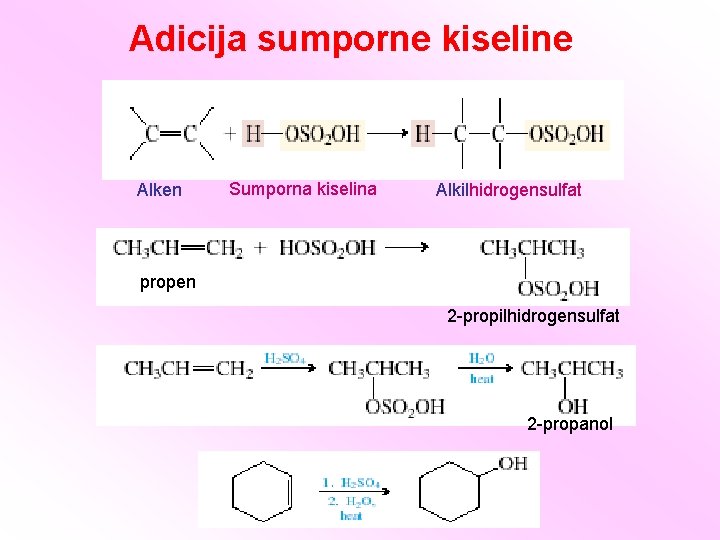
Adicija sumporne kiseline Alken Sumporna kiselina Alkilhidrogensulfat propen 2 -propilhidrogensulfat 2 -propanol

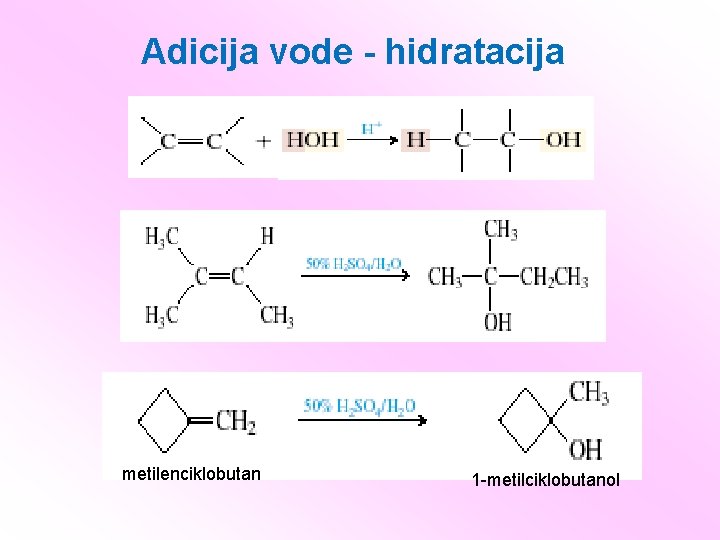
Adicija vode - hidratacija metilenciklobutan 1 -metilciklobutanol

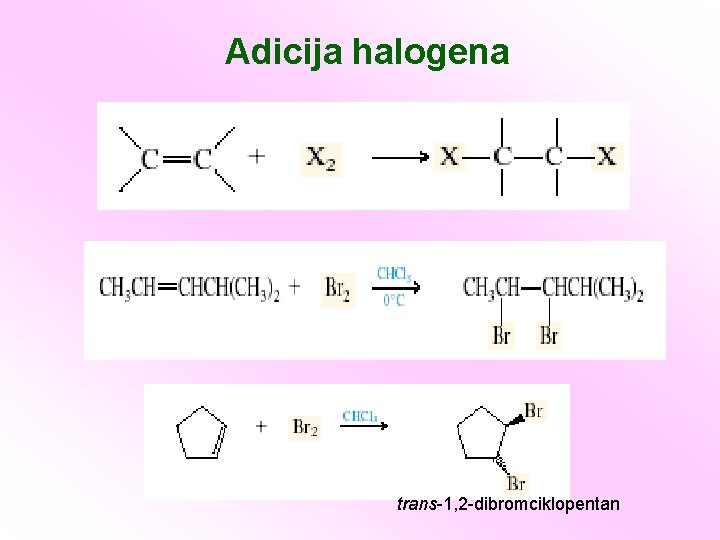
Adicija halogena trans-1, 2 -dibromciklopentan

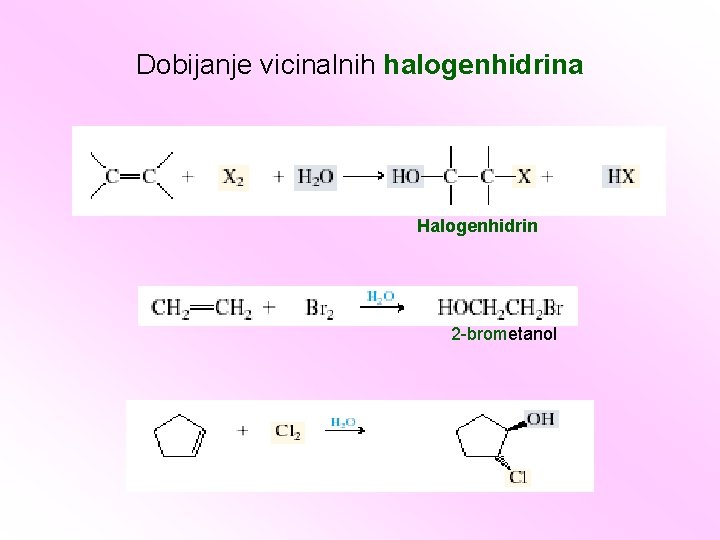
Dobijanje vicinalnih halogenhidrina Halogenhidrin 2 -brometanol


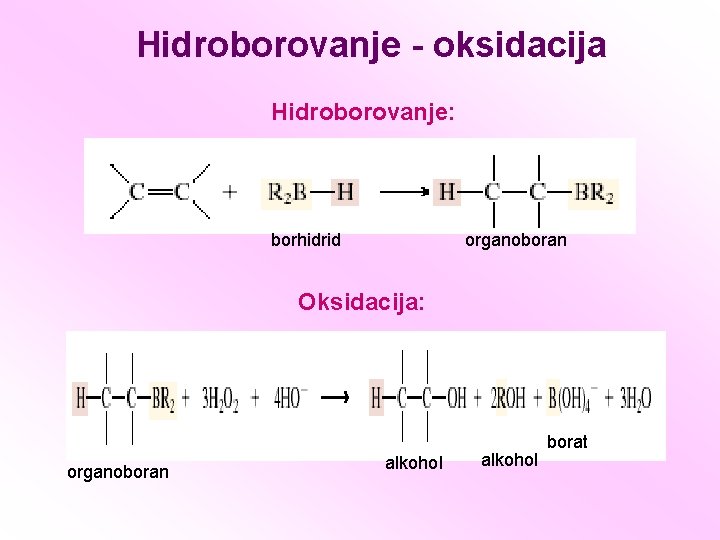
Hidroborovanje - oksidacija Hidroborovanje: borhidrid organoboran Oksidacija: organoboran alkohol borat


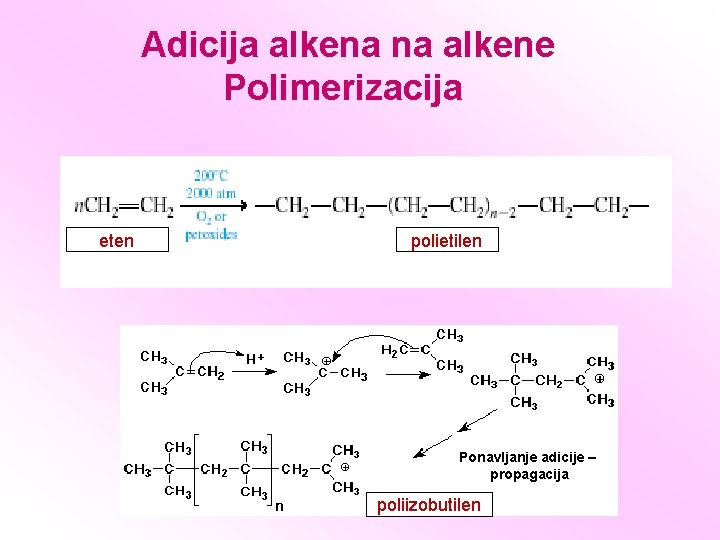
Adicija alkena na alkene Polimerizacija eten polietilen Ponavljanje adicije – propagacija poliizobutilen

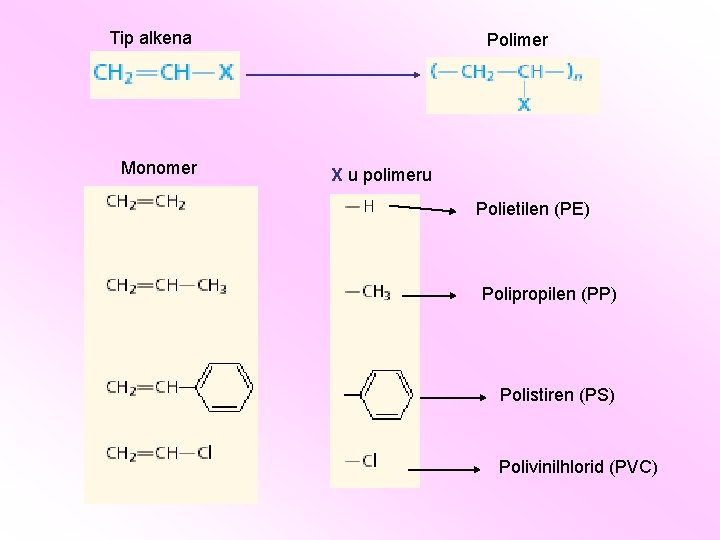
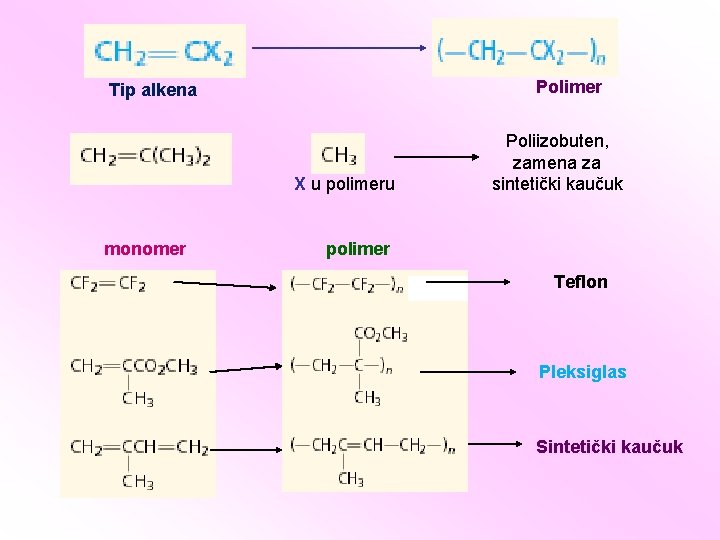
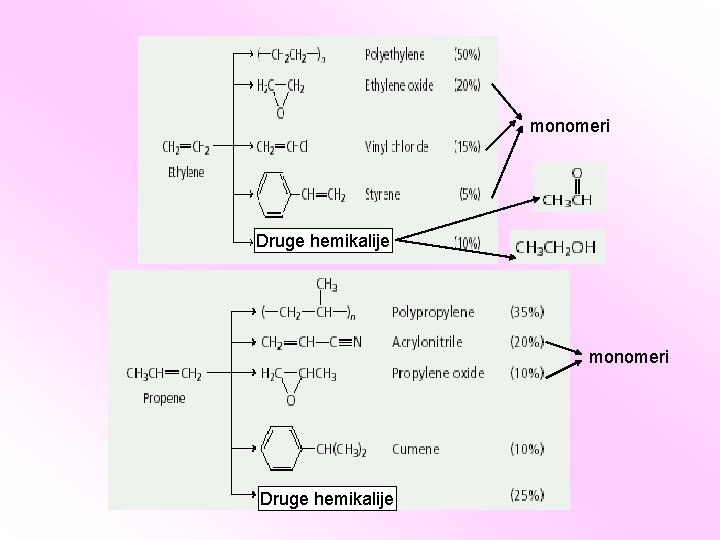
Tip alkena Monomer Polimer X u polimeru Polietilen (PE) Polipropilen (PP) Polistiren (PS) Polivinilhlorid (PVC)

Polimer Tip alkena X u polimeru monomer Poliizobuten, zamena za sintetički kaučuk polimer Teflon Pleksiglas Sintetički kaučuk

monomeri Druge hemikalije


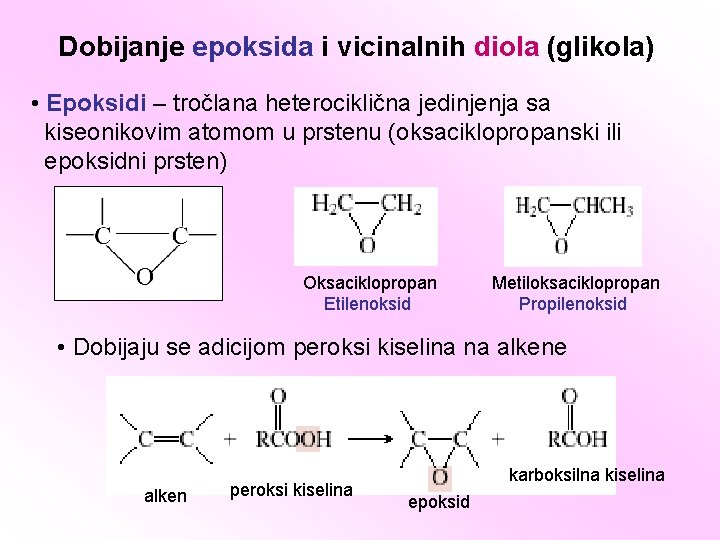
Dobijanje epoksida i vicinalnih diola (glikola) • Epoksidi – tročlana heterociklična jedinjenja sa kiseonikovim atomom u prstenu (oksaciklopropanski ili epoksidni prsten) Oksaciklopropan Etilenoksid Metiloksaciklopropan Propilenoksid • Dobijaju se adicijom peroksi kiselina na alkene alken peroksi kiselina karboksilna kiselina epoksid

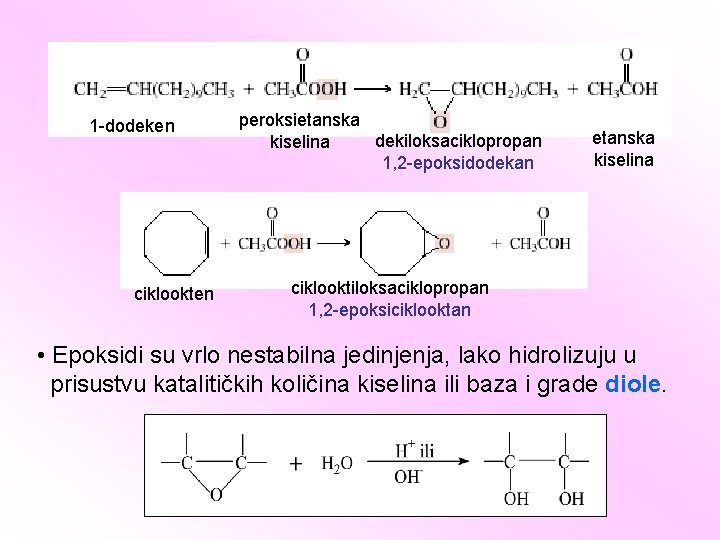
1 -dodeken ciklookten peroksietanska dekiloksaciklopropan kiselina 1, 2 -epoksidodekan etanska kiselina ciklooktiloksaciklopropan 1, 2 -epoksiciklooktan • Epoksidi su vrlo nestabilna jedinjenja, lako hidrolizuju u prisustvu katalitičkih količina kiselina ili baza i grade diole.

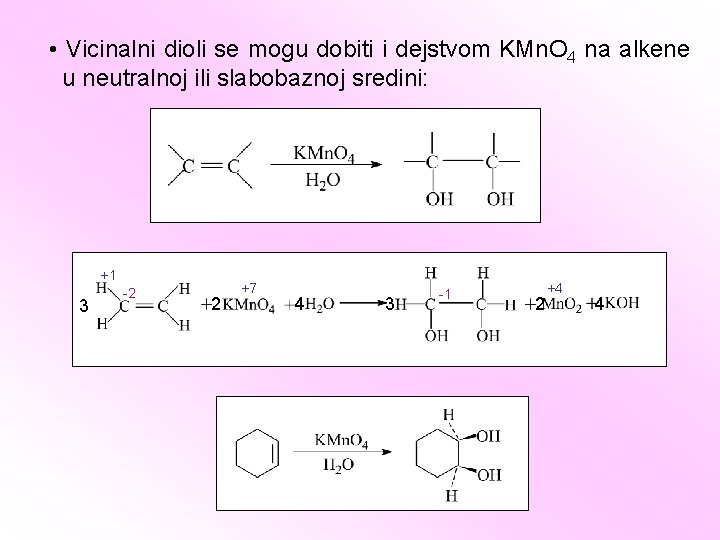
• Vicinalni dioli se mogu dobiti i dejstvom KMn. O 4 na alkene u neutralnoj ili slabobaznoj sredini: +1 3 -2 2 +7 4 3 -1 2 +4 4

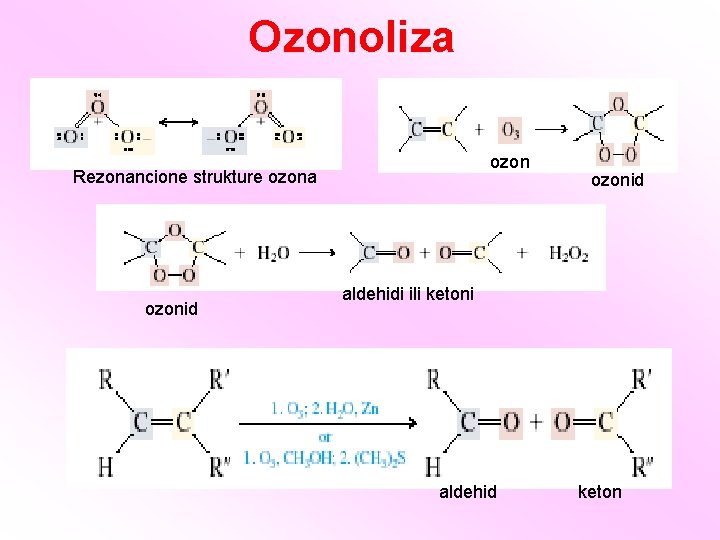
Ozonoliza ozon Rezonancione strukture ozona ozonid aldehidi ili ketoni aldehid keton

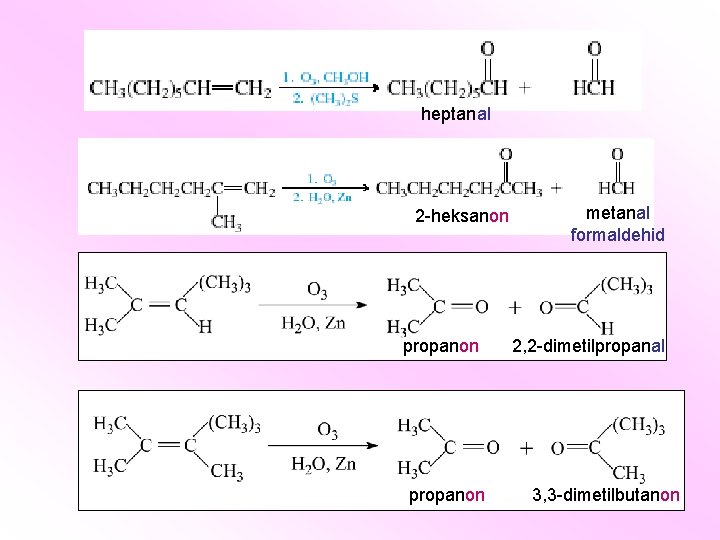
heptanal 2 -heksanon propanon metanal formaldehid 2, 2 -dimetilpropanal 3, 3 -dimetilbutanon


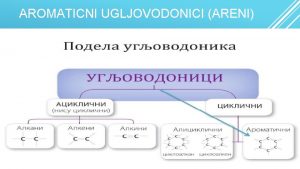
 Ogļūdeņražu nosaukumi
Ogļūdeņražu nosaukumi Tei tetra
Tei tetra Metan etan propan butan tabela
Metan etan propan butan tabela Funkcionalna grupa
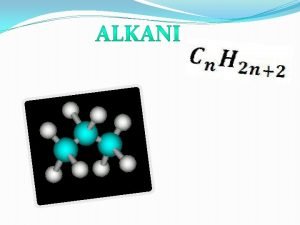
Funkcionalna grupa Dobijanje alkana
Dobijanje alkana Benzen + 3cl2
Benzen + 3cl2 Aliciklicni
Aliciklicni Piroliza butana
Piroliza butana Explicit vs recursive formula
Explicit vs recursive formula I=prt definition
I=prt definition Significance of chemical formula
Significance of chemical formula Empirical formula vs molecular formula
Empirical formula vs molecular formula Percentage to empirical formula
Percentage to empirical formula Define molecular formula
Define molecular formula Thermal energy definition
Thermal energy definition Exponential geometric sequence
Exponential geometric sequence Molecular formula from empirical formula
Molecular formula from empirical formula What is the empirical formula
What is the empirical formula Empirical formula chemistry
Empirical formula chemistry Covalent compound formula
Covalent compound formula Explicit and recursive formulas
Explicit and recursive formulas Arithmetic explicit rule
Arithmetic explicit rule Explicit versus recursive
Explicit versus recursive Ellipsis in sequence
Ellipsis in sequence How to find recursive formula for arithmetic sequence
How to find recursive formula for arithmetic sequence How to find empirical formula from percentages
How to find empirical formula from percentages Empirical formula pogil
Empirical formula pogil Empirical formula rhyme
Empirical formula rhyme Homologous series of hydrocarbons
Homologous series of hydrocarbons Empirical formula vs
Empirical formula vs Compound ratio
Compound ratio Mass mole
Mass mole Formula mass vs gram formula mass
Formula mass vs gram formula mass Fiserove formule
Fiserove formule Zapreminski udeo formula
Zapreminski udeo formula Boiling point formula
Boiling point formula Fret formula
Fret formula Ytm downloader
Ytm downloader Spot forward rate formula
Spot forward rate formula Y=kx2 graph
Y=kx2 graph Teorema o srednjoj vrednosti integrala
Teorema o srednjoj vrednosti integrala Proportion graphs
Proportion graphs Quartile deviation
Quartile deviation Writing formulas (crisscross method)
Writing formulas (crisscross method) Barium nitrate criss cross method
Barium nitrate criss cross method How to write an argumentative thesis statement
How to write an argumentative thesis statement Example of a thematic statement
Example of a thematic statement Kinetic energy and work
Kinetic energy and work How many types of energy are there
How many types of energy are there Mxgxh formula
Mxgxh formula Centerline velocity formula
Centerline velocity formula Hata model formula
Hata model formula Tip speed formula
Tip speed formula Coconut oil chemical formula
Coconut oil chemical formula Carl friedrich gauss formula
Carl friedrich gauss formula Manual wbc count calculation
Manual wbc count calculation Area of cross section of cuboid
Area of cross section of cuboid Jaggi and lau group based valuation model
Jaggi and lau group based valuation model Gravity
Gravity How to calculate consumer and producer surplus
How to calculate consumer and producer surplus How to calculate consumer surplus
How to calculate consumer surplus Gdp calculation expenditure approach
Gdp calculation expenditure approach Physics
Physics Derive coulomb's law from gauss law
Derive coulomb's law from gauss law Hexacarbon decahydride hexoxide
Hexacarbon decahydride hexoxide Wacc formula
Wacc formula Schaeffer's formula in kg
Schaeffer's formula in kg Water jet velocity formula
Water jet velocity formula Price level formula
Price level formula Jfet small signal analysis
Jfet small signal analysis