Zakonitosti i jednaine koje odreuju karakteristike gasova U





















- Slides: 23


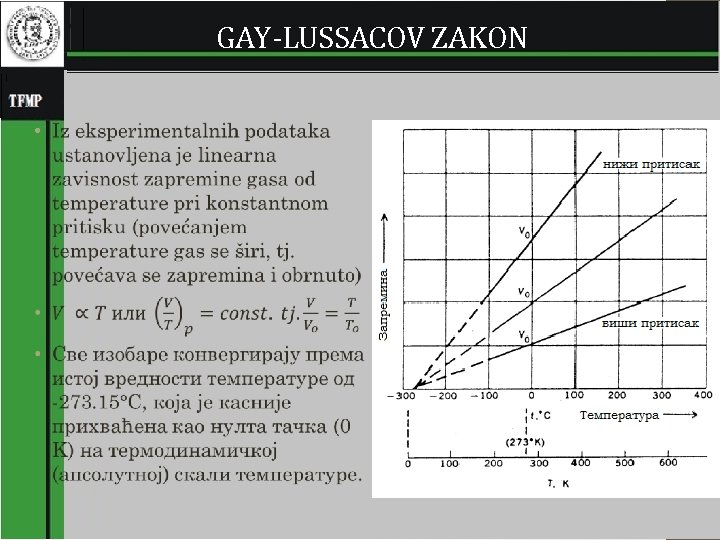
Zakonitosti i jednačine koje određuju karakteristike gasova • U gasovima molekuli su jako udaljene jedni od drugih pa svojstva gasa ne zavise od međumolekulske sile. • Zato se svi gasovi slično ponašaju, osim pri velikom pritisku i temperaturi. • Za razliku od gasova, svojstva tečnost i čvrstih supstanci jako zavisi od međumolekulskih sila. • Gas je homogeni fluid bez oblika i zapremine; gas ispunjava zapremine rezervoara i za razliku od tečnosti nema površine, odnosno međupovršine. • Svaki gas se ponaša kao idealni gas pri niskom pritisku i višoj temperaturi, na pr. pri standardnim uslovima (STP, standardni pritisak i temperatura, psc = 1, 01325 bar, Tsc = 15 °C 2

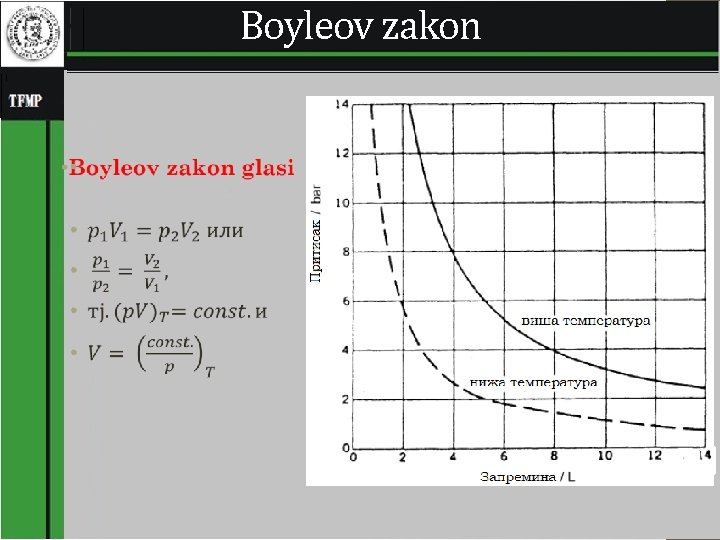
Svojstva idealnog gasa su: 1. Zapremina samih molekula gasa beznačajna je u odnosu na zapreminu koju zauzima gas, 2. Nema sila privlačenja ili odbijanja između molekula gasa niti između molekula i zidova rezervoara. 3. Sudari između molekula su elastični i nema gubitka unutrašnje energije molekula pri sudaru. • Zakon idealnog gasa definiše zavisnost zapremine gasa od pritiska i temperature i količine materije, a izveden je na osnovu eksperimentalnih radova Boylea, Daltona, Guy. Lussaca односно Charlesa и Avogadra. 3

Boyleov zakon • 4

GAY-LUSSACOV ZAKON • 5

Avogadrov закон • 6

ZAPAMTI !!! Avogadrov zakon: Isti broj molekula dva različita gasa pri istim uslovima (pritisak i temperatura) zauzimaju istu zapreminu!!! 7



Opšta i Individualna gasna konstanta • 10

Molarna masa, molarna zapremina, Avogadrov broj Mol je ona količina supstance koja u sebi sadrži toliko čestica koliko ima atoma u 12 g ugljenikovog izotopa C-12, a u tih 12 g ugljenika 12 C ima 6, 023 x 1023 atoma (to jest ako se zaokruži 6 x 1023 atoma) Avogadrov broj je konstanta koja pokazuje "da u 1 mol supstance ima 6 x 1023 čestica" NA = 6 x 1023 1/mol. 11

Molarni (molski) udeo frakcija (yi) • 12

Broj molova • 13

Molarna zapremina • 14

• Ukoliko se koriste ove formule mora se voditi računa da ukoliko je n (mol) količina atoma, onda se sve u formuli odnosi na atome! • Ukoliko je n(mol) količina molekula, onda se sve u formulama odnosi na molekule. • * molekula je količina supstance koja se koristi za supstance izgradjene kao molekuli • (H 2 - 1 molekula vodonika) • * mol atom je količina supstance koja može uvek da se koristi, ali se posmatra broj atoma - indeksi u formuli (H 2 - 2 mol atoma vodonika) 15

Molarna zapremina nije uvek 22, 4 dm 3/mol. Njena vrednost se menja sa promenom pritiska i temperature. Ako je temperatura 0 o. C i pritisak 101, 3 k. Pa onda Vm=22, 4 dm 3/mol, to se dobija iz jednačine idealnog gasnog stanja: p. V=n. RT p-pritisak u k. Pa, V-zapremina u dm 3, n - količina supstance (mol), R = 8, 314 k. Padm 3/(mol. K)-gasna konstanta, T-temperatura u kelvinima (K) Jednačina idealnog gasnog stanja može da se iskoristi ukoliko uslovi nisu normalni a traži se količina supstance ili masa ili zapremina gasa! 16

Tečne supstance: • Voda ima gustinu 1 g/cm 3 (na 4 o. C) ili blizu 1 g/cm 3 na temperaturama od 0 do 100 stepeni Celzijusa. Zbog toga je 1 g vode isto što i 1 cm 3 (to jest 1 ml). • Za ostale supstance: ukoliko je zadata masa, a traži se zapremina, potreban je podatak o gustini. Ukoliko se zna gustina tečne supstnce, "može se iz grama dobiti cm 3, i obrnuto". 17

Maseni udeo • 18

Zapreminski udeo • 19

Odnos između zapreminskih i molskih udela • Za idealni gas je odnos između zapreminskog udela komponentata(Vi) i molskih udela jednaka(yi), Vi = yi, . što je u skladu sa Avogadro's zakonom. • Za sistem idealnih gasova, kao što su naftni gasovi, sastav se može izračunati na osnovu nekog od sledećih podataka: Mase komponenata, zapremine, gustine, napona para itd. 20

Molekulska težina (masa) • 21

Daltonov zakon • Daltonov zakon parcijalnih pritisaka postulira da je ukupni pritisak gasne smeše jednak zbiru pritisaka komponenti smeše. • Parcijalni pritisak svake komponente u smeši jednak je pritisku, koji bi vladao u rezervoaru iste zapremine, ispunjenom istom količinom samo te komponente. pi = p yi 22

Amagatov zakon • 23
 Disperzni sistemi primeri
Disperzni sistemi primeri Ispitivanje lambda sonde
Ispitivanje lambda sonde Ununoktijum
Ununoktijum Molekulsko kineticka teorija gasova zadaci
Molekulsko kineticka teorija gasova zadaci Sistem organa za disanje kod coveka
Sistem organa za disanje kod coveka Kontrola izduvnih gasova
Kontrola izduvnih gasova Osnovna jednacina molekulsko kineticke teorije gasova
Osnovna jednacina molekulsko kineticke teorije gasova Vrste stihova s obzirom na broj slogova
Vrste stihova s obzirom na broj slogova Meritorna javna dobra
Meritorna javna dobra Polarni moment otpora
Polarni moment otpora Hiperbola disa shembuj
Hiperbola disa shembuj Renesansa u muzici
Renesansa u muzici Metrijske karakteristike
Metrijske karakteristike Karakteristike tramvaja
Karakteristike tramvaja Vizija posle propovedi
Vizija posle propovedi Pljevaljski ugalj karakteristike
Pljevaljski ugalj karakteristike Ugalj ugljevik karakteristike
Ugalj ugljevik karakteristike Sekundarne polne karakteristike
Sekundarne polne karakteristike Interni kes
Interni kes Tranje
Tranje Mesimdhenia ndervepruese
Mesimdhenia ndervepruese Karakteristike autizma
Karakteristike autizma Karakteristike turisticke traznje
Karakteristike turisticke traznje Licne karakteristike preduzetnika
Licne karakteristike preduzetnika











































