Trasporto al nucleo MOLTE MOLECOLE ENTRANO ED ESCONO























- Slides: 46

Trasporto al nucleo

MOLTE MOLECOLE ENTRANO ED ESCONO DAL NUCLEO COSA ENTRA Proteine: polimerasi, istoni, fattori di trascrizione, p. ribosomali, etc. Nucleotidi, etc. COSA ESCE r. RNA, t. RNA, m. RNA (uniti a proteine!), ribosomi, etc.


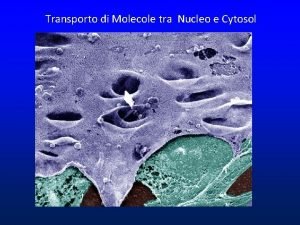
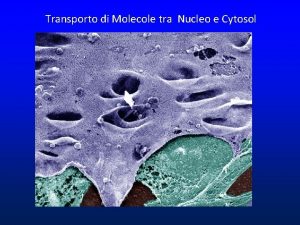
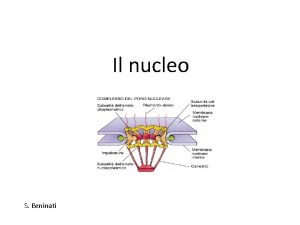
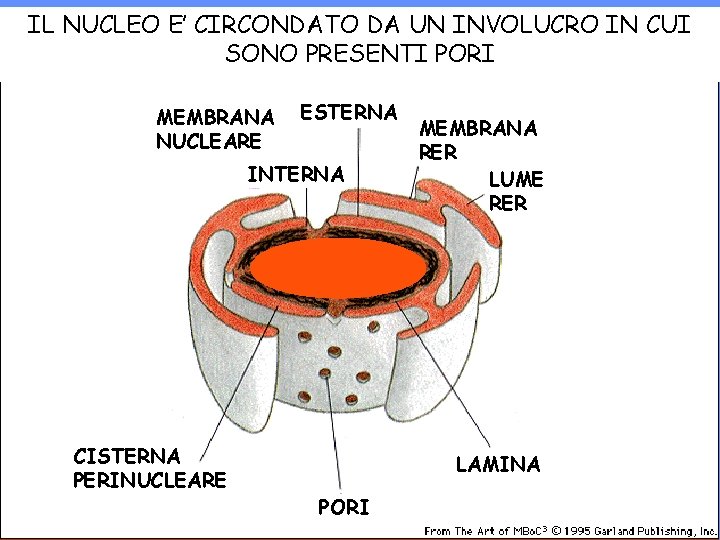
IL NUCLEO E’ CIRCONDATO DA UN INVOLUCRO IN CUI SONO PRESENTI PORI MEMBRANA NUCLEARE ESTERNA INTERNA CISTERNA PERINUCLEARE MEMBRANA RER LUME RER LAMINA PORI

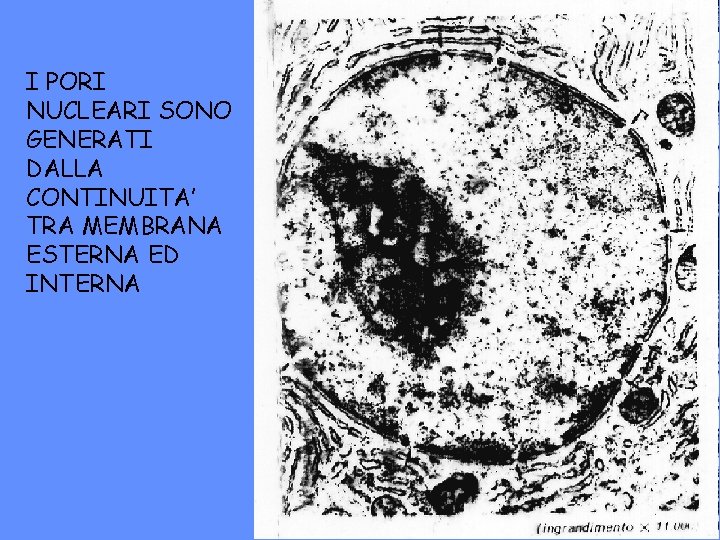
I PORI NUCLEARI SONO GENERATI DALLA CONTINUITA’ TRA MEMBRANA ESTERNA ED INTERNA

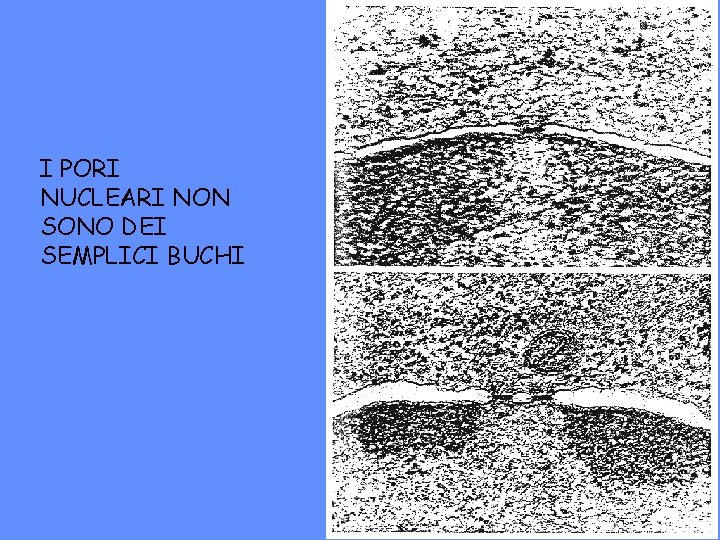
I PORI NUCLEARI NON SONO DEI SEMPLICI BUCHI

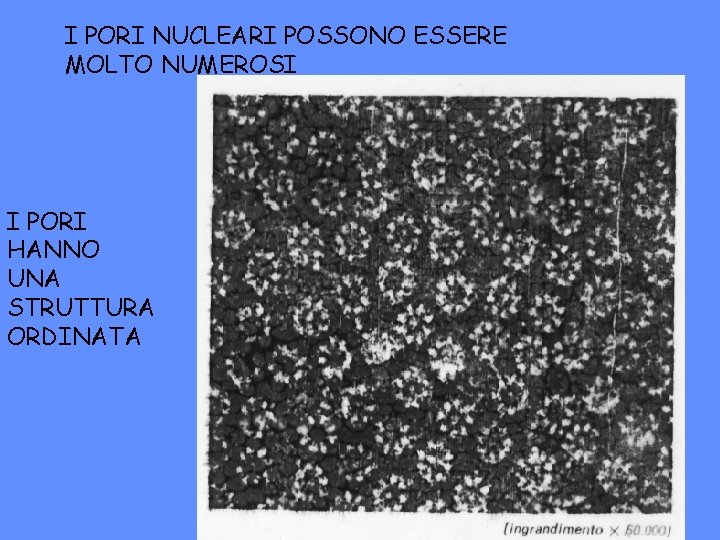
I PORI NUCLEARI POSSONO ESSERE MOLTO NUMEROSI I PORI HANNO UNA STRUTTURA ORDINATA

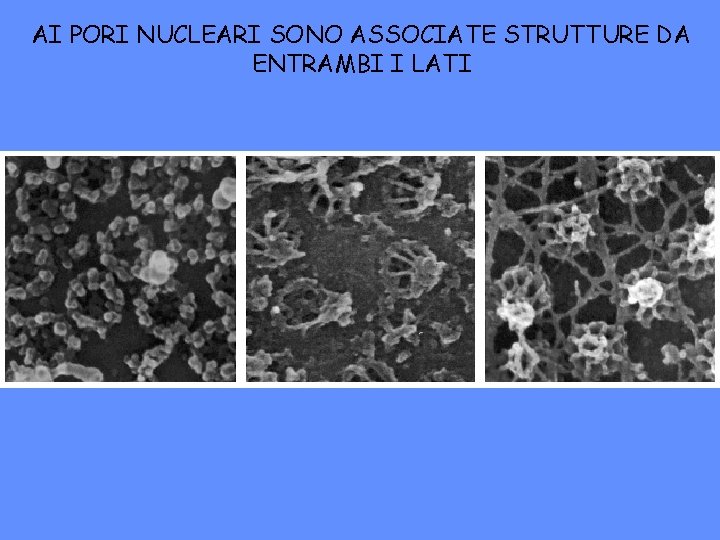
AI PORI NUCLEARI SONO ASSOCIATE STRUTTURE DA ENTRAMBI I LATI

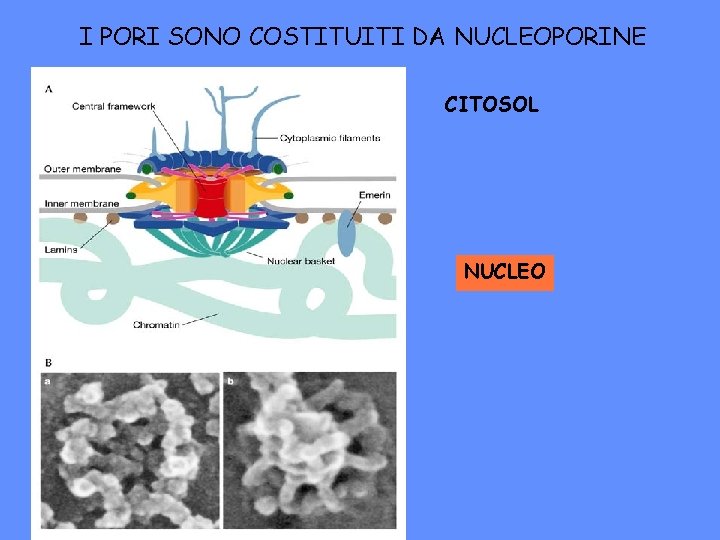
I PORI SONO COSTITUITI DA NUCLEOPORINE CITOSOL NUCLEO


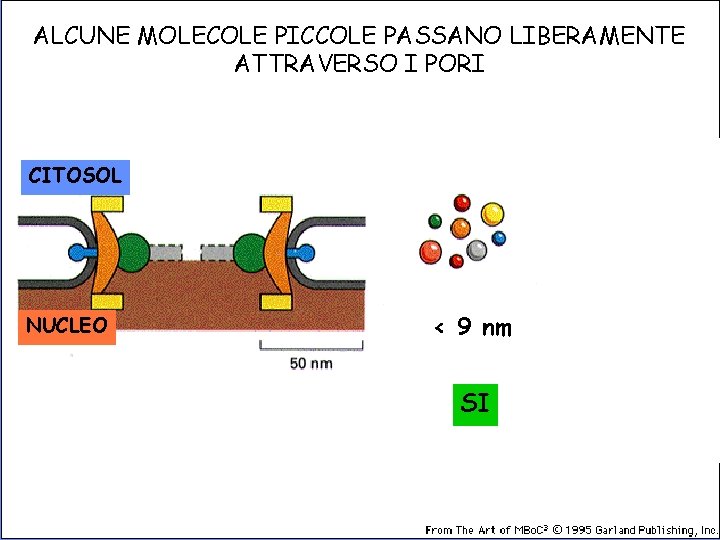
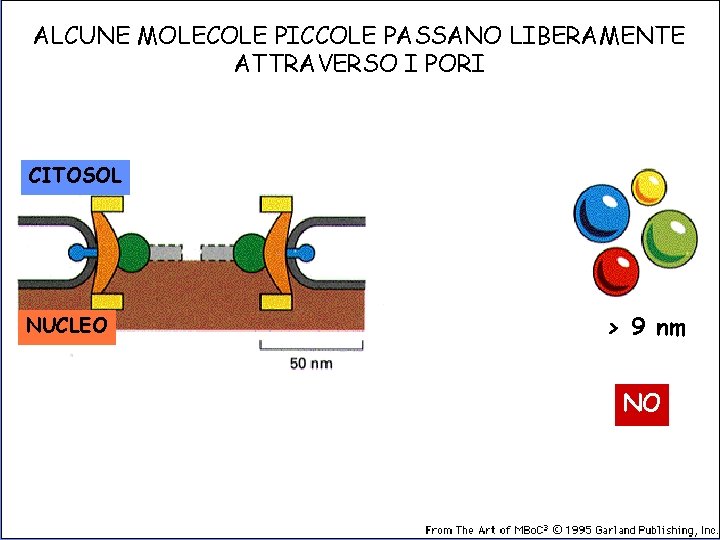
ALCUNE MOLECOLE PICCOLE PASSANO LIBERAMENTE ATTRAVERSO I PORI CITOSOL NUCLEO < 9 nm > 9 nm SI NO

ALCUNE MOLECOLE PICCOLE PASSANO LIBERAMENTE ATTRAVERSO I PORI CITOSOL NUCLEO < 9 nm > 9 nm SI NO



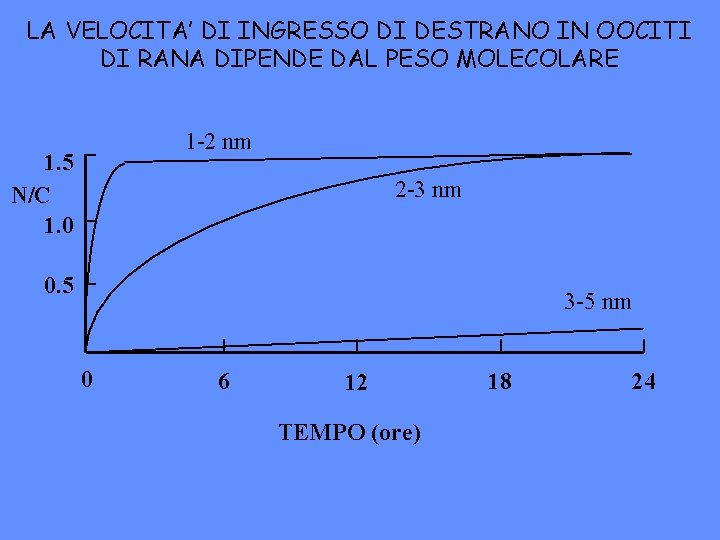
LA VELOCITA’ DI INGRESSO DI DESTRANO IN OOCITI DI RANA DIPENDE DAL PESO MOLECOLARE 1 -2 nm 1. 5 N/C 1. 0 2 -3 nm 0. 5 3 -5 nm 0 6 12 TEMPO (ore) 18 24

ESISTONO SEGNALI DI TRASPORTO DI PROTEINE NEL NUCLEO? COME SONO FATTI QUESTI SEGNALI? COME SI DIMOSTRA L’ESISTENZA DI QUESTI SEGNALI?

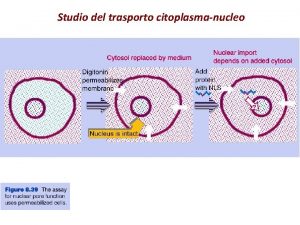
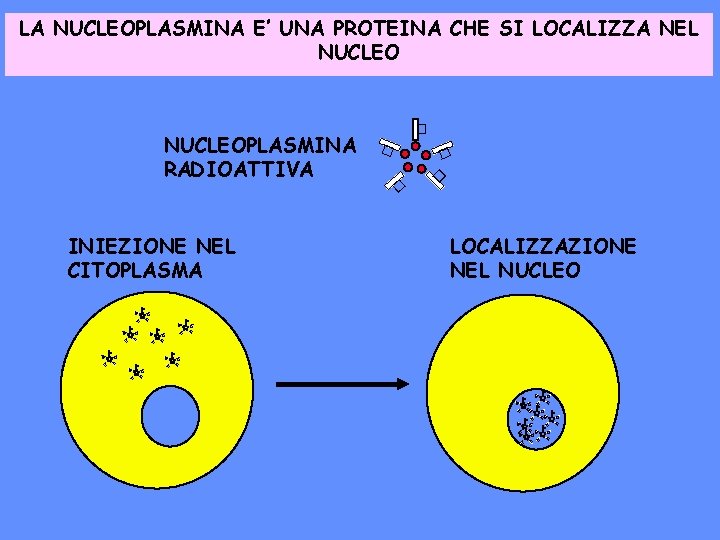
LA NUCLEOPLASMINA E’ UNA PROTEINA CHE SI LOCALIZZA NEL NUCLEO � � INIEZIONE NEL CITOPLASMA � � NUCLEOPLASMINA RADIOATTIVA � LOCALIZZAZIONE NEL NUCLEO � � � � � � � � � � �� � � � � � � � � �

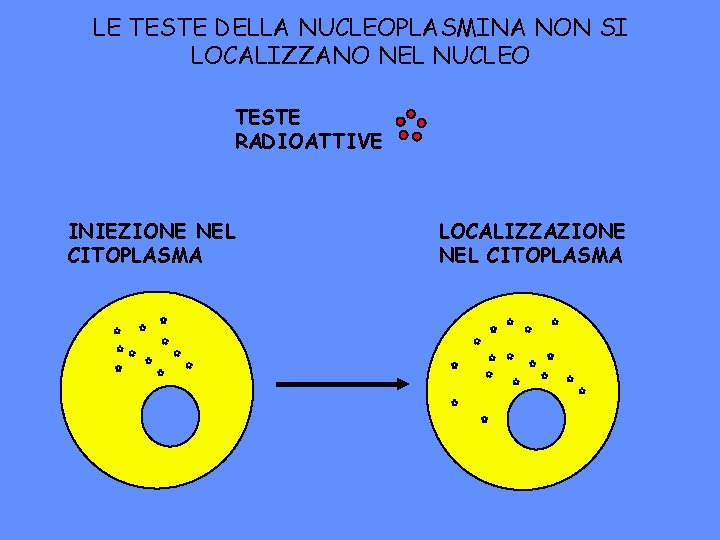
LE TESTE DELLA NUCLEOPLASMINA NON SI LOCALIZZANO NEL NUCLEO TESTE RADIOATTIVE INIEZIONE NEL CITOPLASMA LOCALIZZAZIONE NEL CITOPLASMA � � � � �

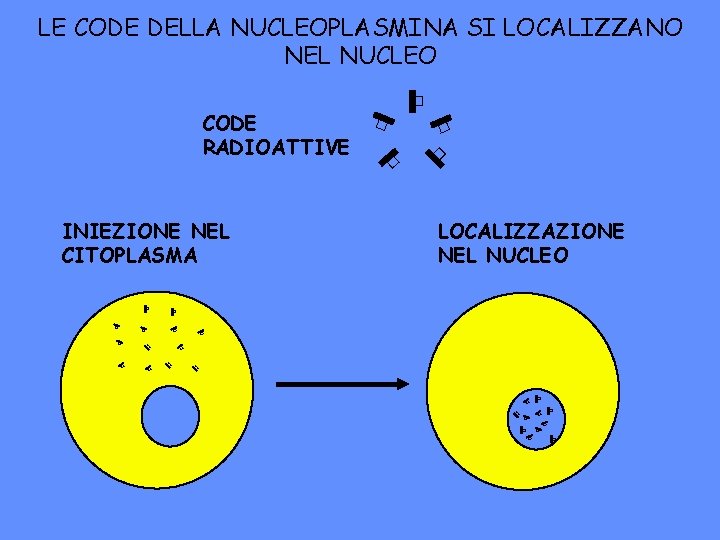
LE CODE DELLA NUCLEOPLASMINA SI LOCALIZZANO NEL NUCLEO � � INIEZIONE NEL CITOPLASMA � � CODE RADIOATTIVE � LOCALIZZAZIONE NEL NUCLEO � � � � � � � � �

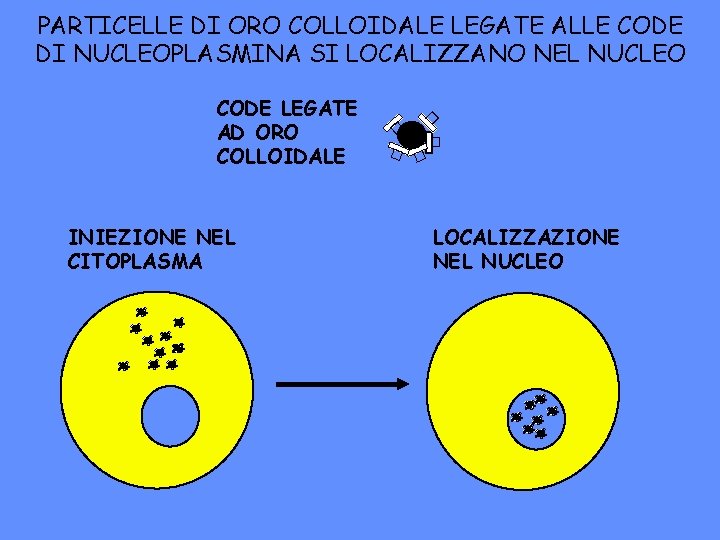
INIEZIONE NEL CITOPLASMA � � � CODE LEGATE AD ORO COLLOIDALE � PARTICELLE DI ORO COLLOIDALE LEGATE ALLE CODE DI NUCLEOPLASMINA SI LOCALIZZANO NEL NUCLEO � LOCALIZZAZIONE NEL NUCLEO � � � � � � � � � � �� � � � � � � � � � � � �

LA SEQUENZA SEGNALE DELL’ANTIGENE T E’ STATA INDIVIDUATA MEDIANTE DELEZIONI N N N/C C N C

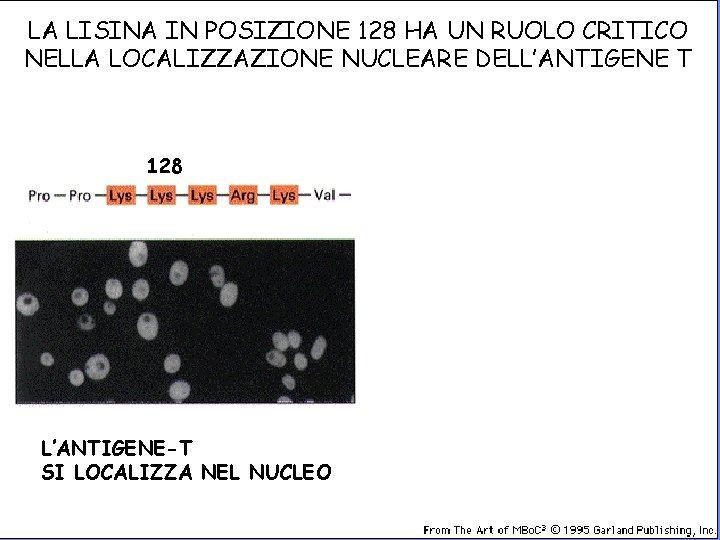
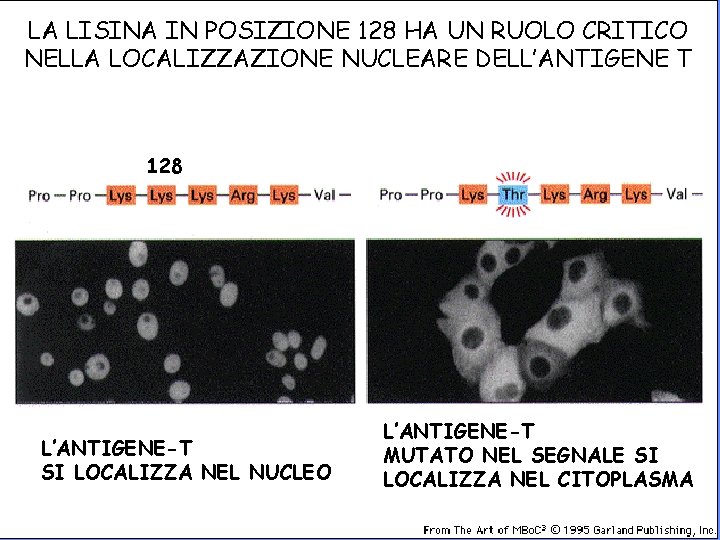
LA LISINA IN POSIZIONE 128 HA UN RUOLO CRITICO NELLA LOCALIZZAZIONE NUCLEARE DELL’ANTIGENE T L’ANTIGENE-T MUTATO NEL SEGNALE SI LOCALIZZA NEL CITOPLASMA 128 L’ANTIGENE-T SI LOCALIZZA NEL NUCLEO

LA LISINA IN POSIZIONE 128 HA UN RUOLO CRITICO NELLA LOCALIZZAZIONE NUCLEARE DELL’ANTIGENE T 128 L’ANTIGENE-T SI LOCALIZZA NEL NUCLEO L’ANTIGENE-T MUTATO NEL SEGNALE SI LOCALIZZA NEL CITOPLASMA

LA DIMOSTRAZIONE CHE UNA SEQUENZA E’ UN SEGNALE PREVEDE ESPERIMENTI DI: 1. RIMOZIONE DELLA SEQUENZA 2. MUTAZIONE DELLA SEQUENZA 3. TRASFERIMENTO DELLA SEQUENZA SU UN’ALTRA PROTEINA

LE SEQUENZE SEGNALE DI LOCALIZZAZIONE NEL NUCLEO HANNO CARATTERISTICHE IN COMUNE PROTEINA SEQUENZA ANTIGENE T (SV 40) Pro-Lys-Lys-Arg-Lys-Val PROTEINA 72 k. Da (adenovirus) Pro-Lys-Lys-Lys-Arg VP 2/3 (polioma) Gln-Lys-Lys-Arg-Lys-Leu 70 k. Da (drosophila) Lys-Arg-Gly-Lys-Arg-Lys c-myc (pollo) Glu-Gln-Lys-Arg-Arg

LE SEQUENZE SEGNALE DI LOCALIZZAZIONE NEL NUCLEO HANNO CARATTERISTICHE IN COMUNE NLS NUCLEAR LOCALIZATION SIGNALS 1. SEQUENZE RICCHE IN AA BASICI PKKKRKV 2. ALL’INTERNO DELLA PROTEINA! 3. FREQUENTEMENTE BIPARTITE!!

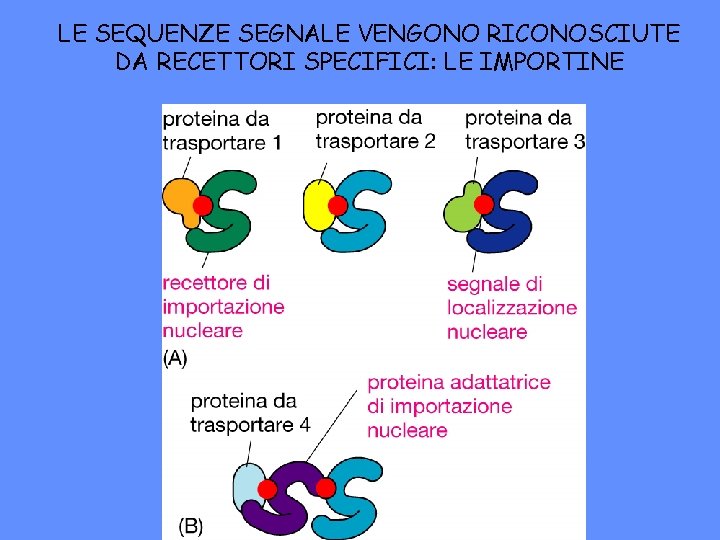
LE SEQUENZE SEGNALE VENGONO RICONOSCIUTE DA RECETTORI SPECIFICI: LE IMPORTINE

SI POSSONO INDIVIDUARE PIU’ TAPPE NEL TRASPORTO NUCLEARE 1. PROTEINE SOLUBILI (IMPORTINE) RICONOSCONO LE NLS 2. IL COMPLESSO IMPORTINE-PROTEINA NUCLEARE SI LEGA ALLE PROTEINE DEL PORO (NUP) (RIPETIZIONI FG) 3. IL PORO SI DILATA ED IL COMPLESSO LO ATTRAVERSA 4. L’IMPORTINA SI DISSOCIA DALLA PROTEINA NUCLEARE 5. L’IMPORTINA TORNA NEL CITOSOL

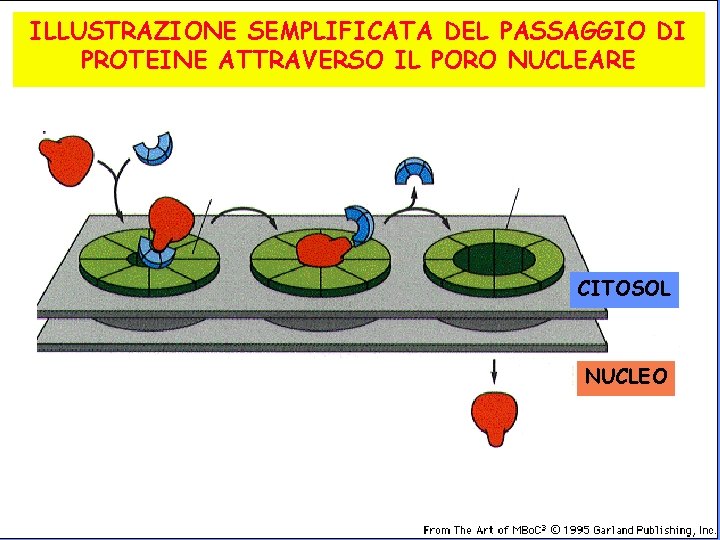
ILLUSTRAZIONE SEMPLIFICATA DEL PASSAGGIO DI PROTEINE ATTRAVERSO IL PORO NUCLEARE CITOSOL NUCLEO

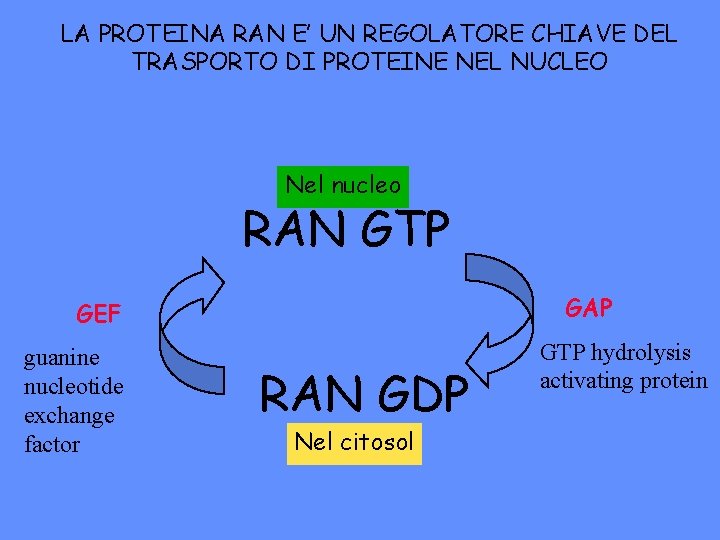
LA PROTEINA RAN E’ UN REGOLATORE CHIAVE DEL TRASPORTO DI PROTEINE NEL NUCLEO Nel nucleo RAN GTP GAP GEF guanine nucleotide exchange factor RAN GDP Nel citosol GTP hydrolysis activating protein

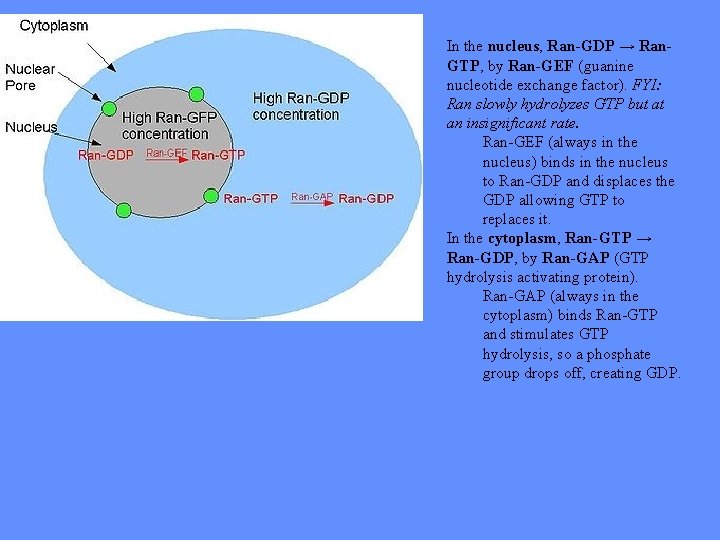
In the nucleus, Ran-GDP → Ran. GTP, by Ran-GEF (guanine nucleotide exchange factor). FYI: Ran slowly hydrolyzes GTP but at an insignificant rate. Ran-GEF (always in the nucleus) binds in the nucleus to Ran-GDP and displaces the GDP allowing GTP to replaces it. In the cytoplasm, Ran-GTP → Ran-GDP, by Ran-GAP (GTP hydrolysis activating protein). Ran-GAP (always in the cytoplasm) binds Ran-GTP and stimulates GTP hydrolysis, so a phosphate group drops off, creating GDP.


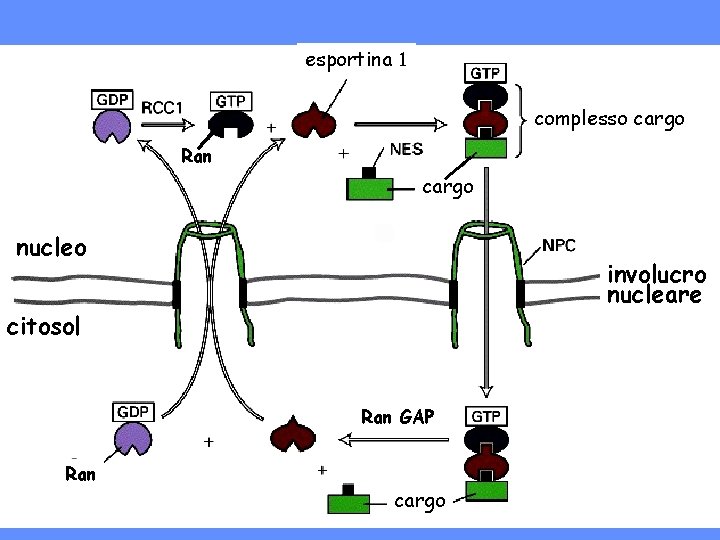
ANCHE L’ESPORTAZIONE DI PROTEINE DAL NUCLEO RICHIEDE SEGNALI NES NUCLEAR EXPORT SIGNALS 1. hn. RNP A 1 (38 RESIDUI AMMINOACIDICI) 2. hn. RNP K 3. PK 1 e Rev (RICCHE DI LEUCINA)


IL TRASPORTO NUCLEO>CITOSOL SI SVOLGE MEDIANTE TAPPE SIMILI A QUELLE CITOSOL>NUCLEO 1. PROTEINE SOLUBILI (ESPORTINA) RICONOSCONO LE NES 2. IL COMPLESSO ESPORTINA-PROTEINA NUCLEARE SI LEGA AL PORO 3. IL COMPLESSO ATTRAVERSA IL PORO 4. L’ESPORTINA SI DISSOCIA DALLA PROTEINA NUCLEARE 5. L’ESPORTINA TORNA NEL NUCLEO

esportina complesso cargo Ran cargo nucleo involucro nucleare citosol Ran GAP Ran cargo

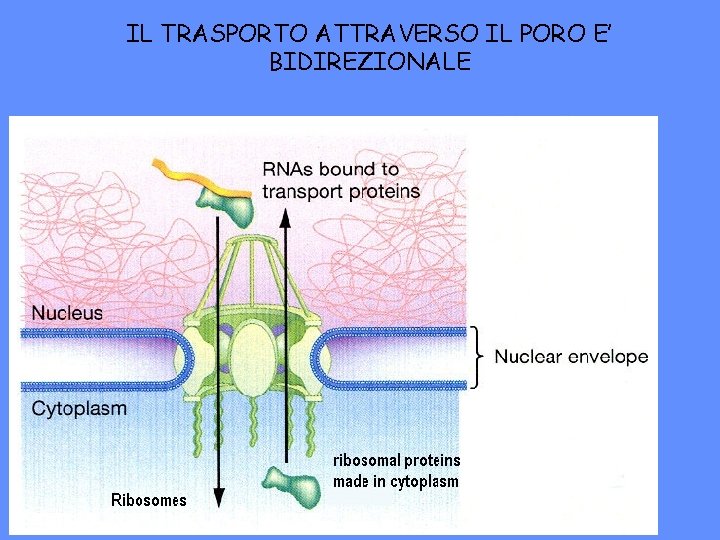
IL TRASPORTO ATTRAVERSO IL PORO E’ BIDIREZIONALE


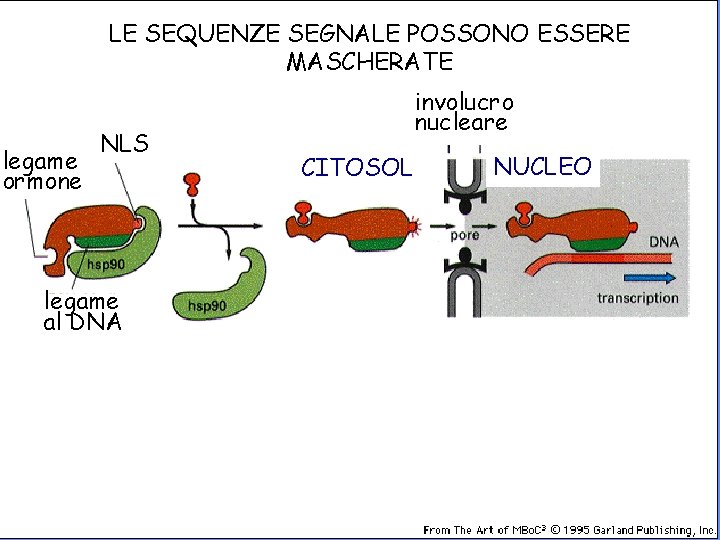
LE SEQUENZE SEGNALE POSSONO ESSERE MASCHERATE legame ormone NLS legame al DNA involucro nucleare CITOSOL NUCLEO


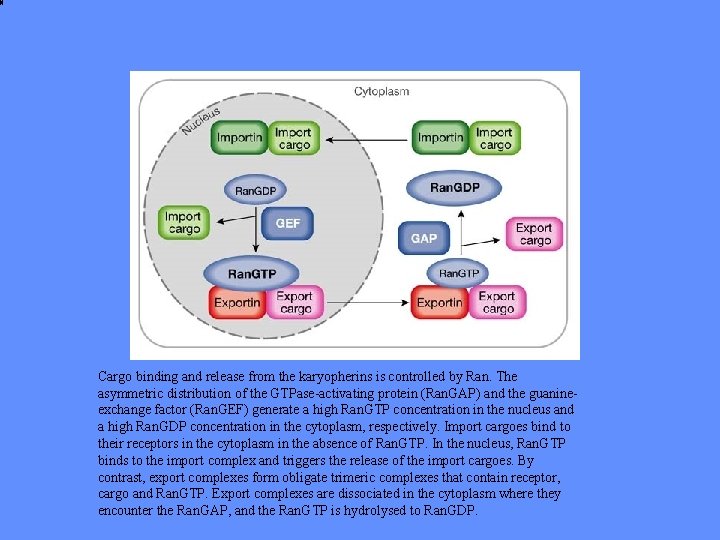
Cargo binding and release from the karyopherins is controlled by Ran. The asymmetric distribution of the GTPase-activating protein (Ran. GAP) and the guanineexchange factor (Ran. GEF) generate a high Ran. GTP concentration in the nucleus and a high Ran. GDP concentration in the cytoplasm, respectively. Import cargoes bind to their receptors in the cytoplasm in the absence of Ran. GTP. In the nucleus, Ran. GTP binds to the import complex and triggers the release of the import cargoes. By contrast, export complexes form obligate trimeric complexes that contain receptor, cargo and Ran. GTP. Export complexes are dissociated in the cytoplasm where they encounter the Ran. GAP, and the Ran. GTP is hydrolysed to Ran. GDP.




Nuclear lamina functions include: DNA replication. During the process of DNA replication, the DNA undergoes an elongation phase where the DNA is stretched out. Studies have indicated that the nuclear lamina provide a support structure for the DNA during this process. Additionally, there have been some indications that free lamin polypeptides may play part in a regulatory role during DNA replication. Nuclear Support. The intermediate fibers that comprise part of the nuclear lamina, help provide structure and support to the nucleus similar to the way the intermediate fibers in the cytoplasm provide support and structure to the rest of the cell. Chromatin organization. With the help of lamin polypeptides the nuclear lamina binds to the chromatin at matrix attachment regions (MAR) which are 300 -1000 base pair sequences in the DNA. Cell cycle regulation. At the beginning of mitosis, the nuclear lamina along with the nuclear membrane and pores start to breakdown, allowing for the chromosomes to intact and bind with the mitotic spindle. Then at the end of mitosis, these 3 structures reassemble to once again encapsulate the nuclear contents. Cell development and differentiation. In embryonic studies of some birds and mammals, five different forms of lamin have been discovered: LI and LII considered to be similar to lamins B 1 and B 2; LIII considered to be similar to a B-type lamin; LA considered to be homologous to lamin type-A; and a fifth type that is specific to germ cells only. Lamins LI, LII and LIII (the Btype) appear to be expressed more in the earlier stages of embryonic development while the A and C-type lamins become significantly expressed in the later stages of development. Apoptosis, also known as cellular suicide involves the early breakdown of nuclear lamina. Without this step, the well coordinated apoptosis process would not continue. Even though there may be only a few genes that code for nuclear lamina, various mutations to these genes are responsible for a number of human heritable diseases including: Emery-Dreifuss muscular dystrophy Limb girdle muscular dystrophy Dilated cardiomyopathy (DCM) with conduction system disease Familial partial lipodystrophy FPLD) Autosomal recessive axonal neuropathy (Charcot-Marie-Tooth disorder type 2, CMT 2) mandibuloacral dysplasia (MAD) Hutchison Gilford Progeria syndrome (HGS) Greenberg Skeletal Dysplasia Pelger-Huet anomaly (PHA) Restrictive dermopathy Nuclear lamina, originally thought to be nothing more than a nuclear skeletal support system is far more complex than this. It is a multifunctional key structure to the nucleus. Any defects in the nuclear lamina can be catastrophic to the overall heath of the organism as the list of diseases above illustrates. l.

 Me lo rimandi
Me lo rimandi Le molecole della vita
Le molecole della vita Soluzioni capitolo 14 chimica più
Soluzioni capitolo 14 chimica più La polarita
La polarita Valitutti esploriamo soluzioni
Valitutti esploriamo soluzioni Solubilit
Solubilit Geometria ottaedrica molecole
Geometria ottaedrica molecole Molecole discrete
Molecole discrete Soluzioni chimica più capitolo 14
Soluzioni chimica più capitolo 14 Geometria delle molecole
Geometria delle molecole Molecole diatomiche
Molecole diatomiche Valitutti esploriamo soluzioni
Valitutti esploriamo soluzioni Mezzi di trasporto via aria
Mezzi di trasporto via aria Contatto indiretto
Contatto indiretto Emoglobina fetale
Emoglobina fetale Trasporto attivo
Trasporto attivo Divisione tra radicali
Divisione tra radicali Trasporto attivo diretto e indiretto
Trasporto attivo diretto e indiretto Fermentazione alcolica zanichelli
Fermentazione alcolica zanichelli Glicolipidi
Glicolipidi L'addetto al trasporto sanitario può rimuovere il casco
L'addetto al trasporto sanitario può rimuovere il casco Termini primitivi e assiomi
Termini primitivi e assiomi Trasporto di cristo
Trasporto di cristo Scienze
Scienze Foglio rosa trasporto cavalli
Foglio rosa trasporto cavalli Trasporto attivo indiretto
Trasporto attivo indiretto Nucleo pedagogico
Nucleo pedagogico Sujeito e predicado
Sujeito e predicado Corteza manto nucleo
Corteza manto nucleo Nucleo universitario rafael rangel
Nucleo universitario rafael rangel Nucleo reticular talamo
Nucleo reticular talamo Predicado tipos
Predicado tipos Eugen goldstein
Eugen goldstein Aparato de golgi estructura
Aparato de golgi estructura Reparto operativo nucleo investigativo
Reparto operativo nucleo investigativo Nucleo
Nucleo Nucleo sintagma adjetival
Nucleo sintagma adjetival Esquema de un postulado dela teoría celular
Esquema de un postulado dela teoría celular Sistema nervioso simpático y parasimpático: diferencias
Sistema nervioso simpático y parasimpático: diferencias Nucleo gracile e cuneato
Nucleo gracile e cuneato Nucleocounter nc-200 manual
Nucleocounter nc-200 manual Endomicio
Endomicio Funzionamento centrale nucleare
Funzionamento centrale nucleare Atenuacion del nucleo lenticular
Atenuacion del nucleo lenticular Estructura interna de la tierra
Estructura interna de la tierra Nucleo celular dibujo
Nucleo celular dibujo Núcleo caracteristicas
Núcleo caracteristicas