TEMA 1 INTRODUCCIN AL ANLISIS QUMICO Asignatura Anlisis










- Slides: 26

TEMA 1: INTRODUCCIÓN AL ANÁLISIS QUÍMICO Asignatura: Análisis Químico Grado: Bioquímica Curso académico: 2011/12 N. Campillo Seva 1

• 1. Generalidades: – Análisis Cualitativo y Análisis Cuantitativo • 2. Conceptos básicos en Análisis Químico • 3. Clasificación de los métodos de Análisis • 4. El proceso analítico 2 N. Campillo Seva

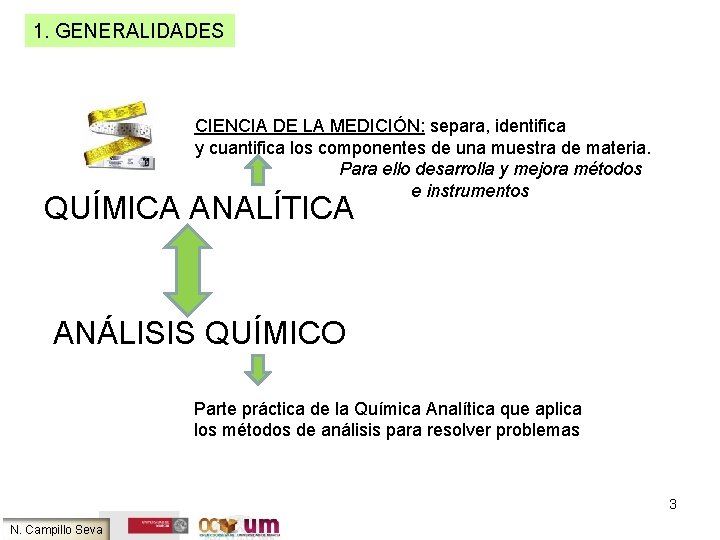
1. GENERALIDADES CIENCIA DE LA MEDICIÓN: separa, identifica y cuantifica los componentes de una muestra de materia. Para ello desarrolla y mejora métodos e instrumentos QUÍMICA ANALÍTICA ANÁLISIS QUÍMICO Parte práctica de la Química Analítica que aplica los métodos de análisis para resolver problemas 3 N. Campillo Seva

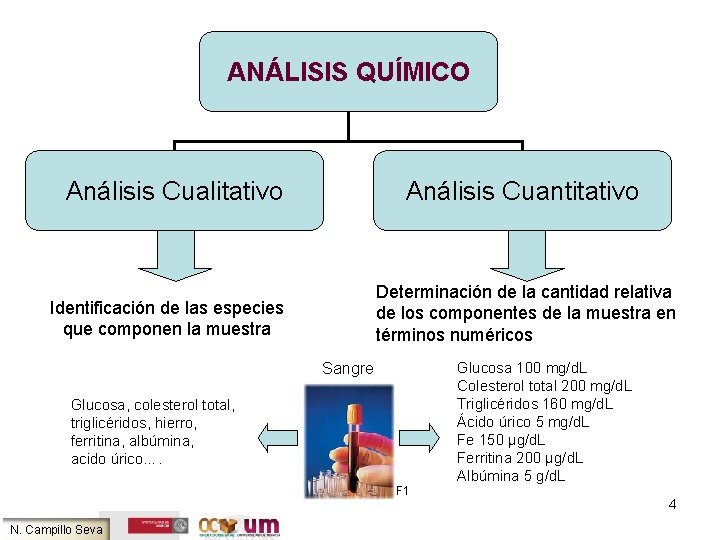
ANÁLISIS QUÍMICO Análisis Cualitativo Análisis Cuantitativo Determinación de la cantidad relativa de los componentes de la muestra en términos numéricos Identificación de las especies que componen la muestra Sangre Glucosa, colesterol total, triglicéridos, hierro, ferritina, albúmina, acido úrico…. F 1 N. Campillo Seva Glucosa 100 mg/d. L Colesterol total 200 mg/d. L Triglicéridos 160 mg/d. L Ácido úrico 5 mg/d. L Fe 150 µg/d. L Ferritina 200 µg/d. L Albúmina 5 g/d. L 4

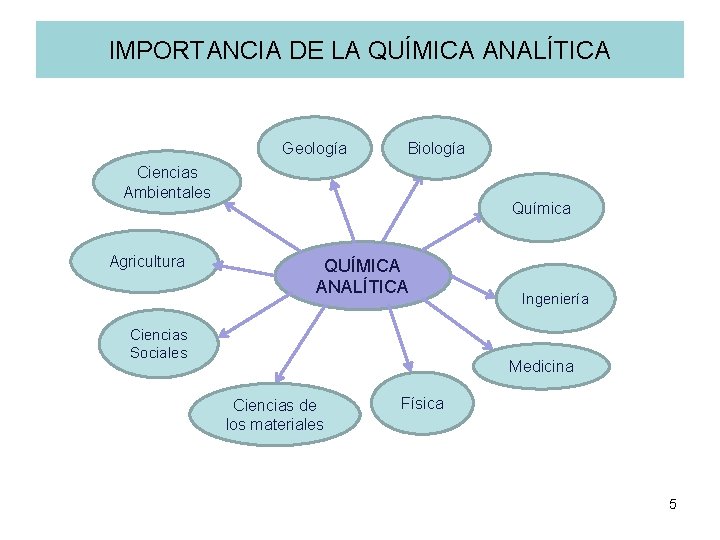
IMPORTANCIA DE LA QUÍMICA ANALÍTICA Geología Biología Ciencias Ambientales Agricultura Química QUÍMICA ANALÍTICA Ciencias Sociales Ingeniería Medicina Ciencias de los materiales Física 5

2. CONCEPTOS BÁSICOS EN ANÁLISIS QUÍMICO • • • MUESTRA: Parte representativa de la materia objeto de análisis. ALÍCUOTA: Fracción o porción de muestra. ANALITO: Especie química objeto del análisis. MATRIZ DE LA MUESTRA: Especies químicas que acompañan al analito en la muestra. TÉCNICA ANALÍTICA: Medio empleado para obtener información sobre el analito. MÉTODO ANALÍTICO: Secuencia de operaciones y técnicas aplicadas para el análisis de una muestra. EJEMPLO: Análisis de glucosa en sangre. Muestra: Sangre Analito: Glucosa Matriz: Proteínas, sales minerales, colesterol… Técnica analítica: Espectrofotometría de absorción molecular visible Método analítico: Implica desde la toma de muestra hasta la obtención del resultado final. 6 N. Campillo Seva

OTROS CONCEPTOS IMPORTANTES • INTERFERENTE: Especie química distinta del analito que aumenta o disminuye la respuesta del analito bajo el método aplicado. (Ej. Analito: Ca 2+, Al 3+ es un interferente si la determinación se lleva a cabo por valoración con EDTA. Interferencia positiva) • ENMASCARAMIENTO: Transformación del interferente en otra especie química que no es detectada con la técnica analítica empleada. (Ej. Al 3+ + 3 OH- → Al(OH)3) • DISOLUCIÓN ESTÁNDAR: Disolución conteniendo el analito en concentración perfectamente conocida. (Ej. Disolución acuosa conteniendo glucosa en una concentración exacta de 75 mg/d. L) • CURVA DE CALIBRADO: Gráfica que representa la señal analítica monitorizada frente a la concentración del analito. 7 N. Campillo Seva

Mediciones en Análisis Cuantitativo - Peso o volumen de muestra - Cantidad proporcional a la cantidad de analito en la muestra 3. CLASIFICACIÓN DE LOS MÉTODOS DE ANÁLISIS ● Métodos clásicos: se basan en propiedades químicas de los analitos. Volumetrías y gravimetrías. ● Métodos instrumentales: se basan en propiedades químico-físicas de los analitos. Se clasifican según la propiedad que se mide (espectroscópicos, electroquímicos, misceláneos…) ● Métodos de separación: la finalidad inicial de estos métodos era separar interferentes antes de proceder a aplicar la técnica analítica seleccionada. En la actualidad, existen métodos de separación que son métodos de análisis en sí mismos, como por ejemplo la cromatografía. 8 N. Campillo Seva

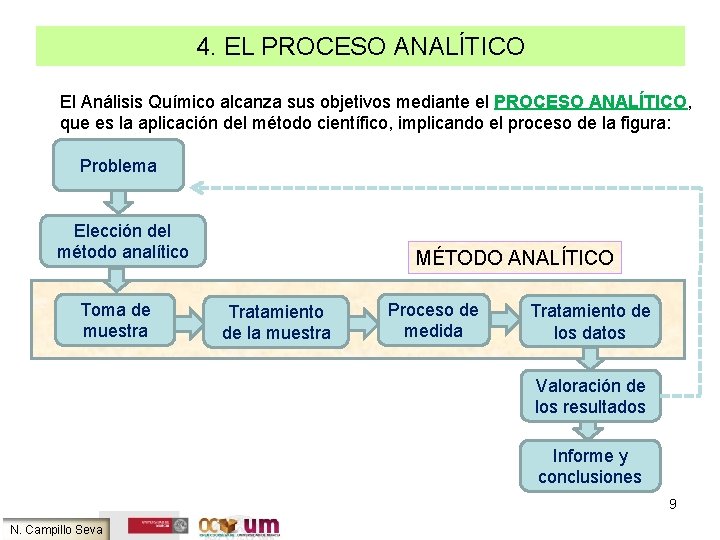
4. EL PROCESO ANALÍTICO El Análisis Químico alcanza sus objetivos mediante el PROCESO ANALÍTICO, que es la aplicación del método científico, implicando el proceso de la figura: Problema Elección del método analítico Toma de muestra MÉTODO ANALÍTICO Tratamiento de la muestra Proceso de medida Tratamiento de los datos Valoración de los resultados Informe y conclusiones 9 N. Campillo Seva

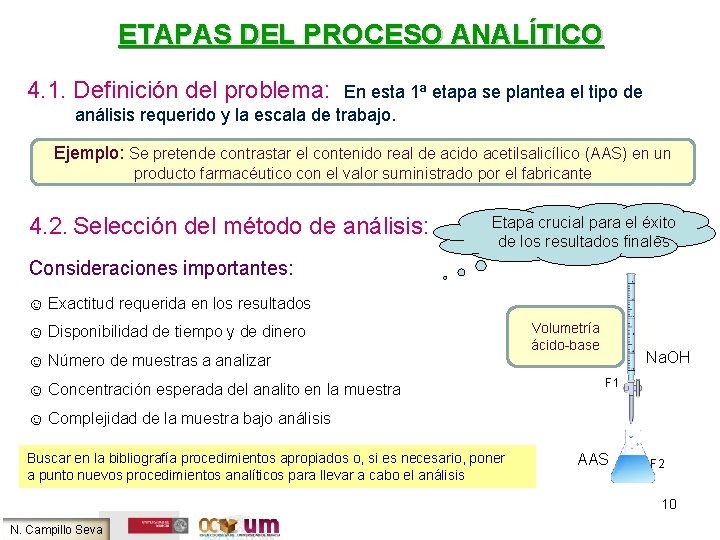
ETAPAS DEL PROCESO ANALÍTICO 4. 1. Definición del problema: En esta 1ª etapa se plantea el tipo de análisis requerido y la escala de trabajo. Ejemplo: Se pretende contrastar el contenido real de acido acetilsalicílico (AAS) en un producto farmacéutico con el valor suministrado por el fabricante 4. 2. Selección del método de análisis: Etapa crucial para el éxito de los resultados finales Consideraciones importantes: ☺ Exactitud requerida en los resultados ☺ Disponibilidad de tiempo y de dinero ☺ Número de muestras a analizar ☺ Concentración esperada del analito en la muestra Volumetría ácido-base Na. OH F 1 ☺ Complejidad de la muestra bajo análisis Buscar en la bibliografía procedimientos apropiados o, si es necesario, poner a punto nuevos procedimientos analíticos para llevar a cabo el análisis AAS F 2 10 N. Campillo Seva

4. 3. Toma de muestra o muestreo • Plan de muestreo: estrategia a seguir para garantizar que los resultados obtenidos reflejen la realidad del material analizado. • Características que ha de cumplir la muestra: – ser representativa del material a analizar – ser homogénea, lo que significa que debe ser igual en todas sus partes. Se reduce el error en los resultados F 1 11 N. Campillo Seva

4. 4. Tratamiento de la muestra Son escasos los problemas que se resuelven sin necesidad de tratamiento de la muestra Lo habitual, es que la muestra necesite algún tipo de tratamiento, con el fin de: 1. Preparar la forma y tamaño de la muestra, así como la concentración del analito(s), más adecuada para la técnica analítica seleccionada 2. Eliminar interferencias matriciales 12 N. Campillo Seva

Consideraciones importantes durante la etapa de preparación de muestra 1) La preparación de la muestra no puede implicar pérdidas de analito, ni tampoco contaminaciones. 2) Se debe transformar el analito en la mejor forma química para el método analítico seleccionado. 3) Si es necesario, se eliminarán las interferencias de la matriz, mejorando así la selectividad del método. 4) No se deben introducir nuevas interferencias. 5) Debe considerarse la dilución o preconcentración del analito, de manera que se halle en el intervalo de linealidad del método seleccionado. 13 N. Campillo Seva

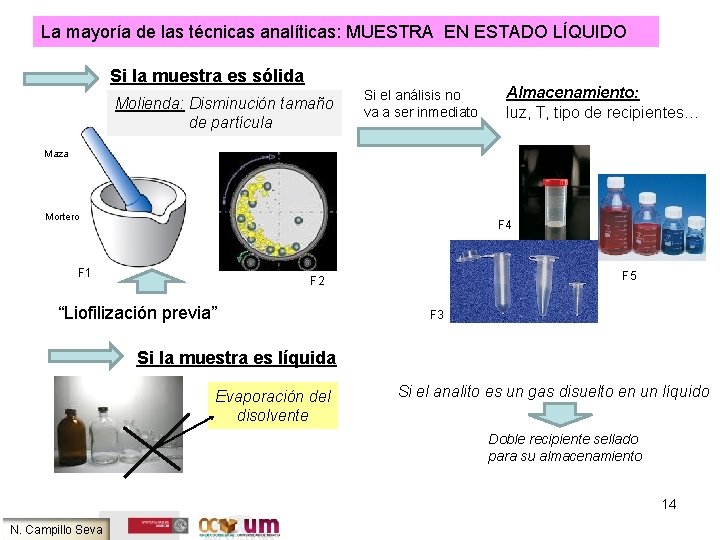
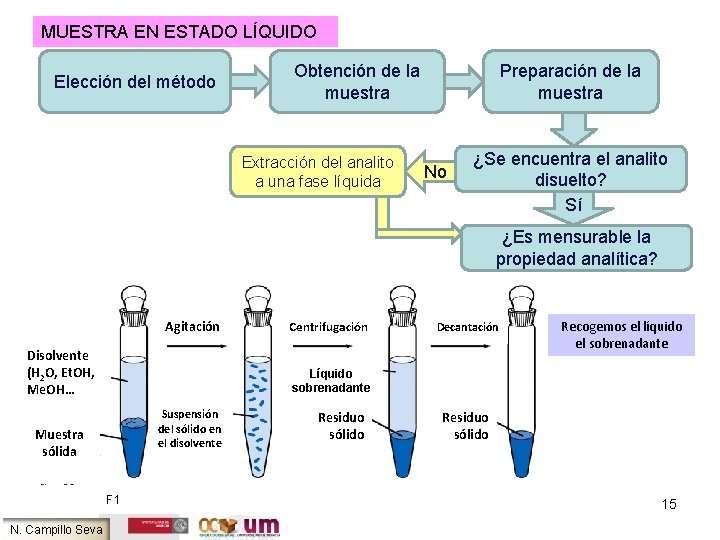
La mayoría de las técnicas analíticas: MUESTRA EN ESTADO LÍQUIDO Si la muestra es sólida Molienda: Disminución tamaño de partícula Si el análisis no va a ser inmediato Almacenamiento: luz, T, tipo de recipientes… Maza Mortero F 4 F 1 F 5 F 2 “Liofilización previa” F 3 Si la muestra es líquida Evaporación del disolvente Si el analito es un gas disuelto en un líquido Doble recipiente sellado para su almacenamiento 14 N. Campillo Seva

MUESTRA EN ESTADO LÍQUIDO Elección del método Obtención de la muestra Extracción del analito a una fase líquida Preparación de la muestra No ¿Se encuentra el analito disuelto? Sí ¿Es mensurable la propiedad analítica? Agitación Disolvente (H 2 O, Et. OH, Me. OH… Decantación Recogemos el líquido el sobrenadante Líquido sobrenadante Suspensión del sólido en el disolvente Muestra sólida F 1 N. Campillo Seva Centrifugación Residuo sólido 15

Para la determinación de AAS en producto farmacéutico mediante volumetría ácido-base Trituración del fármaco y disolución en etanol F 1 F 2 F 3 - En ocasiones, se requieren condiciones más enérgicas para la extracción del analito a la fase líquida: Disoluciones acuosas de: - ácidos fuertes - bases fuertes - agentes oxidantes - agentes reductores - combinaciones de reactivos F 4 Aplicación de energía externa: - microondas - ultrasonidos… F 5 16 N. Campillo Seva

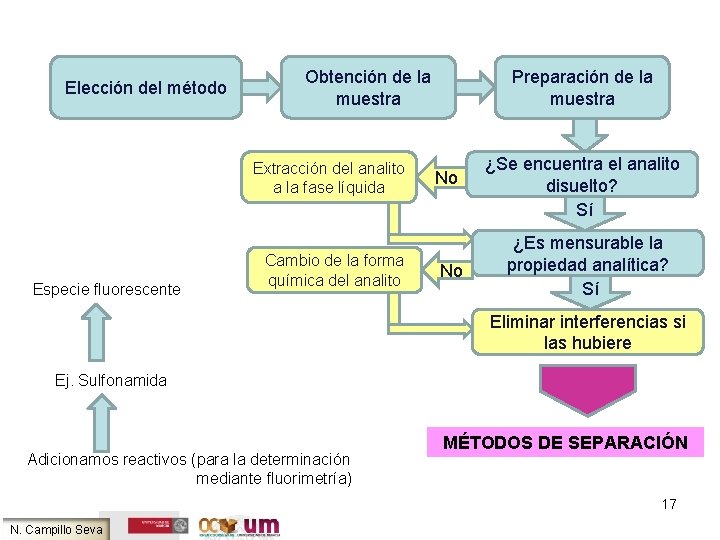
Elección del método Obtención de la muestra Extracción del analito a la fase líquida Especie fluorescente Cambio de la forma química del analito Preparación de la muestra No No ¿Se encuentra el analito disuelto? Sí ¿Es mensurable la propiedad analítica? Sí Eliminar interferencias si las hubiere Ej. Sulfonamida Adicionamos reactivos (para la determinación mediante fluorimetría) MÉTODOS DE SEPARACIÓN 17 N. Campillo Seva

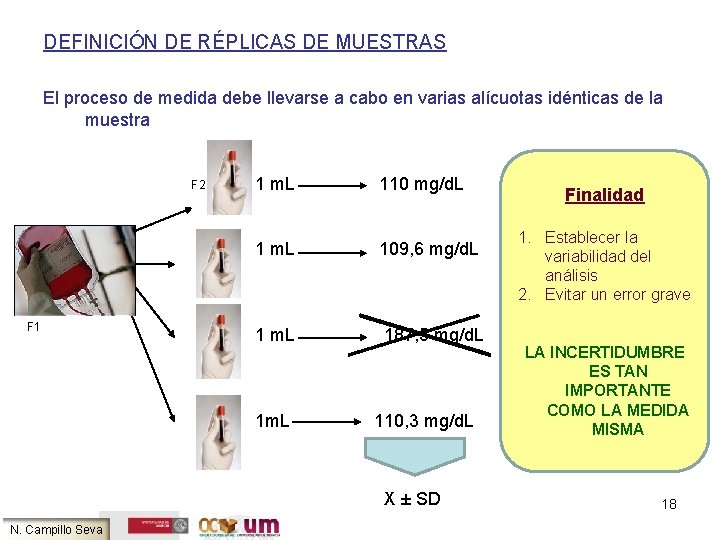
DEFINICIÓN DE RÉPLICAS DE MUESTRAS El proceso de medida debe llevarse a cabo en varias alícuotas idénticas de la muestra F 2 F 1 1 m. L 110 mg/d. L 1 m. L 109, 6 mg/d. L 1 m. L 187, 5 mg/d. L 1 m. L 110, 3 mg/d. L X ± SD N. Campillo Seva Finalidad 1. Establecer la variabilidad del análisis 2. Evitar un error grave LA INCERTIDUMBRE ES TAN IMPORTANTE COMO LA MEDIDA MISMA 18

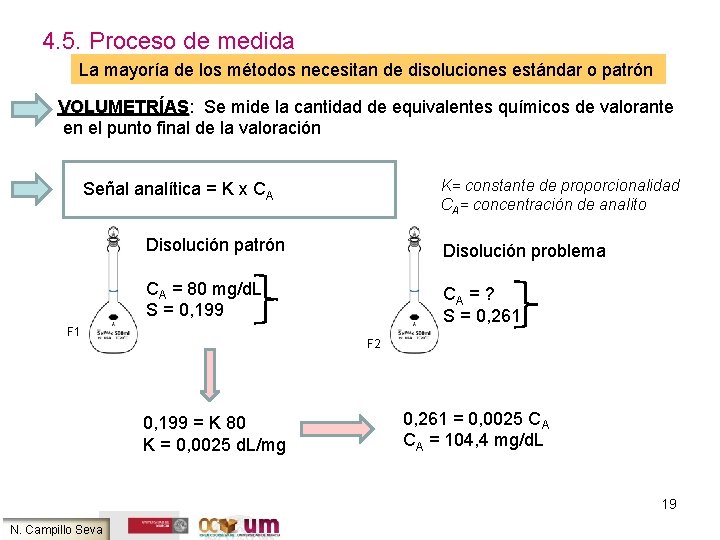
4. 5. Proceso de medida La mayoría de los métodos necesitan de disoluciones estándar o patrón VOLUMETRÍAS: VOLUMETRÍAS Se mide la cantidad de equivalentes químicos de valorante en el punto final de la valoración K= constante de proporcionalidad CA= concentración de analito Señal analítica = K x CA Disolución patrón Disolución problema CA = 80 mg/d. L S = 0, 199 CA = ? S = 0, 261 F 2 0, 199 = K 80 K = 0, 0025 d. L/mg 0, 261 = 0, 0025 CA CA = 104, 4 mg/d. L 19 N. Campillo Seva

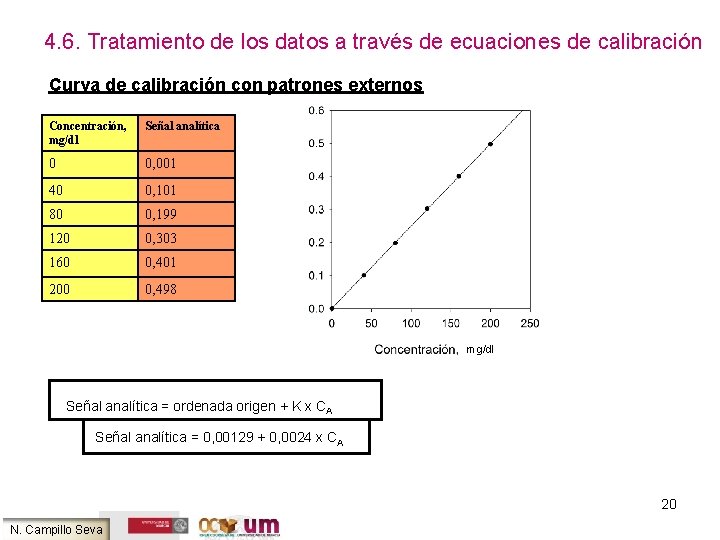
4. 6. Tratamiento de los datos a través de ecuaciones de calibración Curva de calibración con patrones externos Concentración, mg/dl Señal analítica 0 0, 001 40 0, 101 80 0, 199 120 0, 303 160 0, 401 200 0, 498 mg/dl Señal analítica = ordenada origen + K x CA Señal analítica = 0, 00129 + 0, 0024 x CA 20 N. Campillo Seva

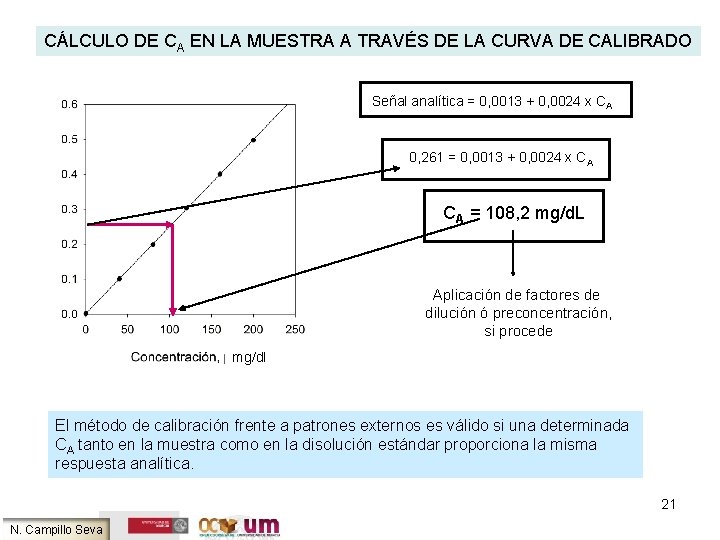
CÁLCULO DE CA EN LA MUESTRA A TRAVÉS DE LA CURVA DE CALIBRADO Señal analítica = 0, 0013 + 0, 0024 x CA 0, 261 = 0, 0013 + 0, 0024 x CA CA = 108, 2 mg/d. L Aplicación de factores de dilución ó preconcentración, si procede mg/dl El método de calibración frente a patrones externos es válido si una determinada CA tanto en la muestra como en la disolución estándar proporciona la misma respuesta analítica. 21 N. Campillo Seva

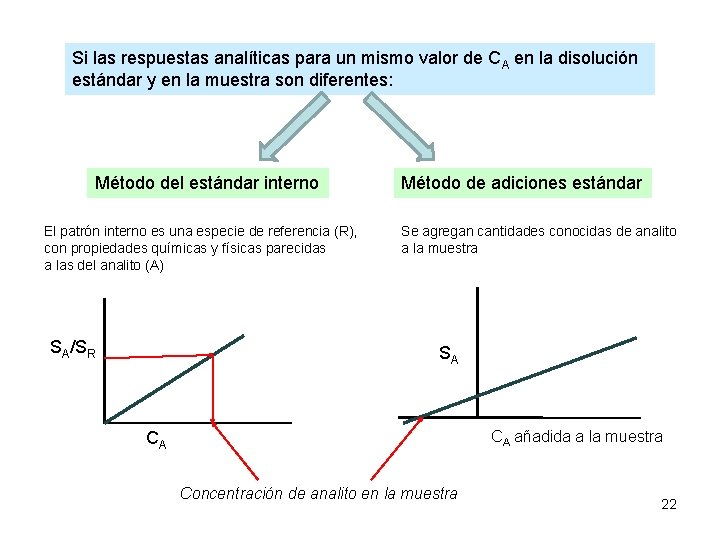
Si las respuestas analíticas para un mismo valor de CA en la disolución estándar y en la muestra son diferentes: Método del estándar interno El patrón interno es una especie de referencia (R), con propiedades químicas y físicas parecidas a las del analito (A) SA/SR Método de adiciones estándar Se agregan cantidades conocidas de analito a la muestra SA CA añadida a la muestra CA Concentración de analito en la muestra 22

4. 7. Evaluación de los resultados, informe y conclusiones Los resultados han de ser evaluados por estimación de su fiabilidad El informe dirigido al solicitante del análisis ha de: 1. Indicar claramente los resultados 2. Las condiciones experimentales empleadas 3. Limitaciones concretas de la técnica analítica empleada 1. Concentración de glucosa obtenida: x ± SD 1. Técnica espectrofotométrica … 2. Intervalo de linealidad, LD, LQ… As en orina 1. ND (no detectado) 2. Espectrometría de absórción atómica con atomización electrotérmica (ETAAS) 3. LD (Límite de detección): 50 ppt 23 N. Campillo Seva

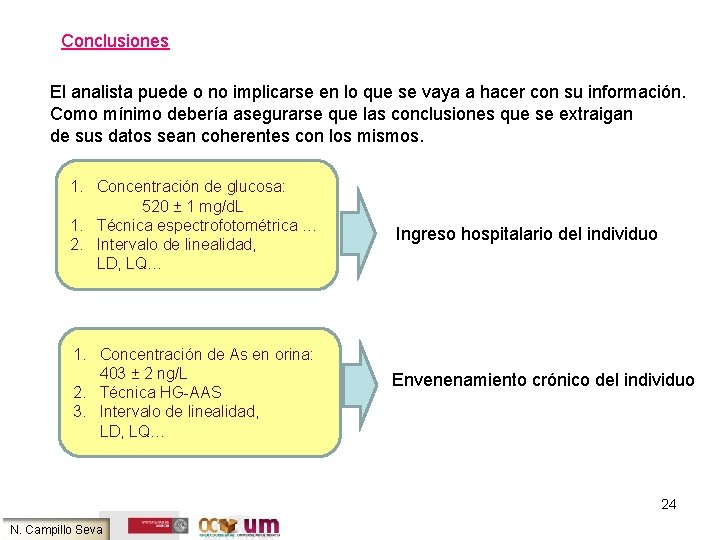
Conclusiones El analista puede o no implicarse en lo que se vaya a hacer con su información. Como mínimo debería asegurarse que las conclusiones que se extraigan de sus datos sean coherentes con los mismos. 1. Concentración de glucosa: 520 ± 1 mg/d. L 1. Técnica espectrofotométrica … 2. Intervalo de linealidad, LD, LQ… 1. Concentración de As en orina: 403 ± 2 ng/L 2. Técnica HG-AAS 3. Intervalo de linealidad, LD, LQ… Ingreso hospitalario del individuo Envenenamiento crónico del individuo 24 N. Campillo Seva

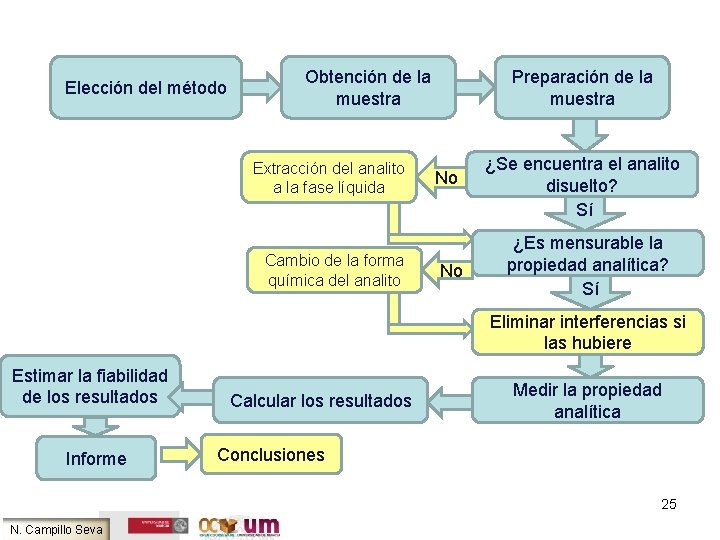
Elección del método Obtención de la muestra Extracción del analito a la fase líquida Cambio de la forma química del analito Preparación de la muestra No No ¿Se encuentra el analito disuelto? Sí ¿Es mensurable la propiedad analítica? Sí Eliminar interferencias si las hubiere Estimar la fiabilidad de los resultados Informe Calcular los resultados Medir la propiedad analítica Conclusiones 25 N. Campillo Seva

CRÉDITOS DE LAS ILUSTRACIONES – PICTURES COPYRIGHTS -Logo Portada OCW-UM. Autor: Universidad de Murcia. Dirección web: http: //ocw. um. es. -Página 5, F 1. Dirección web: http: //blogdelcancer. blogspot. com/ -Página 10, F 1. Autor: Mysid (original by Quantockgoblin). Dirección web: http: //commons. wikimedia. org/wiki/File: burette. svg -Página 10, F 2. Dirección web: http: //commons. wikimedia. org/wiki/File: Chemistry_flask_matthew_02. svg -Página 11, F 1. Dirección web: http: //maikelnai. elcomercio. es/wp-content/uploads/2008/04/farmaco_radiacion. jpg -Página 14, F 1. Fuente: “Quantitative Chemical Analysis”, Seventh Edition, © 2007 W. H. Freeman and Company. -Página 14, F 2. Dirección web: http: //profesores. elo. utfsm. cl/~agv/elo 323/2 s 06/projects/Gerardo. Alvarez/proyecto_final_archivos/image 009. gif -Página 14, F 3. Dirección web: http: //commons. wikimedia. org/wiki/File: Eppendorf_tubes. jpg -Página 14, F 4. Dirección web: http: //www. sunbox. es/es/envases-industriales-3/botes-5/frascos-roscados-111. html -Página 14, F 5. Dirección web: http: //www. adendorf. net/ -Página 15, F 1. Fuente: “Quantitative Chemical Analysis”, Seventh Edition, © 2007 W. H. Freeman and Company. -Página 16, F 1. Autor: Hannes Grobe. Dirección web: http: //commons. wikimedia. org/wiki/File: Mortar_achat_hg. jpg -Página 16, F 2. Autor. User: Ruhrfisch. Dirección web: http: //commons. wikimedia. org/wiki/File: Magnetic_Stirrer. JPG -Página 16, F 3. Autor: Hannes Grobe. Dirección web: http: //commons. wikimedia. org/wiki/File: Volumetric_flask_hg. jpg -Página 16, F 4. Dirección web: http: //www. inilab. es/media/catalog/product/cache/1/small_image/160 x/9 df 78 eab 33525 d 08 d 6 e 5 fb 8 d 27136 e 95/2/2/22001. png -Página 16, F 5. Dirección web: http: //www. icb. csic. es/fileadmin/grupos/Procesos. Quimicos. Avanzados/Horno. De. Microondas-m. jpg -Página 18, F 1. Dirección web: http: //newsimg. bbc. co. uk/media/images/41203000/jpg/_41203257_050531 vihbody. jpg -Página 18, F 2. Dirección web: http: //us. cdn 3. 123 rf. com/168 nwm/dusanzidar 0801/dusanzidar 080100075/2443753 -parte-lacelebraci-n-de-sangre-en-tubo-de-ensayo-cerca. jpg -Página 19, F 1 y F 2. Fuente: “Quantitative Chemical Analysis”, Seventh Edition, © 2007 W. H. Freeman and Company. 26 N. Campillo Seva
 Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Qumica
Qumica Regla del octeto
Regla del octeto Introduccin
Introduccin Introducción de las enzimas
Introducción de las enzimas Introduccin
Introduccin Introduccin
Introduccin Introduccin
Introduccin Induccin
Induccin Estrategia maxi maxi ejemplos
Estrategia maxi maxi ejemplos Master memfi
Master memfi Nombre de la asignatura
Nombre de la asignatura Pica asignatura
Pica asignatura Estrategia maxi maxi
Estrategia maxi maxi Anlisis de riesgos
Anlisis de riesgos Nombre de asignatura
Nombre de asignatura Verduras de bulbo ejemplos
Verduras de bulbo ejemplos Baitang 7
Baitang 7 Amenazas de una empresa ejemplos
Amenazas de una empresa ejemplos Nombre de la asignatura
Nombre de la asignatura Que es la educacion civica
Que es la educacion civica Anlisis financiero
Anlisis financiero Ejemplo de cono
Ejemplo de cono Ejemplo de delimitacion de una investigacion
Ejemplo de delimitacion de una investigacion El tema y sub tema
El tema y sub tema