Asignatura ANLISIS QUMICO Grado Ciencia y Tecnologa de



















- Slides: 24

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 TEMA 13 TÉCNICAS CONDUCTIMÉTRICAS 1

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 CONTENIDOS 1. 2. Fundamentos Conceptos, definiciones y unidades - 3. Medidas de la conductancia - 4. Unidades para expresión de resultados Efecto de la temperatura Celdas de conductividad Determinación de la constante de la célula. Calibrado del conductímetro Aplicaciones - 5. Resistencia, Conductancia y Conductividad Conductancia molar y equivalente Variación de la conductividad con la concentración Variación de la conductancia con la concentración Ley de la migración independiente de los iones Conductancia a dilución infinita Características analíticas Control de la pureza del agua Valoraciones conductimétricas Aplicaciones al análisis de alimentos 2

Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 1. Fundamento Los métodos conductimétricos están basados en la conducción eléctrica de los iones en una disolución. La técnica conductimétrica es una técnica electroanalítica en la que se mide la conductancia de la disolución problema y se relaciona la medida con la concentración de las especies en disolución. La conducción de la corriente eléctrica a través de la disolución de un electrolito supone la migración de las especies con carga positiva hacia el cátodo y las de carga negativa hacia el ánodo. Todos los iones contribuyen al proceso de conducción, pero la fracción de corriente transportada por una especie dada está determinada por su concentración relativa y su movilidad intrínseca en ese medio. La conductividad es una medida de la concentración iónica total que tiene una disolución. 3

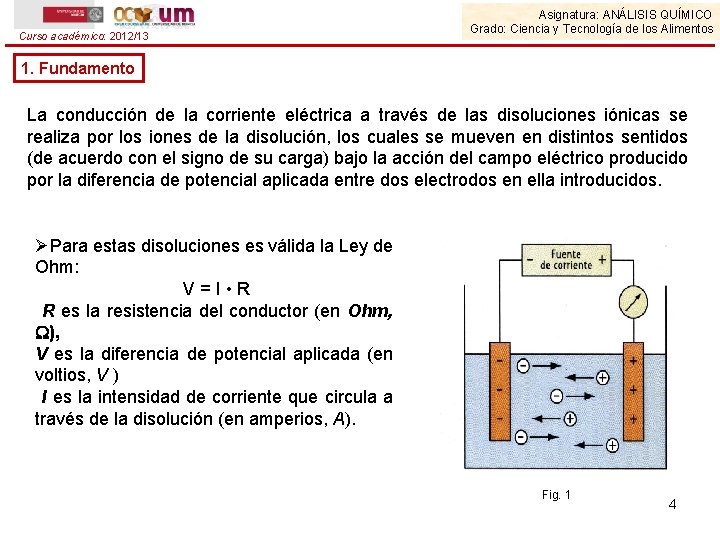
Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 1. Fundamento La conducción de la corriente eléctrica a través de las disoluciones iónicas se realiza por los iones de la disolución, los cuales se mueven en distintos sentidos (de acuerdo con el signo de su carga) bajo la acción del campo eléctrico producido por la diferencia de potencial aplicada entre dos electrodos en ella introducidos. ØPara estas disoluciones es válida la Ley de Ohm: V = I • R R es la resistencia del conductor (en Ohm, ), V es la diferencia de potencial aplicada (en voltios, V ) I es la intensidad de corriente que circula a través de la disolución (en amperios, A). Fig. 1 4

Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 1. Fundamento Una forma de conocer la capacidad conductora de una disolución es poner dos electrodos en la disolución, aplicar una diferencia de potencial entre ambos y medir la resistencia, que depende de los siguientes factores: a) el área de la superficie de los electrodos, b) la forma de los electrodos, c) la posición de los electrodos entre sí en la disolución, d) el tipo de especies en la disolución entre ellos su carga, e) la concentración de las especies y f) la temperatura. 5

Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 2. Resistencia, Conductancia y Conductividad Consideremos la porción disolución comprendida entre dos electrodos planos de una celda de conductividad, la resistencia R correspondiente vendrá dada por: donde es la resistividad (en ohm • cm) de la disolución, l es la distancia entre los dos electrodos planos (en cm) y A es el área de los electrodos (en cm 2). Se denomina constante de la celda a la cantidad y es específica para cada celda de conductividad 6

Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 2. Resistencia, Conductancia y Conductividad La magnitud recíproca de la resistencia es la conductancia electrolítica (G), cuya unidad es el Siemens (S)= ohm-1 o mho Combinando las dos ecuaciones se obtiene: donde es la conductividad de la disolución (en S/cm), definida como la inversa de la resistividad. La conductividad de una disolución es la conductancia de la misma encerrada en un cubo de 1 cm 3 (l = 1 cm, A = 1 cm 2). 7

Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 2. Conductancia molar y equivalente Ø La conductividad mide la facilidad con que los portadores de carga, cationes y aniones, migran bajo la acción de un campo eléctrico. El valor de la conductividad dependerá del número de iones presentes. Ø La conductancia molar ( ), se define como: donde = S/cm y C es la concentración molar (mol/L) del electrolito totalmente ionizado. Ø La cantidad de corriente que pueden transportar los iones, para un tamaño iónico dado, aumenta al aumentar la carga. Ø La conductancia equivalente ( eq), se define como la conductancia de un electrolito de concentración 1 eq. para un volumen de 1 L. ØLa relación entre eq y es: donde z representa la carga de la especie considerada. 8

Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 2. Variación de la Conductividad con la concentración ØLa conductividad aumenta al aumentar la concentración de los electrolitos hasta que a partir de un determinado valor de concentración empieza a disminuir, debido a que las interacciones entre los iones dificultan la conducción de la corriente 2. Variación de la conductancia con la concentración ØLa conductancia equivalente eq disminuye al aumentar la concentración, debido a que aumenta la atracción interiónica y disminuye la fuerza de repulsión de los iones ØKohlrausch demostró que los electrolitos fuertes (KCl, HCl, etc. ) muestran una disminución lineal de la conductancia con la raíz cuadrada de la concentración: donde 0 es la conductancia molar límite o conductancia equivalente a dilución infinita, y A es un coeficiente que depende de la naturaleza del electrolito, del disolvente y de la temperatura. 9

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 2. Ley de la migración independiente de los iones Ø A dilución infinita las atracciones entre los iones se anulan. Ø La 0 para cualquier electrolito, será la suma de las contribuciones de las conductancias iónicas de cada una de las especies constituyentes. ØLlamando +° y ° a las conductancias molares de los cationes y los aniones y z+ y z- es el número de oxidación de los cationes y aniones respectivamente, la Ley de las Migraciones Independientes de los Iones es: ° = z + + ° + z ° De acuerdo con la ley, la conductancia de una disolución G G = 1/k Ci 0 i donde k es la constante de la celda, Ci y 0 i la concentración y la conductancia molar de las especies iónicas, respectivamente. 10

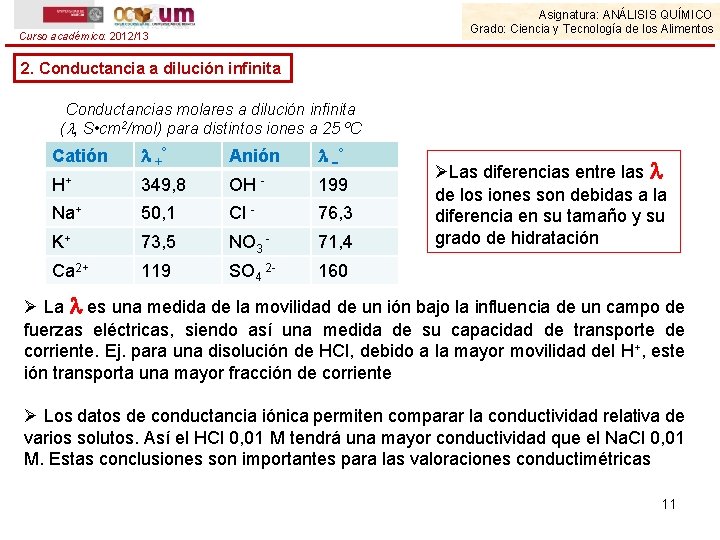
Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 2. Conductancia a dilución infinita Conductancias molares a dilución infinita ( , S • cm 2/mol) para distintos iones a 25 ºC Catión +° Anión ° H+ 349, 8 OH - 199 Na+ 50, 1 Cl - 76, 3 K+ 73, 5 NO 3 - 71, 4 Ca 2+ 119 SO 4 2 - 160 ØLas diferencias entre las de los iones son debidas a la diferencia en su tamaño y su grado de hidratación Ø La es una medida de la movilidad de un ión bajo la influencia de un campo de fuerzas eléctricas, siendo así una medida de su capacidad de transporte de corriente. Ej. para una disolución de HCl, debido a la mayor movilidad del H+, este ión transporta una mayor fracción de corriente Ø Los datos de conductancia iónica permiten comparar la conductividad relativa de varios solutos. Así el HCl 0, 01 M tendrá una mayor conductividad que el Na. Cl 0, 01 M. Estas conclusiones son importantes para las valoraciones conductimétricas 11

Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 3. Medidas de la conductancia ¿Cómo se mide la conductividad? Un sistema completo para la medida de conductividad está formado por los siguientes elementos básicos: - Célula de conductividad. - Sonda de temperatura. - Instrumento de medida: Conductímetro El conductímetro mide la conductividad eléctrica de los iones en una disolución. Para ello aplica un campo eléctrico entre dos electrodos de la célula y mide la resistencia eléctrica de la disolución. Para evitar cambios en las sustancias, efectos de capa sobre los electrodos, etc. se aplica una corriente alterna. 12

Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 3. Unidades para expresión de resultados Ø Las unidades de medida habituales de la conductividad de una disolución son los Siemens/cm (S/cm). Otras formas alternativas de expresar la conductividad de una disolución son la Salinidad y los Sólidos Totales Disueltos (STD). Ø Salinidad Se refiere a la concentración de una disolución teórica de Na. Cl con la misma conductividad que la muestra en estudio. Se expresa en ppm ó g/L de Na. Cl. Ø STD (Sólidos Totales Disueltos) La conductividad puede ser utilizada como un indicador de la cantidad de materias disueltas en una disolución. Se expresa en ppm ó g/L de Ca. CO 3. 13

Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 3. Efecto de la temperatura La conductividad de una disolución depende de la temperatura. Ésta tiene un doble efecto sobre los electrolitos, influye en su disolución y en la movilidad iónica. La conductividad de una disolución aumenta con la temperatura. Este aumento normalmente se expresa en %/ºC, y se denomina Coeficiente de Temperatura (CT). En general las disoluciones acuosas poseen un CT cercano al 2%/ºC. Las medidas de conductividad deben hacerse a temperatura controlada y expresar los resultados indicándola. Para poder controlar la temperatura, algunas células de conductividad albergan en su interior un sensor de temperatura, en otros casos es necesario adquirirlo separadamente. 14

Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 3. Celdas de conductividad - Células con dos electrodos: es el modelo clásico. Se construyen con dos o tres electrodos metálicos. Tradicionalmente se representa la célula con dos electrodos de chapa de Pt de 1 cm 2 recubiertos de Pt finamente divido, fijos al vidrio de la misma y separados entre sí 1 cm. Fig. 1 Fig. 2 El valor de constante k ( l/A ) de la celda caracteriza a la misma. En el caso descrito k = 1 cm-1. Permite medir conductividades en un amplio intervalo. - Células con cuatro o más electrodos: El número, tamaño, forma y material de los electrodos varía según las características de las muestras en las que van a ser introducidos. - Células con sensor de temperatura: Permiten la medida simultánea de la conductividad y la temperatura para poder corregir automáticamente el efecto de la misma sobre la conductividad de la muestra. Fig 3 15

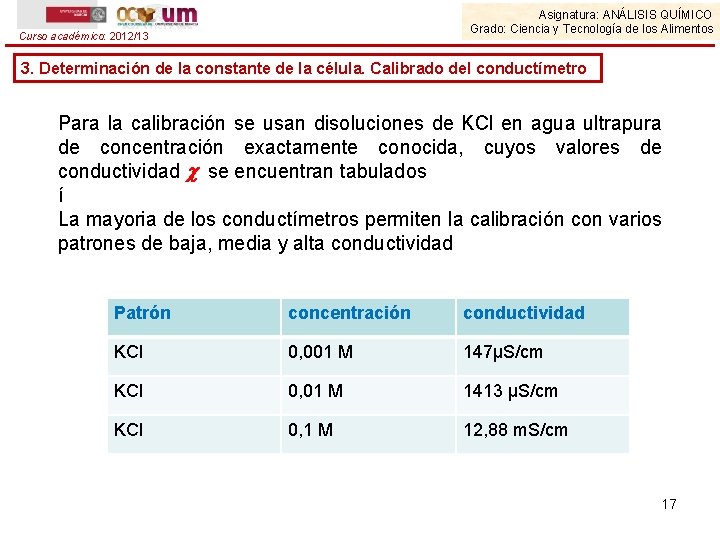
Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 3. Determinación de la constante de la célula. Calibrado del conductímetro El valor de constante k de la celda caracteriza a la misma. Como k es un factor que refleja una configuración física particular de la celda, el valor observado de la conductancia de la muestra G, debe ser multiplicado por el valor determinado de la constante de la celda para obtener la conductividad de la disolución (en S/cm). Por ejemplo, para una lectura de conductancia de 200 S usando una celda de constante 0, 1 cm-1, el valor de conductividad será de 200 • 0, 1 = 20 S/cm. Para poder determinar experimentalmente el valor de k, se calibra la celda midiendo la conductancia G de una disolución patrón de conductividad conocida . El valor de k vendrá dado por: 16

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 3. Determinación de la constante de la célula. Calibrado del conductímetro Para la calibración se usan disoluciones de KCl en agua ultrapura de concentración exactamente conocida, cuyos valores de conductividad se encuentran tabulados í La mayoria de los conductímetros permiten la calibración con varios patrones de baja, media y alta conductividad Patrón concentración conductividad KCl 0, 001 M 147µS/cm KCl 0, 01 M 1413 µS/cm KCl 0, 1 M 12, 88 m. S/cm 17

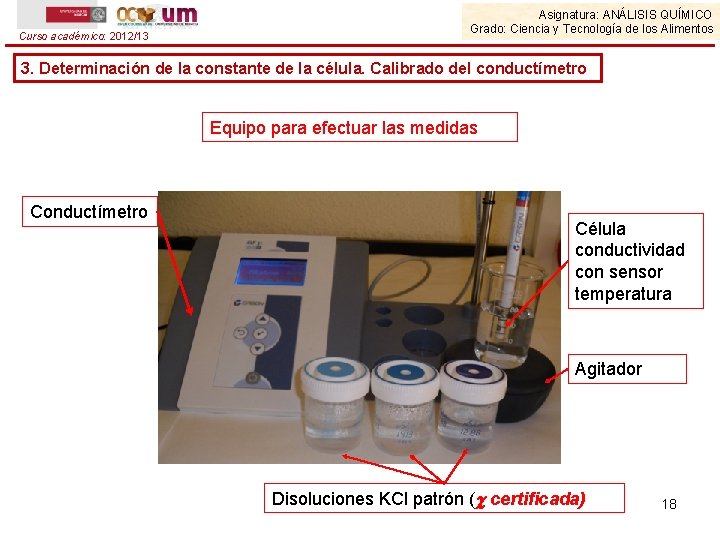
Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 3. Determinación de la constante de la célula. Calibrado del conductímetro Equipo para efectuar las medidas Conductímetro Célula conductividad con sensor temperatura Agitador Disoluciones KCl patrón ( certificada) 18

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 4. Aplicaciones Características analíticas Ø Selectividad: Las medidas conductimétricas directas tienen poca selectividad ya que cualquier especie cargada contribuye a la conductividad total de la disolución. No se suelen utilizar para medir la concentración de un determinado electrolito. Su principal aplicación es la medida de la concentración total de electrolitos. Ø Sensibilidad: la sensibilidad es alta, por ello es un importante instrumento analítico para ciertas aplicaciones como por ejemplo detectores en cromatografía iónica. Ø Exactitud y precisión: Con los estándares apropiados y un buen control de la temperatura podemos obtener una alta precisión y exactitud del orden del 0, 1 %. 19

Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 4. Aplicaciones - La principal aplicación de las medidas directas es determinación de la concentración total de electrolitos. Esta última medida es particularmente útil como un criterio de pureza para el agua destilada Algunos de los usos de las técnicas conductimétricas son para control de: - Contenidos salinos en calderas - Concentración de iones a la salida de una columna de cromatografía líquida, es decir como detector en cromatografía iónica se utiliza un equipo conductimétrico - Concentraciones de disoluciones ácidas utilizadas en procesos industriales - Concentraciones de fertilizante líquido a medida que el fertilizante se aplica - Contaminación en arroyos y ríos - Determinación del punto final de valoraciones ácido-base 20

Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 4. Aplicaciones Control de la pureza del agua El agua potable suministrada por las cañerías posee un contenido de electrolitos que no es adecuado para su uso en los laboratorios. Esta agua puede ser purificada por destilación, intercambio iónico o por métodos combinados de intercambiadores y membranas para ósmosis inversa. Se puede conocer el grado de purificación alcanzado midiendo la conductividad total del agua producida. Ø El agua desionizada de alta calidad, agua ultrapura tiene una conductividad de 0, 05 µS/cm (25 ºC). Ø El agua natural (ej. agua potable o agua superficial) se encuentra en el rango de 100 -1000 µS/cm. 21

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 4. Aplicaciones Valoraciones conductimétricas • Se basan en la medida del cambio de la conductancia de una disolución a medida que se agrega el reactivo valorante. • Durante una valoración, la sustitución de algunas especies iónicas por otras de diferente conductividad equivalente, como consecuencia de la reacción de valoración, producirá un cambio en la conductancia, el cual puede ser aprovechado para determinar el punto final de una valoración. Valoración conductimétrica de HCl con Na. OH En las valoraciones conductimétricas, la conductancia de la disolución a valorar se mide después de la adición de cantidades determinadas de reactivo valorante. Se representan los valores de conductancia en función del volumen de valorante agregado, y se obtiene dos rectas de pendientes diferentes, cuya intersección se corresponde al punto final de una valoración. 21

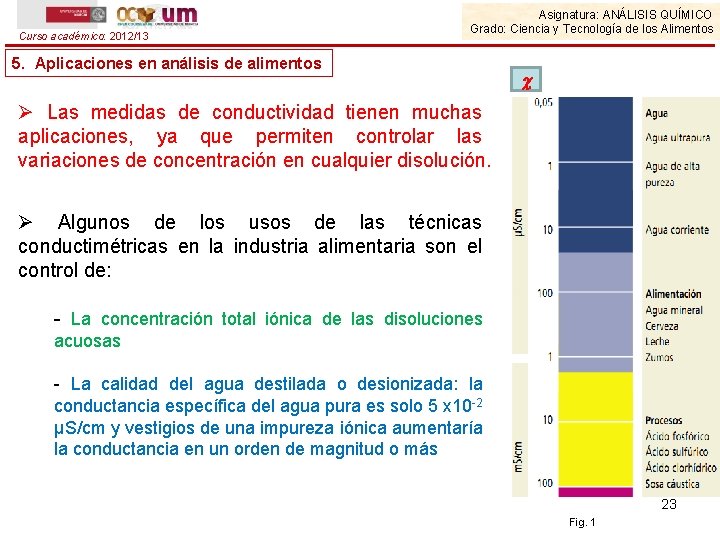
Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 5. Aplicaciones en análisis de alimentos Ø Las medidas de conductividad tienen muchas aplicaciones, ya que permiten controlar las variaciones de concentración en cualquier disolución. Ø Algunos de los usos de las técnicas conductimétricas en la industria alimentaria son el control de: - La concentración total iónica de las disoluciones acuosas - La calidad del agua destilada o desionizada: la conductancia específica del agua pura es solo 5 x 10 -2 µS/cm y vestigios de una impureza iónica aumentaría la conductancia en un orden de magnitud o más 23 Fig. 1

Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos CRÉDITOS DE LAS ILUSTRACIONES – PICTURES COPYRIGHTS -Logo Encabezado páginas OCW-UM. Autor: Universidad de Murcia. Dirección web: http: //ocw. um. es. -Página 4, Fig. 1. Fuente catálogo Crison -Página 15, Figs. 1, 2 y 3. Fuente catálogo Crison -Página 23, Fig. 1. Fuente catálogo Crison 23
 Tecnologa en alimentos
Tecnologa en alimentos Que es tecnologa
Que es tecnologa Tecnologa
Tecnologa Plasmidos que es
Plasmidos que es Enlace covalente coordinado
Enlace covalente coordinado Tipo de enlace del oxígeno
Tipo de enlace del oxígeno Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Ambientales
Ambientales Foda mini maxi
Foda mini maxi Amenazas foda ejemplos
Amenazas foda ejemplos Anlisis financiero
Anlisis financiero Master memfi
Master memfi Estrategia fa (maxi-mini)
Estrategia fa (maxi-mini) Nombre curso fecha
Nombre curso fecha Nombre de la asignatura
Nombre de la asignatura Enfoque de formacion civica y etica en secundaria
Enfoque de formacion civica y etica en secundaria Ejemplo de cono
Ejemplo de cono Nombre de la asignatura
Nombre de la asignatura Batayang aklat sa baitang 7
Batayang aklat sa baitang 7 Pica asignatura
Pica asignatura Nombre de la asignatura
Nombre de la asignatura Concepto de grado relativo
Concepto de grado relativo Si
Si