Asignatura ANLISIS QUMICO Grado Ciencia y Tecnologa de



















- Slides: 30

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 TEMA 11 TÉCNICAS ESPECTROFOTOMÉTRICAS DE EMISIÓN ATÓMICA (EAS) 1

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 CONTENIDOS 1. Introducción Fundamento Espectros de emisión. Diferencias y similitudes entra AAS y EAS Fuentes de excitación 2. Espectrometría de emisión atómica en llama (FAES) Instrumentación. Componentes esenciales y su función Procesos en la llama 3. Espectrometría de emisión atómica con Plasma por acoplamiento inductivo (ICP) Instrumentación. Componentes esenciales y su función Procesos en la antorcha ICP 4. Aplicaciones al análisis de alimentos Procedimiento para llevar a cabo los análisis por AES 2

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 1. Introducción Fundamento • La espectrofotometría de emisión atómica se basa en la medida de la emisión de radiación electromagnética, característica de átomos previamente excitados. Q Muestra(A)+Q → procesos físicos y químicos→ A(átomos)→A* → A + hδemisión • Los átomos en estado elemental (A) que han sido excitados a un nivel superior, vuelven a su estado energético original con emisión de energía en forma de radiación electromagnética de longitud de onda definida. • La intensidad de emisión está relacionada con el número de átomos que han sido excitados • La medida de la Intensidad de emisión (Iem) constituye la base de la determinación cuantitativa: Iem = f ([A]) 3

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 1. Introducción Fundamento • Las emisiones tienen lugar cuando los electrones de los átomos neutros excitados regresan a los estados de energía inferiores. • Las emisiones presentan las longitudes de onda características de los distintos elementos porque los niveles de energía permitidos a los electrones son propios de cada uno de los elementos. • La energía para la excitación puede ser producida por medio de varios métodos: üEl calor (Q), habitualmente, procedente de una llama üLa luz (procedente de un láser), üLa electricidad (arcos voltáicos o chispas) üLas ondas de radio (plasma de acoplamiento inductivo). • Las emisiones se hacen pasar a través de monocromadores o filtros, antes de su detección mediante detectores del tipo PMT (Tubo fotomultiplicador), dispositivos de acoplamiento de carga o dispositivos de inyección de carga. • Las dos formas comunes de la espectroscopia AES son ØLa espectroscopia de emisión de llama (FAES) ØLa espectroscopia de emisión atómica por plasma de acoplamiento inductivo (ICP-AES). 4

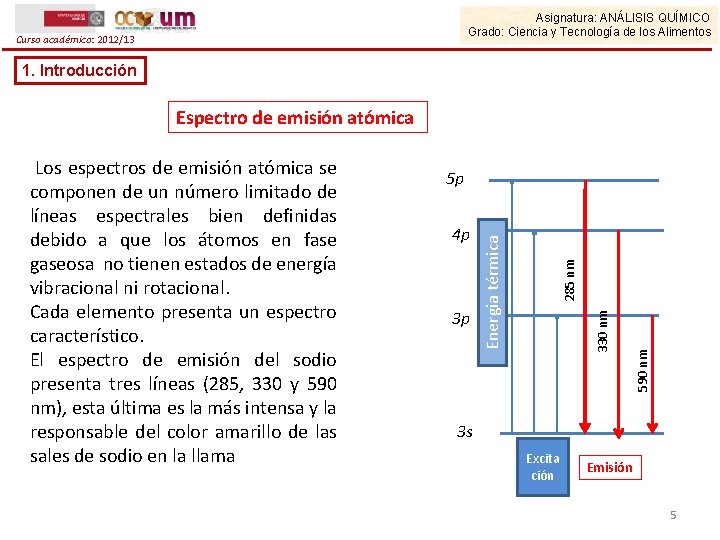
Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 1. Introducción Espectro de emisión atómica 5 p 590 nm 330 nm 3 p 285 nm 4 p Energia térmica Los espectros de emisión atómica se componen de un número limitado de líneas espectrales bien definidas debido a que los átomos en fase gaseosa no tienen estados de energía vibracional ni rotacional. Cada elemento presenta un espectro característico. El espectro de emisión del sodio presenta tres líneas (285, 330 y 590 nm), esta última es la más intensa y la responsable del color amarillo de las sales de sodio en la llama 3 s Excita ción Emisión 5

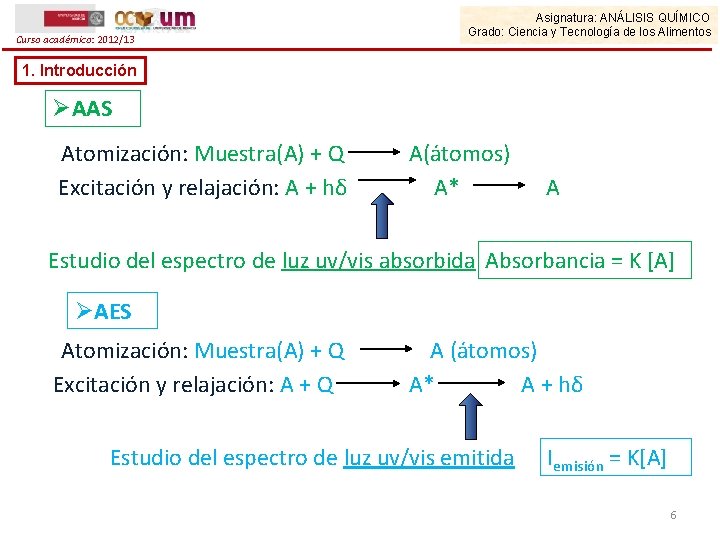
Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 1. Introducción ØAAS Atomización: Muestra(A) + Q Excitación y relajación: A + hδ A(átomos) A* A Estudio del espectro de luz uv/vis absorbida Absorbancia = K [A] ØAES Atomización: Muestra(A) + Q Excitación y relajación: A + Q A (átomos) A* A + hδ Estudio del espectro de luz uv/vis emitida Iemisión = K[A] 6

Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 1. Introducción Diferencias y similitudes entre AAS y AES En AAS y AES la muestra debe ser atomizada para producir un espectro aprovechable para el análisis cuantitativo. La diferencia entre AES y AAS es que en AES se comunica a la muestra un calor suficiente para excitar los átomos a niveles de energía superiores y se mide la radiación que emite al volver al estado fundamental. En AAS se mide la cantidad de radiación incidente absorbida. En AES la fuente de la radiación son los átomos o los iones excitados presentes en la muestra. En AAS la fuente de la radiación es una fuente externa, lámpara de cátodo hueco. La instrumentación para AAS y AES es similar, se diferencian en que en AES no es necesaria la fuente externa de radiación requerida en AAS. De hecho, muchos instrumentos se pueden hacer funcionar en cualquiera de los modos: absorción o emisión. 7

Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 2. Espectrometría de emisión de llama (FAES) • FAES hace uso de un sistema nebulizador-quemador para atomizar y excitar la muestra semejante al descrito para AAS. • El instrumento puede ser: ØUn espectrofotómetro, que hace uso de un monocromador para separar la línea de emisión deseada. ØUn fotómetro que utiliza un filtro para separar las líneas de emisión obtenidas. • FAES es muy útil para la determinación de aquellos elementos con energías de excitación relativamente bajas: Ø Na, K y Ca. 8

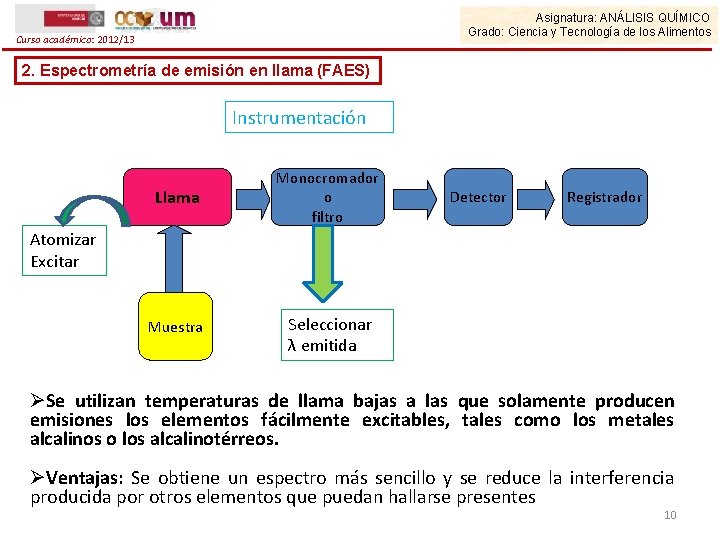
Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 2. Espectrometría de emisión en llama (FAES) Instrumentación Los espectrómetros de emisión de llama constan de los siguientes componentes: Ø Una fuente de atomización-excitación, habitualmente un quemador-nebulizador de flujo laminar. Ø Un monocromador o unos filtros. Los instrumentos provistos de un monocromador son más versátiles puesto que se puede seleccionar cualquier λ en el espectro UV-Vis. Los instrumentos diseñados para análisis de rutina de los metales alcalinos y alcalinotérreos pueden hacer uso de filtros de interferencia para separar la línea de emisión deseada. Ø Un detector. Ø Un dispositivo de lectura de la señal de salida. 9

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 2. Espectrometría de emisión en llama (FAES) Instrumentación Llama Monocromador o filtro Detector Registrador Atomizar Excitar Muestra Seleccionar λ emitida ØSe utilizan temperaturas de llama bajas a las que solamente producen emisiones los elementos fácilmente excitables, tales como los metales alcalinos o los alcalinotérreos. ØVentajas: Se obtiene un espectro más sencillo y se reduce la interferencia producida por otros elementos que puedan hallarse presentes 10

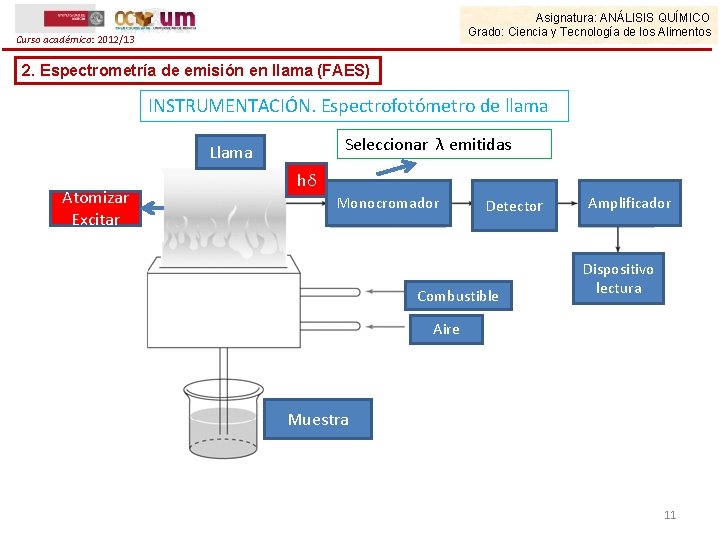
Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 2. Espectrometría de emisión en llama (FAES) INSTRUMENTACIÓN. Espectrofotómetro de llama Seleccionar λ emitidas Llama Atomizar Excitar hδ Monocromador Detector Combustible Amplificador Dispositivo lectura Aire Muestra 11

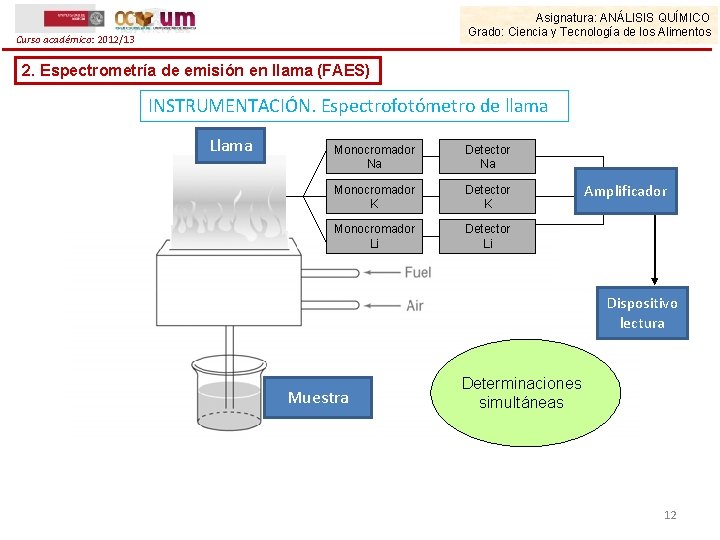
Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 2. Espectrometría de emisión en llama (FAES) INSTRUMENTACIÓN. Espectrofotómetro de llama Llama Monocromador Na Detector Na Monocromador K Detector K Monocromador Li Detector Li Amplificador Dispositivo lectura Muestra Determinaciones simultáneas 12

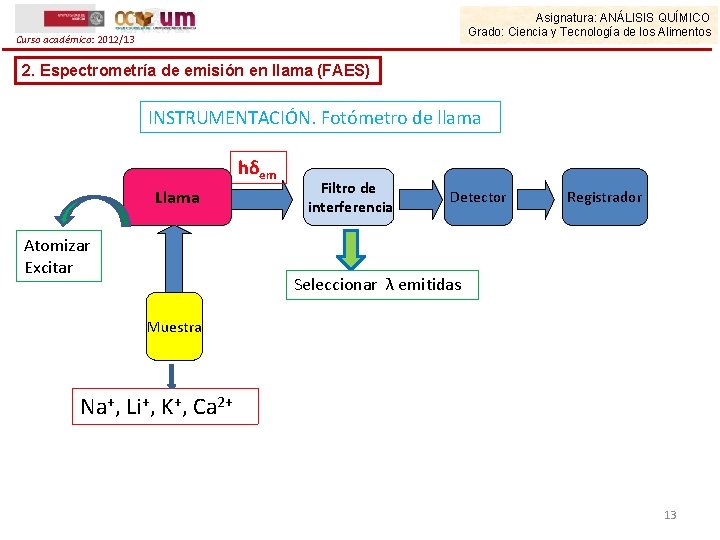
Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 2. Espectrometría de emisión en llama (FAES) INSTRUMENTACIÓN. Fotómetro de llama hδem Llama Atomizar Excitar Filtro de interferencia Detector Registrador Seleccionar λ emitidas Muestra Na+, Li+, K+, Ca 2+ 13

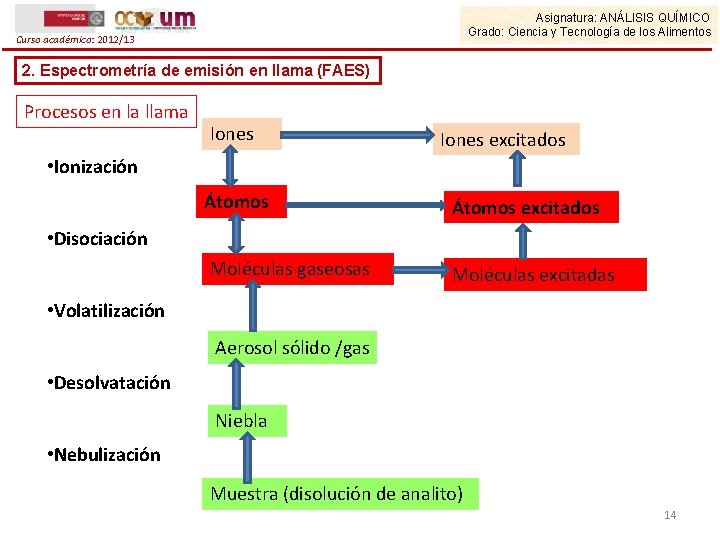
Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 2. Espectrometría de emisión en llama (FAES) Procesos en la llama Iones excitados • Ionización Átomos excitados Moléculas gaseosas Moléculas excitadas • Disociación • Volatilización Aerosol sólido /gas • Desolvatación Niebla • Nebulización Muestra (disolución de analito) 14

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 3. Espectroscopía de emisión atómica por plasma de acoplamiento inductivo (ICP) • En ICP-AES, se hace uso de un plasma como fuente de atomización y de excitación. • Un plasma se define como una mezcla gaseosa que contiene concentraciones importantes de cationes y electrones. El plasma más empleado es el de argon: Ar+ y e- son las principales especies conductoras en este plasma. También contribuyen los iones la muestra cuando alcanzan el plasma. e- + Ar e- Ar+ e- Ar+ e- e- X- M + M+ X X- M + • Las temperaturas en los plasmas son muy elevadas (en las proximidades de los 5000 -10000 K), lo cual da como resultado una atomización muy efectiva de la muestra aplicable a gran número de elementos. • A pesar de la elevada temperatura, la ionización excesiva de los átomos de la muestra no supone un problema, probablemente a causa de la alta concentración de electrones aportados por la ionización del Ar. • En los instrumentos de plasma acoplado por inducción se pueden determinar de forma simultanea muchos elementos 15

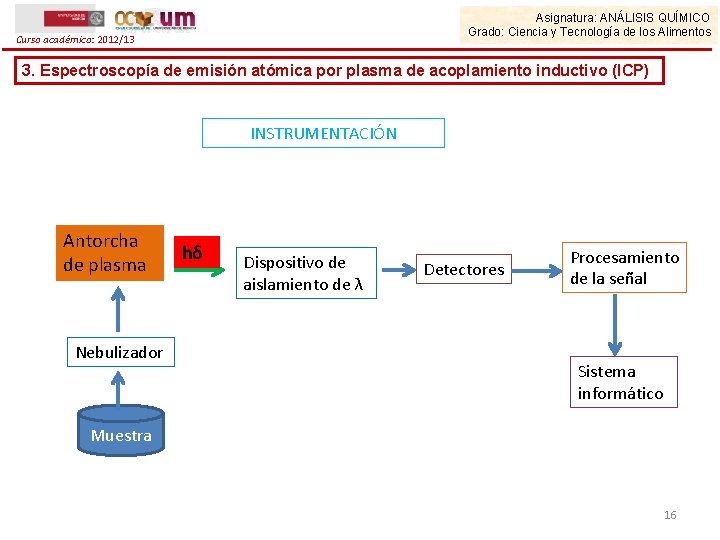
Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 3. Espectroscopía de emisión atómica por plasma de acoplamiento inductivo (ICP) INSTRUMENTACIÓN Antorcha de plasma Nebulizador hδ Dispositivo de aislamiento de λ Detectores Procesamiento de la señal Sistema informático Muestra 16

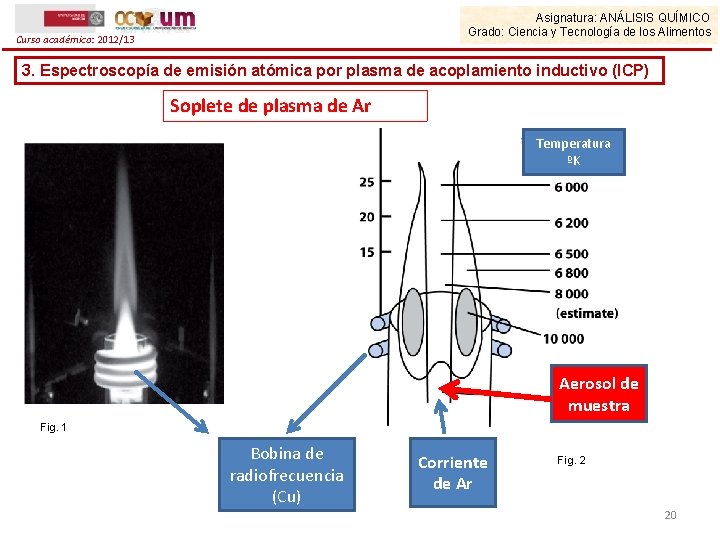
Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 3. Espectroscopía de emisión atómica por plasma de acoplamiento inductivo (ICP) Antorcha o soplete de plasma de Ar El soplete consta de dos tubos concéntricos de cuarzo, centrados en una bobina de cobre. Durante el funcionamiento del soplete, una corriente de Ar gaseoso fluye a través de los tubos y se aplica energía de radiofrecuencias (RF) a la bobina de cobre, creando un campo magnético oscilante en el interior del tubo. El plasma se inicia mediante la aplicación de la energía de radiofrecuencia (RF) y la ionización del Ar gaseoso mediante una chispa eléctrica, para formar así iones argón y electrones. El campo magnético oscilante se acopla con los electrones y los iones Ar, forzándolos a fluir en una trayectoria anular. El argón es calentado mediante un proceso conocido como acoplamiento inductivo, hasta temperaturas que alcanzan incluso los 10000 K. La muestra se introduce en el plasma por un canal central en forma de aerosol 17

Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 3. Espectroscopía de emisión atómica por plasma de acoplamiento inductivo (ICP) El soplete de plasma de Ar. Ventajas üLas temperaturas extremadamente elevadas y la atmósfera inerte de los plasmas de Ar son ideales para la atomización y la excitación de los analitos. üEl bajo contenido en oxígeno reduce la formación de óxidos lo cual, algunas veces, resulta ser un problema con los métodos de llama. üLa atomización casi completa de la muestra minimiza las interferencias químicas. üSe obtienen respuestas lineales a lo largo de un amplio rango de concentraciones de analito debido a las temperaturas relativamente uniformes dentro del plasma, en comparación con las temperaturas no uniformes en el interior de las llamas y el relativamente largo tiempo de residencia en el plasma. 18

Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 3. Espectroscopía de emisión atómica por plasma de acoplamiento inductivo (ICP) Características de las fuentes de plasma Ø Son ricas en líneas de emisión características Ø Útiles para el análisis elemental, cualitativo y cuantitativo ØAportan datos analíticos cuantitativos mejores que otras fuentes de emisión, debido a: ü su estabilidad, ü bajo ruido, ü poca radiación de fondo üausencia de interferencias cuando se trabaja en condiciones adecuadas. ØLímites de detección aceptables. 19

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 3. Espectroscopía de emisión atómica por plasma de acoplamiento inductivo (ICP) Soplete de plasma de Ar Temperatura ºK Aerosol de muestra Fig. 1 Bobina de radiofrecuencia (Cu) Corriente de Ar Fig. 2 20

Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 3. Espectroscopía de emisión atómica por plasma de acoplamiento inductivo (ICP) Procesos que sufre la muestra en el plasma A) Introducción de la muestra: Las muestras son introducidas en el tubo inyector situado en el interior del anillo de plasma, en la base de la bobina de carga de RF, en forma de aerosoles transportados por una corriente de Ar. La temperatura del plasma a lo largo del eje, en la zona de la bobina de carga, varía entre 1000 y 3000 K. B) Cuando el aerosol se introduce en el anillo del plasma, experimenta varios cambios. 1. - Desolvatación : el agua es evaporada de las gotitas de aerosol MX)n. H 2 O → (MX)n (sólido) + H 2 O 2. - Vaporización: la muestra es convertida en un gas (MX)n (sólido) → (MX)n (gas) 3. - Atomización: se rompen todos los enlaces químicos y los compuestos son separados en átomos: MXgas → Mgas + Xgas 4. - Excitación: un electrón de valencia del analito se promociona desde el estado fundamental a un estado (excitado) de mayor energía debido a que la temperatura en la zona se extiende desde 1000 hasta los 5000 K, lo cual es suficiente producir átomos excitados. M + energía → M* 5. - Emisión de luz: Cuando los átomos del analito se relajan, de vuelta a un estado de menor energía, se emite luz a longitudes de onda discretas: M* → M +hϑ 21

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 3. Espectroscopía de emisión atómica por plasma de acoplamiento inductivo (ICP) INSTRUMENTACIÓN Hay disponibles tres tipos básicos de instrumentos ICP-AES: Øespectrómetro simultáneo con tubo fotomultiplicador (PMT) Øespectrómetro secuencial con PMT Øespectrómetros de dispositivo de inyección de carga (CID) o dispositivo de acoplamiento de carga (CCD). Estos instrumentos son capaces, todos ellos, de determinar múltiples elementos en una misma muestra. El espectrómetro simultáneo PMT analiza de forma simultánea un número reducido de elementos es una muestra El espectrómetro secuencial PMT mide múltiple elementos de modo secuencial, en una rápida sucesión. Los espectrómetros CID y CCD miden múltiples elementos simultáneamente y son capaces de detectar un número mucho mayor de elementos que los instrumentos equipados con un detector PMT. 22

Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 3. Espectroscopía de emisión atómica por plasma de acoplamiento inductivo (ICP) Ventajas de la emisión de plasma (ICP) frente a llama (FAES) ØMenor interferencia entre elementos (altas temperaturas) ØBuenos espectros de emisión para muchos elementos en las mismas condiciones de excitación Ø Registro simultáneo para una gran número de elementos (análisis multielemental) ØDeterminación de bajas concentraciones de elementos refractarios (resistentes a la descomposición térmica) Ø Permite la determinación de no metales (Cl, Br, I, S) ØIntervalos lineales de concentración que abarcan varios órdenes de magnitud. 23

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 4. Aplicaciones al análisis de alimentos ØLas espectroscopia de emisión atómica es ampliamente utilizada para la medida cuantitativa de los elementos inorgánicos contenidos en los alimentos. ØEn principio, cualquier alimento puede ser analizado con cualquiera de los métodos de espectroscopia atómica Preparación de la muestra ØEn la mayor parte de los casos, es necesario calcinar el alimento, para destruir la materia orgánica, y disolver la ceniza en un disolvente adecuado (habitualmente, agua o un ácido diluido), con antelación al análisis. ØAlgunos productos líquidos pueden ser analizados sin necesidad de calcinación, tomando las precauciones apropiadas para evitar las interferencias. ØLos aceites vegetales pueden ser analizados disolviendo el aceite en un disolvente orgánico, tal como acetona o etanol, y aspirando la disolución directamente. ØLas muestras de leche pueden ser tratadas con ácido tricloroacético para precipitar las proteínas; el sobrenadante que así resulta es analizado directamente. 24

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 4. Aplicaciones al análisis de alimentos Selección de la línea analítica ØSe pueden utilizar varias líneas significativas para la identificación y cuantificación. ØLa selección dependerá de los elementos presentes en la muestra y de la posibilidad de solapamiento de líneas. Curva de calibrado ØDe acuerdo con la ley de Beer, la Intensidad de emisión es directamente proporcional a la concentración. Iemisión = K Canalito en la muestra ØLa representación gráfica de Ia Iemisión frente a la Canalito se desvía de la linealidad cuando la concentración excede un determinado nivel. ØUtilización de un patrón interno: Se añade una cantidad constante de itrio a los patrones ⇒ la intensidad relativa de la línea del analito respecto a la línea del itrio a 242, 2 nm sirve como parámetro analítico. ØEs necesario introducir patrones periódicamente para comprobar la deriva instrumental, si la hubiera. 25

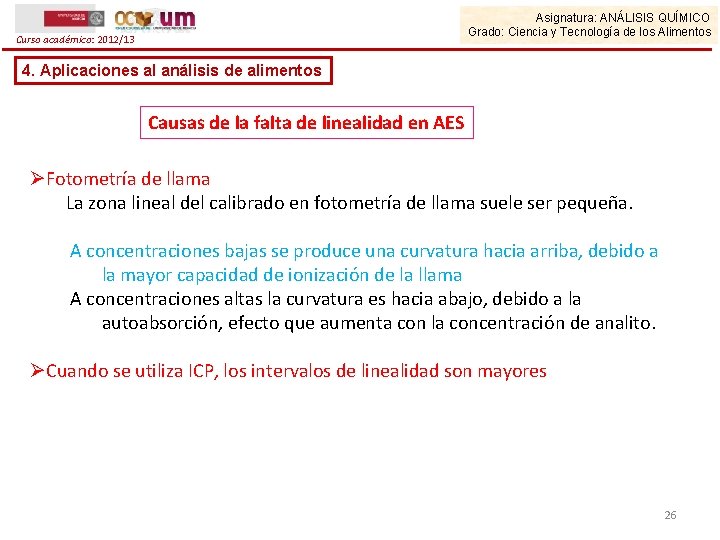
Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 4. Aplicaciones al análisis de alimentos Causas de la falta de linealidad en AES ØFotometría de llama La zona lineal del calibrado en fotometría de llama suele ser pequeña. A concentraciones bajas se produce una curvatura hacia arriba, debido a la mayor capacidad de ionización de la llama A concentraciones altas la curvatura es hacia abajo, debido a la autoabsorción, efecto que aumenta con la concentración de analito. ØCuando se utiliza ICP, los intervalos de linealidad son mayores 26

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 4. Aplicaciones al análisis de alimentos La calibración Es necesario siempre calibrar el instrumento. • Calibrado con patrones externos Se preparan una serie de patrones apropiados y se representa gráficamente la intensidad de emisión frente a la concentración. En el caso de los instrumentos modernos, se programa el instrumento para dar la lectura en unidades de concentración. • Calibrado por adición estándar de un solo punto o múltiple Se añade a varias alícuotas de muestra, diferentes volúmenes de una disolución patrón de concentración conocida, se diluyen todas ellas al mismo volumen y se representa la intensidad de emisión frente a la concentración de patrón en cada una de ellas. 27

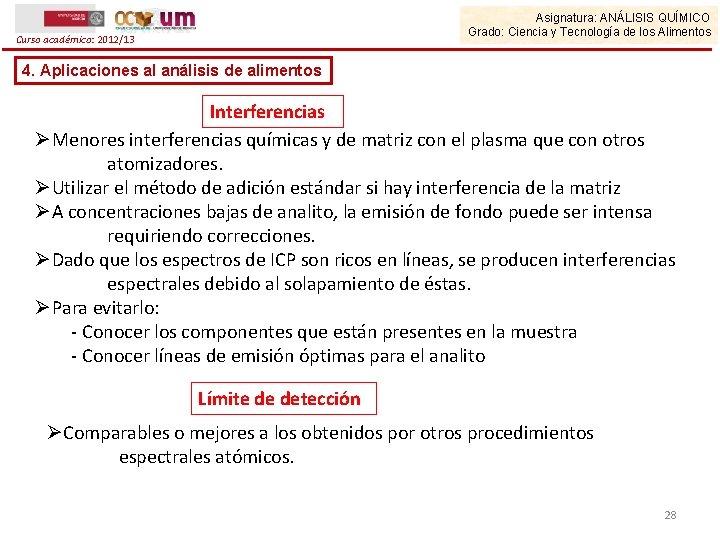
Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 4. Aplicaciones al análisis de alimentos Interferencias ØMenores interferencias químicas y de matriz con el plasma que con otros atomizadores. ØUtilizar el método de adición estándar si hay interferencia de la matriz ØA concentraciones bajas de analito, la emisión de fondo puede ser intensa requiriendo correcciones. ØDado que los espectros de ICP son ricos en líneas, se producen interferencias espectrales debido al solapamiento de éstas. ØPara evitarlo: - Conocer los componentes que están presentes en la muestra - Conocer líneas de emisión óptimas para el analito Límite de detección ØComparables o mejores a los obtenidos por otros procedimientos espectrales atómicos. 28

Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 4. Aplicaciones al análisis de alimentos Ejemplo: DETERMINACIÓN DE POTASIO EN VINO POR FOTOMETRÍA DE LLAMA El K es un componente fundamental del vino y puede constituir las tres cuartas partes de la concentración de cationes de esta muestra. La determinación cuantitativa de potasio puede poner en evidencia la realización de un tratamiento no permitido al vino. Procedimiento 1. Preparar disolución patrón de potasio a partir de KCl sólido 2. Preparar disoluciones patrón diluidas de potasio de concentraciones apropiadas 3. Medir la emisión de cada una de ellas a 768 nm. 4. Medir la emisión de la muestra de vino tinto o blanco previamente diluida con agua para que su señal esté incluida en el intervalo de Iemisión de los patrones Prácticamente no se producen interferencias 29

Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos CRÉDITOS DE LAS ILUSTRACIONES – PICTURES COPYRIGHTS -Logo Encabezado páginas OCW-UM. Autor: Universidad de Murcia. Dirección web: http: //ocw. um. es. -Página 208, Fig. 1 y Fig. 2. Fuente: “Quantitative Chemical Analysis”, Seventh Edition, © 2007 W. H. Freeman and Company. 30
 X-gal
X-gal Tecnologa en alimentos
Tecnologa en alimentos Que es tecnologa
Que es tecnologa Tecnologa
Tecnologa Enlace dativo
Enlace dativo Tipo de enlace de oxígeno
Tipo de enlace de oxígeno Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Anlisis foda
Anlisis foda Ambientales
Ambientales Maxi maxi maxi mini
Maxi maxi maxi mini Amenazas foda ejemplos
Amenazas foda ejemplos Anlisis financiero
Anlisis financiero Anlisis foda
Anlisis foda Nombre de la asignatura
Nombre de la asignatura Verduras de bulbo ejemplos
Verduras de bulbo ejemplos Nombre de la asignatura
Nombre de la asignatura Qué es educación cívica
Qué es educación cívica Que es el radio
Que es el radio Nombre de la asignatura
Nombre de la asignatura Batayan sa pagsulat ng tekstong nagsasalaysay
Batayan sa pagsulat ng tekstong nagsasalaysay Division en cantos de la epopeya
Division en cantos de la epopeya Grado relativo de monomios
Grado relativo de monomios La astrologia ciencia o camelo
La astrologia ciencia o camelo Que es la ciencia formal
Que es la ciencia formal 1786 administracion considerada ciencia
1786 administracion considerada ciencia Qué entiendes por ciencia
Qué entiendes por ciencia Las ramas de la ciencia
Las ramas de la ciencia Focalização textual
Focalização textual Ciencia noetica
Ciencia noetica