Asignatura ANLISIS QUMICO Grado Ciencia y Tecnologa de







- Slides: 16

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 TEMA 6 VALORACIONES DE PRECIPITACIÓN 1

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 CONTENIDOS 1. Introducción 2. Curvas de valoración 3. Detección del punto final y aplicaciones 3. A. Método de Mohr 3. B. Método de Volhard 3. C. Método de Fajans 2

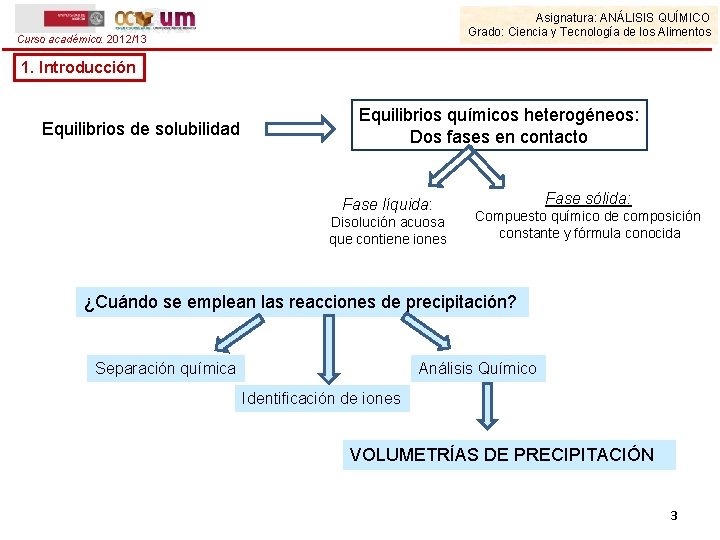
Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 1. Introducción Equilibrios de solubilidad Equilibrios químicos heterogéneos: Dos fases en contacto Fase líquida: Disolución acuosa que contiene iones Fase sólida: Compuesto químico de composición constante y fórmula conocida ¿Cuándo se emplean las reacciones de precipitación? Separación química Análisis Químico Identificación de iones VOLUMETRÍAS DE PRECIPITACIÓN 3

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 1. Introducción SOLUBILIDAD Y PRODUCTO DE SOLUBILIDAD Solubilidad (s) de un soluto (AB) en un disolvente dado: cantidad de soluto necesaria para formar una disolución saturada en una cantidad dada de disolvente. La solubilidad se expresa en unidades de concentración y es un valor característico y constante (a una temperatura fija) para cada especie química. AB(s) AB(ac) A + + B- Producto de solubilidad termodinámico Dentro de los límites de las disoluciones diluidas: actividad ≈ concentración Kps = [A+] [B-] Producto de solubilidad (Kps) es el producto de las concentraciones de los iones de un sólido poco soluble en una disolución saturada, elevadas a una potencia igual a su coeficiente estequiométrico 4

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 1. Introducción De forma general, Am. Bn(s) m. An+ + n. Bm- Kps = [An+]m [Bm-]n Condiciones de precipitación y disolución: [An+]m [Bm-]n > Kps Condición de precipitación. Disolución sobresaturada. [An+]m [Bm-]n = Kps Condición de equilibrio. Disolución saturada. [An+]m [Bm-]n < Kps Condición de disolución. Disolución insaturada. 5

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 1. Introducción Fundamento de una volumetría de precipitación: Reacción de precipitación – aparece un precipitado en el transcurso de la valoración m. An+ + n. Bm • Am. Bn (s) Keq= 1/K ps Kps= [An+]m[Bm-]n Para que una reacción de precipitación pueda emplearse en una volumetría debe ser: – – Cuantitativa: KS ↓ Estequiométrica Rápida Y ha de disponerse de un sistema indicador del punto final Pocas reacciones cumplen simultáneamente estos requisitos Las aplicaciones de este tipo de volumetrías son muy limitadas. Las disoluciones de Ag+ son ampliamente usadas como reactivos valorante, para la cuantificación de haluros, CN-, SCN-, CNO-, R-SH, S 2 -, SO 42 -. . . 6

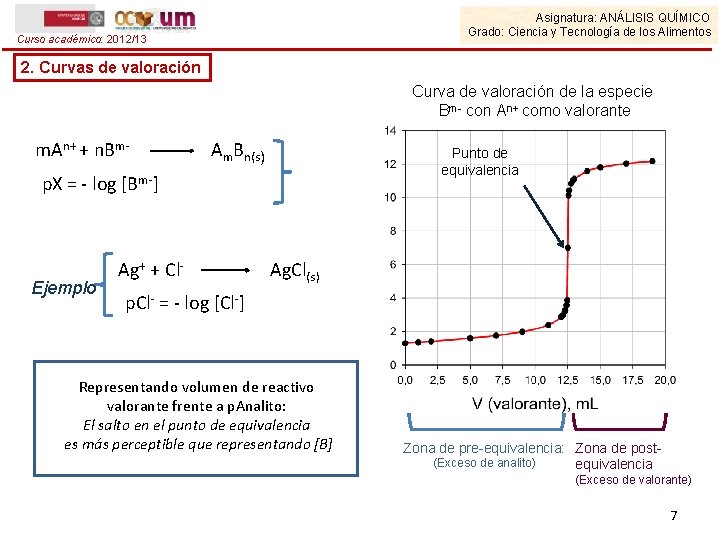
Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 2. Curvas de valoración Curva de valoración de la especie Bm- con An+ como valorante m. An+ + n. Bm- Am. Bn(s) Punto de equivalencia p. X = - log [Bm-] Ejemplo Ag+ + Cl- Ag. Cl(s) p. Cl- = - log [Cl-] Representando volumen de reactivo valorante frente a p. Analito: El salto en el punto de equivalencia es más perceptible que representando [B] Zona de pre-equivalencia: Zona de post(Exceso de analito) equivalencia (Exceso de valorante) 7

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 3. Detección del punto final y aplicaciones Indicadores químicos - Por formación de un compuesto coloreado - Método de Mohr: Determinación de Cl- y Br- Método de Volhard: - Determinación directa de Ag+ - Determinación indirecta de haluros - Empleando indicadores de adsorción - Método de Fajans En cualquier caso la reacción volumétrica es una argentometría: Ag+ + X- → Ag. X(s) 8

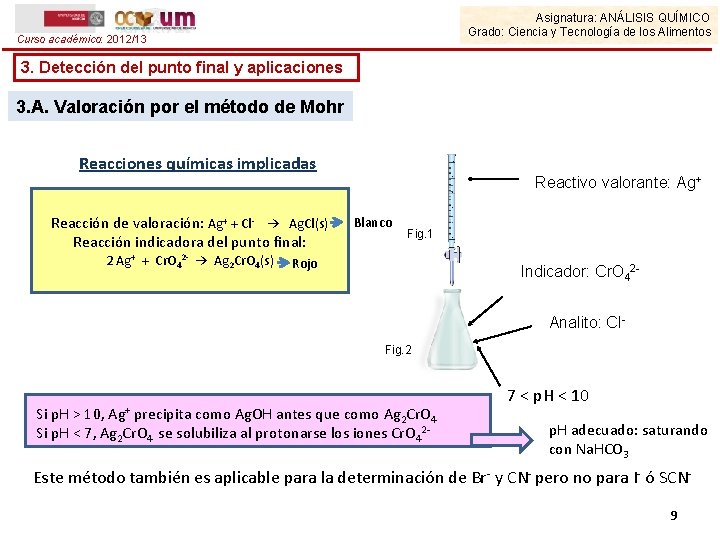
Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 3. Detección del punto final y aplicaciones 3. A. Valoración por el método de Mohr Reacciones químicas implicadas Reacción de valoración: Ag+ + Cl- → Ag. Cl(s) Reacción indicadora del punto final: 2 Ag+ + Cr. O 42 - → Ag 2 Cr. O 4(s) Reactivo valorante: Ag+ Blanco Fig. 1 Rojo Indicador: Cr. O 42 Analito: Cl. Fig. 2 Ag+ Si p. H > 10, precipita como Ag. OH antes que como Ag 2 Cr. O 4 Si p. H < 7, Ag 2 Cr. O 4 se solubiliza al protonarse los iones Cr. O 42 - 7 < p. H < 10 p. H adecuado: saturando con Na. HCO 3 Este método también es aplicable para la determinación de Br- y CN- pero no para I- ó SCN 9

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 3. Detección del punto final y aplicaciones El método de Mohr implica siempre llevar a cabo un blanco, ¿por qué? En el punto de equivalencia: [Ag+] = Kps(Ag. Cl)½ = 1, 35 • 10 -5 M Ks (Ag. Cl) = 1, 8 • 10 -10 ¿Qué concentración de indicador es necesaria para formar el precipitado rojo? Si Ks (Ag 2 Cr. O 4) = 1, 2 • 10 -12 , en el medio de valoración es necesario que [Cr. O 42 -] = 6, 6 • 10 -3 M, para que precipite Ag 2 Cr. O 4 En la práctica se trabaja en condiciones de [Cr. O 42 -] < 6, 6 • 10 -3 M y se corrige el exceso de Ag+: El medio de valoración presentará una coloración amarilla muy intensa Es difícil detectar el comienzo de la precipitación de Ag 2 Cr. O 4 Valoración del problema Fig. 1 V(Ag+)1 Fig. 1 Cl- + Cr. O 42 Fig. 2 Valoración del blanco V(Ag+)2 V(Ag+) = V(Ag+)1 – V(Ag+)2 Cr. O 4210

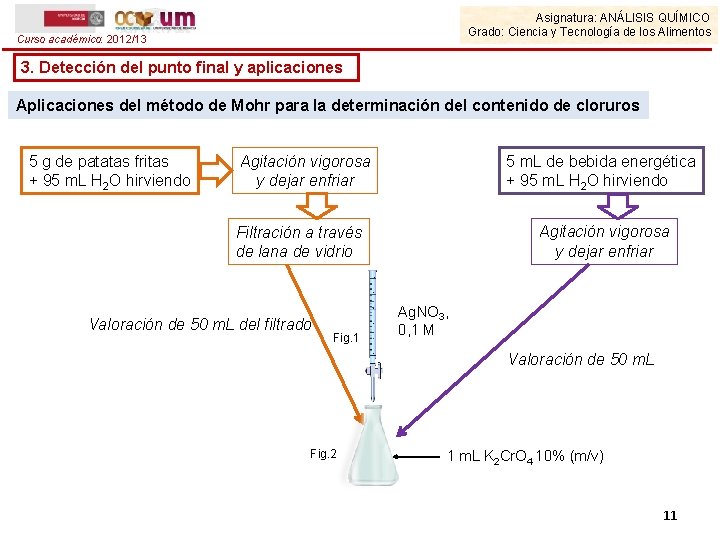
Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 3. Detección del punto final y aplicaciones Aplicaciones del método de Mohr para la determinación del contenido de cloruros 5 g de patatas fritas + 95 m. L H 2 O hirviendo Agitación vigorosa y dejar enfriar 5 m. L de bebida energética + 95 m. L H 2 O hirviendo Agitación vigorosa y dejar enfriar Filtración a través de lana de vidrio Valoración de 50 m. L del filtrado Fig. 1 Ag. NO 3, 0, 1 M Valoración de 50 m. L Fig. 2 1 m. L K 2 Cr. O 4 10% (m/v) 11

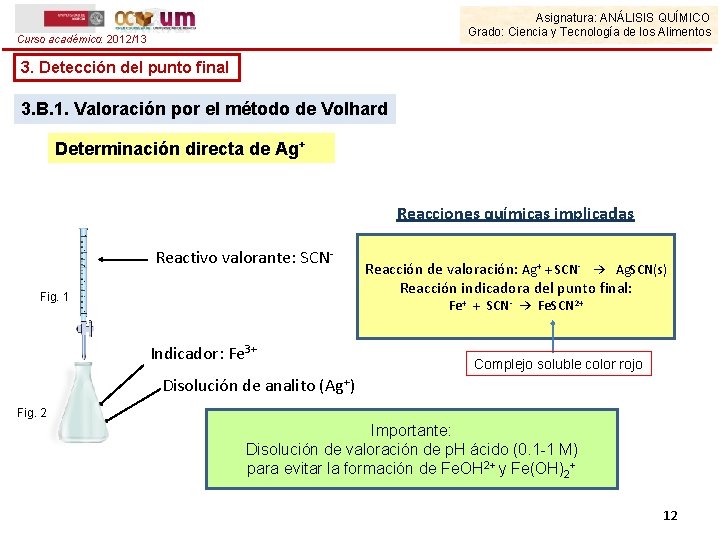
Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 3. Detección del punto final 3. B. 1. Valoración por el método de Volhard Determinación directa de Ag+ Reacciones químicas implicadas Reactivo valorante: SCNFig. 1 Reacción de valoración: Ag+ + SCN- → Ag. SCN(s) Reacción indicadora del punto final: Fe+ + SCN- → Fe. SCN 2+ Indicador: Fe 3+ Complejo soluble color rojo Disolución de analito (Ag+) Fig. 2 Importante: Disolución de valoración de p. H ácido (0. 1 -1 M) para evitar la formación de Fe. OH 2+ y Fe(OH)2+ 12

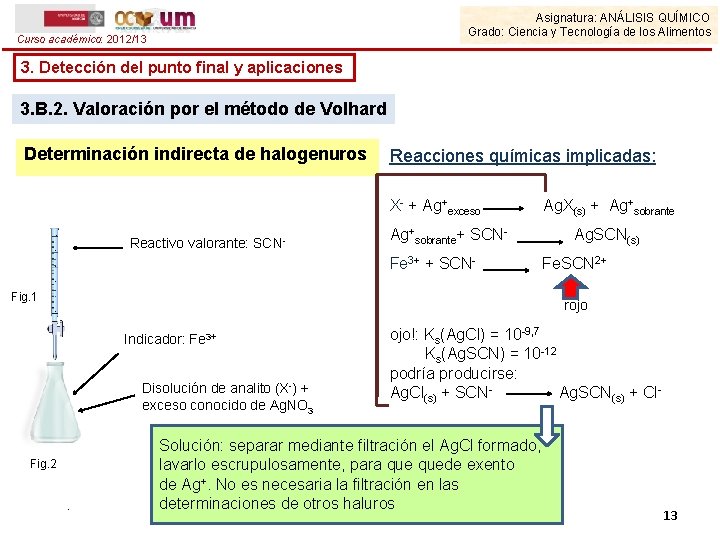
Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 3. Detección del punto final y aplicaciones 3. B. 2. Valoración por el método de Volhard Determinación indirecta de halogenuros Reacciones químicas implicadas: X- + Ag+exceso Reactivo valorante: SCN- Ag+sobrante+ SCNFe 3+ + SCN- Fig. 1 Ag. X(s) + Ag+sobrante Ag. SCN(s) Fe. SCN 2+ rojo Indicador: Fe 3+ Disolución de analito (X-) + exceso conocido de Ag. NO 3 Fig. 2 . ojo!: Ks(Ag. Cl) = 10 -9, 7 Ks(Ag. SCN) = 10 -12 podría producirse: Ag. Cl(s) + SCNAg. SCN(s) + Cl- Solución: separar mediante filtración el Ag. Cl formado, lavarlo escrupulosamente, para quede exento de Ag+. No es necesaria la filtración en las determinaciones de otros haluros 13

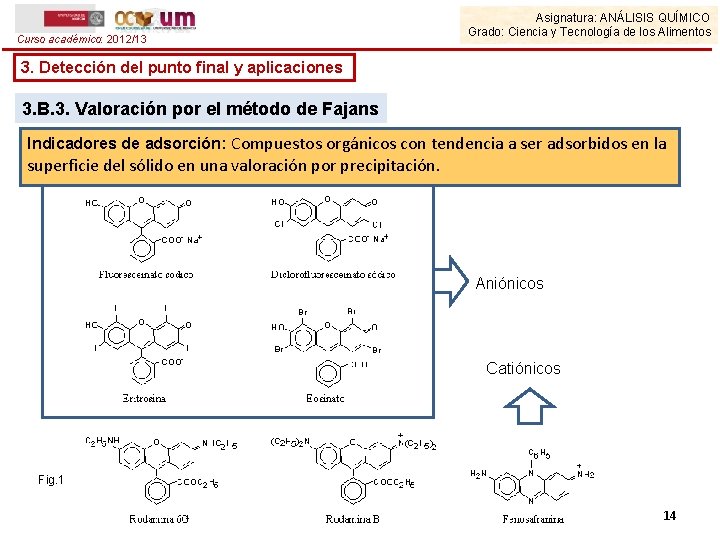
Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 3. Detección del punto final y aplicaciones 3. B. 3. Valoración por el método de Fajans Indicadores de adsorción: Compuestos orgánicos con tendencia a ser adsorbidos en la superficie del sólido en una valoración por precipitación. Aniónicos Catiónicos Fig. 1 14

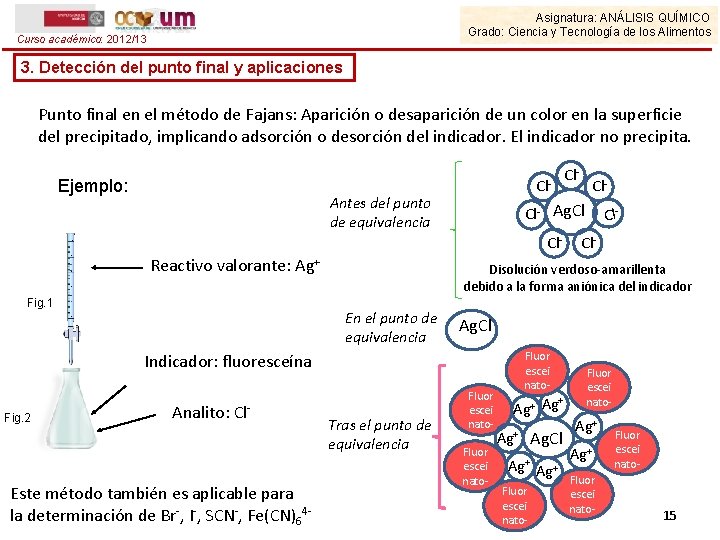
Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 3. Detección del punto final y aplicaciones Punto final en el método de Fajans: Aparición o desaparición de un color en la superficie del precipitado, implicando adsorción o desorción del indicador. El indicador no precipita. Ejemplo: Cl- Antes del punto de equivalencia Fig. 1 Este método también es aplicable para la determinación de Br-, I-, SCN-, Fe(CN)64 - Cl- Ag. Cl Fluor escei nato- Indicador: fluoresceína Fig. 2 Cl- Disolución verdoso-amarillenta debido a la forma aniónica del indicador En el punto de equivalencia Analito: Cl- Cl- Ag. Cl Cl- Reactivo valorante: Ag+ Cl- Tras el punto de equivalencia Fluor escei nato- + Ag Ag+ Fluor escei nato- Ag. Cl Ag+ Fluor escei nato- 15

Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos CRÉDITOS DE LAS ILUSTRACIONES – PICTURES COPYRIGHTS -Logo encabezado páginas OCW-UM. Autor: Universidad de Murcia. Dirección web: http: //ocw. um. es. -Páginas 9, 10, 11, 12, 13 y 15, Fig. 1. Dirección web: http: //commons. wikimedia. org/wiki/File: burette. svg. Autor: Mysid (original by Quantockgoblin. -Páginas 9, 10, 11, 12, 13 y 15, Fig. 2. Dirección web: http: //commons. wikimedia. org/wiki/File: Chemistry_flask_matthew_02. svg 16
 Que es tecnologa
Que es tecnologa Tecnologa
Tecnologa Ciclo lisogénico
Ciclo lisogénico Tecnologa en alimentos
Tecnologa en alimentos Tipo de enlace de oxígeno
Tipo de enlace de oxígeno Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Polar y no polar
Polar y no polar Amenazas de una empresa ejemplos
Amenazas de una empresa ejemplos Anlisis financiero
Anlisis financiero Anlisis foda
Anlisis foda Estrategia da mini-mini ejemplo
Estrategia da mini-mini ejemplo Ambientales
Ambientales Analisis foda de una universidad
Analisis foda de una universidad Enfoque didactico de formacion civica y etica
Enfoque didactico de formacion civica y etica Asignatura cono
Asignatura cono