Asignatura ANLISIS QUMICO Grado Ciencia y Tecnologa de


















- Slides: 29

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 TEMA 7 TÉCNICAS GRAVIMÉTRICAS 1

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 CONTENIDOS 1. 2. 3. 4. Fundamentos Clasificación de los métodos gravimétricos Gravimetrías por volatilización Gravimetrías por precipitación 1. 2. 3. 4. 5. 6. 7. 8. 9. 5. Conceptos importantes Propiedades ideales de los precipitados y de los reactivos precipitantes Clasificación de la partículas del precipitado Factores que determinan el tamaño de la partícula Mecanismo de formación de precipitados Conceptos relacionados con la gravimetría de precipitación Etapas experimentales en Gravimetrías por precipitación Tipos de reactivos precipitantes Características analíticas de los métodos gravimétricos Aplicaciones de los métodos gravimétricos al análisis de alimentos 2

Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 1. Fundamentos El Análisis Gravimétrico se basa en las medidas de masa. Requiere fundamentalmente dos medidas experimentales: Ø Peso o volumen de la muestra a analizar. Ø Peso de un sólido seco que o bien es el propio analito o una sustancia de composición química conocida que contenga el analito. 3

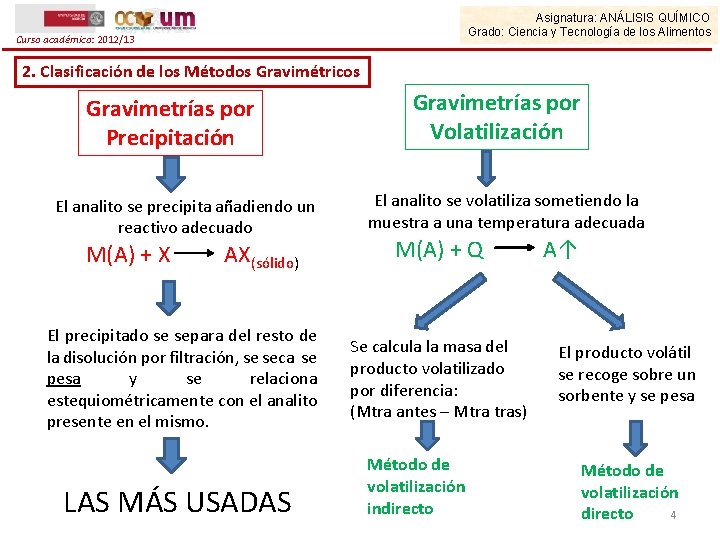
Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 2. Clasificación de los Métodos Gravimétricos Gravimetrías por Precipitación El analito se precipita añadiendo un reactivo adecuado M(A) + X AX(sólido) El precipitado se separa del resto de la disolución por filtración, se seca se pesa y se relaciona estequiométricamente con el analito presente en el mismo. LAS MÁS USADAS Gravimetrías por Volatilización El analito se volatiliza sometiendo la muestra a una temperatura adecuada M(A) + Q Se calcula la masa del producto volatilizado por diferencia: (Mtra antes – Mtra tras) Método de volatilización indirecto A↑ El producto volátil se recoge sobre un sorbente y se pesa Método de volatilización 4 directo

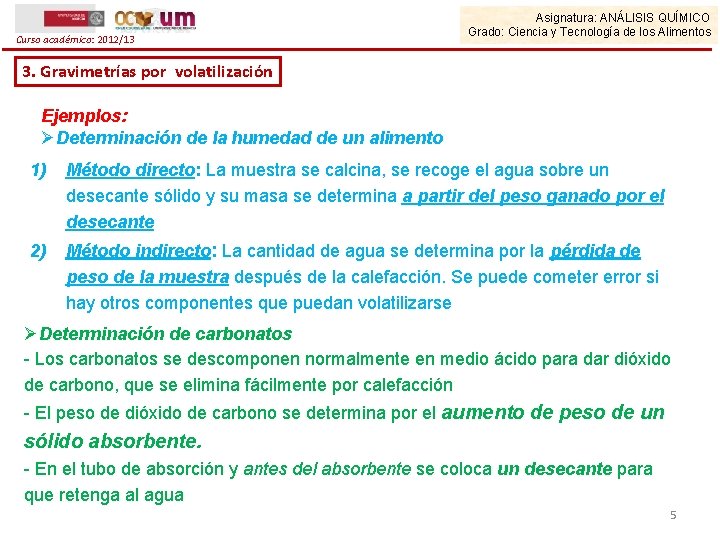
Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 3. Gravimetrías por volatilización Ejemplos: ØDeterminación de la humedad de un alimento 1) Método directo: La muestra se calcina, se recoge el agua sobre un desecante sólido y su masa se determina a partir del peso ganado por el desecante 2) Método indirecto: La cantidad de agua se determina por la pérdida de peso de la muestra después de la calefacción. Se puede cometer error si hay otros componentes que puedan volatilizarse ØDeterminación de carbonatos - Los carbonatos se descomponen normalmente en medio ácido para dar dióxido de carbono, que se elimina fácilmente por calefacción - El peso de dióxido de carbono se determina por el aumento de peso de un sólido absorbente. - En el tubo de absorción y antes del absorbente se coloca un desecante para que retenga al agua 5

Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 4. Gravimetrías por precipitación Ejemplo: Determinación de la cantidad de calcio en aguas naturales -Se añade un exceso de ácido oxálico, H 2 C 2 O 4, a un volumen de muestra medido cuidadosamente - En presencia de amoniaco, todo el calcio precipita como oxalato de calcio Ca 2+(ac) + C 2 O 42 -(ac) Ca. C 2 O 4(s) - El precipitado se transfiere a un crisol, previamente pesado, se seca y se calcina al rojo vivo - El precipitado se transforma cuantitativamente en óxido de calcio Ca. C 2 O 4(s) Ca. O(s) + CO(g) + CO 2(g) - El crisol con el precipitado se enfría, se pesa y, por diferencia, se determina la masa de óxido de calcio - A continuación se calcula el contenido de calcio en la muestra 6

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 4. Gravimetrías por precipitación Conceptos importantes ØSolubilidad (S) : • Se define como la máxima cantidad de soluto disuelto permitida por litro de disolución. • Todas las sustancias en mayor o menor grado son solubles en agua. ØEquilibrio de solubilidad. Disolver el sólido AB(sólido) AB(disuelto) (S) A+ (S) + B(S) ØEquilibrio de precipitación. Formación del precipitado Es el que se establece si el compuesto AB se forma al mezclar disoluciones iónicas de compuestos solubles que contienen los iones A+ y B- por separado Ba 2+ + SO 42 Ba SO 4 (sólido) Precipitado ØConstante del equilibrio. Producto de solubilidad Kps = [A] [B] = (S)2 7

Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 4. Gravimetrías por precipitación Propiedades ideales de los precipitados y de los reactivos precipitantes 1) Reacción específica , ( selectiva en condiciones adecuadas) entre agente precipitante y analito y con Ks baja 2) Precipitado fácilmente filtrable (tamaño partícula adecuado)y lavable para quedar libre de contaminantes 3) El precipitado debe tener una solubilidad baja para que las pérdidas del analito durante la filtración y el lavado sean despreciables 4) El precipitado debe ser estable ante agentes atmosféricos (humedad, O 2, CO 2) 5) El precipitado debe de tener una composición estequiométrica perfectamente conocida después de secar o calcinar, si fuera necesario 8

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 4. Gravimetrías por precipitación Clasificación de la partículas del precipitado El tamaño de las partículas del precipitado es función de la naturaleza del precipitado y de las condiciones experimentales bajo las cuales se producen Por el tamaño, el precipitado puede ser: Precipitado coloidal • El tamaño es del orden de μm • No sedimentan, forman suspensiones coloidales • No se pueden filtrar usando medios comunes de filtración • Hay que coagularlos Precipitado cristalino • Su tamaño es del orden de mm • Sedimentan con facilidad • Se pueden filtrar usando papel o vidrio filtrante • Son los mas deseables para gravimetría 9

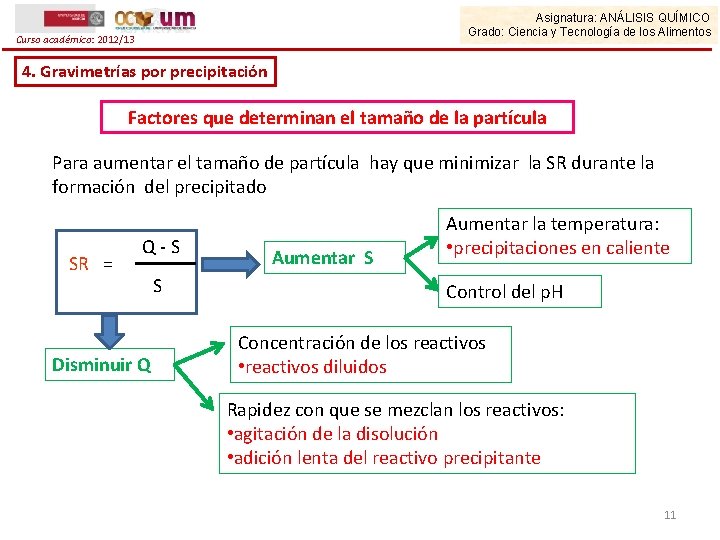
Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 4. Gravimetrías por precipitación Factores que determinan el tamaño de la partícula El tamaño de la partícula del precipitado está relacionado con una propiedad del sistema llamada Sobresaturación Relativa SR SR = Q-S Q SR grande SR pequeño Q = concentración soluto en un instante dado S= solubilidad soluto en el equilibrio Precipitado coloidal Precipitado cristalino Se puede incidir sobre el control del tamaño de las partículas y sobre la facilidad para su filtrado modificando el valor de la Sobresaturación Relativa (SR) 10

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 4. Gravimetrías por precipitación Factores que determinan el tamaño de la partícula Para aumentar el tamaño de partícula hay que minimizar la SR durante la formación del precipitado SR = Q-S Disminuir Q S Aumentar la temperatura: • precipitaciones en caliente Control del p. H Concentración de los reactivos • reactivos diluidos Rapidez con que se mezclan los reactivos: • agitación de la disolución • adición lenta del reactivo precipitante 11

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 4. Gravimetrías por precipitación Mecanismo de formación de precipitados Los precipitados se forman por medio de dos procesos distintos. Ø Nucleación Ø Crecimiento del cristal Nucleación ØProceso en el que se agrupa una cantidad mínima de iones, átomos o moléculas para formar un sólido estable, nucleo. Es un proceso espontáneo o inducido. Crecimiento cristalino ØProceso de crecimiento tridimensional del núcleo de una partícula para formar la estructura de un cristal. La precipitación se inicia con la nucleación y éste proceso y el de crecimiento del cristal compiten siempre en la formación de un precipitado. 12

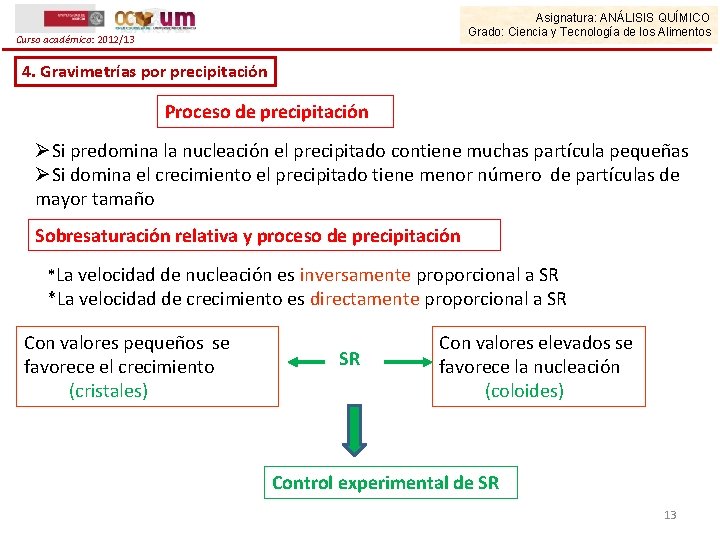
Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 4. Gravimetrías por precipitación Proceso de precipitación ØSi predomina la nucleación el precipitado contiene muchas partícula pequeñas ØSi domina el crecimiento el precipitado tiene menor número de partículas de mayor tamaño Sobresaturación relativa y proceso de precipitación *La velocidad de nucleación es inversamente proporcional a SR *La velocidad de crecimiento es directamente proporcional a SR Con valores pequeños se favorece el crecimiento (cristales) SR Con valores elevados se favorece la nucleación (coloides) Control experimental de SR 13

Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 4. Gravimetrías por precipitación Conceptos relacionados con la gravimetría de precipitación 1) Coprecipitación: fenómeno por el que sustancias normalmente solubles se eliminan de la disolución “arrastradas” por un precipitado. Tipos: - Adsorción superficial: La sustancia se une a la superficie del precipitado y precipita con él. Es un proceso de equilibrio - Formación de cristales mixtos: El ion contaminante sustituye a un ion de analito en la red cristalina del precipitado. Es un proceso de equilibrio - Oclusión: Un ion extraño es atrapado dentro de un cristal en crecimiento. No es un proceso de equilibrio - Atrapamiento mecánico: Un ión extraño es atrapado entre dos cristales en crecimiento. No es un proceso de equilibrio 14

Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 4. Gravimetrías por precipitación Conceptos relacionados con la gravimetría de precipitación 2) Reprecipitación (o doble precipitación): Un sólido filtrado se redisuelve y se vuelve a precipitar. Permite reducir el número de partículas adsorbidas al precipitado 3) Precipitación homogenea: �Es una técnica en la que, mediante una reacción química se genera un agente precipitante en el seno de la disolución del analito. Se añade una sustancia a la disolución que no es el reactivo precipitante. �El agente precipitante se genera lentamente y de manera inmediata precipita con el analito. �Se forman precipitados con buena tamaño de partícula y poco contaminados 15

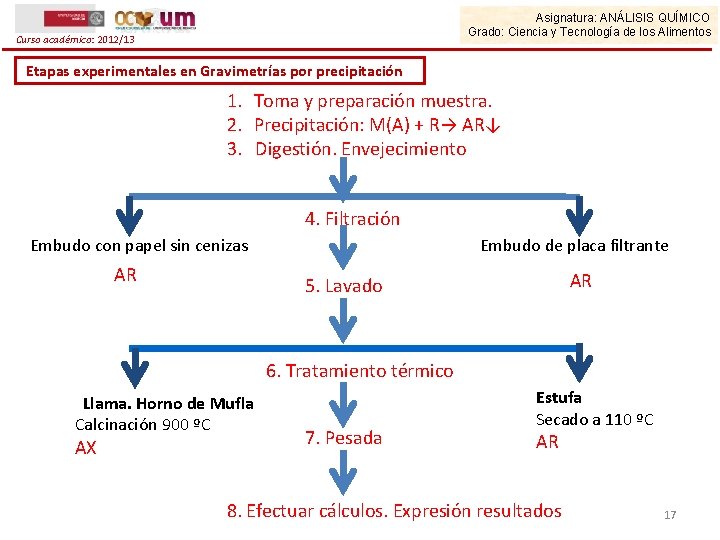
Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 4. Gravimetrías por precipitación Etapas experimentales en Gravimetrías por precipitación 1. Pesar o medir exactamente la muestra 2. Tratar la muestra : disolver, transformar. . etc. 3. Formar el precipitado: adición reactivo, reacción de precipitación 4. Tratamiento del precipitado: digestión , envejecimiento 5. Separar el precipitado: filtración 6. Purificación del precipitado. lavar. . etc 7. Secar o calcinar 8. Pesar 9. Cálculos gravimétricos Instrumentación Ø Balanza analítica Ø Material volumétrico Ø Crisoles • De placa filtrante ( sólo secado) • Convencionales: porcelana, metálicos (si hay que calcinar) Ø Estufa, mechero de buen tiro, horno de Mufla 16

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 Etapas experimentales en Gravimetrías por precipitación 1. Toma y preparación muestra. 2. Precipitación: M(A) + R→ AR↓ 3. Digestión. Envejecimiento 4. Filtración Embudo con papel sin cenizas AR Embudo de placa filtrante AR 5. Lavado 6. Tratamiento térmico Llama. Horno de Mufla Calcinación 900 ºC AX 7. Pesada Estufa Secado a 110 ºC AR 8. Efectuar cálculos. Expresión resultados 17

Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 4. Gravimetrías por precipitación Etapas experimentales en Gravimetrías por precipitación Precipitación: Llevar a cabo la precipitación en condiciones favorables: - usando disoluciones diluidas - formación lenta del precipitado, con agitación - calentamiento de la disolución - Evitar la coprecipitación de otras especies Ø El precipitado formado se llama “Forma de precipitación” Ø Digestión y envejecimiento: Mejoran las propiedades del precipitado para su filtración. Consisten en: 1. Calentar la disolución durante un tiempo largo, una vez que se ha formado el precipitado para eliminar el agua enlazada 2. Mantener el precipitado en las aguas madres para aumentar su tamaño de partícula. 18

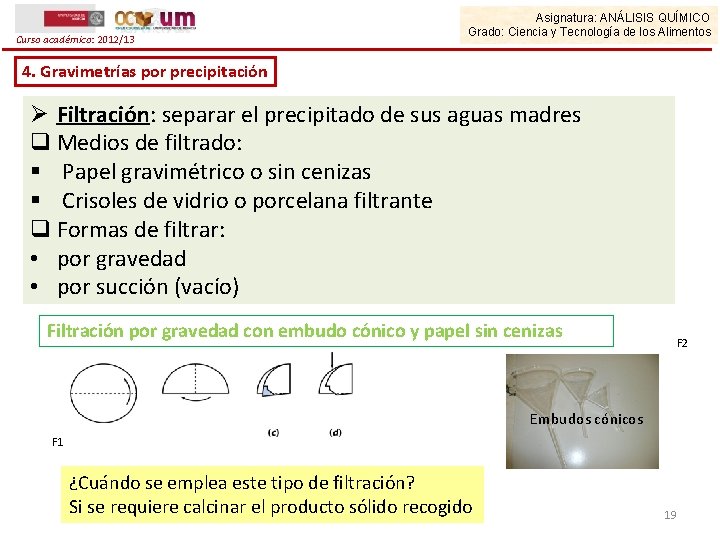
Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 4. Gravimetrías por precipitación Ø Filtración: separar el precipitado de sus aguas madres q Medios de filtrado: § Papel gravimétrico o sin cenizas § Crisoles de vidrio o porcelana filtrante q Formas de filtrar: • por gravedad • por succión (vacío) Filtración por gravedad con embudo cónico y papel sin cenizas F 2 Embudos cónicos F 1 ¿Cuándo se emplea este tipo de filtración? Si se requiere calcinar el producto sólido recogido 19

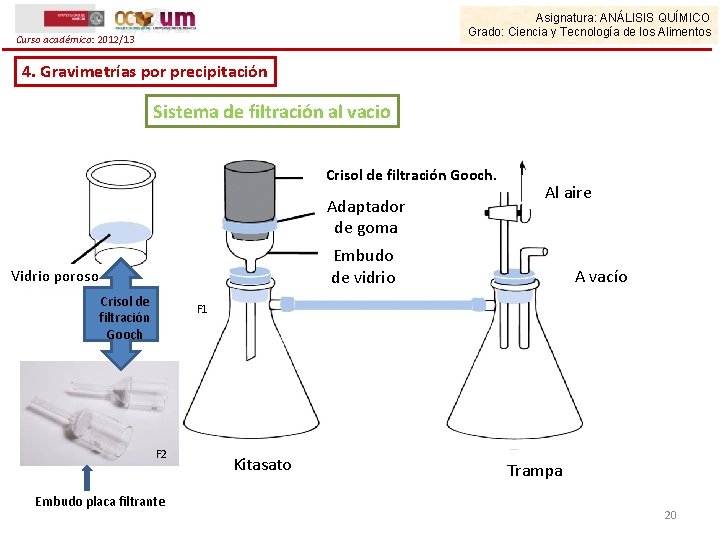
Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 4. Gravimetrías por precipitación Sistema de filtración al vacio Crisol de filtración Gooch. Adaptador de goma Al aire Embudo de vidrio Vidrio poroso Crisol de filtración Gooch A vacío F 1 F 2 Embudo placa filtrante Kitasato Trampa 20

Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 4. Gravimetrías por precipitación Etapas experimentales en Gravimetrías por precipitación Ø Lavado del precipitado: Para eliminar las impurezas adsorbidas. q. El líquido de lavado: § no debe reaccionar con el precipitado § debe de poder eliminarse por tratamiento térmico §debe contener un electrolito inerte § no debe contener ningún ión común con el precipitado §suelen ser específicas para cada precipitado, no se suele recomendar agua 21

Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 4. Gravimetrías por precipitación Etapas experimentales en Gravimetrías por precipitación ØTratamiento térmico: Dos tipos: A. Secado a 80 -120 ºC Forma de precipitación = Forma de pesada Se aplica si la forma de precipitado es estable y de composición química definida En estufa B. Calcinación a temperaturas mayores F. precipitación ≠ F. pesada Calcinando conseguimos un precipitado estable y de composición química definida que no habría sido obtenido en la etapa de precipitación En horno de mufla 22

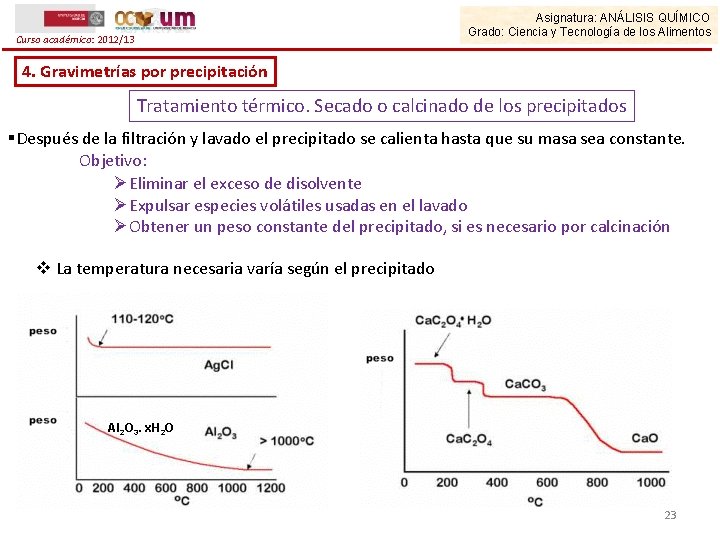
Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 4. Gravimetrías por precipitación Tratamiento térmico. Secado o calcinado de los precipitados §Después de la filtración y lavado el precipitado se calienta hasta que su masa sea constante. Objetivo: ØEliminar el exceso de disolvente ØExpulsar especies volátiles usadas en el lavado ØObtener un peso constante del precipitado, si es necesario por calcinación v La temperatura necesaria varía según el precipitado Al 2 O 3. x. H 2 O 23

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 4. Gravimetrías por precipitación Ø Pesada en balanza de precisión una vez enfriado el precipitado Ø Cálculos numéricos mediante relaciones estequiométricas Cálculos de los resultados a partir de datos gravimétricos Datos: üMasa o volumen de muestra üMasa del crisol vacío üMasa del crisol conteniendo el producto de composición conocida que contiene el analito 1. El peso del precipitado ⇒ Pg (g) = Peso crisol lleno – peso crisol vacío 2. Cálculos estequiométricos Factor gravimétrico (Fg) Fg = Peso fórmula analito / peso molecular forma de pesada Gramos de analito en la muestra: Pg x Fg % de analito = ( gramos de analito / gramos de muestra) x 100 24

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 4. Gravimetrías por precipitación Características analíticas ØSelectividad: Esta vinculada a la selectividad del reactivo analítico precipitante seleccionado. ØSensibilidad: Al igual que las volumetrías solo se pueden aplicar para el análisis de componentes mayoritarios. La concentración del analito ha de ser superior al 1% del contenido de la muestra. ØExactitud: Excelente : 1 -2%. Los cálculos son estequiométricos. ØPrecisión: Está vinculada a la precisión de la obtención del peso del precipitado. Hoy en día se dispone de excelentes balanzas analíticas. ØOtras: ØNo se requieren estándares ØNo requieren calibración ØMínimos requerimientos instrumentales ØSon procedimientos lentos 25

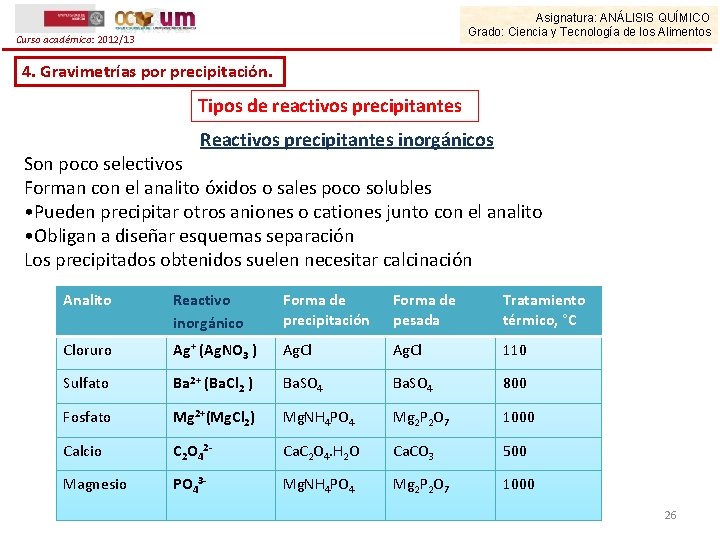
Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 4. Gravimetrías por precipitación. Tipos de reactivos precipitantes Reactivos precipitantes inorgánicos Son poco selectivos Forman con el analito óxidos o sales poco solubles • Pueden precipitar otros aniones o cationes junto con el analito • Obligan a diseñar esquemas separación Los precipitados obtenidos suelen necesitar calcinación Analito Reactivo inorgánico Forma de precipitación Forma de pesada Tratamiento térmico, °C Cloruro Ag+ (Ag. NO 3 ) Ag. Cl 110 Sulfato Ba 2+ (Ba. Cl 2 ) Ba. SO 4 800 Fosfato Mg 2+(Mg. Cl 2) Mg. NH 4 PO 4 Mg 2 P 2 O 7 1000 Calcio C 2 O 42 - Ca. C 2 O 4. H 2 O Ca. CO 3 500 Magnesio PO 43 - Mg. NH 4 PO 4 Mg 2 P 2 O 7 1000 26

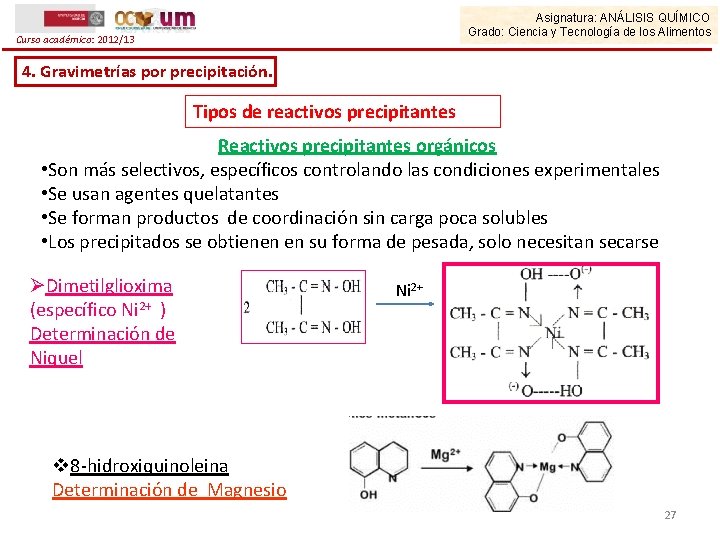
Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 4. Gravimetrías por precipitación. Tipos de reactivos precipitantes Reactivos precipitantes orgánicos • Son más selectivos, específicos controlando las condiciones experimentales • Se usan agentes quelatantes • Se forman productos de coordinación sin carga poca solubles • Los precipitados se obtienen en su forma de pesada, solo necesitan secarse ØDimetilglioxima (específico Ni 2+ ) Determinación de Niquel Ni 2+ v 8 -hidroxiquinoleina Determinación de Magnesio 27

Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos 5. Aplicaciones de los métodos gravimétricos Se han desarrollado métodos gravimétricos para: ØAniones inorgánicos: sulfato, fosfato, cloruro, silicatos, etc ØCationes inorgánicos: calcio, magnesio, hierro, aluminio, potasio, etc ØEspecies neutras: agua, dióxido de azufre, dióxido de carbono. ØDiversas sustancias orgánicas: lactosa, colesterol, benzaldehido, etc En alimentos se aplican entre otros para: üDeterminación de la humedad üDeterminación de fibra bruta en diversos alimentos üDeterminación de sulfatos en aguas de diversas procedencias üDeterminación de calcio en productos lacteos üDeterminación de lactosa en productos lacteos üDeterminación de colesterol en cereales üDeterminación de benzaldehido en extractos de almendras 28

Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos CRÉDITOS DE LAS ILUSTRACIONES. PICTURES COPYRIGHTS -Logo Portada OCW-UM. Autor: Universidad de Murcia. Dirección web: http: //ocw. um. es. -Página 19, F 1. Fuente: “Quantitative Chemical Analysis”, Seventh Edition, © 2007 W. H. Freeman and Company. -Página 19, F 2. Autor: Lilly_M. Dirección web: http: //commons. wikimedia. org/wiki/File: Sintered_glass_funnel-02. jpg. -Página 20, F 1. Fuente: “Quantitative Chemical Analysis”, Seventh Edition, © 2007 W. H. Freeman and Company. -Página 20, F 2. Autor: Nickele. Dirección web: http: //commons. wikimedia. org/wiki/File: Entonnoirs_verre. JP 29
 Tecnologa
Tecnologa Plasmidos que es
Plasmidos que es Tecnologa en alimentos
Tecnologa en alimentos Que es tecnologa
Que es tecnologa Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Fqcolindres 2 eso
Fqcolindres 2 eso Estructura enlace ionico
Estructura enlace ionico Anlisis foda
Anlisis foda Estrategia fa (maxi-mini)
Estrategia fa (maxi-mini) Ambientales
Ambientales Estrategias maxi maxi
Estrategias maxi maxi Amenazas foda ejemplos
Amenazas foda ejemplos Anlisis financiero
Anlisis financiero Nombre de la asignatura
Nombre de la asignatura Estratehiya sa pagtuturo ng tatas
Estratehiya sa pagtuturo ng tatas Division en cantos de la epopeya
Division en cantos de la epopeya Nombre de asignatura
Nombre de asignatura Nombre curso fecha
Nombre curso fecha Nombre de la asignatura
Nombre de la asignatura Enfoque de formación cívica y ética secundaria
Enfoque de formación cívica y ética secundaria Que es el radio
Que es el radio El grado absoluto del siguiente polinomio es
El grado absoluto del siguiente polinomio es Slujb
Slujb La contabilidad es una ciencia social
La contabilidad es una ciencia social Toda ciencia trascendiendo san juan de la cruz
Toda ciencia trascendiendo san juan de la cruz Ciencia que estudia los vectores
Ciencia que estudia los vectores Descripción de ciencia
Descripción de ciencia Cosas basicas de la quimica
Cosas basicas de la quimica