Asignatura ANLISIS QUMICO Grado Ciencia y Tecnologa de












- Slides: 21

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 TEMA 3 VALORACIONES ÁCIDO-BASE 1

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 CONTENIDOS 1. Introducción 1. A. Curvas de valoración 1. B. Reactivos para volumetrías ácido-base 2. Detección del punto final en valoraciones ácido-base 2. A. Con un electrodo de p. H 2. B. Con indicadores ácido-base 3. Aplicaciones de las volumetrías ácido-base al análisis de alimentos 3. A. Acidez de un vinagre 3. B. Acidez de un aceite 3. C. Acidez de la leche 3. D. Contenido de proteínas 2

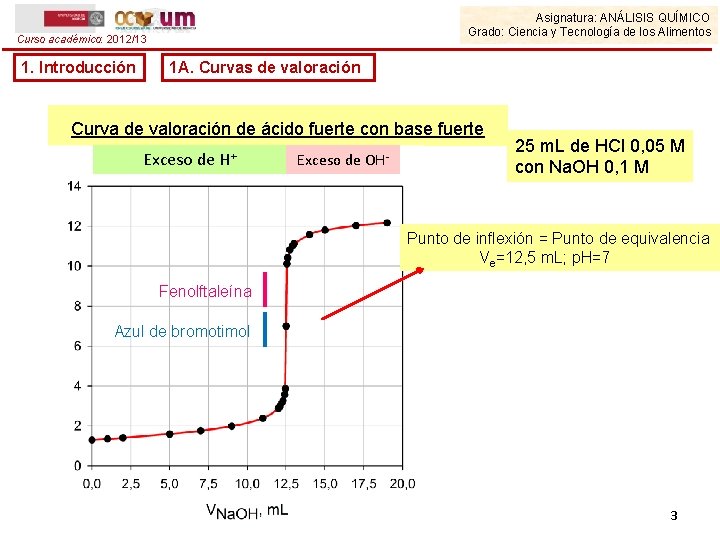
Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 1. Introducción 1 A. Curvas de valoración Curva de valoración de ácido fuerte con base fuerte Exceso de H+ Exceso de OH- 25 m. L de HCl 0, 05 M con Na. OH 0, 1 M Punto de inflexión = Punto de equivalencia Ve=12, 5 m. L; p. H=7 Fenolftaleína Azul de bromotimol 3

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 1. Introducción 1 A. Curvas de valoración p. H en el punto de equivalencia de las valoraciones de: Ácido fuerte con fase fuerte: p. H = 7. Los iones son débiles no se hidrolizan. Ej. HCl con Na. OH Base fuerte con ácido fuerte: p. H = 7. Los iones son débiles no se hidrolizan. Ej. KOH con HCl. O 4 Ácido débil con fase fuerte: p. H > 7. Los iones son fuertes, se hidrolizan. Ej. Ac. H con Na. OH: Ac- + H 2 O Ac. H + OH- Base débil con ácido fuerte: p. H < 7. Los iones son fuertes, se hidrolizan. Ej. NH 4 OH con HCl: NH 4+ + H 2 O NH 4 OH + H+ 4

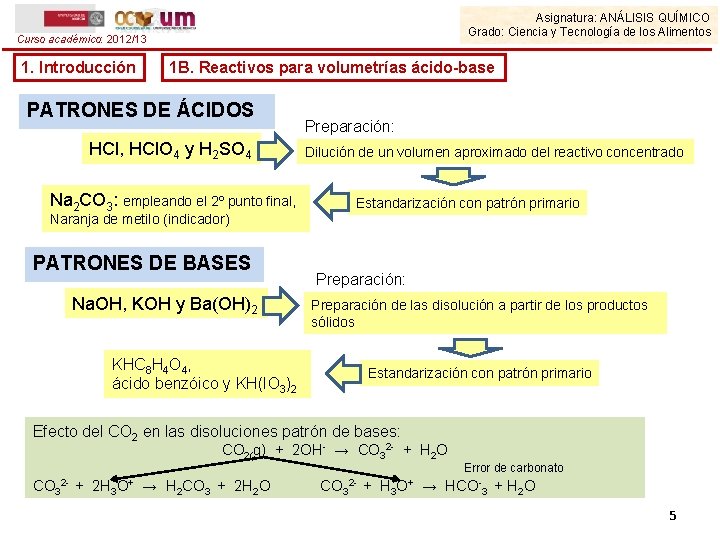
Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 1. Introducción 1 B. Reactivos para volumetrías ácido-base PATRONES DE ÁCIDOS HCl, HCl. O 4 y H 2 SO 4 Na 2 CO 3: empleando el 2º punto final, Preparación: Dilución de un volumen aproximado del reactivo concentrado Estandarización con patrón primario Naranja de metilo (indicador) PATRONES DE BASES Na. OH, KOH y Ba(OH)2 Preparación: Preparación de las disolución a partir de los productos sólidos KHC 8 H 4 O 4, ácido benzóico y KH(IO 3)2 Estandarización con patrón primario Efecto del CO 2 en las disoluciones patrón de bases: CO 2(g) + 2 OH- → CO 32 - + H 2 O Error de carbonato CO 32 - + 2 H 3 O+ → H 2 CO 3 + 2 H 2 O CO 32 - + H 3 O+ → HCO-3 + H 2 O 5

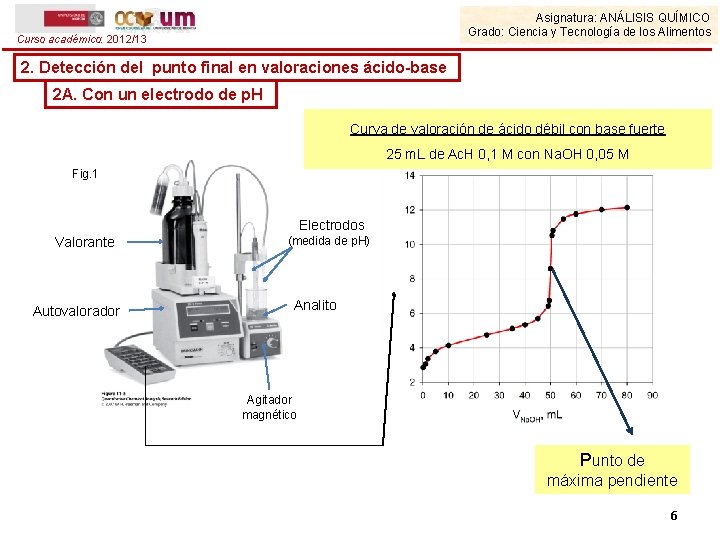
Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 2. Detección del punto final en valoraciones ácido-base 2 A. Con un electrodo de p. H Curva de valoración de ácido débil con base fuerte 25 m. L de Ac. H 0, 1 M con Na. OH 0, 05 M Fig. 1 Electrodos Valorante Autovalorador (medida de p. H) Analito Agitador magnético Punto de máxima pendiente 6

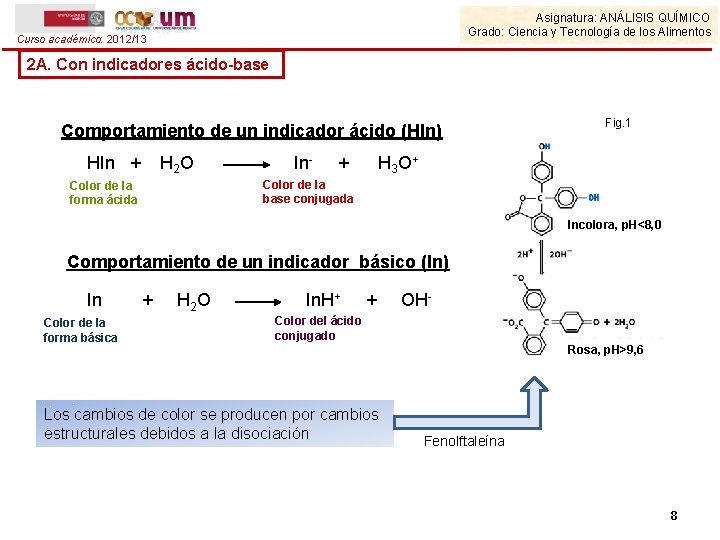
Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 2. Detección del punto final en valoraciones ácido-base 2 A. Con indicadores ácido-base • Los indicadores acido-base son ácidos o bases débiles y de carácter orgánico, cuyas especies en distintos estados de protonación tienen colores diferentes. • Presentan estructuras moleculares complejas Fig. 1 Verde de bromocresol (C 2 H 14 O 4) Fenolftaleína (C 20 H 14 O 4) Fig. 2 • Son intensamente coloreados: Con concentraciones 10 -4 – 10 -5 M se aprecia perfectamente el cambio de color. Cantidad de valorante consumido despreciable) 7

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 2 A. Con indicadores ácido-base Comportamiento de un indicador ácido (HIn) HIn + H 2 O In- + Fig. 1 H 3 O+ Color de la base conjugada Color de la forma ácida Incolora, p. H<8, 0 Comportamiento de un indicador básico (In) In Color de la forma básica + H 2 O In. H+ + OH- Color del ácido conjugado Los cambios de color se producen por cambios estructurales debidos a la disociación Rosa, p. H>9, 6 Fenolftaleína 8

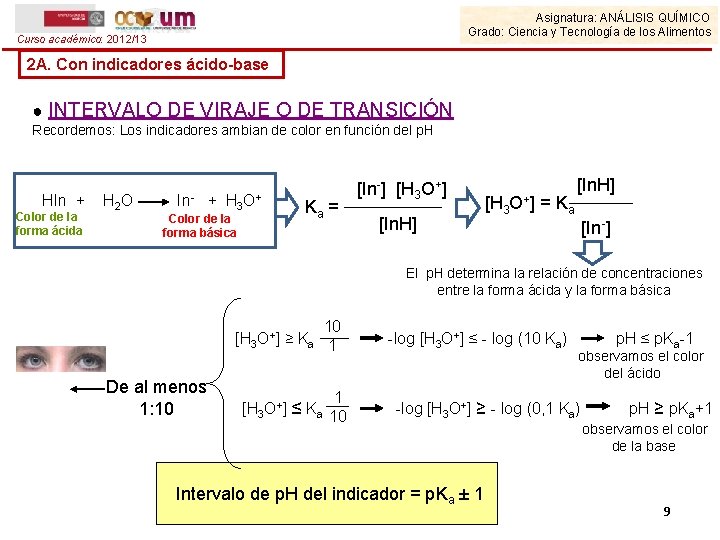
Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 2 A. Con indicadores ácido-base ● INTERVALO DE VIRAJE O DE TRANSICIÓN Recordemos: Los indicadores ambian de color en función del p. H HIn + Color de la forma ácida H 2 O In- + H 3 Color de la forma básica O+ Ka = [In-] [H 3 O+] [In. H] [H 3 O+ ] = Ka [In. H] [In-] El p. H determina la relación de concentraciones entre la forma ácida y la forma básica 10 [H 3 O+] ≥ Ka 1 De al menos 1: 10 1 [H 3 O+] ≤ Ka 10 -log [H 3 O+] ≤ - log (10 Ka) observamos el color del ácido -log [H 3 O+] ≥ - log (0, 1 Ka) Intervalo de p. H del indicador = p. Ka ± 1 p. H ≤ p. Ka-1 p. H ≥ p. Ka+1 observamos el color de la base 9

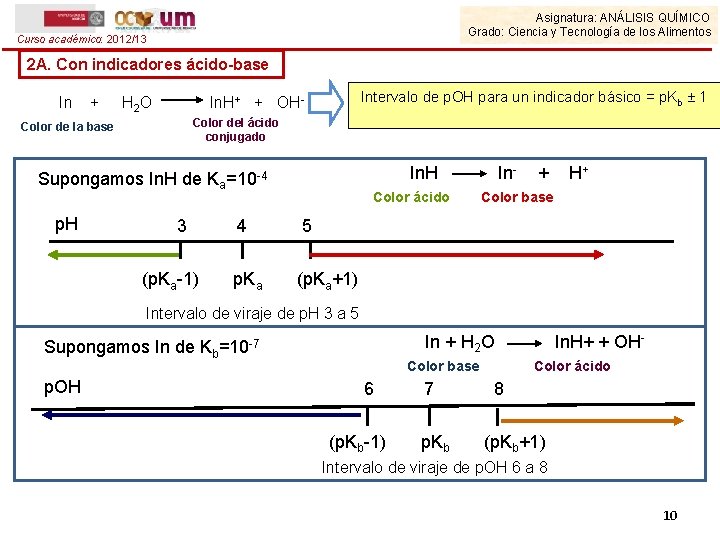
Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 2 A. Con indicadores ácido-base In + H 2 O Intervalo de p. OH para un indicador básico = p. Kb ± 1 In. H+ + OHColor del ácido conjugado Color de la base In. H Supongamos In. H de Ka=10 -4 p. H 3 (p. Ka-1) Color ácido 4 5 p. Ka (p. Ka+1) In- + H+ Color base Intervalo de viraje de p. H 3 a 5 In + H 2 O Supongamos In de Kb=10 -7 p. OH Color base 6 (p. Kb-1) 7 p. Kb In. H+ + OHColor ácido 8 (p. Kb+1) Intervalo de viraje de p. OH 6 a 8 10

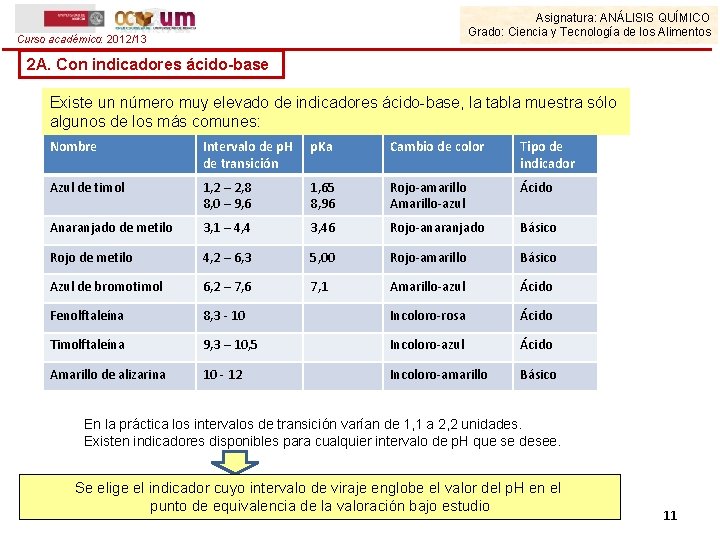
Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 2 A. Con indicadores ácido-base Existe un número muy elevado de indicadores ácido-base, la tabla muestra sólo algunos de los más comunes: Nombre Intervalo de p. H de transición p. Ka Cambio de color Tipo de indicador Azul de timol 1, 2 – 2, 8 8, 0 – 9, 6 1, 65 8, 96 Rojo-amarillo Amarillo-azul Ácido Anaranjado de metilo 3, 1 – 4, 4 3, 46 Rojo-anaranjado Básico Rojo de metilo 4, 2 – 6, 3 5, 00 Rojo-amarillo Básico Azul de bromotimol 6, 2 – 7, 6 7, 1 Amarillo-azul Ácido Fenolftaleína 8, 3 - 10 Incoloro-rosa Ácido Timolftaleína 9, 3 – 10, 5 Incoloro-azul Ácido Amarillo de alizarina 10 - 12 Incoloro-amarillo Básico En la práctica los intervalos de transición varían de 1, 1 a 2, 2 unidades. Existen indicadores disponibles para cualquier intervalo de p. H que se desee. Se elige el indicador cuyo intervalo de viraje englobe el valor del p. H en el punto de equivalencia de la valoración bajo estudio 11

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 3. Aplicaciones de las volumetrías ácido-base al análisis de alimentos 3 A. Acidez de un vinagre • • • La acidez total (o grado acético): totalidad de los ácidos (volátiles y fijos) que contiene el vinagre. Se expresa como gramos de ácido acético por 100 m. L de vinagre. La normativa española establece que los vinagres comerciales contengan, al menos, una concentración molar de Ac. H de 0, 8. DETERMINACIÓN: Valoración de ácido débil con base fuerte. CH 3 -COOH + KOH → CH 3 -COO- K+ + H 2 O Fig. 1 Na. OH ~0, 1 M factorada Ind. fenolftaleína Fig. 2 M(ácido acético)=60 g/mol 5 -20 m. L de vinagre hasta ~50 m. L con agua 12

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 3 A. Acidez de un vinagre Supongamos que para la valoración de 5 m. L de vinagre se han necesitado 10, 55 m. L de KOH 0, 1078 M. KOH, moles = 0, 01055 • 0, 1078 = 1, 14 • 10 -3 = moles de ácido acético • 100/5 ACIDEZ DEL VINAGRE: 1, 37 % m/v • 60 g/mol 0, 0684 g de ácido oléico También llamado GRADO ACÉTICO 13

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 3. Aplicaciones de las volumetrías ácido-base al análisis de alimentos 3 B. Acidez de un aceite Grado de acidez: indicador de la cantidad de ácidos grasos libres presentes en el aceite, expresada en tanto por ciento de ácido oleico. Estos ácidos se liberan cuando la aceituna es defectuosa. Mayor grado de acidez significa mayor deterioro de las aceitunas, mayor enranciamiento. Índice de acidez: mg de KOH necesarios para neutralizar 1 g de aceite • DETERMINACIÓN: Valoración de ácido débil con base fuerte. C 17 H 33 -COOH + KOH → C 17 H 33 -COO- K+ + H 2 O F 1 KOH ~0, 1 -0, 5 M (en disolución hidroalcohólica) factorada Ind. fenolftaleína F 2 M(ácido oléico)=282 g/mol ~ 10 -15 g de aceite + 50 m. L de mezcla etanol: éter etílico (1: 1) 14

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 3 B. Acidez de un aceite Supongamos que para la valoración de 14, 9390 g de aceite se han necesitado 8, 75 m. L de KOH 0, 1045 M. KOH, moles = 0, 00875 • 0, 1045 = 9, 14 • 10 -4 = moles de ácido oléico GRADO DE ACIDEZ: 17, 3 % m/m • 100/14, 9390 • 282 g/mol 0, 258 g de ácido oléico KOH, mg = 8, 75 • 0, 1045 • 56, 1 = 51, 3; para neutralizar 14, 939 g de muestra Masa molecular KOH para 1 g de aceite: ÍNDICE DE ACIDEZ: 3, 43 mg 15

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 3. Aplicaciones de las volumetrías ácido-base al análisis de alimentos 3 C. Acidez de la leche El ácido mayoritario en la leche es el ácido láctico, por ello la acidez en estas muestras se expresa como gramos de dicho ácido por cada 100 m. L de leche (% m/v) • DETERMINACIÓN: Valoración de ácido débil con base fuerte. CH 3 -CHOH-COOH + KOH → CH 3 –CHOH-COO- K+ + H 2 O Fig. 1 Na. OH ~0, 1 M factorada Ind. fenolftaleína Fig. 2 10 m. L de leche + 25 m. L de agua M(ácido láctico)= 90 g/mol 16

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 3 C. Acidez de la leche Supongamos que para la valoración de 10 m. L de leche se han necesitado 9, 85 m. L de Na. OH 0, 1050 M. KOH, moles = 0, 01055 • 0, 00985 = 1, 04 • 10 -4 = moles de ácido láctico • 100/10 ACIDEZ DE LA LECHE: 0, 094% m/v • 90 g/mol 9, 36 • 10 -3 g de ácido láctico 17

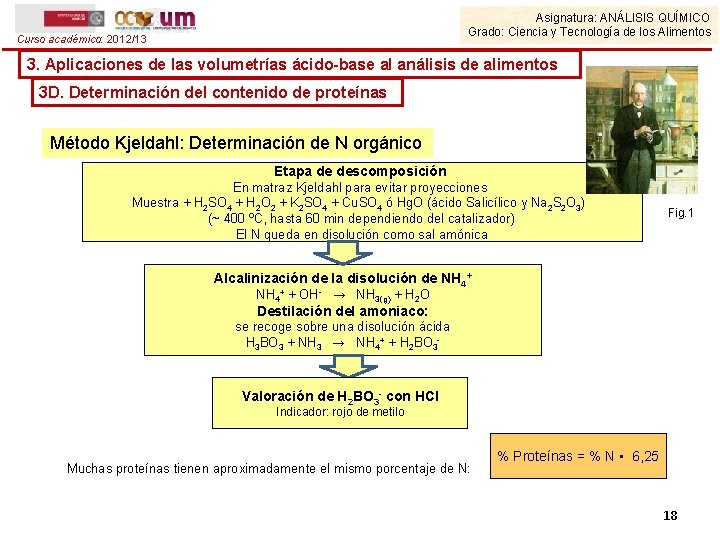
Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 3. Aplicaciones de las volumetrías ácido-base al análisis de alimentos 3 D. Determinación del contenido de proteínas Método Kjeldahl: Determinación de N orgánico Etapa de descomposición En matraz Kjeldahl para evitar proyecciones Muestra + H 2 SO 4 + H 2 O 2 + K 2 SO 4 + Cu. SO 4 ó Hg. O (ácido Salicílico y Na 2 S 2 O 3) (~ 400 ºC, hasta 60 min dependiendo del catalizador) El N queda en disolución como sal amónica Fig. 1 Alcalinización de la disolución de NH 4+ + OH- → NH 3(g) + H 2 O Destilación del amoniaco: se recoge sobre una disolución ácida H 3 BO 3 + NH 3 → NH 4+ + H 2 BO 3 - Valoración de H 2 BO 3 - con HCl Indicador: rojo de metilo Muchas proteínas tienen aproximadamente el mismo porcentaje de N: % Proteínas = % N • 6, 25 18

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 3. D. Determinación del contenido de proteínas Supongamos que para la valoración del anión borato producido tras el tratamiento de 5, 480 g de carne mediante el método Kjeldahl consumen 10, 15 m. L de HCl 0, 1088 M. HCl, moles = 0, 01015 • 0, 1088 = 1, 10 • 10 -3 = moles de H 2 BO 31, 10 • 10 -3 moles de NH 4+ • 14 g/mol 0, 0155 g de N • 6, 25 0, 0969 g de proteína (en 5, 348 g de carne) 1, 81% m/m CONTENIDO DE PROTEÍNAS 19

Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos Curso académico: 2012/13 3. D. Determinación del contenido de proteínas Supongamos que el amoniaco destilado del tratamiento de 5, 3690 g de carne mediante el método Kjeldahl se recoge sobre 25 m. L de una disolución de ácido bórico 0, 1205 M, y que la valoración del exceso de ácido bórico se lleva a cabo con 10, 05 m. L de Na. OH 0, 1044 M. Moles totales de H 3 BO 3 = 0, 025 • 0, 1205 = 3, 01 • 10 -3 Moles de H 3 BO 3 en exceso = 0, 01005 • 0, 1044 = 1, 05 • 10 -3 Moles de H 3 BO 3 que reaccionan con NH 3 = (3, 01 – 1, 05) 10 -3 = 1, 96 • 10 -3 0, 02744 g de N • 14 g/mol 1, 96 • 10 -3 moles de NH 3 • 6, 25 0, 1715 g de proteína (en 5, 369 g de carne) 3, 19% m/m CONTENIDO DE PROTEÍNAS 20

Curso académico: 2012/13 Asignatura: ANÁLISIS QUÍMICO Grado: Ciencia y Tecnología de los Alimentos CRÉDITOS DE LAS ILUSTRACIONES – PICTURES COPYRIGHTS -Logo Portada OCW-UM. Autor: Universidad de Murcia. Dirección web: http: //ocw. um. es. -Página 6, Fig. 1. Fuente: “Quantitative Chemical Analysis”, Seventh Edition, © 2007 W. H. Freeman and Company. -Página 7, Fig. 1. Dirección web: http: //commons. wikimedia. org/wiki/File: Bromocresol_green. png. -Página 7, Fig. 2. Dirección web: http: //commons. wikimedia. org/wiki/File: Phenolphtaleine_3 D. jpg. Autor: Sébastien Bruneau. -Página 8, Fig. 1. Fuente: : “Quantitative Chemical Analysis”, Seventh Edition, © 2007 W. H. Freeman and Company. -Página 12, 14 y 16, Fig. 1. Dirección web: http: //commons. wikimedia. org/wiki/File: burette. svg. Autor: Mysid (original by Quantockgoblin. -Página 12, 14 y 16, Fig. 2. Dirección web: http: //commons. wikimedia. org/wiki/File: Chemistry_flask_matthew_02. svg -Página 18, Fig. 1. Dirección web: http: //commons. wikimedia. org/wiki/File: Johan. Kjeldahl_in_1883. jpg? uselang=es 21
 Tecnologa
Tecnologa Plasmidos que es
Plasmidos que es Tecnologa en alimentos
Tecnologa en alimentos Que es tecnologa
Que es tecnologa Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Polar y no polar
Polar y no polar Regla del octeto
Regla del octeto Anlisis financiero
Anlisis financiero Master memfi
Master memfi Maxi maxi maxi mini
Maxi maxi maxi mini Ambientales
Ambientales Estrategia fo maxi maxi
Estrategia fo maxi maxi Amenazas foda ejemplos
Amenazas foda ejemplos Asignatura cono
Asignatura cono Nombre de la asignatura
Nombre de la asignatura Mga asignatura sa ikatlong baitang
Mga asignatura sa ikatlong baitang Pica asignatura
Pica asignatura Nombre de asignatura
Nombre de asignatura Nombre curso asignatura
Nombre curso asignatura Nombre de la asignatura
Nombre de la asignatura