CONCEPTOS DE ESTEQUIOMETRA Las ramas de la ciencia





- Slides: 8

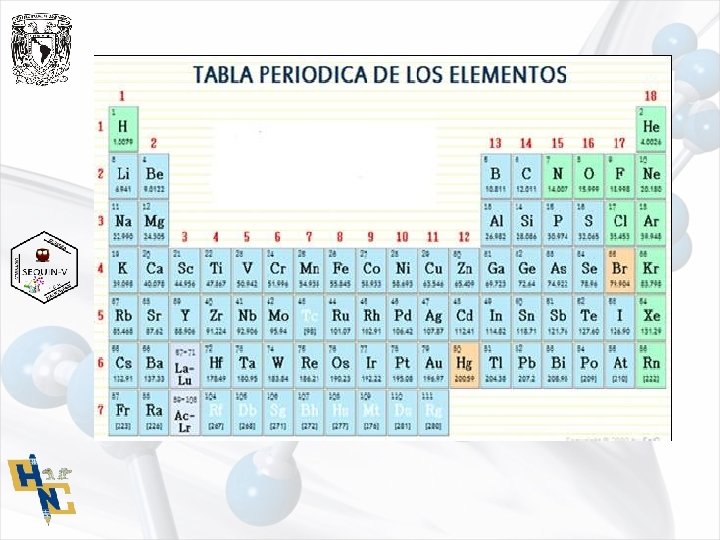
CONCEPTOS DE ESTEQUIOMETRÍA • Las ramas de la ciencia que requieren el conocimiento de la estequiometría, son muchas, ya que en casi todas se maneja materia prima medible, que son productos químicos. Estos se hacen reaccionar para generar productos, también medibles, en el transcurso de la reacción química. Algunas de esta son: la farmacología, industria de alimentos, elaboración de perfumes, elaboración de cosméticos, industria de plásticos, combustibles, metalurgia, entre otras. • Cuando Lavoisier, en 1789, estableció lo que hoy se conoce como ley de la conservación de la materia sentó las bases para la estequiometría que la podemos definir como el procedimiento por medio del cual se determinan las cantidades de reactivos y productos que intervienen en una reacción química. Su etimología deriva del griego stoicheion que significa primer principio o elemento y metrón que significa medida. • La masa de los átomos y de las moléculas se mide tomando como unidad la llamada: unidad de masa atómica (u), que corresponde a la doceava parte de la masa atómica del átomo de carbono 12.

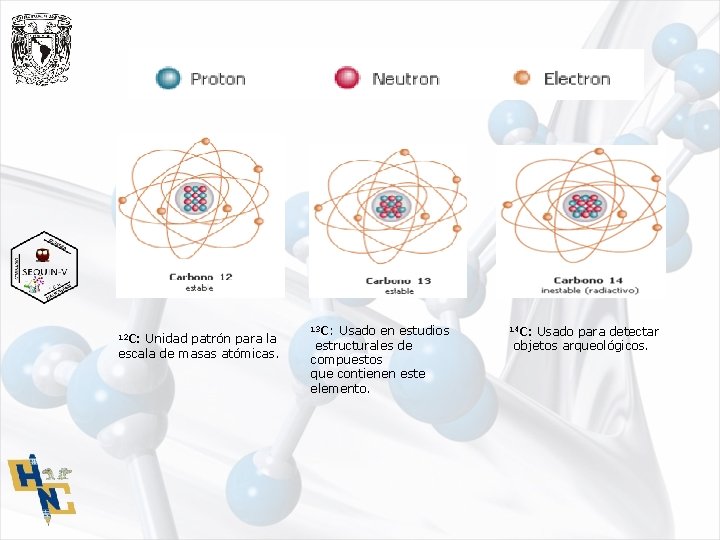
12 C: Unidad patrón para la escala de masas atómicas. 13 C: Usado en estudios estructurales de compuestos que contienen este elemento. 14 C: Usado para detectar objetos arqueológicos.

• Masa molecular es la masa de una molécula, medida en u. Es la suma de las masas de los átomos que forman la molécula. Ejemplo: La masa molecular del agua H 2 O es: H = 1. 0 u X 2 = 2. 0 u O= 16 u X 1 = 16. 0 u Masa molecular del agua = 18. 0 u • El término masa molecular se debe reservar para las sustancias que existen en forma de moléculas; al referirse a compuestos iónicos y a otros en los que no existen moléculas es preferible utilizar la expresión masa fórmula. • Ejemplo el Na. Cl no forma moléculas, lo hace en redes cristalinas.


Masa molar es la masa, en gramos, de un mol de sus moléculas. La masa fórmula de un compuesto iónico es la masa, en unidades de masa atómica, de una unidad fórmula. Su masa molar es la masa, en gramos, de un mol de unidades fórmula. Determinación de masas atómicas, masa molecular, masa molar y masa fórmula. Etanol, C₂H₅OH, un compuesto covalente. 2 átomos de carbono 2 X 12. 0 u = 24. 00 u 6 átomos de hidrógeno 6 X 1. 00 u = 6. 00 u 1 átomo de oxígeno 1 X 16. 0 u = 16. 00 u Masa molecular de C₂H₅OH 46. 00 u Masa de un mol de moléculas de C₂H₅OH = 46 g Masa molar del C₂H₅OH = 46. 0 g/mol

Cloruro de calcio, Ca. Cl₂, un compuesto iónico 1 átomo de calcio 2 átomos de cloro 1 X 40. 1 u = 40. 1 u 2 X 35. 5 u = 71. 0 u Masa molecular de Ca. Cl₂ = 111. 1 u Masa fórmula de Ca. Cl₂ = 111. 1 u Masa de un mol de unidades fórmula de Ca. Cl₂ = 111. 1 g Masa molar del cloruro de calcio = 111. 1 g/mol

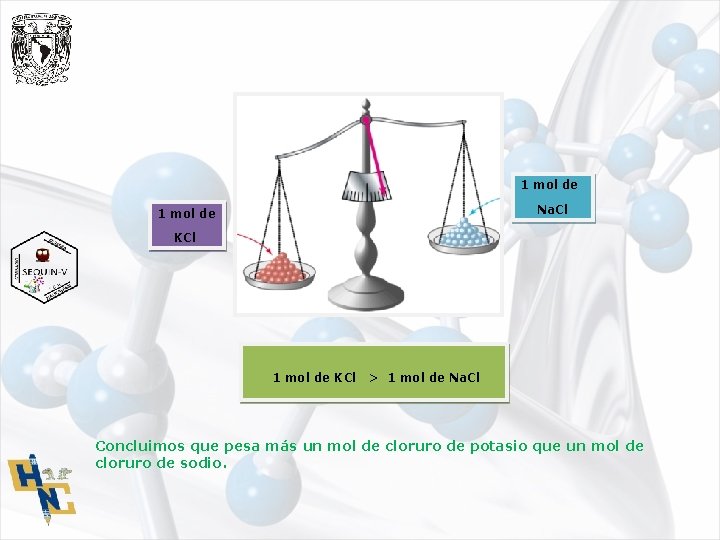
El profesor plantea la siguiente pregunta ¿Qué pesa más? Un mol de cloruro de potasio o un mol de cloruro de sodio. El KCl Cloruro de potasio, es un compuesto iónico. 1 átomo de potasio 2 átomos de cloro 1 X 39. 0 u = 39. 0 u 1 X 35. 5 u = 35. 5 u Masa fórmula del KCl = 74. 5 u Masa de un mol de unidades fórmula del KCl = 74. 5 g Masa molar del KCl = 74. 5 g/mol Na. Cl Cloruro de sodio, es un compuesto iónico. 1 átomo de sodio 1 átomo de cloro Masa fórmula del Na. Cl 1 X 23. 0 u = 23. 0 u 1 X 35. 5 u = 58. 5 u Masa de un mol de unidades fórmula del Na. Cl = 58. 5 g Masa molar del Na. Cl = 58. 5 g/mol

1 mol de Na. Cl 1 mol de KCl > 1 mol de Na. Cl Concluimos que pesa más un mol de cloruro de potasio que un mol de cloruro de sodio.














