TEMA 4 INTRODUCCIN AL ANLISIS VOLUMTRICO Asignatura Anlisis








![G. Curva de valoración [Valorante] ó [Analito] Representación gráfica de la variación de la G. Curva de valoración [Valorante] ó [Analito] Representación gráfica de la variación de la](https://slidetodoc.com/presentation_image_h2/3a79113ff811200c12735da8bdb0c019/image-12.jpg)














- Slides: 30

TEMA 4: INTRODUCCIÓN AL ANÁLISIS VOLUMÉTRICO Asignatura: Análisis Químico Grado: Bioquímica Curso académico: 2011/12 N. Campillo Seva 1

1. 2. 3. 4. 5. 6. Definición de análisis volumétrico Terminología Tipos de volumetrías Preparación de disoluciones Características de los métodos volumétricos Principios y cálculos en análisis volumétrico 2 N. Campillo Seva

1. DEFINICIÓN DE ANÁLISIS VOLUMÉTRICO Métodos Clásicos de Análisis Cuantitativo - Valoraciones Volumétricas - Valoraciones Gravimétricas En una volumetría se añaden incrementos de la disolución del reactivo (valorante) a la disolución de analito hasta que la reacción química se haya completado. Analito + A Reactivo R Producto AR Al medir de forma exacta el volumen de reactivo, de concentración perfectamente conocida, necesario para reaccionar completamente con el analito contenido en la muestra Conoceremos la cantidad de analito 3 N. Campillo Seva

MONTAJE UTILIZADO EN ANÁLISIS VOLUMÉTRICO Nivel de valorante Pinza de bureta Bureta Llave Matraz erlenmeyer (vaso de precipitados mejor si agitamos con varilla) Disolución de analito Barra de agitación magnética F 1 Agitador magnético N. Campillo Seva 4

2. TERMINOLOGÍA A. Disolución estándar de reactivo (agente valorante) Disolución de concentración perfectamente conocida B. Proceso: ¿En qué consiste una volumetría? Disolución estándar de reactivo Agregamos disolución estándar de reactivo al medio de valoración ¿Hasta cuando? F 1 Hasta que la reacción se haya completado F 2 Disolución de analito 5 N. Campillo Seva

C. Punto de equivalencia Resultado ideal (teórico) que se busca en toda valoración Punto en el que la cantidad de valorante añadida es: químicamente equivalente a la cantidad de analito ó la necesaria para que reaccione estequiométricamente con el analito Ejemplo: 2 KMn. O 4 + 16 HCl → 2 Mn. Cl 2 + 5 Cl 2 + 8 H 2 O + 2 KCl Valorante (púrpura) Analito (incoloro) Si el problema contiene ácido clorhídrico 16 moles, el punto de equivalencia se alcanza cuando hayan sido añadidos 2 moles de permanganato potásico D. Punto final En realidad no se mide el punto de equivalencia sino el punto final, que es “el cambio físico, observado en el medio de valoración, asociado a la condición de equivalencia” Para el ejemplo anterior: el punto final podría ser detectado por la aparición brusca en el medio de valoración del color púrpura del valorante. En este caso, el punto final no puede coincidir exactamente con el de equivalencia: se necesita un pequeño exceso de KMn. O 4 para detectar su color. 6 N. Campillo Seva

E. Error de valoración = Diferencia entre el volumen de valorante necesario para detectar el punto final y el necesario para alcanzar la condición de equivalencia Situación ideal Volumen punto final = Volumen punto de equivalencia Error de valoración = 0 El error de valoración es prácticamente inevitable ¿Cómo minimizarlo? Escogiendo una propiedad física cuyo cambio sea fácilmente observable Estimación del error de valoración: valoración del blanco (se lleva a cabo el mismo protocolo de valoración pero sin el analito) Para el ejemplo de valoración de HCl con KMn. O 4, se valora una disolución que no contiene HCl, midiendo el volumen de reactivo necesario para detectar el color púrpura, y restando este volumen del obtenido en la valoración del HCl. 7 N. Campillo Seva

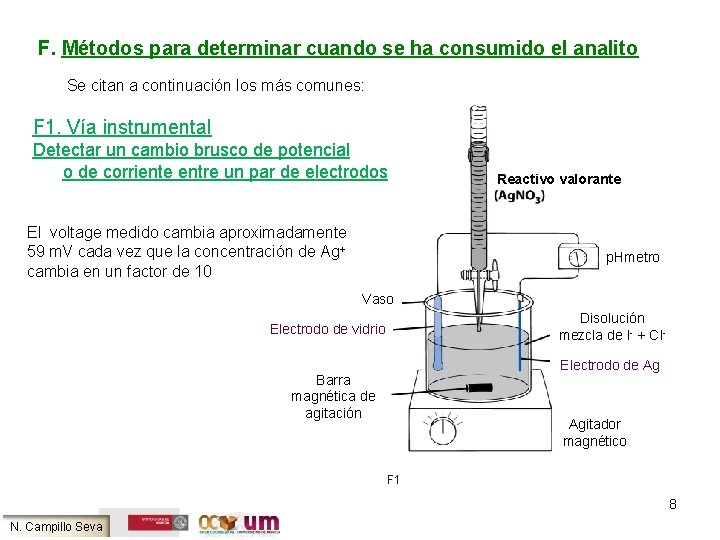
F. Métodos para determinar cuando se ha consumido el analito Se citan a continuación los más comunes: F 1. Vía instrumental Detectar un cambio brusco de potencial o de corriente entre un par de electrodos El voltage medido cambia aproximadamente 59 m. V cada vez que la concentración de Ag+ cambia en un factor de 10 Reactivo valorante p. Hmetro Vaso Disolución mezcla de I- + Cl- Electrodo de vidrio Electrodo de Ag Barra magnética de agitación Agitador magnético F 1 8 N. Campillo Seva

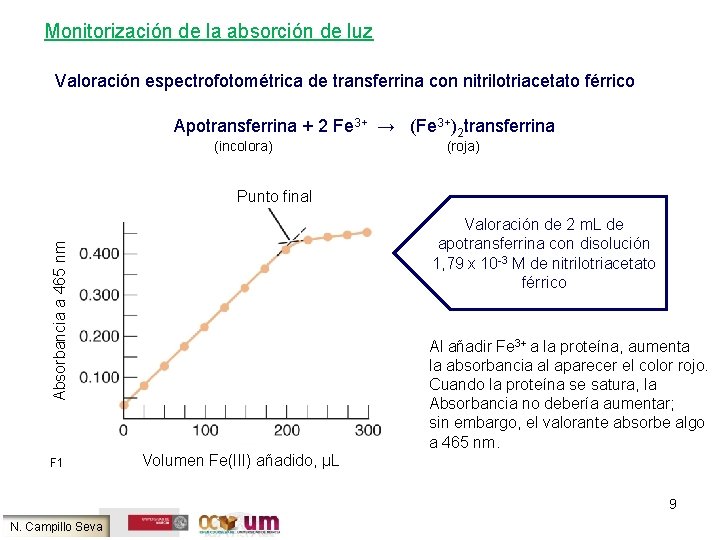
Monitorización de la absorción de luz Valoración espectrofotométrica de transferrina con nitrilotriacetato férrico Apotransferrina + 2 Fe 3+ → (Fe 3+)2 transferrina (incolora) (roja) Punto final Absorbancia a 465 nm Valoración de 2 m. L de apotransferrina con disolución 1, 79 x 10 -3 M de nitrilotriacetato férrico F 1 Al añadir Fe 3+ a la proteína, aumenta la absorbancia al aparecer el color rojo. Cuando la proteína se satura, la Absorbancia no debería aumentar; sin embargo, el valorante absorbe algo a 465 nm. Volumen Fe(III) añadido, μL 9 N. Campillo Seva

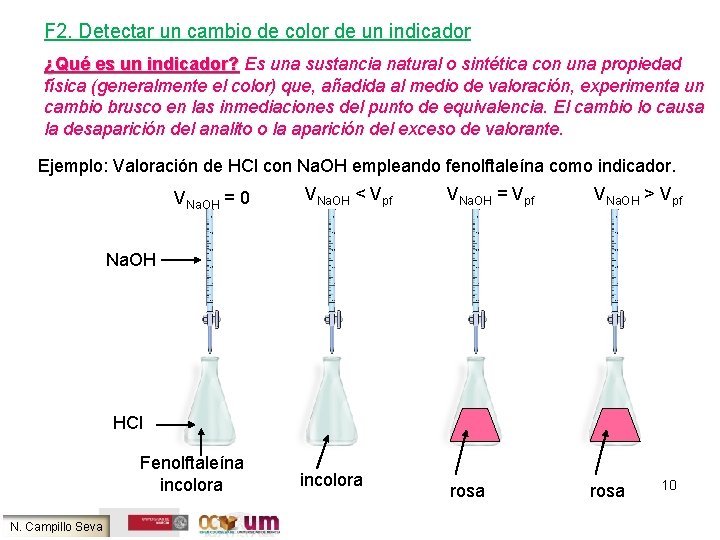
F 2. Detectar un cambio de color de un indicador ¿Qué es un indicador? Es una sustancia natural o sintética con una propiedad física (generalmente el color) que, añadida al medio de valoración, experimenta un cambio brusco en las inmediaciones del punto de equivalencia. El cambio lo causa la desaparición del analito o la aparición del exceso de valorante. Ejemplo: Valoración de HCl con Na. OH empleando fenolftaleína como indicador. VNa. OH = 0 VNa. OH < Vpf VNa. OH = Vpf VNa. OH > Vpf rosa Na. OH HCl Fenolftaleína incolora N. Campillo Seva incolora 10

Tipos de indicadores: Pueden clasificarse de acuerdo a que tipo de reacción química esté relacionada con el cambio de color Indicadores ácido-base: fenolftaleína Indicadores redox: difenilamino sulfonato bárico Ciertos indicadores responden a más de un tipo de reacción Indicadores metalocrómicos: negro de eriocromo T Indicadores de precipitación: K 2 Cr. O 4, indicadores de adsorción 11 N. Campillo Seva
![G Curva de valoración Valorante ó Analito Representación gráfica de la variación de la G. Curva de valoración [Valorante] ó [Analito] Representación gráfica de la variación de la](https://slidetodoc.com/presentation_image_h2/3a79113ff811200c12735da8bdb0c019/image-12.jpg)
G. Curva de valoración [Valorante] ó [Analito] Representación gráfica de la variación de la concentración de uno de los reactivos con la adición de reactivo valorante Volumen de valorante añadido Estas concentraciones varían en varios órdenes de magnitud; por tanto, resulta más útil representar la función p: p. Analito = - log 10 [Analito] p. Valorante = - log 10 [Valorante] 12 N. Campillo Seva

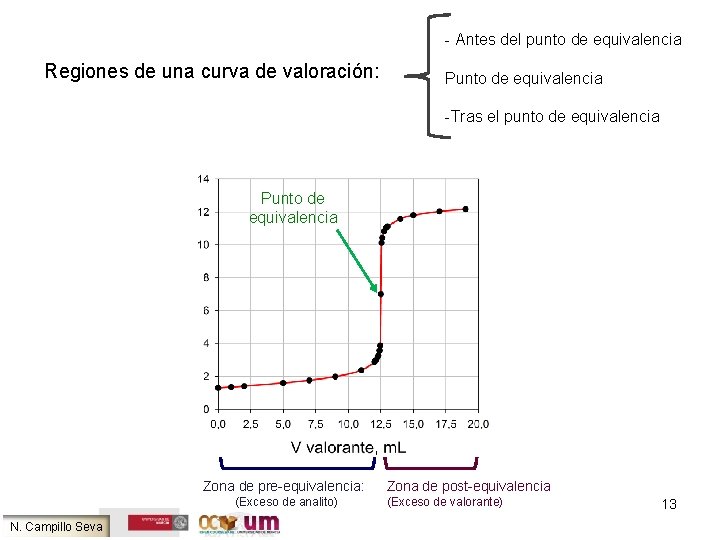
- Antes del punto de equivalencia Regiones de una curva de valoración: Punto de equivalencia -Tras el punto de equivalencia Punto de equivalencia Zona de pre-equivalencia: (Exceso de analito) N. Campillo Seva Zona de post-equivalencia (Exceso de valorante) 13

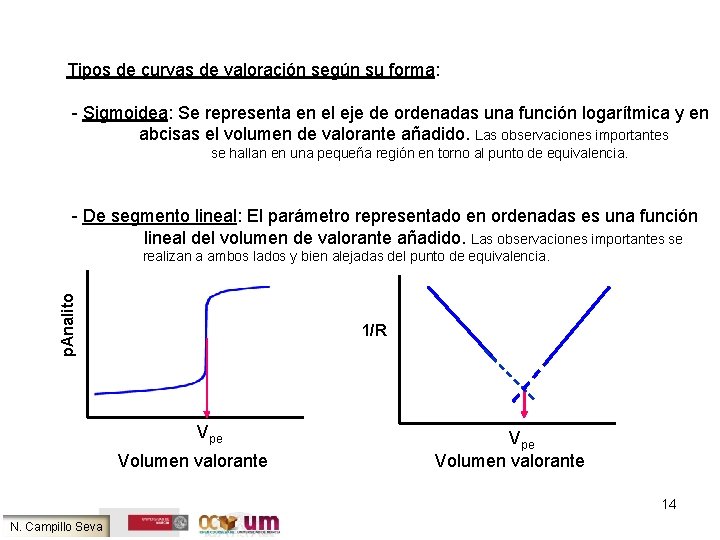
Tipos de curvas de valoración según su forma: - Sigmoidea: Se representa en el eje de ordenadas una función logarítmica y en abcisas el volumen de valorante añadido. Las observaciones importantes se hallan en una pequeña región en torno al punto de equivalencia. - De segmento lineal: El parámetro representado en ordenadas es una función lineal del volumen de valorante añadido. Las observaciones importantes se p. Analito realizan a ambos lados y bien alejadas del punto de equivalencia. 1/R Vpe Volumen valorante 14 N. Campillo Seva

Para trazar la curva de valoración: 1º. Se estudia como varían las concentraciones de valorante y/o analito a lo largo de la valoración. 2º. Se aplican las ecuaciones adecuadas que predicen la curva de valoración EXISTEN 2 RAZONES PARA SABER TRAZAR LAS CURVAS DE VALORACIÓN: • Ayudan a comprender las reacciones químicas que tienen lugar en cada momento de la valoración. • Para saber controlar las condiciones experimentales que influyen en la calidad de una valoración: – Por ejemplo, en las volumetrías ácido-base es necesario conocer el p. H en el punto de equivalencia para seleccionar el indicador apropiado. 15 N. Campillo Seva

3. TIPOS DE VOLUMETRÍAS 3 A. Según el tipo de reacción química implícita en la valoración: • Ácido-base: acidimetrías y alcalimetrías H+ + OH(Ácido) H 2 O (Base) • Oxidación-reducción: transferencia de electrones Red 1 + (Oxidante) • Complejación M (Metal) Ox 2 Ox 1 + Red 2 (Reductor) + L Complejo (ML) (Ligando) • Precipitación Cl- + Ag+ N. Campillo Seva Ag. Cl(s) 16

Requisitos necesarios en una reacción química para poder ser aplicada como reacción de valoración en una volumetría • • Sencilla: La reacción entre el analito y el valorante debe ser simple, ya que es la base de los cálculos. Rápida: para llevar a cabo la volumetría en poco tiempo. Estequiométrica: para los cálculos ha de existir una reacción definida. Completa: permitiendo así realizar los cálculos. Además ha de disponerse de : • Una disolución patrón del reactivo valorante. • Un sistema de detección del punto final. • Material de medida exacta: buretas, pipetas aforadas y balanzas análíticas. 17 N. Campillo Seva

3 B. Según el procedimiento seguido para llevar a cabo la valoración: 3 tipos ● Valoración directa Se aplica siempre que sea posible El valorante se añade al analito hasta completar la reacción química Analito (A) + Reactivo (R) → Producto (P) ● Valoración por retroceso Su aplicación es deseable ocasionalmente. ¿Cúando? ● Si la detección de su punto final es más clara que la de la valoración directa. ● Cuando se necesita un exceso del 1 er reactivo para que se de por completo la reacción con el analito. ● Si la reacción de la valoración directa no es favorable, por ejemplo tiene una cinética lenta. A + R 1 (en exceso conocido) → P + R 1 que no ha reaccionado Se valora con un 2º reactivo estándar (R 2) Equivalentes de R 1 totales añadidos = Equivalentes de R 1 invertidos en formar P + Equivalentes de R 1 valorados con R 2 18 N. Campillo Seva

Ejemplo de valoración por retroceso A: Analito: C 2 O 42 R 1: Reactivo añadido en exceso conocido: Mn. O 45 C 2 O 4 2 -+ 2 Mn. O 4 - + 16 H+ → 10 CO 2 + 2 Mn 2+ + 8 H 2 O + (Mn. O 4 - sobrante) R 2: Segundo reactivo para la valoración del Mn. O 4 - sobrante: Fe 2+ Mn. O 4 - (sobrante) + 5 Fe 2+ + 8 H+ → Mn 2+ + 5 Fe 3+ + 4 H 2 O Equivalentes totales de Mn. O 4 - = Equivalentes de Fe 2+ + equivalentes de C 2 O 4 2 - Única incógnita de la ecuación 19 N. Campillo Seva

● Valoración por sustitución o por desplazamiento Se basan en la sustitución de un ión por otro. Su campo de aplicación más importante se halla en las valoraciones de iones metálicos con el ligando AEDT (volumetrías de complejación): Mn+ + Mg. Y 2 - → MY(n-2)+ + Mg 2+ (Analito) El equilibrio se halla desplazado hacia la derecha pues el complejo MY(n-2)+ es más estable que el de magnesio con EDTA (Mg. Y 2 -) Los iones magnesio liberados se valoran con disolución estándar de EDTA: Mg 2+ + Y 4 - → Mg. Y 2 - 20 N. Campillo Seva

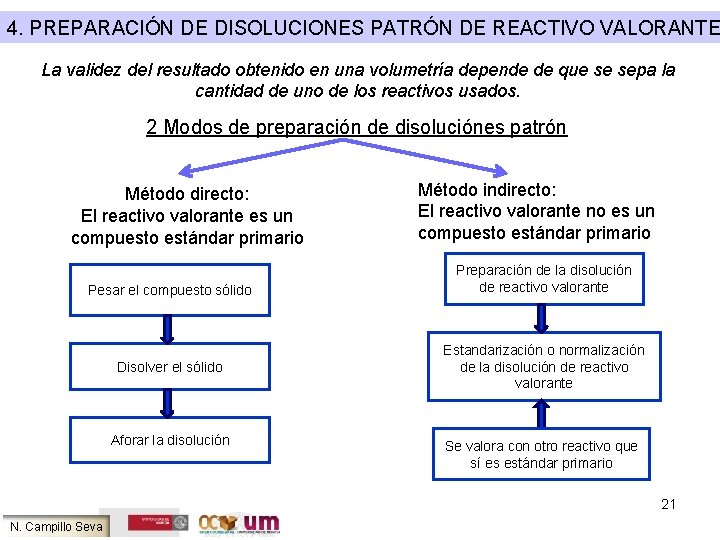
4. PREPARACIÓN DE DISOLUCIONES PATRÓN DE REACTIVO VALORANTE La validez del resultado obtenido en una volumetría depende de que se sepa la cantidad de uno de los reactivos usados. 2 Modos de preparación de disoluciónes patrón Método directo: El reactivo valorante es un compuesto estándar primario Pesar el compuesto sólido Disolver el sólido Aforar la disolución Método indirecto: El reactivo valorante no es un compuesto estándar primario Preparación de la disolución de reactivo valorante Estandarización o normalización de la disolución de reactivo valorante Se valora con otro reactivo que sí es estándar primario 21 N. Campillo Seva

¿Qué es una sustancia tipo estándar primario o patrón? Sustancia que presenta determinadas características que garantizan el conocimiento exacto de la concentración de sus disoluciones por pesada directa, disolución y aforo. Generalmente son sólidos y presentan la siguientes características: a. Composición conocida: Se conoce tanto su estructura como los elementos que la componen b. Elevada pureza (igual o mayor del 99, 9%) c. Estabilidad atmosférica: no es una sustancia higroscópica, ni reacciona con O 2, H 2 O o CO 2, entre otros gases. No debe descomponerse en las condiciones normales de almacenamiento. d. Ausencia de agua de hidratación, para que la composición del sólido no cambie con las variaciones de humedad. e. Elevada masa molar con el fin de minimizar el error relativo al pesar el patrón. f. Solubilidad razonable en el medio de valoración. g. Es deseable que su coste sea moderado. 22 N. Campillo Seva

El número de compuestos que cumplen los 7 requisitos simultáneamente es bajo: K 2 Cr 2 O 7, EDTA, biftalato potásico, Na 2 CO 3, Mg. CO 3, Na. NO 2, KNO 3, KIO 3, Na 2 C 2 O 4, KH(IO 3)2… Permiten la preparación de la disolución estándar de forma directa: 1. Se pesa en balanza de precisión una cantidad exacta del estándar primario 3. Se lleva a un volumen final en un matraz aforado 2. Se disuelve en un disolvente adecuado 250 m. L F 1 3, 2542 g K 2 Cr 2 O 7 M=294, 18 g/mol N. Campillo Seva F 2 F 3 C = 13, 0168 g/L= 0, 0442 M 23

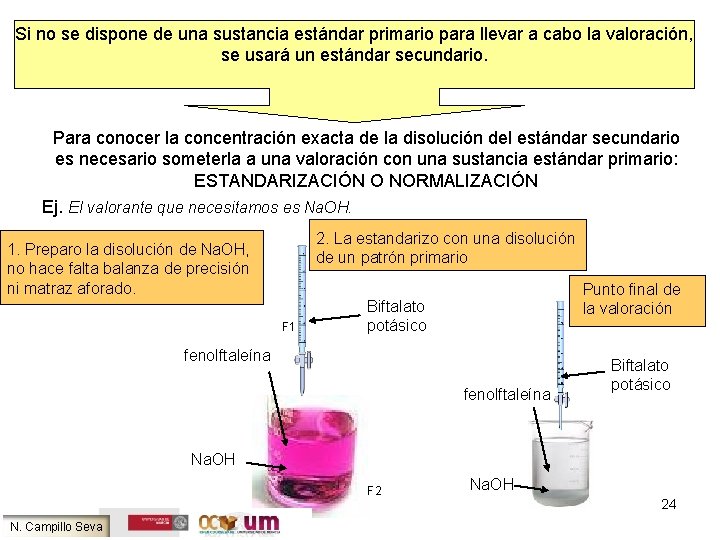
Si no se dispone de una sustancia estándar primario para llevar a cabo la valoración, se usará un estándar secundario. Para conocer la concentración exacta de la disolución del estándar secundario es necesario someterla a una valoración con una sustancia estándar primario: ESTANDARIZACIÓN O NORMALIZACIÓN Ej. El valorante que necesitamos es Na. OH. 2. La estandarizo con una disolución de un patrón primario 1. Preparo la disolución de Na. OH, no hace falta balanza de precisión ni matraz aforado. F 1 Punto final de la valoración Biftalato potásico fenolftaleína Biftalato potásico Na. OH F 2 N. Campillo Seva Na. OH 24

PROPIEDADES DE UNA DISOLUCIÓN PATRÓN (YA SEA PREPARADA DIRECTAMENTE O ESTANDARIZANDO CON UN PATRÓN SECUNDARIO) 1. Ser suficientemente estables, como para que sólo sea necesario determinar su concentración una vez (en ocasiones es necesaria su estandarización antes de cada uso) 2. Reaccionar rápidamente con el analito, reduciendo el tiempo requerido entre adiciones de valorante. 3. Reaccionar estequiométricamente con el analito. 4. Reaccionar completamente con el analito, obteniendo puntos finales bien definidos. 5. Reaccionar selectivamente con el analito. 25 N. Campillo Seva

5. CARACTERÍSTICAS ANALÍTICAS DE LOS MÉTODOS VOLUMÉTRICOS Selectividad: directamente relacionada con las características de la reacción química de valoración y con el tipo de indicador. Sensibilidad: estos métodos se usan para análisis de componentes mayoritarios (10 -2 M). Exactitud: directamente relacionada con las operaciones de pesada y medidas con el material volumétrico; en general son bastante exactos. Precisión: directamente relacionada con la habilidad del laborante, generalmente buena (2%). Rapidez: son métodos relativamente rápidos, sencillos y fácilmente automatizables. Diferentes métodos oficiales de análisis se basan en técnicas volumétricas, por ejemplo el método Kjeldahl. 26 N. Campillo Seva

6. PRINCIPIOS Y CÁLCULOS EN ANÁLISIS VOLUMÉTRICO En análisis volumétrico deben considerarse los siguientes principios generales: 1. La muestra pesada no debe ser menor de 0, 1 g. 2. El volumen de valorante consumido debe encontrarse entre 10 y 20 m. L (dependiendo de la escala de la bureta). Si el volumen es muy pequeño, el error de lectura y de drenaje de la bureta no será despreciable. 3. El volumen de la disolución de analito no debe ser tan grande como para volver a llenar la bureta para completar la valoración. Eso implicaría un aumento en el error de lectura y drenaje de la bureta. 4. La concentración del reactivo valorante debe seleccionarse de acuerdo con el tamaño de la muestra y el material a emplear. 5. Debe llevarse a cabo la valoración del blanco del indicador cuando sea posible. Si el valorante ha sido normalizado mediante la misma reacción de valoración de la muestra, el error del indicador queda anulado. 6. El análisis debe fundamentarse en los resultados de al menos tres valoraciones en estrecha concordancia. 27 N. Campillo Seva

CÁLCULOS EN ANÁLISIS VOLUMÉTRICO En volumetrías directas: En el punto de equivalencia nº Equivalentes A = nº equivalentes de R VA • N A = V R • N R Paso clave: Relacionar los moles de valorante con los moles de analito Veamos algún ejemplo: 1. Para la valoración de 50 m. L de una disolución de ácido clorhídrico se necesitaron 29, 7 m. L de una disolución de hidróxido bárico preparada pesando 0, 0897 g del producto sólido y disolviéndolo en 250 m. L. El punto final de la valoración se detectó usando verde de bromocresol como indicador. Calcula la molaridad de la disolución de ácido clorhídrico. 2 HCl + Ba(OH)2 → H 2 O + Ba. Cl 2 1 mol de valorante reacciona con 2 moles de analito 28 N. Campillo Seva

Cálculo de la concentración del reactivo valorante: Cálculo de los moles de valorante añadidos hasta el punto final: Relación moles de valorante y moles de analito: 1 mol de Ba(OH)2 → 2 moles de HCl 6, 2 x 10 -5 → x 1, 24 x 10 -4 moles de HCl contenidos en 50 m. L SOLUCIÓN: 2, 48 x 10 -3 M N. Campillo Seva 29

CRÉDITOS DE LAS ILUSTRACIONES – PICTURES COPYRIGHTS -Logo Portada OCW-UM. Autor: Universidad de Murcia. Dirección web: http: //ocw. um. es. -Página 4, F 1. Fuente: “Quantitative Chemical Analysis”, Seventh Edition, © 2007 W. H. Freeman and Company. -Página 5, F 1. Autor: Mysid (original by Quantockgoblin. Dirección web: http: //commons. wikimedia. org/wiki/File: burette. svg -Página 5, F 2. Dirección web: http: //commons. wikimedia. org/wiki/File: Chemistry_flask_matthew_02. svg -Página 8 y 9, F 1. Fuente: “Quantitative Chemical Analysis”, Seventh Edition, © 2007 W. H. Freeman and Company. -Página 23, F 1. Página 8, F 1. Autor: Leandro Maranghetti Lourenco. Dirección web: http: //commons. wikimedia. org/wiki/File: Balance-Na. Cl-1 mol. jpg -Página 23, F 2. Autor: Andrés Díaz. Dirección web: http: //commons. wikimedia. org/wiki/File: Vaso_precipitados. jpg -Página 23, F 3. Autor: Padleckas. Dirección web: http: //commons. wikimedia. org/wiki/File: Volumetric_flask. PNG -Página 24, F 1. Autor: Mysid (original by Quantockgoblin. Dirección web: http: //commons. wikimedia. org/wiki/File: burette. svg -Página 24, F 2. Dirección web: http: //4. bp. blogspot. com/_axpy. Cj 3 jbgo/SXdt 9 z. R 3 LEI/AAAAAEA/EJUy. NDGXSs. A/s 320/100 px-Phenolphthalein-at-p. H -9%5 B 1%5 D. jpg 30 N. Campillo Seva
 Introduccin
Introduccin Introduccin
Introduccin Introducción de enzimas
Introducción de enzimas Introduccin
Introduccin Introduccin
Introduccin Introduccin
Introduccin Nombre de la asignatura
Nombre de la asignatura Anlisis foda
Anlisis foda Analisis foda maxi mini ejemplos
Analisis foda maxi mini ejemplos Que es el radio
Que es el radio Pica asignatura
Pica asignatura Anlisis de riesgos
Anlisis de riesgos Nombre de la asignatura
Nombre de la asignatura Mga asignatura sa ikatlong baitang
Mga asignatura sa ikatlong baitang Foda de recursos humanos
Foda de recursos humanos Nombre curso fecha
Nombre curso fecha Amenazas de una empresa ejemplos
Amenazas de una empresa ejemplos Nombre de asignatura
Nombre de asignatura Anlisis financiero
Anlisis financiero Cual es el enfoque de formacion civica y etica
Cual es el enfoque de formacion civica y etica Ejemplos de temas delimitados
Ejemplos de temas delimitados Subtema
Subtema Entrevista estructurada caracteristicas
Entrevista estructurada caracteristicas Aliran seni lukis tertua di dunia adalah
Aliran seni lukis tertua di dunia adalah Tema-tema teologi perjanjian lama
Tema-tema teologi perjanjian lama Romeo y julieta tema
Romeo y julieta tema Imaji puisi gadis peminta minta
Imaji puisi gadis peminta minta Vreau sa joc lucian blaga comentariu
Vreau sa joc lucian blaga comentariu Sacramentos
Sacramentos Et grundskud perspektivering
Et grundskud perspektivering Stratený robot literarny druh
Stratený robot literarny druh