MOL Mol es un numero dicho numero es





























- Slides: 40

MOL: Mol es un numero, dicho numero es 6. 02 1023. Este número también se conoce como numero de Avogadro. Así podemos hablar de: 1 mol de vasos 6. 02 1023 vasos 1 mol de sillas 6. 02 1023 sillas 1 mol de electrones 6. 02 1023 electrones 1 mol de átomos 6. 02 1023 átomos 1 mol de moléculas 6. 02 1023 moléculas

HIPÓTESIS DE AVOGADRO: El concepto de mol se debe a Avogadro. Este concepto establece que volúmenes iguales de gases a las mismas condiciones de presión y temperatura contienen el mismo numero de partículas.

PESO ATÓMICO: Es el peso en gramos de una mol de átomos de un elemento químico. Por ejemplo; el peso atómico del fierro es 55. 85 grs/mol, lo que significa que 6. 02 1023 átomos de fierro pesan 55. 85 grs. PESO MOLECULAR: Peso molecular es el peso de una mol ó 6. 02 1023 moléculas de una sustancia. El peso molecular del oxigeno es de 32 grs/mol, ya que una molécula de oxigeno se compone de dos átomos de este elemento. PESO FORMULAR: En ocasiones no es posible hablar de peso molecular ya que el compuesto no es de esta naturaleza. Por ejemplo, el Na. Cl consiste de iones sodio y iones cloruro alternados en una estructura cristalina. En este caso, hablamos de peso formular (58. 45 grs/mol) que significa el peso de una mol (6. 02 1023) de unidades reticulares que forman parte de la estructura cristalina del compuesto.

n=m/M n=número de moles m=masa de la sustancia en gramos M=Peso atómico, molecular o formular del elemento o compuesto. m=250 grs. de plata n=250 grs/107. 87 grs/mol=2. 32 mol de Ag m=1. 5 Kgs de Na. Cl=1500 grs Na. Cl n=1500 grs/58. 45 grs/mol=25. 66 mol de Na. Cl

ECUACIONES QUÍMICAS: Una ecuación química es una expresión de la ley de la conservación de la masa, la cual establece que: "la materia no puede ser creada o destruida sino únicamente se transforma". En términos químicos, esta ley de la conservación de la materia indica que en una reacción química los productos que desaparecen, deben aparecer en otra forma diferente y equivalente a la masa o materia de los productos transformados. masa de reactivos=masa de productos

Para que las reacciones químicas estén de acuerdo con la ley de la conservación de la materia , la ecuación química debe estar balanceada. Una ecuación química esta balanceada cuando el numero de átomos de cada elemento que intervienen en la reacción es el mismo en productos y reactivos 4 Fe. S 2 + 11 O 2 2 Fe 2 O 3 + 8 SO 2 Reactivos Productos

Las masas relativas de cada uno de los componentes que intervienen en la reacción química es: 4 Fe. S 2 + 11 O 2 2 Fe 2 O 3 + 8 SO 2 479. 4 + 352 831. 4 grs 319. 4 + 512 831. 4 grs

Ejercicio: Balancee la siguiente ecuación química y realice un balance de materia entre productos y reactivos. C 3 H 8 + O 2 CO 2 + H 2 O

Ecuación balanceada. C 3 H 8 + 5 O 2 3 CO 2 + 4 H 2 O Balance de materia: C 3 H 8 + 5 O 2 3 CO 2 + 4 H 2 O 44 grs + 160 grs 204 grs = 132 grs + 72 grs = 204 grs

GASES IDEALES Los gases ideales son aquellos que siguen ciertas leyes (Boyle, Charles, Gay Lussac, ley general del estado gaseoso, etc) y que no dependen en su comportamiento de la naturaleza del gas. Estas leyes las obedece cualquier gas como: CO 2, H 2 O, CH 4, O 2, N 2, He, H 2, etc.

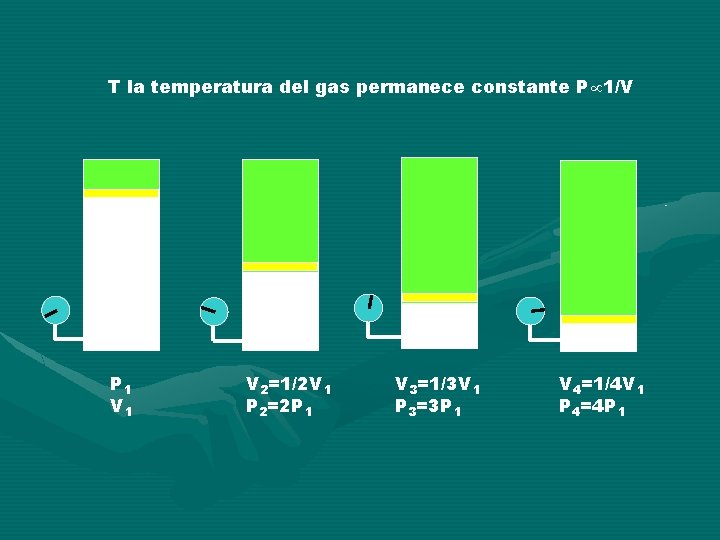
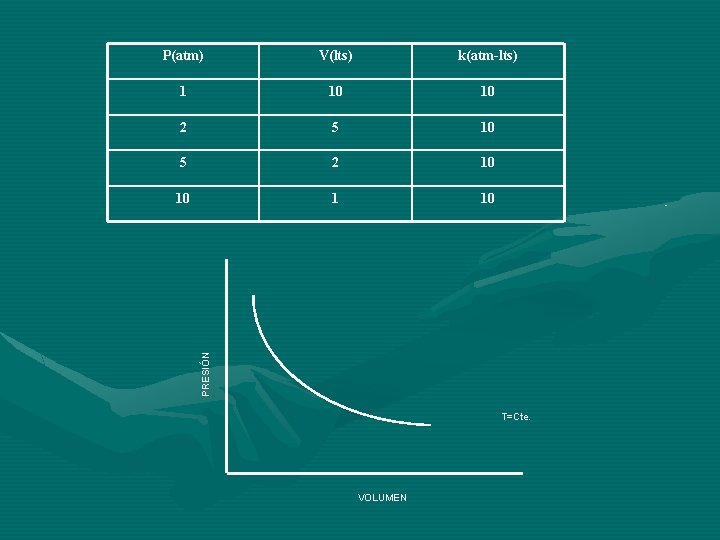
LEY DE BOYLE: Para una masa fija de gas, si la temperatura permanece constante, la presión varía en forma inversamente proporcional a como lo hace el volumen. Si el volumen aumenta, la presión disminuye en forma proporcional. Si el volumen disminuye la presión aumenta en la misma proporción. P 1/V P=k/V PV=k=Constante P 1 V 1=P 2 V 2=P 3 V 3=. . . Pn. Vn Siempre y cuando n=Cte y t=Cte. k= (t)

T la temperatura del gas permanece constante P 1/V P 1 V 2=1/2 V 1 P 2=2 P 1 V 3=1/3 V 1 P 3=3 P 1 V 4=1/4 V 1 P 4=4 P 1

V(lts) k(atm-lts) 1 10 10 2 5 10 5 2 10 10 1 10 PRESIÓN P(atm) T=Cte. VOLUMEN

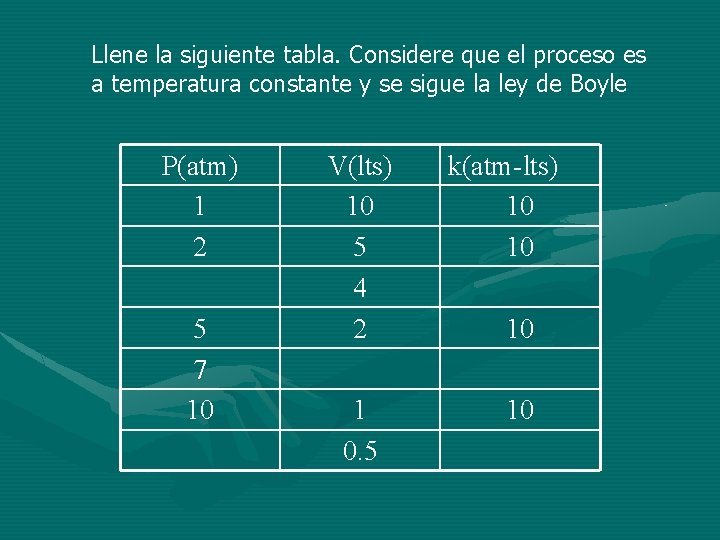
Llene la siguiente tabla. Considere que el proceso es a temperatura constante y se sigue la ley de Boyle P(atm) 1 2 5 7 10 V(lts) 10 5 4 2 1 0. 5 k(atm-lts) 10 10

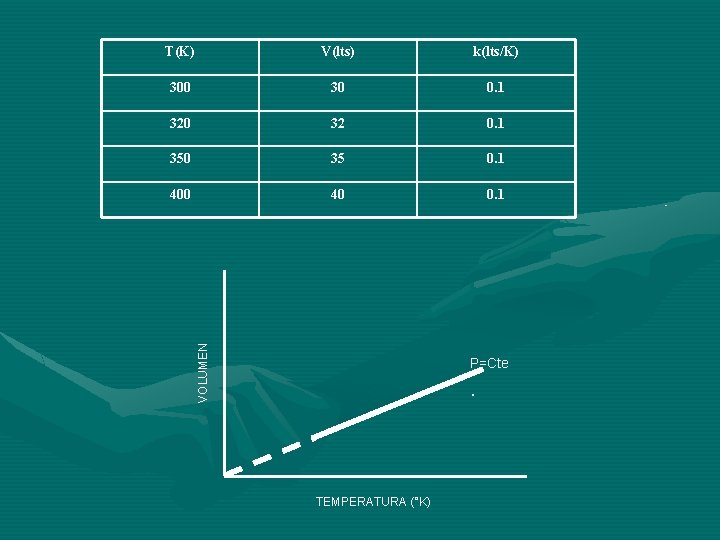
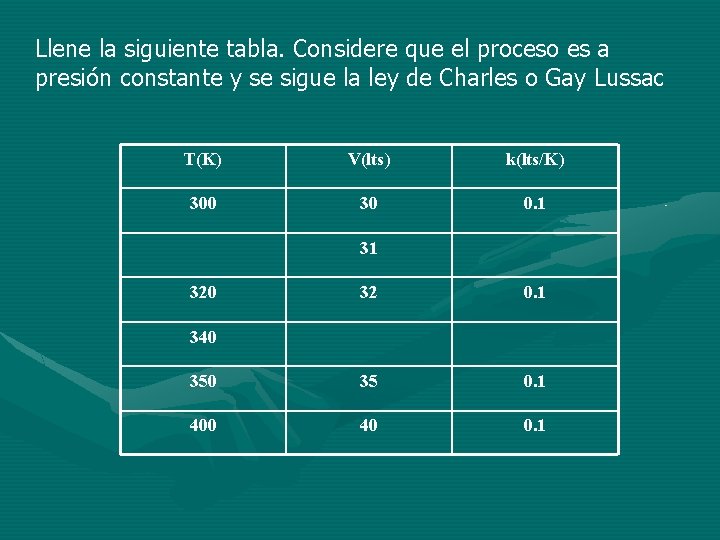
La ley de Charles o Gay Lussac establece que a presión constante el volumen del gas varia directamente con la temperatura absoluta. Si la temperatura en ºK aumenta, el volumen del gas aumenta en la misma proporción y si la temperatura en ºK disminuye, el volumen del gas también disminuye en la misma proporción. V T V=k. T V/T=k=Constante V 1/T 1=V 2/T 2=V 3/T 3=. . . Vn/Tn Siempre y cuando n=Cte y P=Cte. k= (P)

P la presión del gas permanece constante V T V 1 T 2=1. 5 T 1 V 2=1. 5 V 1 T 3=2 T 1 V 3=2 V 1 T 4=4 V 1 V 4=4 V 1

V(lts) k(lts/K) 300 30 0. 1 320 32 0. 1 350 35 0. 1 400 40 0. 1 VOLUMEN T(K) P=Cte . TEMPERATURA (°K)

Llene la siguiente tabla. Considere que el proceso es a presión constante y se sigue la ley de Charles o Gay Lussac T(K) V(lts) k(lts/K) 300 30 0. 1 31 320 32 0. 1 350 35 0. 1 400 40 0. 1 340

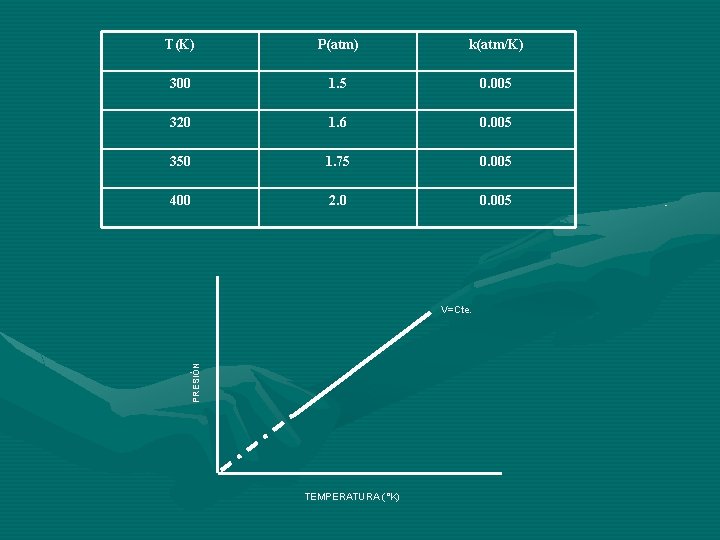
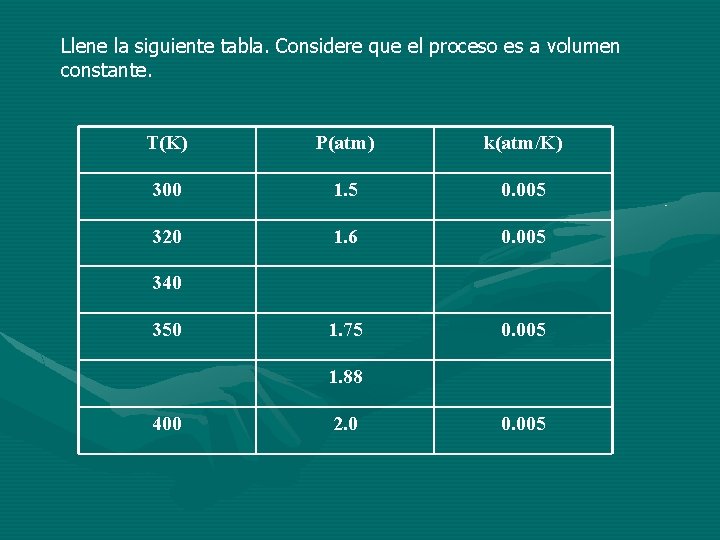
También y como consecuencia de las anteriores relaciones, es posible establecer una relación que es: a volumen constante, la presión varía en forma directamente proporcional con la temperatura absoluta, esto es, si permanece sin cambio el volumen y la masa de gas, la presión varia proporcionalmente con la temperatura absoluta. P T P=k. T P/T=k=Constante P 1/T 1=P 2/T 2=P 3/T 3=. . . Pn/Tn Siempre y cuando n=Cte y V=Cte k= (V)

V el volumen del gas permanece constante P T P 1 T 2=1. 1 T 1 P 2=1. 1 P 1 T 3=1. 5 V 1 P 3=1. 5 P 1 T 4=2 T 1 P 4=2 P 1

T(K) P(atm) k(atm/K) 300 1. 5 0. 005 320 1. 6 0. 005 350 1. 75 0. 005 400 2. 0 0. 005 PRESIÓN V=Cte. TEMPERATURA (°K)

Llene la siguiente tabla. Considere que el proceso es a volumen constante. T(K) P(atm) k(atm/K) 300 1. 5 0. 005 320 1. 6 0. 005 1. 75 0. 005 340 350 1. 88 400 2. 0 0. 005

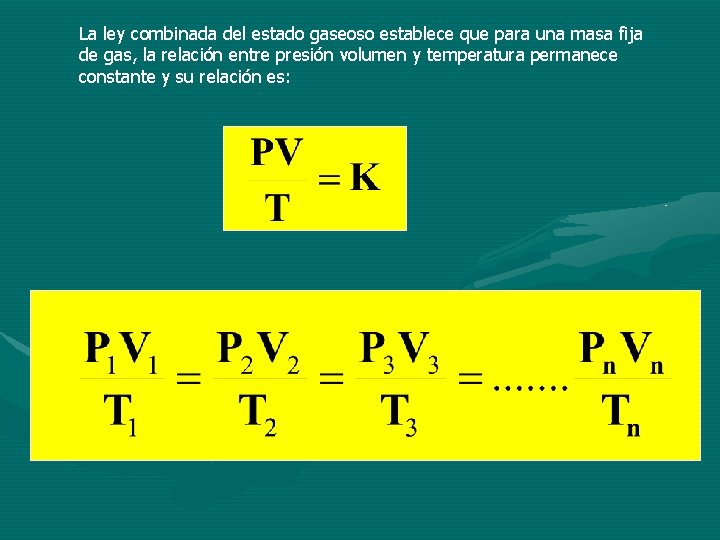
La ley combinada del estado gaseoso establece que para una masa fija de gas, la relación entre presión volumen y temperatura permanece constante y su relación es:

En esta relación T, la temperatura deberá ser temperatura absoluta. Si sustituimos K, la constante por n. R tenemos: Ecuación general del estado gaseoso PV=n. RT

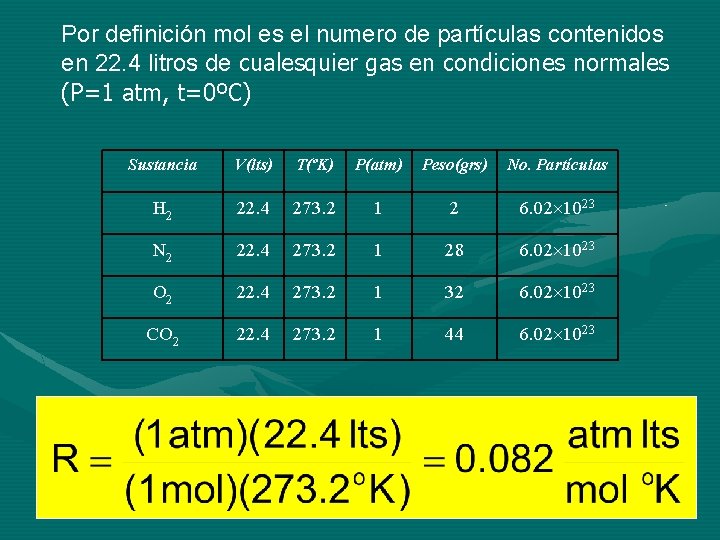
Por definición mol es el numero de partículas contenidos en 22. 4 litros de cualesquier gas en condiciones normales (P=1 atm, t=0ºC) Sustancia V(lts) T(ºK) P(atm) Peso(grs) No. Partículas H 2 22. 4 273. 2 1 2 6. 02 1023 N 2 22. 4 273. 2 1 28 6. 02 1023 O 2 22. 4 273. 2 1 32 6. 02 1023 CO 2 22. 4 273. 2 1 44 6. 02 1023

Una vez encontrado el valor de R se puede establecer la siguiente relación para los gases ideales: PV=n. RT Esta relación se conoce como ley general del estado gaseoso y es aplicable para cualesquier gas que se comporte como gas ideal. Ejemplo: cuantos gramos de metano estarán contenidos en un recipiente de 50 litros a una presión de 2 atm. a 300ºK. n=PV/RT=(2 atm 50 lts)/(0. 082 atm-lts/molºK 300ºK) =4. 065 moles n=m/M m=Mn=16 grs/mol 4. 065 mol=65. 04 grs

Densidad o peso especifico de un gas: PV=n. RT y n=m/M Sustituyendo n en la ecuación PV=n. RT PV=(m/M)RT PV/RT=m/M m/M=PV/RT m/V=d=densidad=PM/RT Ejemplo: cual es la densidad del nitrógeno en condiciones normales (CN, P=1 atm, T=273. 2ºK) d=(1 atm 28 grs/mol)/(0. 082 atm-lts/molºK 273. 2ºK)=1. 25 grs/lto

Ejemplo: Cual es la densidad del aire a 0ºC y P=1800 mm Hg P=2. 368 atm M=28. 84 grs/mol T=273. 2ºK d=PM/RT d=(2. 368 atm)×(28. 84 grs/mol)/(0. 082 atm-lts/molºK)(273. 2ºK) d=3. 048 grs/lto

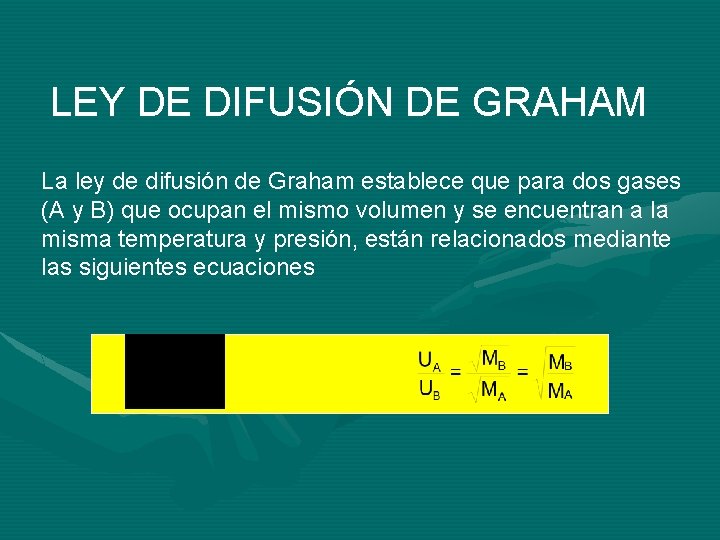
LEY DE DIFUSIÓN DE GRAHAM La ley de difusión de Graham establece que para dos gases (A y B) que ocupan el mismo volumen y se encuentran a la misma temperatura y presión, están relacionados mediante las siguientes ecuaciones

s, la distancia promedio que recorre una molécula para difundirse es la misma para el gas A y para el gas B, si escapan del mismo recipiente U=Velocidad de difusión del gas M=Peso molecular del gas s=distancia recorrida por el gas t=tiempo que tarda en difundirse el gas d=densidad del gas Ejercicio: demuestre que si la presión y la temperatura de los gases A y B es la misma entonces la relación de densidades es igual a la relación de pesos moleculares

MEZCLAS DE GASES IDEALES Para una gas que contiene una mezcla gaseosa de los gases A, B, C. . . se tienen las siguientes relaciones: nt=n. A+n. B+n. C+. . . . Dividiendo ambos miembros de la ecuación por nt el numero total de moles: nt/nt=n. A/nt+n. B/nt+n. C/nt+. . . . =1 Por definición Xi=ni/nt=fracción mol del componente i n. A/nt+n. B/nt+n. C/nt+. . . . =1 y XA+XB+XC+. . . . =1 %molar de A=(n. A/nt) 100= XA 100 %molar de B=(n. B/nt) 100= XB 100 %molar de C=(n. C/nt) 100= XC 100

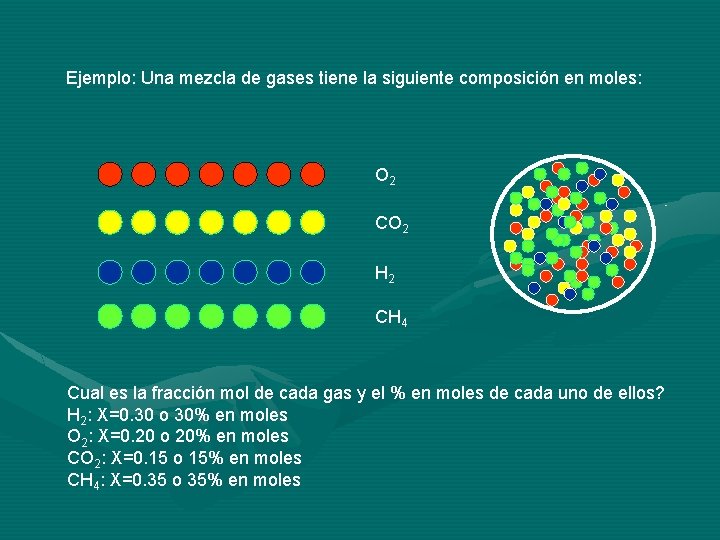
Ejemplo: Una mezcla de gases tiene la siguiente composición en moles: O 2 CO 2 H 2 CH 4 Cual es la fracción mol de cada gas y el % en moles de cada uno de ellos? H 2: X=0. 30 o 30% en moles O 2: X=0. 20 o 20% en moles CO 2: X=0. 15 o 15% en moles CH 4: X=0. 35 o 35% en moles

m. A+m. B+m. C+. . . . =mt Como ni=mi/Mi, donde: ni=numero de moles del componente i mi=masa del componente i Mi=Peso molecular del componente i mi=ni. Mi Mt=n. AMA+n. BMB+n. CMC+. . . . Dividiendo ambos miembros de la ecuación entre nt el numero total de moles nt. Mt/nt=n. AMA/nt+n. BMB/nt+n. CMC/nt+. . . . Mt=XAMA+XBMB+XCMC+. . . . =Mp Mt=Mp=Peso Molecular Promedio de la mezcla gaseosa

Cual es el peso molecular promedio de la mezcla gaseosa que tiene la siguiente composición: H 2: X=0. 30 ó 30% en moles O 2: X=0. 20 ó 20% en moles CO 2: X=0. 15 ó 15% en moles CH 4: X=0. 35 ó 35% en moles Mt=XAMA+XBMB+XCMC+. . . . =Mp Mp=(0. 30× 2 grs/mol)+ (0. 20× 32 grs/mol)+(0. 15× 44 grs/mol)+ (0. 35× 16 grs/mol) Mp=12. 86 grs/mol

LEY DE DALTON: Primera Expresión. - La presión total de una mezcla gaseosa, es igual a la suma de las presiones parciales de cada uno de los componentes de esta mezcla. Pt=PA+PB+PC+. . . . Segunda Expresión. - La presión parcial que ejerce un componente de una mezcla gaseosa, es igual a la presión que ejercería dicho componente si él ocupase solo, todo el volumen del recipiente. Pi=ni. RT/V PA=n. ART/V PB=n. BRT/V PC=n. CRT/V Pero V=nt. RT/Pt y PA=n. ART/{nt. RT/Pt} y eliminando RT de la ecuación: PA=n. A/nt. Pt=XAPt de igual manera PB=XBPt y PC=XCPt En general: Pi=Xi. Pt Tercera Expresión. - La presión parcial de un gas en una mezcla gaseosa es igual a la fracción mol de dicho componente, multiplicado por la presión total.

LEY DE AMAGAT: Primera Expresión. - El volumen total de un gas en una mezcla gaseosa es igual a la suma de los volúmenes individuales de cada gas que forma parte de dicha mezcla. Vt=VA+VB+VC+. . . . Segunda Expresión. - El volumen parcial que ocupa un gas en una mezcla gaseosa, es igual al volumen que ocuparía dicho gas, si el solo ejerciera toda la presión (la presión total) en dicha mezcla gaseosa Vi=ni. RT/Pt También VA=n. ART/Pt VB=n. BRT/Pt VC=n. CRT/Pt Pero Pt=nt. RT/Vt y VA=n. ART/{nt. RT/V} y eliminando RT de la ecuación: VA=n. A/nt. V=XAV de igual manera VB=XBV y VC=XCV En general Vi=Xi. V

Nota. - Obsérvese que Vi/V=Xi, esto es, la fracción volumen es igual a la fracción mol. Como la fracción mol multiplicada por cien es igual al porcentaje en moles y la fracción volumen multiplicada por cien es igual al porcentaje en volumen, entonces: (Vi/V) 100=Xi 100=% en moles Porcentaje en volumen=Porcentaje en moles Tercera Expresión: El volumen parcial de un gas en una mezcla gaseosa, es igual a la fracción mol del componente, multiplicado por el volumen total de la mezcla gaseosa.

Humedad Relativa: La humedad relativa está relacionada de la siguiente manera: =Pv/Pv* = Humedad relativa Pv= Presión de vapor del agua P*v= Presión de vapor del agua en condiciones de saturación a la temperatura de la mezcla gaseosa. El porcentaje de humedad es: % Humedad= (100)

Ejemplo: Se tiene oxigeno con agua a 20ºC y el porcentaje de humedad del gas es de 55%. Cual es la humedad relativa y la presión del vapor de agua. A 20ºC P*v la presión del vapor de agua en condiciones de saturación es de 17. 4 mm Hg. Entonces: =55/100=0. 55 =Pv/P*v y despejando Pv=0. 55× 17. 4 mm Hg=9. 57 mm Hg Si la presión total es de 750 mm de Hg cual es la presión de cada gas: Pt=PO 2 + PH 2 O =750 mm Hg PO 2 =750 -9. 57=740. 43 mm Hg PH 2 O=9. 57 mm Hg

PRESIÓN MANOMÉTRICA, PRESIÓN ATMOSFÉRICA Y PRESIÓN ABSOLUTA: La presión manométrica es aquella que se registra en un manómetro o instrumento de medición de presión. La presión atmosférica es aquella que ejerce el aire del medio ambiente sobre todos los cuerpos que se encuentran en la superficie de la tierra. De acuerdo a esto tenemos la siguiente definición: Presión Absoluta=Presión Atmosférica + Presión Manométrica. Pabs. =Patm. + Pman. 550 0 Pabs=Patm+ Pman Patm=760 mm Hg Pman=0 mm Hg Patm=760 mm Hg Pman=550 mm Hg Pabs=760 mm Hg Pabs=1310 mm Hg