CONCEPTO DE MOL Y NUMERO DE AVOGADRO MASA



















- Slides: 25

CONCEPTO DE MOL Y NUMERO DE AVOGADRO

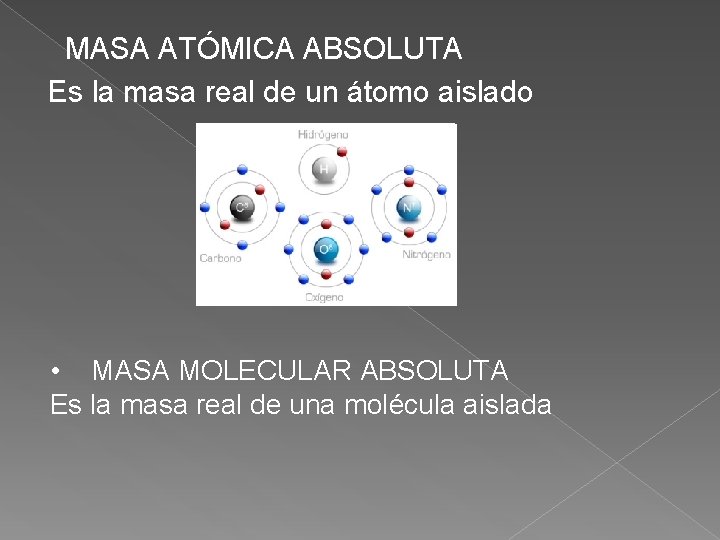
MASA ATÓMICA ABSOLUTA Es la masa real de un átomo aislado • MASA MOLECULAR ABSOLUTA Es la masa real de una molécula aislada

Determinar estas masas absolutas no tiene aplicación práctica. No es posible pesar un átomo aislado, o una molécula aislada, pero si se puede determinar la masa de una partícula con la de otra tomada como patrón.

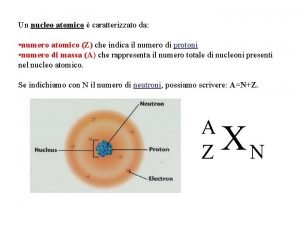
La masa atómica Micro-mundo Átomos y moléculas Macro-mundo Gramos En 1962 se fija como patrón de comparación el isótopo más abundante del C (12 C) al cual se le asigna una masa de 12, 000 uma. La masa atómica es la masa de un átomo en unidades de masa atómica (u. m. a. ), esto se mide más fácilmente respecto a la masa de un átomo estándar. u. m. a. = 1/12 masa 12 C Una u (uma) es la masa equivalente a la masa de la doceava parte de un átomo de carbono 12. Equivale a 1, 66 · 10– 24 g. 12 C = 12 uma 56 Fe = 55, 935 u 18 O = 17, 9972 uma

Indican cuantas veces más pesado es, en promedio, el átomo de un elemento o la molécula de una sustancia, en comparación con la uma. El O tiene mat=15, 9998 significa que el átomo de O es 15, 9998 veces más pesado que la uma.

El peso atómico de un elemento se calcula hallando la masa media ponderada de la masa de todos los isótopos del mismo. El Litio se encuentra en la naturaleza como (isótopos): 7, 42% 6 Li (6, 015 uma) 92, 58% 7 Li (7, 016 uma) Masa atómica promedio del Litio 7, 42 x 6, 015 + 92, 58 x 7, 016 100 = 6, 941 uma

Estos son los valores que figuran en la tabla periódica y surgen del promedio de todos los isótopos naturales del elemento considerado.

Masa molecular relativa La Mr se obtiene sumando los pesos atómicos de todos los átomos que componen la molécula. Ejemplo: Calcular la masa molecular del H 2 SO 4 M (H 2 SO 4) = 1, 008 u · 2 + 32, 06 u · 1 + 16, 00 u · 4 = 98, 076 u que es la masa de una molécula.

Número de Avogadro (NA ) El número real de átomos en 12 g de C-12 se ha determinado experimentalmente y es igual a 6, 0221376. 1023 partículas elementales. Se denomina Número de Avogadro (NA ) y el valor comúnmente aceptado es: 23 6, 02. 10

MOL: unidad química para representar cantidad de materia (átomos, moléculas, iones, electrones, etc. ) = número de átomos que hay en exactamente 12 g de C 12 1 mol = NA = 6. 0221367 x 1023 Número de Avogadro (NA)

El Mol El mol es la cantidad de sustancia de un sistema que contiene tantas entidades elementales (átomos, moléculas, iones. . . ) como átomos hay en 12 g de carbono-12 (12 C). 6. 022 x 10²³ átomos de Cu = 1 mol de átomos de Cu 6. 022 x 10²³ moléculas de NH 3 = 1 mol de moléculas de NH 3

1 mol de átomos = 6, 02. 1023 átomos 1 mol de moléculas = 6, 02. 1023 moléculas 1 mol de alumnos = 6, 02. 1023 alumnos 1 mol de flores = 6, 02. 1023 flores

6, 02 x 10 23 1

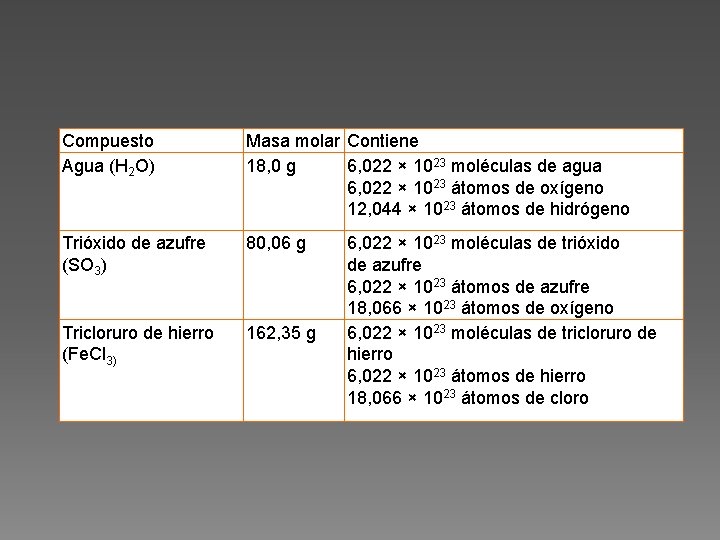
Compuesto Agua (H 2 O) Masa molar Contiene 18, 0 g 6, 022 × 1023 moléculas de agua 6, 022 × 1023 átomos de oxígeno 12, 044 × 1023 átomos de hidrógeno Trióxido de azufre (SO 3) 80, 06 g Tricloruro de hierro (Fe. Cl 3) 162, 35 g 6, 022 × 1023 moléculas de trióxido de azufre 6, 022 × 1023 átomos de azufre 18, 066 × 1023 átomos de oxígeno 6, 022 × 1023 moléculas de tricloruro de hierro 6, 022 × 1023 átomos de hierro 18, 066 × 1023 átomos de cloro


¿Qué tan grande es un mol? El número de Avogadro es más grande que la cantidad de granos de arena en las dunas del desierto. Un mol de puntos (. ) puestos uno al lado de otro igualaría el radio de nuestra galaxia. Un mol de canicas colocadas una junto a la otra podría cubrir la superficie de estados unidos con 100 km de profundidad

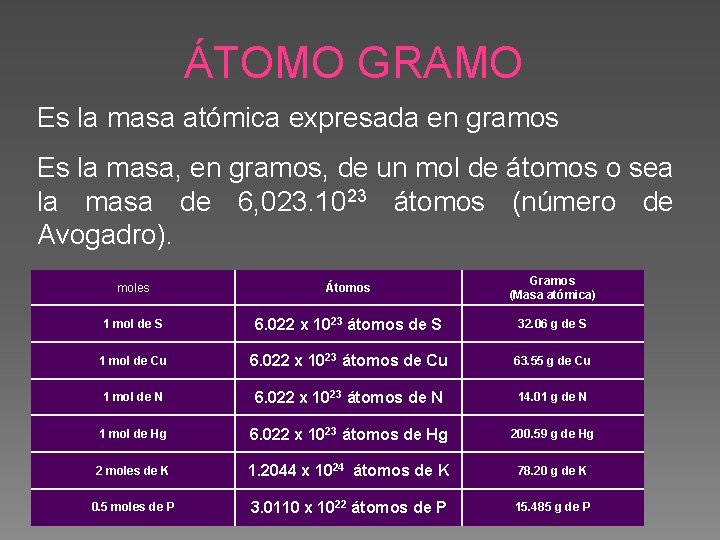
ÁTOMO GRAMO Es la masa atómica expresada en gramos Es la masa, en gramos, de un mol de átomos o sea la masa de 6, 023. 1023 átomos (número de Avogadro). moles Átomos Gramos (Masa atómica) 1 mol de S 6. 022 x 1023 átomos de S 32. 06 g de S 1 mol de Cu 6. 022 x 1023 átomos de Cu 63. 55 g de Cu 1 mol de N 6. 022 x 1023 átomos de N 14. 01 g de N 1 mol de Hg 6. 022 x 1023 átomos de Hg 200. 59 g de Hg 2 moles de K 1. 2044 x 1024 átomos de K 78. 20 g de K 0. 5 moles de P 3. 0110 x 1022 átomos de P 15. 485 g de P

MOLÉCULA-GRAMO Es la masa molecular expresada en gramos Es la masa, en gramos , de una mol de moléculas o sea la masa de 6, 023. 1023 moléculas (número de Avogadro). Ejemplos: 1) 1 mol-g H 2 O = 18 g H 2 O = 6, 022 x 1023 moléculas de H 2 O 2) 1 mol-g CO 2 = 44 g CO 2 = 6, 022 x 1023 moléculas de CO 2 3) 10 mol-g NH 3 = 170 g NH 3 = 6, 022 x 1024 moléculas de NH 3

NÚMERO DE MOLES (n) Es común tener que realizar conversiones de masa a moles y de moles a masa en cálculos en los que se usa el concepto de mol. Si queremos conocer la masa de un número determinado de moles (n) de la misma, aplicando el concepto de masa molar se tiene: n= m Mr

Si queremos saber el número de moles en 150 g de agua contenidos en un vaso, tendremos: n= m n= 150 g M 18 g/mol n= 8, 33 moles

huevos Masa molar es la masa de 1 mol de zapatos en gramos átomos 1 mol 12 C atomos = 6, 022 x 1023 atomos = 12, 00 g 1 mol de átomos de litio = 6, 941 g de Li Para un elemento unidades de masa atómica (uma) = masa molar (gramos) ¿Cuántos átomos hay en 0, 551 g de potasio (K) ? 1 mol de K = 39, 10 g K 1 mol K = 6, 022 x 1023 atoms K 8, 49 x 1021 átomos de K

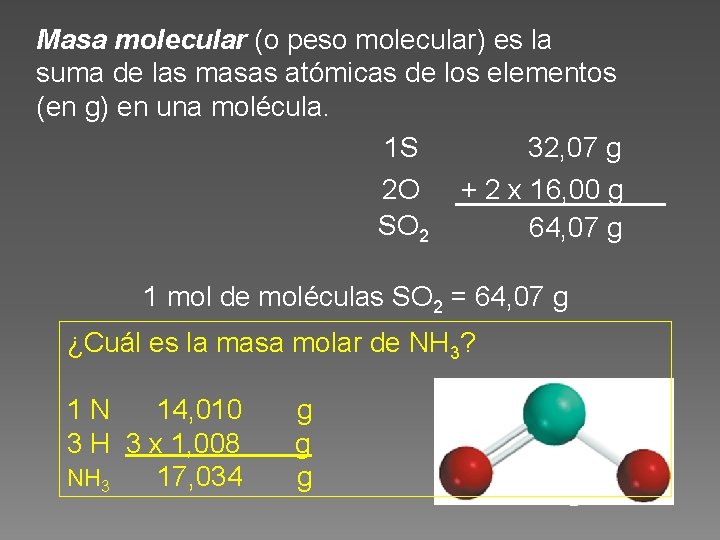
Masa molecular (o peso molecular) es la suma de las masas atómicas de los elementos (en g) en una molécula. 1 S 32, 07 g 2 O SO 2 + 2 x 16, 00 g 64, 07 g 1 mol de moléculas SO 2 = 64, 07 g ¿Cuál es la masa molar de NH 3? 1 N 14, 010 3 H 3 x 1, 008 NH 3 17, 034 g g g SO 2

¿Cuántas moléculas hay en un mol de NH 3? Como es un mol, hay 6, 02 x 1023 moléculas ¿Cuántos átomos de H hay en un mol de NH 3? Como hay 3 átomos de hidrógeno por cada molécula de NH 3, hay 3 x 6, 02 x 1023 átomos de H. ¿Cuántos moles de NH 3 hay en 50 g de NH 3? 1 mol de NH 3 tiene una masa de 17, 034 g x moles de NH 3 tiene una masa de 50 g x = 2, 94 moles

Ejercicios: Trabajo Práctico a entregar 1. - Calcule la masa en gramos de: • • 3 moles de agua 1, 8 X 1022 moléculas de CO 2 2. - ¿Cuál es la masa de un mol de C 2 H 6? • ¿cuántos moles de C e H hay? • ¿cuántas moléculas de etano hay? y • ¿cuántas de carbono e hidrógeno? 3. - Calcule los moles presentes en 170 g de: • Na. NO 3 - Ca. CO 3 - H 2 SO 4 - K 2 HP 04 - Al 2(SO 4)3 4. -¿Cuántos átomos de hidrógeno hay en 72, 5 g de C 3 H 8 O? 5. - Una cruz de plata tiene 8. 1023 moléculas. ¿Cuánto pesa la cruz? 6. - Quién tiene menos cantidad de moléculas? a) 5 g de cloro molecular, b) 5 g de monóxido de dicloro, c) 5 g de trióxido de dicloro, d) 5 g de ácido clorhídrico. continúa

7. - Calcule en número de milimoles de H 2 SO 4 en 0, 147 g. Se determinó que una muestra de un elemento puro, con masa igual a 1 g contiene 1, 5. 1022 átomos. ¿Cuál es el peso atómico del elemento? ¿De qué elemento se trata? 8. - Los átomos de hidrógeno son los más pequeños de la naturaleza. El radio de un átomo de hidrógeno es de 0, 74 ángstrom. ¿cuántos átomos de hidrógeno habría en una fila de 2, 5 cm de longitud? Nota: 1 ángstrom= 1. 10 -8 cm 9. - ¿Qué longitud va a tener la pared si utilizo el número de avogadro de ladrillos? 10. - ¿En cuál de las siguientes moléculas hay más cantidad de carbono? Justificar CH 4 (NH 4)2 CO 3 H 2 CO 3 CO 2 e. CO f. Na 2 CO 3 g. KHCO 3 h. Fe. CO 3
 Mol hesabı
Mol hesabı Stała avogadra
Stała avogadra N de avogadro
N de avogadro Numero di avogadro unità di misura
Numero di avogadro unità di misura La mole schema
La mole schema Formula minima
Formula minima G/mol to mol
G/mol to mol G/mol to mol
G/mol to mol What can be said about 1 mol ag and 1 mol au
What can be said about 1 mol ag and 1 mol au Mole to particles
Mole to particles How to calculate grams to moles
How to calculate grams to moles Masa molar
Masa molar Perkembangan hardware saat ini
Perkembangan hardware saat ini Ejercicios masa/masa
Ejercicios masa/masa Relativna molekulska masa
Relativna molekulska masa Concentración de soluciones
Concentración de soluciones Pendidikan masa kini dan masa depan
Pendidikan masa kini dan masa depan Perkembangan desain dari masa ke masa
Perkembangan desain dari masa ke masa Perkembangan mobil dari masa ke masa
Perkembangan mobil dari masa ke masa Erwin schrödinger modelo atomico
Erwin schrödinger modelo atomico Avocado avogadro
Avocado avogadro Avogadro's number
Avogadro's number How to calculate boyle's law
How to calculate boyle's law Estimating avogadro's number lab
Estimating avogadro's number lab Charles's law
Charles's law Law of combining volumes
Law of combining volumes