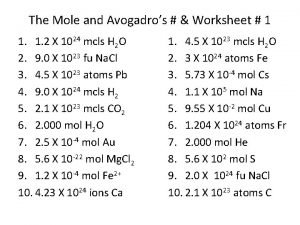
Mol och Avogadros tal En mol av en
















- Slides: 30

Mol och Avogadros tal • En mol av en substans innehåller lika många enheter (atomer, molekyler, bilar, …) som det finns atomer i 0. 012 kg kol-12, och det råkar vara Avogadro’s tal NA. • molekyler/mol • molmassan M är massan av en mol. © 2016 Pearson Education, Ltd.

Tillståndsekvationer och almänna gaslagen • Storheter som tryck, volym, temperatur, substansmängd är tillståndsvariabler eftersom de beskriver tillståndet av en substans. • Tillståndsekvationer beskriver sambandet mellan tillståndsvariabler. • Almänna gaslagen är en tillståndsekvation för en ideal gas: • Molmassan M är massan per mol. Totala massan av n mol blir då mtotal = n. M. © 2016 Pearson Education, Ltd.

© 2016 Pearson Education, Ltd.

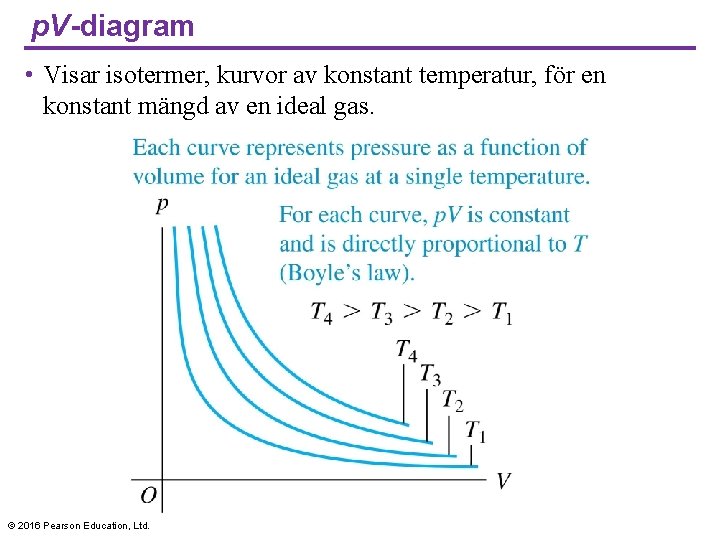
p. V-diagram • Visar isotermer, kurvor av konstant temperatur, för en konstant mängd av en ideal gas. © 2016 Pearson Education, Ltd.

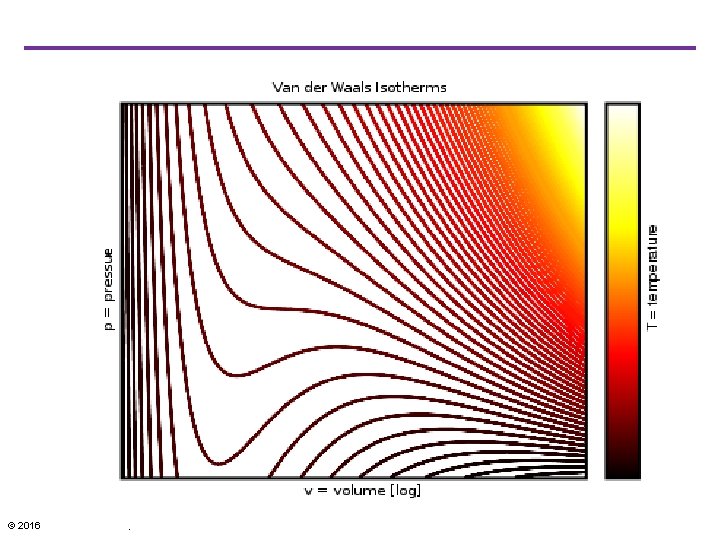
Van der Waals ekvationen • Modelen för almänna gaslagen ignorerar att varje molekyl har en viss volym och att det finns attraktiva krafter mellan dem. • Van der Waals ekvationen är mera realistisk: © 2016 Pearson Education, Ltd.

© 2016 Pearson Education, Ltd.

p. V-diagram • Ett p. V-diagram för en icke ideal gas med isotermer för olika temperaturer över och under den kritiska temperaturen Tc. • Under Tc gör gasen en fasövergång till flytande om man höjer trycket. © 2016 Pearson Education, Ltd.

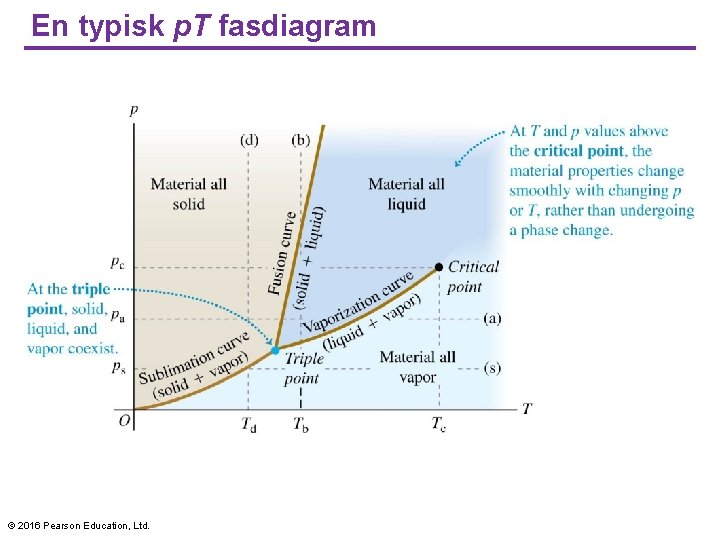
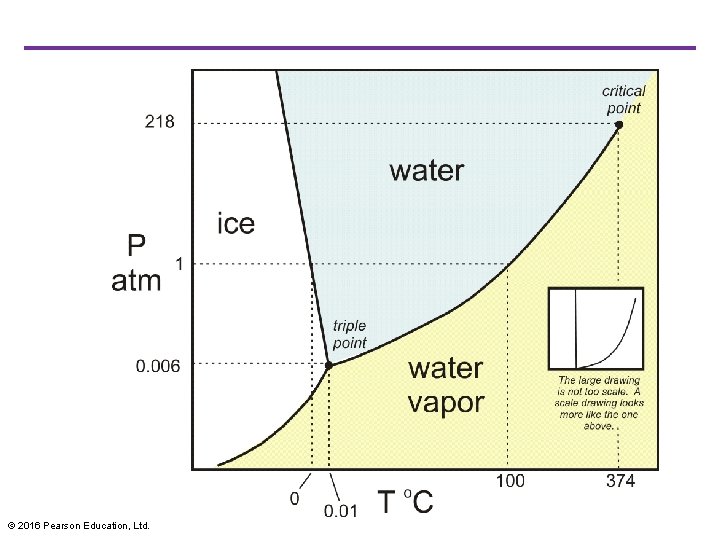
En typisk p. T fasdiagram © 2016 Pearson Education, Ltd.

© 2016 Pearson Education, Ltd.

Kinetisk molekulär model av en ideal gas • Man gör följande antaganden: 1. En behållare innehåller ett stort antal identiska molekyler. 2. Molekylerna beter sig som partiklar som är väldigt små jämfört med behållaren och jämfört medelavståndet mellan molekylerna. 3. Molekylerna är i ständig rörelse och interagerar bara genom perfekt elastiska kollisioner. 4. Behållarens väggar är perfekt elastiska, men utan att röra sig. © 2016 Pearson Education, Ltd.

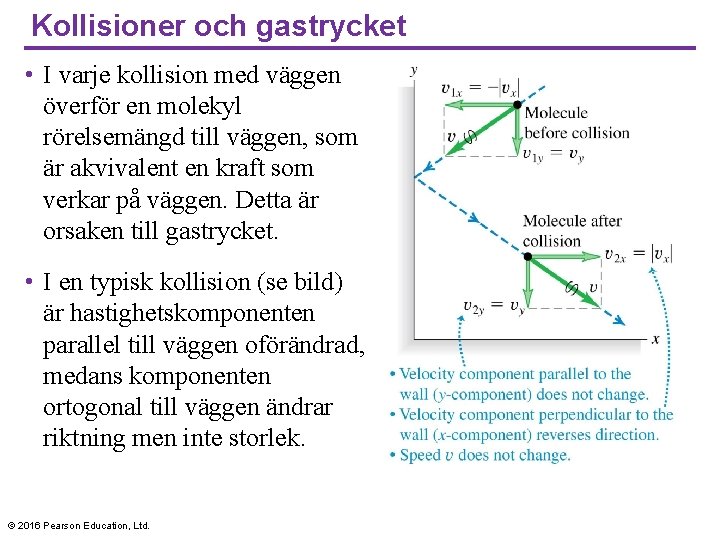
Kollisioner och gastrycket • I varje kollision med väggen överför en molekyl rörelsemängd till väggen, som är akvivalent en kraft som verkar på väggen. Detta är orsaken till gastrycket. • I en typisk kollision (se bild) är hastighetskomponenten parallel till väggen oförändrad, medans komponenten ortogonal till väggen ändrar riktning men inte storlek. © 2016 Pearson Education, Ltd.

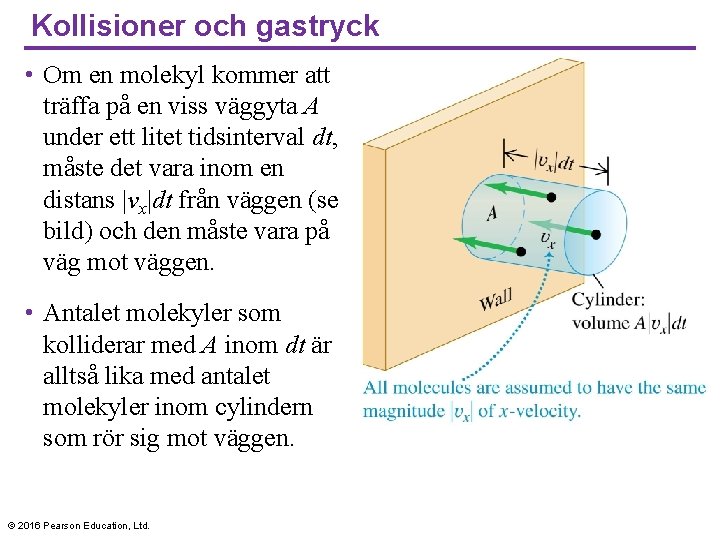
Kollisioner och gastryck • Om en molekyl kommer att träffa på en viss väggyta A under ett litet tidsinterval dt, måste det vara inom en distans |vx|dt från väggen (se bild) och den måste vara på väg mot väggen. • Antalet molekyler som kolliderar med A inom dt är alltså lika med antalet molekyler inom cylindern som rör sig mot väggen. © 2016 Pearson Education, Ltd.

Tryck och molekylernas kinetiska energi • Totala kinetiska energin Ktr av translationsröreslsen av alla gasmolekyler är proportionell den absoluta temperaturen T: • Medelvärdet av translationsenergin är alltså bara beroende på temperaturen och inte på tryck, volym och molekylsort. Per molekyl blir sambandet följande: © 2016 Pearson Education, Ltd.

Molekylära hastigheter • RMS (root-mean-square) hastigeheten av en molekyl i en gas: © 2016 Pearson Education, Ltd.

Kollisioner mellan molekyler • Vi tänker oss molekyler som kulor av radie r. • Medelfria vägen av en molekyl är medelvärdet av distansen mellan två kollisioner. • Medelvärdet av tiden mellan två kollisioner kallas medelfri tid dt. • Inom tiden dt kolliderar en molekyl av radie r med varje molekyl inom en cylinder av radie 2 r och längd v dt. © 2016 Pearson Education, Ltd.

Kollisioner mellan molekyler • Medelfri väg (mean free path): • RMS hastigheten multiplicerad medelfria tiden: • Ju fler och ju större molekylerna är, desto mindre är den medelfria vägen, men den är oberoende av hastigheten. © 2016 Pearson Education, Ltd.

Värmekapacitet av gaser • Frihetsgrader: 3 gånger antal atomer. • En ädelgasatom har 3 frihetsgrader. en diatomär gasmolekyl som kväve har 3 translationer, 2 rotationer (och en vibration). Vid vanliga temperaturer kommer vibrationen inte igång och det blir bara 5 tillgängliga frihetsgrader. Varje frihetsgrad tar upp 1/2 k. T kinetisk energi. • För en ideal monatomär gas: • För en ideal diatomär gas: © 2016 Pearson Education, Ltd.

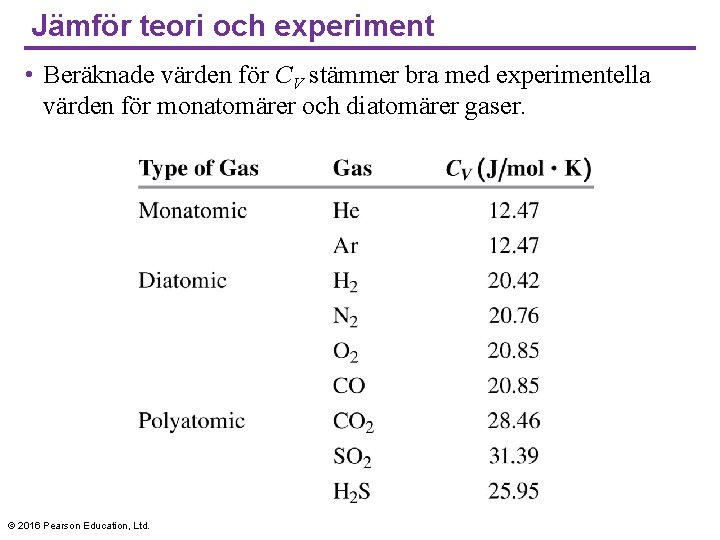
Jämför teori och experiment • Beräknade värden för CV stämmer bra med experimentella värden för monatomärer och diatomärer gaser. © 2016 Pearson Education, Ltd.

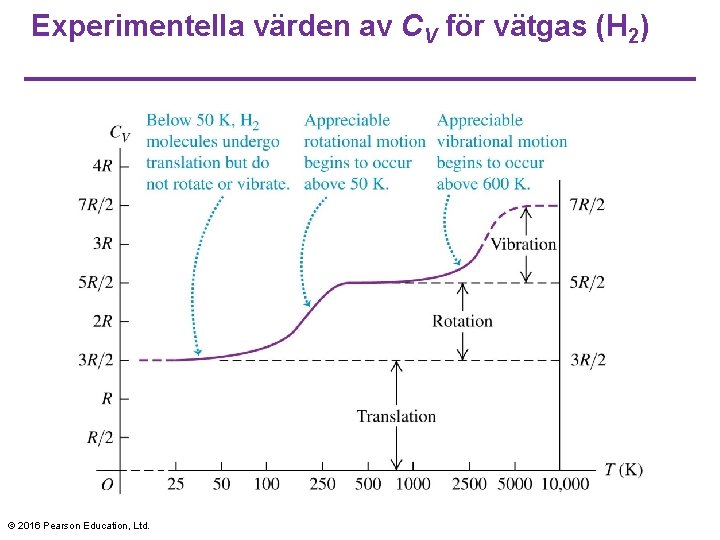
Experimentella värden av CV för vätgas (H 2) © 2016 Pearson Education, Ltd.

Värmekapacitet av fasta tillståndet • Betrakta en kristall med N identiska atomer. • Varje atom är bunden i en jämviktsposition. • Vi kan tänka os kristallen som atomer ihopkopplade genom fjädrar. • Varje atom har i medel kinetisk energi 3/2 k. T och i medel potentiell energi 3/2 k. T, eller total 3 k. T per atom. • Den molara värmekapaciteten av en kristal är: © 2016 Pearson Education, Ltd.

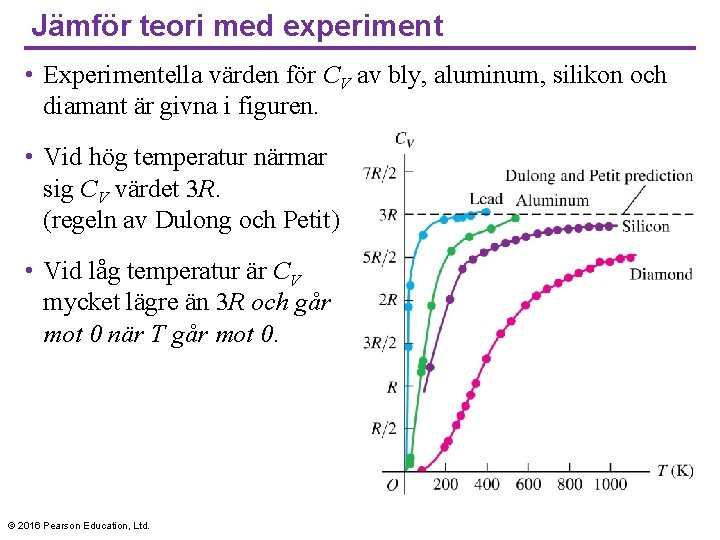
Jämför teori med experiment • Experimentella värden för CV av bly, aluminum, silikon och diamant är givna i figuren. • Vid hög temperatur närmar sig CV värdet 3 R. (regeln av Dulong och Petit) • Vid låg temperatur är CV mycket lägre än 3 R och går mot 0 när T går mot 0. © 2016 Pearson Education, Ltd.

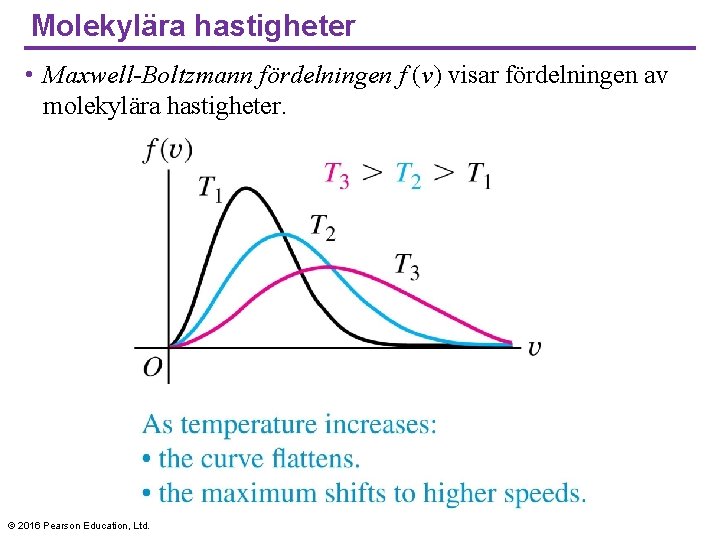
Molekylära hastigheter • Maxwell-Boltzmann fördelningen f (v) visar fördelningen av molekylära hastigheter. © 2016 Pearson Education, Ltd.

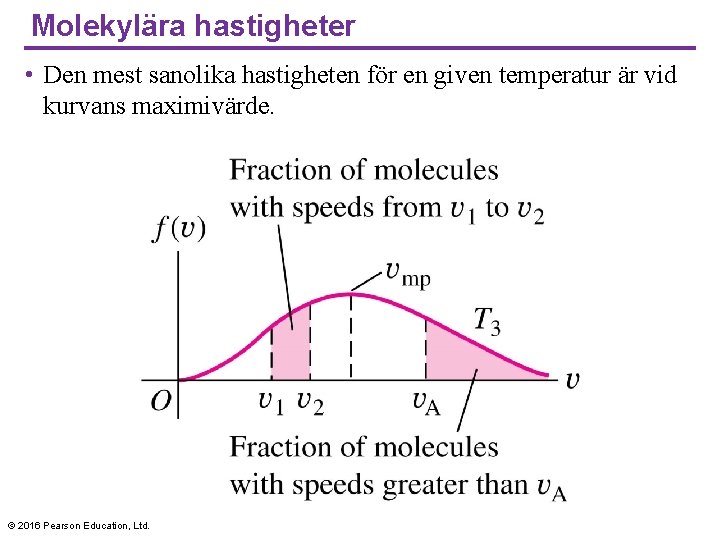
Molekylära hastigheter • Den mest sanolika hastigheten för en given temperatur är vid kurvans maximivärde. © 2016 Pearson Education, Ltd.

Molekylära hastigheter • Funktionen f (v) som beskriver distributionen av molekylära hastigheter Maxwell–Boltzmann distribution. • Den kan härledas med hjälp av statistisk mekanik. • Här är resultatet: © 2016 Pearson Education, Ltd.

Agregattillstånd av materia • För en ideal gas ignorerar vi krafterna mellan molekylerna. • Men det är just dessa interaktioner som gär att gaser kondenserar till vätskor och vätskor fryser till fasta. • Varje aggregattillstånd är stabil inom ett visst temperatur- och tryckintervall. • Övergången från ett tillstånd till ett annat kräver fasjämvikt mellan dem två faserna och för ett visst tryck är detta bara möjligt vid en specifik temperatur. • Vi kan representera dessa förutsättnigar i en fasdiagram. • Varje punkt i diagrammen representerar ett värde för p och ett för T. © 2016 Pearson Education, Ltd.

En typisk p. T fasdiagram © 2016 Pearson Education, Ltd.

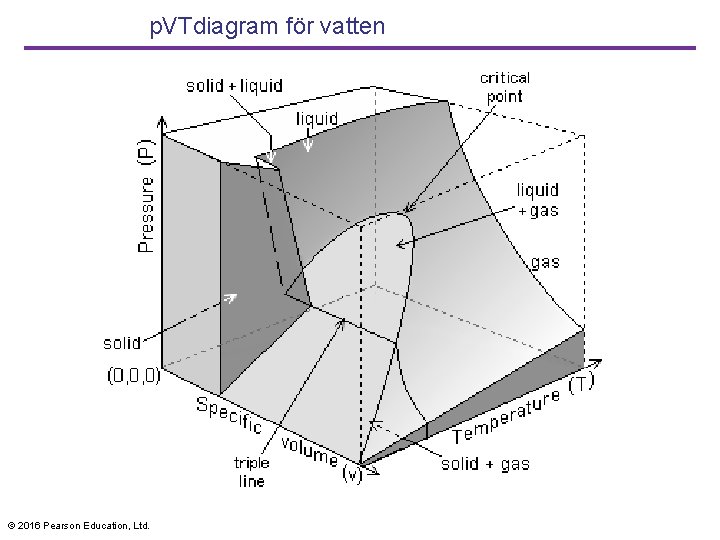
p. VT-yta för en substans som expanderar när den smälter • En p. VT-yta representerar ttillståndsekvationen grafiskt. Projektioner på p. T- och p. V-planet visas också. © 2016 Pearson Education, Ltd.

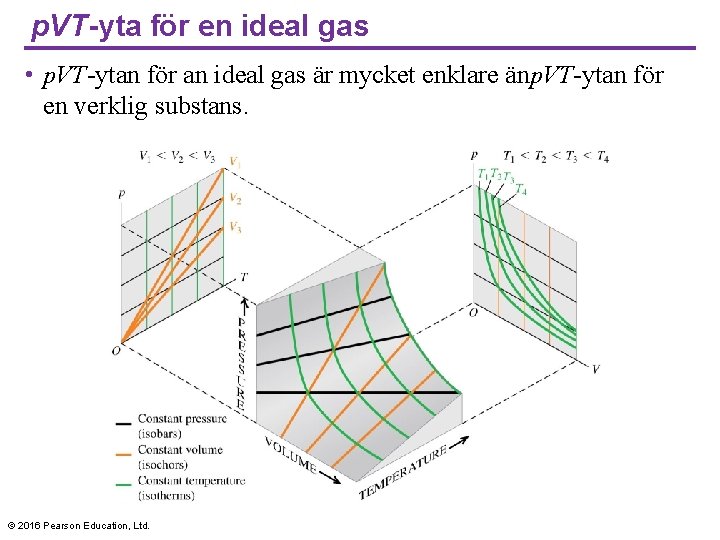
p. VT-yta för en ideal gas • p. VT-ytan för an ideal gas är mycket enklare änp. VT-ytan för en verklig substans. © 2016 Pearson Education, Ltd.

p. VTdiagram för vatten © 2016 Pearson Education, Ltd.

© 2016 Pearson Education, Ltd.
 Indirekt fråga exempel
Indirekt fråga exempel Avogadros konstant
Avogadros konstant Paulo coelho poemas
Paulo coelho poemas Cual es su pensamiento tal es el
Cual es su pensamiento tal es el De tal palo tal astilla
De tal palo tal astilla Skillnader och likheter hinduism buddhism
Skillnader och likheter hinduism buddhism Tjock och smal liten och stor
Tjock och smal liten och stor What is avogadros hypothesis
What is avogadros hypothesis Avogadros principle
Avogadros principle Percent mass formula
Percent mass formula Avogadro
Avogadro G/mol to mol
G/mol to mol Define avogadros law
Define avogadros law The mole and avogadro's law worksheet answers
The mole and avogadro's law worksheet answers Avogadro's law
Avogadro's law Syra bas reaktion
Syra bas reaktion Avagadros number symbol
Avagadros number symbol What can be said about 1 mol ag and 1 mol au
What can be said about 1 mol ag and 1 mol au Grams to mols
Grams to mols Grams mass
Grams mass Grams to moles using molar mass
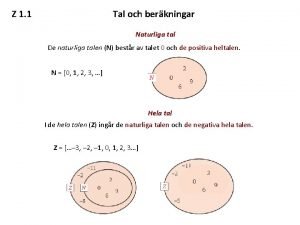
Grams to moles using molar mass Naturliga talen
Naturliga talen Subjunctive with doubt
Subjunctive with doubt Uma chapa de zinco tem area de 8cm a 20c
Uma chapa de zinco tem area de 8cm a 20c Pantera nombre cientifico
Pantera nombre cientifico Tal rho
Tal rho Teckenspråk argumenterande tal
Teckenspråk argumenterande tal Avrunda decimaltal
Avrunda decimaltal Maskil ta naghga
Maskil ta naghga Tal matematik
Tal matematik Torri tal istandard
Torri tal istandard