Kovy Kovy a jejich vlastnosti 63 z 83




















































- Slides: 62

Kovy

Kovy a jejich vlastnosti • 63 z 83 neradioaktivních prvků • Zařazení na základě fysikálních vlastností: – Kujnost – Tažnost – Vodivost • Tepelná • Elektrická

Chemické vlastnosti kovů • Nízká elektronegativita • Obvykle kladné oxidační číslo ve sloučeninách s nekovovými prvky • V solích tvoří vždy kationty

Molekulární struktura kovů – kovová vazba • • Atomy kovů v kovech obklopeny stejnými, nebo podobnými atomy Společná vlastnost → schopnost uvolňovat část valenčních elektronů Struktura: kladně nabité „zbytky atomů“ tvoří statickou mřížku, ve které se volně pohybují uvolněné elektrony „zbytky atomů“: průměrný počet uvolněných elektronů není celočíselný nejedná se o ionty Valenční elektrony vazby současně sdíleny všemi obklopujícími se atomy Vznik obrovského delokalisovaného vazebného orbitalu Ve sloučeninách s nekovovými prvky tvoří atomy kovů vazby kovalentní, nebo iontové v závislosti na charakteru vázaného protiatomu

Fysikální vlastnosti kovů – kujnost a tažnost • Kujnost = možnost deformování plastickou deformací • Tažnost = schopnost prodlužovat se při tahu (dráty) • Při plastické deformaci se posouvají vrstvy atomů vůči sobě, aniž by se měnilo jejich okolí

Fysikální vlastnosti kovů – pevnost a tvrdost Vlákno Hmotnost závaží Skleněné vlákno 10 Al – drát 17 Cu – drát 28 Drát z běžné oceli 40 Duralový drát 60 Drát ze speciální oceli 120 Kov Tt (°C) Poměrná tvrdost W 3 400 7, 5 Ti 1 670 6 Cu 1 080 3 Pb 330 1, 5 Na 100 0, 4 • Pevnost - zatížení, jaké unese drát o průměru 1 mm • Tvrdost kovů je závislá na teplotě tání

Fysikální vlastnosti kovů – vodivost • Valenční elektrony tvoří tzv. „elektronový plyn“ – oblak snadno pohyblivých elektronů • Přiložení vnějšího napětí má za následek usměrněný tok elektronů – elektrická vodivost • Zahřátí na konci kovu má za následek zvýšení srážek mezi elektrony navzájem – rázy se přenáší energie postupně přes celou délku kovu – tepelná vodivost

Fysikální vlastnosti – optické vlastnosti • Volně pohyblivé elektrony snadno absorbují a následně emitují záření • Kovový lesk • Ionty kovů zbarvují charakteristicky plamen

Slitiny – ovlivňování vlastností kovů • Elektrická vodivost – lepší u čistých kovů • Topné spirály – odporové slitiny – nichrom (80 % Ni a 20 % Cr); kanthal (80 % Fe, 18 % Cr a 2 % Al) • Oceli – zvýšená tvrdost a pevnost oproti surovému Fe • Mosaz (Cu – Zn) • Dural (Al, Mg + další prvky) – konstrukční materiál pro výrobu dopravních prostředků, nízká teplota tání • Bronz (Cu – Sn) • Titanové slitiny – nejvýhodnější poměr pevnost/hmotnost, letecká a raketová technika

Otázky k opakování • • Co jsou kovy? Co je kovová vazba a jak vypadá? Proč jsou kovy dobře kujné a tažné? Proč jsou kovy dobře vodivé? Jakou mají kovy barvu? Které se liší a jak? Jmenujte dvě slitiny. Proč se slitiny používají?

Výskyt kovů • Ryzí – Au, Ag, Pt, … • Vázané - většina • Rudy: přírodniny vhodné k výrobě kovů – Nejčastěji oxidické a sulfidické – Bohaté: bauxit 40 – 60 % Al. O(OH) – Chudé: měděné rudy 1 % Cu. Fe. S 2 • Hlušina = příměsi rud, balast • Geopolitické souvislosti • Recyklace a tříděný sběr

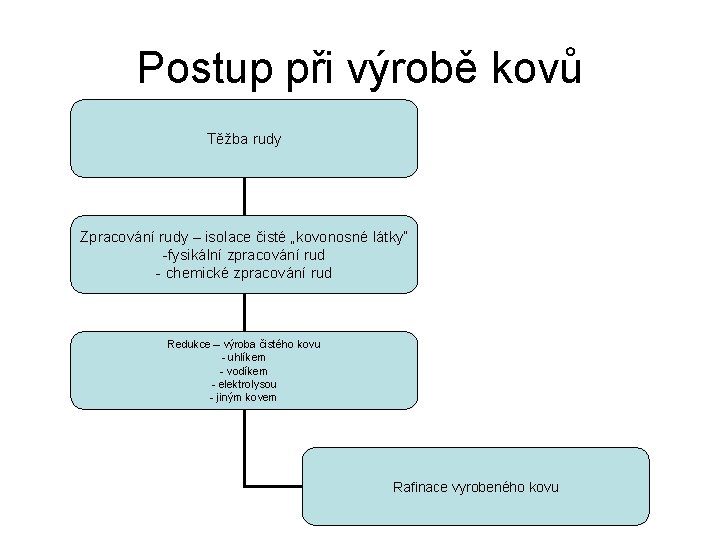
Postup při výrobě kovů Těžba rudy Zpracování rudy – isolace čisté „kovonosné látky“ -fysikální zpracování rud - chemické zpracování rud Redukce – výroba čistého kovu - uhlíkem - vodíkem - elektrolysou - jiným kovem Rafinace vyrobeného kovu

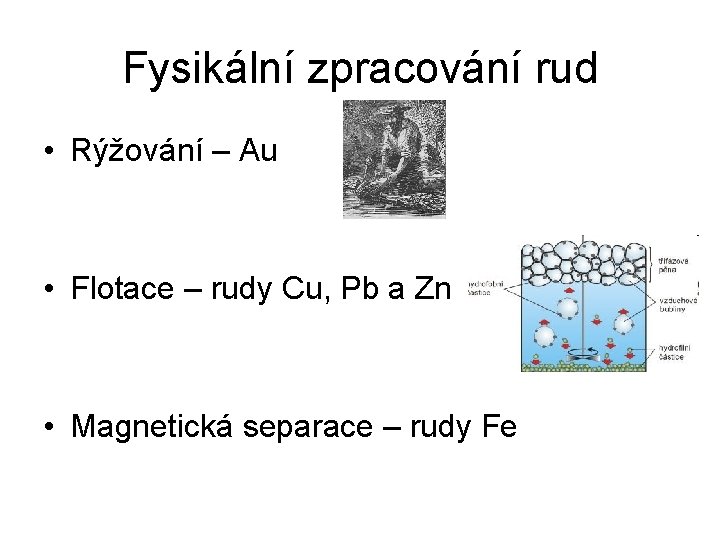
Fysikální zpracování rud • Rýžování – Au • Flotace – rudy Cu, Pb a Zn • Magnetická separace – rudy Fe

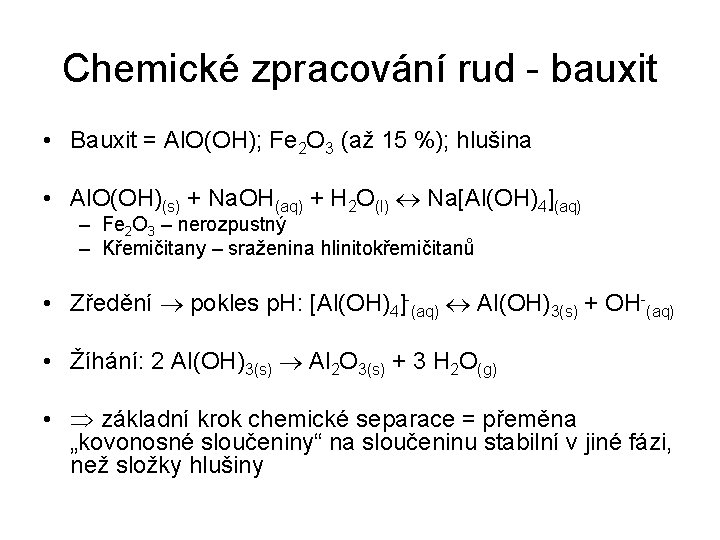
Chemické zpracování rud - bauxit • Bauxit = Al. O(OH); Fe 2 O 3 (až 15 %); hlušina • Al. O(OH)(s) + Na. OH(aq) + H 2 O(l) Na[Al(OH)4](aq) – Fe 2 O 3 – nerozpustný – Křemičitany – sraženina hlinitokřemičitanů • Zředění pokles p. H: [Al(OH)4]-(aq) Al(OH)3(s) + OH-(aq) • Žíhání: 2 Al(OH)3(s) Al 2 O 3(s) + 3 H 2 O(g) • základní krok chemické separace = přeměna „kovonosné sloučeniny“ na sloučeninu stabilní v jiné fázi, než složky hlušiny

Chemické zpracování rud • Au – 0, 0001 % v rudě – 4 Au(s) + 8 CN-(aq) + O 2(g) + 2 H 2 O 4 [Au(CN)2]-(aq) + 4 OH-(aq) – V ČR postup zakázán • Ti – Rutil – Ti. O 2(s) + C(s) + 2 Cl 2(g)500 °C Ti. Cl 4(g) + CO 2(g) • Pražení t – 2 Zn. S(s) + 3 O 2 2 Zn. O(s) + 2 SO 2(g) – Zn, Cu, Pb, Ni, Fe – Příprava rudy pro redukci kovu uhlíkem

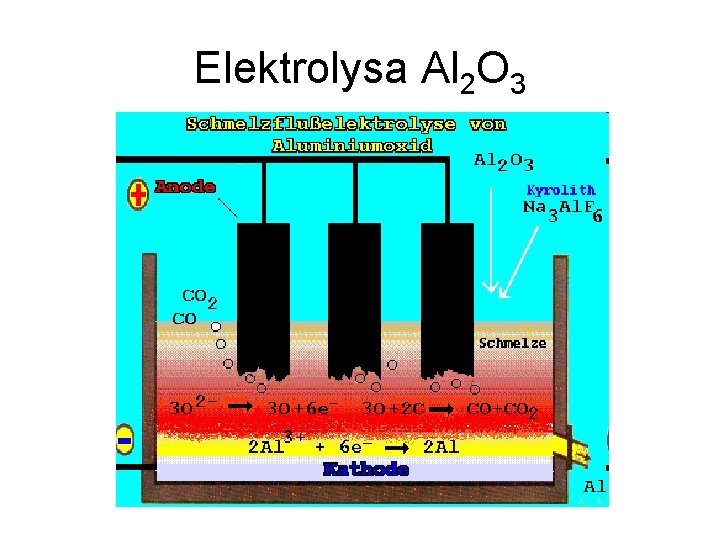
Redukce elektrolysou • Výroba elektropositivních kovů • Elektrolysa tavenin (hlavně chloridy) • Na, Mg • Al – Elektrolysa Al 2 O 3 při 950 °C – Přídavek Na 3[Al. F 6] – snižuje teplotu tání Al 2 O 3 (normálně 2 050 °C) – 2 Al 2 O 3(l) 4 Al(l) + 3 O 2(g)

Elektrolysa Al 2 O 3

Redukce uhlíkem – výroba Fe • Redukce uhlíkem za vysokých teplot • Suroviny: – Obohacená železná ruda: Fe 2 O 3, zbytky hlušiny s Si. O 2 – Koks: uhlík – slouží současně i jako palivo 2 C(s) + O 2(g) 2 CO(g) – Vápenec: Ca. CO 3 – Vzduch: předehřátý, vháněný spodem • Hlavní redukovadlo – CO, C pouze v tavící části pece!

Redukce uhlíkem – výroba Fe Napište rovnice pro redukci uhlíkem!

Redukce uhlíkem – výroba Fe • Struska: – Střední část pece: Ca. CO 3(s) Ca. O(s) + CO 2(g) – Reakce se zbytky hlušiny: Ca. O(s) + Si. O 2(s) Ca. Si. O 3(l) – Význam: • Brání styku s kyslíkem • Brání reakci s Si

Redukce jiným kovem • Redukce hořčíkem: Ti. Cl 4(g) + 2 Mg(l) Ti(s) + 2 Mg. Cl 2(l) • Redukce hliníkem = aluminothermie: Cr 2 O 3(s) + 2 Al(l) 2 Cr(l) + Al 2 O 3(s) • Obdobně V; Nb; Mn • Redukce v roztoku: 2 [Au(CN)2]-(aq) + Zn(s) [Zn(CN)4]2 -(aq) + 2 Au(s) • Elektrolysou roztoku Ni; Zn; Cd; Ga

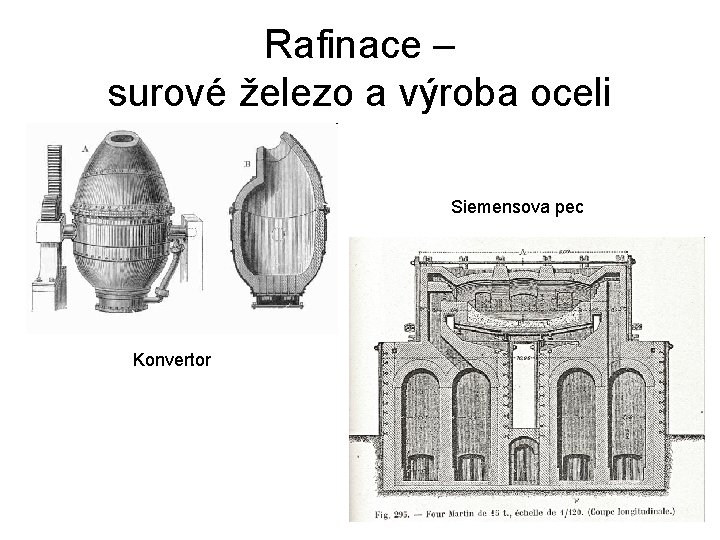
Rafinace – surové železo a výroba oceli • Surové železo: 4 % C; 2 % Si; P; Mn; S • Princip: oxidace příměsí kyslíkem na oxidy – Plynné – CO, SO 2 – Pevné – Si. O 2, P 4 O 10, Mn. O 2 součást strusky • Rozhodující pro vlastnosti – obsah C – Nástrojová ocel – 1, 5 % C – Konstrukční ocel – méně než 0, 3 % • Další přísady: – Cr (více než 12 %) – nerezocel

Rafinace – surové železo a výroba oceli Siemensova pec Konvertor

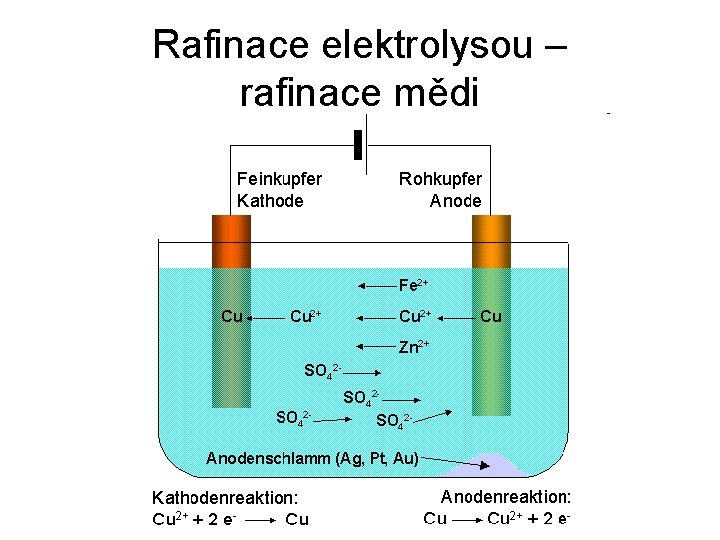
Rafinace elektrolysou – rafinace mědi

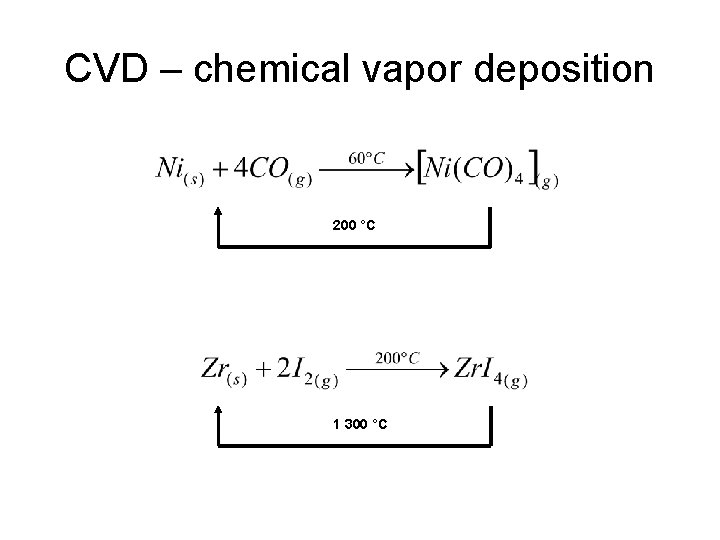
CVD – chemical vapor deposition 200 °C 1 300 °C

Otázky k opakování • • Co je flotace a jaký je její princip? Jak se vyrábí hliník? Popište činnost vysoké pece! Co je struska a jakou má funkci? Co je aluminothermie a k čemu se používá? Jak se rafinuje měď? K čemu jsou dobré anodové kaly? Popište princip CVD!

Koroze kovů a elektrochemie

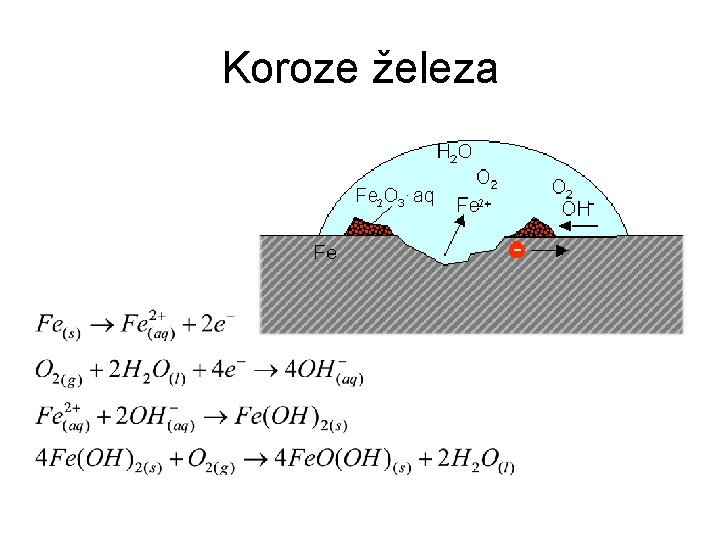
Koroze • Elementární kovy jsou obvykle nestabilní a přeměňují se zpět na částice s kladným oxidačním číslem • Postupná oxidace kovů slučováním s jinými prvky působením okolního prostředí • Obvykle ve vodném prostředí • Soubor procesů, kterými se postupně mění vlastnosti jakýchkoliv materiálů do té míry, že ztrácejí užitnou hodnotu

Koroze železa

Beketovova řada kovů • • • Kovy odštěpují valenční elektrony a tvoří kationty Kovy se liší svojí schopností kationty tvořit Reaktivnější kovy vytěsňují z roztoku kovy méně reaktivní Reaktivní kovy snadno korodují – ušlechtilé a neušlechtilé kovy Ušlechtilé a neušlechtilé kovy se liší svojí reakcí s kyselinami Beketov – sestavil kovy do řady dle jejich schopnosti vzájemně se redukovat: Ušlechtilé kovy K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Au Neušlechtilé kovy • • Vodík – výsadní postavení Kovy vlevo redukují kovy vpravo Neušlechtilé kovy reagují s kyselinami za vzniku vodíku, snadno korodují Ušlechtilé kovy s kyselinami nereagují, a nebo pouze za současné redukce kyseliny a vzniku vody – vodík nevzniká. Jsou extrémně stále, korodují pomalu, v přírodě často v ryzí formě

Voltův sloup • Pokud se dva rozdílné kovy vodivě spojí, generuje se elektrické napětí • Alessandro Volta – 1799/1800 – Voltův sloup • Měděné a zinkové destičky proložené papírem nasáklým elektrolytem (vodivou kapalinou)

Daniellův článek • John Frederic Daniell – 1836 • Zinková a měděná tyčinka ponořené do svých iontových roztoků (Zn. SO 4; Cu. SO 4), spojené solným můstkem, který nedovolí průchod iontů

Pojmy • Elektroda: vodivý materiál ponořený do příslušného elektrolytu • Anoda: elektroda, na níž dochází k oxidaci • Katoda: elektroda, na níž dochází k redukci • Elektrolyt: vodivý roztok • Poločlánek: elektroda • Článek: kombinace dvou poločlánků, zdroj elektrického napětí

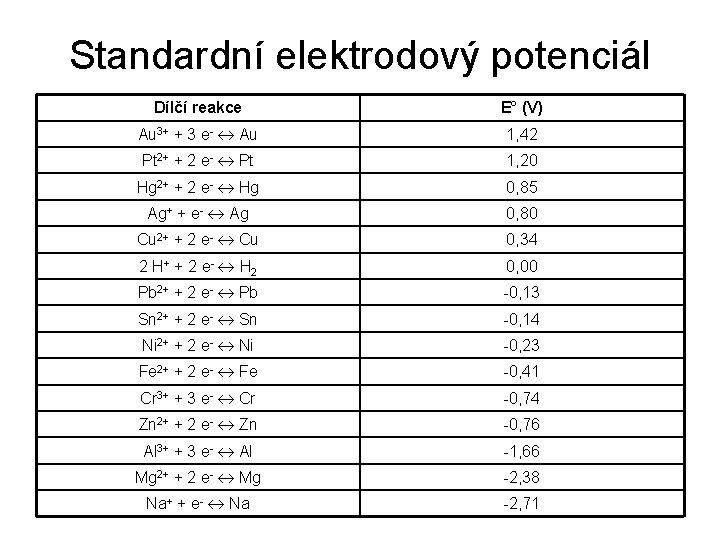
Standardní elektrodový potenciál • Schopnost generovat napětí je možné využít pro charakterisaci reaktivity kovů • Standardní elektrodový potenciál – E° – Charakterisuje schopnost atomů daného kovu odštěpovat elektrony za vzniku iontů – Určuje se jako napětí, které je generováno v článku, tvořeném elektrodou kation/kov a vodíkovou elektrodou za standardních podmínek (101, 325 k. Pa, 1 M roztoky) – Tabelován jako dílčí iontová poloreakce, vyjadřující redukční reakci na katodě • Ušlechtilé kovy: – Odštěpují elektrony méně snadno než vodík – Kladný E° • Neušlechtilé kovy: – Odštěpují elektrony snadněji než vodík – Záporný E° Vodíková elektroda: - E° = 0 V

Standardní elektrodový potenciál Dílčí reakce E° (V) Au 3+ + 3 e- Au 1, 42 Pt 2+ + 2 e- Pt 1, 20 Hg 2+ + 2 e- Hg 0, 85 Ag+ + e- Ag 0, 80 Cu 2+ + 2 e- Cu 0, 34 2 H+ + 2 e - H 2 0, 00 Pb 2+ + 2 e- Pb -0, 13 Sn 2+ + 2 e- Sn -0, 14 Ni 2+ + 2 e- Ni -0, 23 Fe 2+ + 2 e- Fe -0, 41 Cr 3+ + 3 e- Cr -0, 74 Zn 2+ + 2 e- Zn -0, 76 Al 3+ + 3 e- Al -1, 66 Mg 2+ + 2 e- Mg -2, 38 Na+ + e- Na -2, 71

Využití E° pro určení průběhu reakce • Pokud se kovy seřadí dle vzrůstajícího E°, získá se Beketovova řada kovů • Kovy s nižším E° redukují kovy s vyšším E° Ag + Cu(NO 3)2 Zn + Cu. SO 4 Mg + Ni. Cl 2 Cr + Al 2 O 3 Cu + Ag. NO 3 Zn. SO 4 + Cu Mg. Cl 2 + Ni Cr 2 O 3 + Al

Využití E° pro odhad napětí článku • Z rovnic dílčích reakcí se sestaví celková rovnice • E° příslušných poloreakcí se od sebe odečtou – Je-li rozdíl kladný, probíhá reakce zleva doprava – Je-li rozdíl záporný, probíhá reakce opačně – Hodnota rozdílu udává napětí článku • Daniellův článek: – Cu 2+ + Zn → Cu + Zn 2+ – DE° = E°(Cu 2+ + 2 e- Cu) – E°(Zn 2+ + 2 e- Zn) = 0, 34 – (-0, 76) = 1, 00 V

Monočlánek

Monočlánek • Spočtěte napětí monočlánku, jsou-li známé E° dílčích poloreakcí: • Zn(OH)2 / Zn • Mn. O 2 / Mn 2 O 3 ; Zn(OH)2 + 2 e- Zn + 2 OH- E 0 = - 1, 246 2 Mn. O 2 + 2 e- + H 2 O Mn 2 O 3 + 2 OH- E 0 = + 0, 15

Olověný akumulátor • • • Možnost zpětného nabití – obrácení chemického děje dodáním energie Katoda: houbovité olovo Anoda: vrstva oxidu olovičitého Elektrolyt: 38% kyselina sírová Nenabitý akumulátor – obě elektrody pokryty vrstvou síranu olovnatého

Olověný akumulátor • Spočtěte napětí olověného akumulátoru, jsou-li známé E° dílčích poloreakcí:

Elektrolysa • fyzikálně-chemický jev, způsobený průchodem elektrického proudu kapalinou, při kterém dochází k chemickým změnám na elektrodách • Při elektrolyse putují kationty elektrolytu ke katodě, kde jsou redukovány a anionty putují k anodě, kde jsou oxidovány • Využití: – – – – – Výroba chlóru Rozklad různých chemických látek (elektrolýza vody) Elektrometalurgie - výroba čistých kovů (hliník) – viz presentace 01 Kovy Elektrolytické čištění kovů - rafinace (měď, zinek, nikl) – viz presentace 01 Kovy Galvanické pokovování (chromování, niklování, zlacení) - pokrývání předmětů vrstvou kovu Galvanoplastika - kovové obtisky předmětů, např. pro výrobu odlévacích forem Galvanické leptání - kovová elektroda se v některých místech pokryje nevodivou vrstvou, nepokrytá část se průchodem proudu elektrolytem vyleptá Polarografie - určování chemického složení látky pomocí změn elektrického proudu procházejícího roztokem zkoumané látky Akumulátory - nabíjení chemického zdroje elektrického napětí průchodem elektrického proudu Epilace - metoda jak permanentně odstranit chloupky na těle

Elektrolysa solanky • • • Elektrolytem vodný roztok Na. Cl (kuchyňská sůl) –disociován na Na+ a Cl− Elektrody např. uhlíkové, železné Elektrické napětí mezi elektrodami usměrní pohyb Na+ ke katodě, ze které si iont H+ vezme elektron a změní se na elektricky neutrální částici - atom vodíku H, který se sloučí s jiným atomem vodíku za vzniku molekuly H 2 Záporné ionty Cl− jsou přitahovány k anodě, které odevzdají svůj přebytečný elektron, a po dvou se sloučí do elektricky neutrální molekuly chloru Cl 2 Na záporné elektrodě se z roztoku nevylučuje pevný sodík (to by se stalo v tavenině – viz výroba sodíku), ale probíhá zde redukce vodíku Sodíkové kationty zůstávají v roztoku spolu s hydroxidovými anionty - jedná se o výrobu hydroxidu sodného.

Elektrolysa vody • • Elektrolyt roztok H 2 SO 4 ve vodě Elektrody z platiny (nereaguje s H 2 SO 4) Disociací H 2 SO 4 vznikají v roztoku H+ a záporné ionty SO 42− Kationty vodíku se pohybují ke katodě, od které přijímají elektron a slučují se do molekuly vodíku H 2. Anionty SO 42− se pohybují ke kladné elektrodě, které odevzdají své přebytečné elektrony a elektricky neutrální molekula SO 4 okamžitě reaguje s vodou za vzniku H 2 SO 4 a molekuly kyslíku O 2 U katody se vylučuje z roztoku vodík, u anody se vylučuje kyslík, počet molekul kyseliny sírové H 2 SO 4 se nemění ubývá molekul H 2 O koncentrace roztoku se zvyšuje Hofmanův přístroj. Energetická účinnost elektrolýzy vody (získaná chemická energie/dodaná elektrická energie) dosahuje v praxi 6070%. Navrhněte rovnice!

Faradayovy zákony • 1. zákon: „Hmotnost látky vyloučené na elektrodě závisí přímo úměrně na elektrickém proudu, procházejícím elektrolytem, a na čase, po který elektrický proud procházel. “ m … hmotnost vyloučené látky [g] A … elektrochemický ekvivalent [g/C] I … proud [A] t … čas [s] Q … náboj [C] • 2. zákon: „Látková množství vyloučená stejným nábojem jsou pro všechny látky chemicky ekvivalentní, neboli elektrochemický ekvivalent A závisí přímo úměrně na molární hmotnosti látky. “ M … molární hmotnost vyloučené látky [g/mol] F … Faradayova konstanta [9, 6481× 104 C. mol− 1 ] z … počet elektronů potřebných pro průběh redukce

Příklad 1 • Vypočítejte, kolik mědi se vyloučilo na katodě při rafinaci surové mědi, pokud elektrolysa probíhala po dobu 1, 5 h a elektrolytem tekl proud 2 A. tabulky konstanta – 9, 6481× 104 Cu 2+ + 2 e- Cu 0

Příklad 2 • Kolik chromu se vyloučí na povrch elektrody při galvanickém pokovování v roztoku kyseliny chromové, pokud elektrolysa bude probíhat po dobu 24 h a bude použit proud o velikosti 2, 5 A

Zástupci kovů, jejich vlastnosti a použití

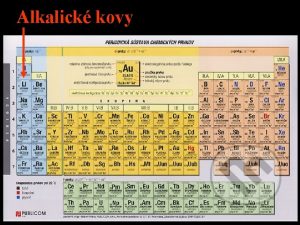
Alkalické kovy • Prvky skupiny I. A • Li, Na, K, Rb, Cs, Fr • Valenční konfigurace ns 1 • Elementární kovy odevzdávají 1 elektron a přechází na oxidační číslo +I • Obecné vlastnosti: – – – Nízká elektronegativita Nízké teploty tání a varu Malá hustota Měkké (lze je krájet nožem) Velmi reaktivní – všechny reagují s vodou podle rovnice:

Lithium – Li • Přídavek do slitin s hliníkem – součástky letadel (extremně nízká hustota) • Výroba akumulátorových baterií s dlouhou životností • Použití v organické synthese

Sodík – Na • Redukční činidlo v organických laboratořích • Chladící činidlo v jaderných reaktorech (nízká teplota tání – 98 °C je spojena s dobrou tepelnou vodivostí) • Sloučeniny: – Chlorid sodný – Na. Cl – kuchyňská sůl, výroba sodíku i chloru – Hydroxid sodný – Na. OH – důležitá průmyslová chemikálie – Uhličitan sodný – Na 2 CO 3 – soda, levná náhražka hydroxidu, změkčovadlo vody, výroba skla – Hydrogenuhličitan sodný – Na. HCO 3 – jedlá soda, soda bicarbona, antacidum, prášek do pečiva

Draslík – K • Sloučeniny: – Chlorid draselný – KCl – hnojivo – Uhličitan draselný – K 2 CO 3 – potaš, výroba skla

Kovy alkalických zemin • Prvky skupiny II. A • Be, Mg, Ca, Sr, Ba, Ra • Valenční konfigurace ns 2 • Elementární odevzdávají 2 elektrony elektronegativnějšímu prvku a přechází v oxidační číslo +II • Obecné vlastnosti: – Méně reaktivní než kovy alkalické – Ra je radioaktivní

Hořčík - Mg • Oproti ostatním zástupcům této skupiny relativně málo reaktivní – možno skladovat na suchém vzduchu • Redukovadlo v organických laboratořích a použití v organické synthese • Využití ve slitinách s hořčíkem • Pyrotechnika • Sloučeniny: – Oxid hořečnatý – Mg. O – žáruvzdorný materiál, tepelná isolace pecí – Hydroxid hořečnatý – Mg(OH)2 - antacidum

Sloučeniny vápníku a baria Vápník – Ca Barium – Ba • Oxid vápenatý – Ca. O – nejrozšířenější průmyslová base – pálené vápno • Rozpustné sloučeniny baria jsou jedovaté! • Hemihydrát síranu vápenatého – Ca. SO 4. 1/2 H 2 O – sádra • Uhličitan vápenatý – Ca. CO 3 – vápenec, mramor, výroba Ca. O • Síran barnatý – Ba. SO 4 – nerozpustný, netoxický, pohlcuje rentgenové záření, použití v lékařství pro vyšetření trávicího ústrojí

Zajímavé kovy p-bloku Hliník – Al Olovo – Pb • Používá se jako vodič elektrického proudu • Válený na folii – alobal • Výroba nádobí a příborů • Použití do slitin • Těžký, ale měkký kov • Nízká teplota tání • Ve sloučeninách zaujímá oxidační číslo +II a +IV • Sloučeniny s ox. č. +IV jsou nestálé a snadno se redukují na +II – využití jako oxidačních činidel • Výroba akumulátorů, olůvek, ochrana před zářením (X, g) • Sloučeniny: – Oxid hlinitý – Al 2 O 3 – chemicky stálý, přetavený = korund – brusivo, korundová keramika (laboratorní vybavení) – Síran hlinitý – Al 2(SO 4)3 – výroba papíru a úprava vody

Kovy d-bloku • Na vazbách se podílí jak valenční elektrony, tak i elektrony předcházející vrstvy (n-1)d • Rozmanité vazebné možnosti, více stabilních oxidačních stavů • Vysoká hustota

Skupina I. B – Cu, Ag, Au Měď - Cu Stříbro - Ag • • • Rudohnědý kov Výborný vodič Výroba kotlů a slitin Na vzduchu oxiduje (za sucha na hnědý Cu 2 O, za vlhka na zelenou měděnku Cu. CO 3. Cu(OH)2) Sloučeniny: – Oxid měďný – Cu 2 O – polovodič – Oxid měďnatý – Cu. O – oxidační činidlo – Pentahydrát síranu měďnatého – Cu. SO 4. 5 H 2 O – modrá skalice, poměďování, ocharana před škůdci • • Bílý, stříbrolesklý kov Výborný vodič Součástky v elektronice Pamětní medaile, šperky, ozdobné předměty, mince Výroba zrcadel Slitiny se zlatem Na vzduchu postupně černá (Ag 2 S – působení sulfanu ve vzduchu) Sloučeniny: – Dusičnan stříbrný – Ag. NO 3 – nejznámější sloučenina stříbra, výchozí látka pro výrobu stříbrných sloučenin, fotografických materiálů, použití v lékařství (lápis – léčba bradavic)

Zlato - Au • Žlutý kov • Chemicky velmi stálé – rozpouští se pouze v lučavce královské (HCl : HNO 3 = 3 : 1) (Pozn. : Všechny kovy skupiny I. B jsou ušlechtilé kovy, chemicky stálé, ale Au vyniká) • Z větší části zlatý poklad státu – mezinárodní platidlo • Zubní lékařství • Zlatnictví, pamětní medaile • Slitiny se stříbrem a mědí • Zdobení skla a keramiky

Skupina II. B – Zn, Cd, Hg Zinek - Zn Rtuť - Hg • • • Kapalný kov! Dobrý vodič Páry i sloučeniny prudce jedovaté Ušlechtilý kov Reaguje jen s kyselinou dusičnou Amalgámy Náplň teploměrů a tlakoměrů Elektroda Zubní lékařství • Sloučeny: • • • Bílý kov s modrošedým odstínem Křehký Na vzduchu se pokrývá vrstvou Zn. O – pasivace Pozinkovávání železných plechů Tiskařské štočky Slitiny – mosaz • Sloučeniny: – – – Oxid zinečnatý – Zn. O – zinková běloba, kosmetika, lékařství (masti Heptahydrát síranu zinečnatého Zn. SO 4. 7 H 2 O – bílá skalice, oční lékařství, galvanické pokovování, impregnace dřeva, kůže Sulfid zinečnatý – Zn. S – sfalerit, stínítka na televisní obrazovky, stínící číselníky, etc. – – Chlorid rtuťný – Hg 2 Cl 2 – kalomel, oční lékařství – mast Chlorid rtuťnatý – Hg. Cl 2 – sublimát, desinfekce, impregnace Poznámka: Cadmium a jeho sloučeniny jsou prudce jedovaté, použití do akumulátorů

Chrom – Cr • Bílý kov s modrých nádechem • Lesklý, velmi tvrdý • Pokovování, přísada do nerez-ocelí (ložiska, chirurgické nástroje, příbory) • Vyskytuje se v oxidačním stavu +III a +VI, přičemž stav +VI je nestabilní a snadno se redukuje na +III – oxidační činidla • Sloučeniny v oxidačním stupni +VI jsou toxické, karcinogenní • Sloučeniny: – Oxid chromitý – Cr 2 O 3 – zelený prášek (chromová zeleň), hlavní složkou rudy chromitu (Fe. O. Cr 2 O 3) – Oxid chomičitý – Cr. O 2 – součást magnetofonových pásků – Oxid chromový – Cr. O 3 – tmavočervené krystaly, silné oxidační činidlo, pokovování, v roztoku přechází na kyselinu chromovou – H 2 Cr. O 4, obé se používá v organické synthese – Chroman olovnatý – Pb. Cr. O 4 – žlutý pigment (chromová žluť)

Mangan – Mn • Šedý, tvrdý a křehký kov • Slitiny se železem na výrobu namáhaných součástek • Slitina Mn, Cu a Ni na výrobu přesných odporů v elektrotechnice • Oxidační stavy II, IV, VII – nejstabilnější II, ostatní oxidační činidla se vzrůstající silou • Sloučeniny: – Oxid manganičitý – Mn. O 2 – burel, černý prášek, oxidační činidlo, barvivo ve sklářství, katalysator – Manganistan draselný – KMn. O 4 – hypermangan, fialová krystalická pevná látka, velmi silné oxidační činidlo, desinfekční prostředek v lékařství
 Počet valenčních elektronů
Počet valenčních elektronů Funkce a jejich vlastnosti
Funkce a jejich vlastnosti Slavní chemici a jejich objevy
Slavní chemici a jejich objevy Druhy plastů a jejich využití
Druhy plastů a jejich využití Sfarbenie plameňa alkalické kovy
Sfarbenie plameňa alkalické kovy Biogénne kovy
Biogénne kovy Rozličné kovy zpracovávali
Rozličné kovy zpracovávali Delenie pevnych latok
Delenie pevnych latok Typické vlastnosti zvířat v bajkách
Typické vlastnosti zvířat v bajkách Množiny bodov danej vlastnosti
Množiny bodov danej vlastnosti Technologické vlastnosti dreva
Technologické vlastnosti dreva Vlastnosti plynů prezentace
Vlastnosti plynů prezentace Vlastnosti kvapalín a plynov
Vlastnosti kvapalín a plynov Chemické vlastnosti vlasu
Chemické vlastnosti vlasu Melancholik
Melancholik Vlastnosti osobnosti
Vlastnosti osobnosti Druhy opisu a charakteristiky
Druhy opisu a charakteristiky Vlastnosti štvorca
Vlastnosti štvorca Lineárne funkcie príklady
Lineárne funkcie príklady Tangentoida
Tangentoida Slimák a ružový ker hlavna myslienka
Slimák a ružový ker hlavna myslienka Mechanika kapalin a plynů test
Mechanika kapalin a plynů test Pasivne elektricke vlastnosti tkaniv
Pasivne elektricke vlastnosti tkaniv Struktura a vlastnosti pevných látek test
Struktura a vlastnosti pevných látek test Co jsou to sulfidy
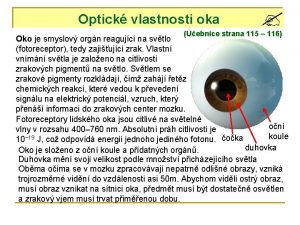
Co jsou to sulfidy Optické vlastnosti oka
Optické vlastnosti oka Typologie osobnosti
Typologie osobnosti Využitie vlastností kvapalín
Využitie vlastností kvapalín Sulfid železnatý magnetické vlastnosti
Sulfid železnatý magnetické vlastnosti Chemické vlastnosti vlasu
Chemické vlastnosti vlasu Konstrukce rovnoběžníku příklady
Konstrukce rovnoběžníku příklady Vlastnosti kosodélníku
Vlastnosti kosodélníku Melancholik kladné vlastnosti
Melancholik kladné vlastnosti Protilahle strany
Protilahle strany Charakter osobnosti
Charakter osobnosti Amynoplasty
Amynoplasty Vlastnosti lichoběžníku
Vlastnosti lichoběžníku Vlastnosti vodcu triedy
Vlastnosti vodcu triedy Tekutost plynov
Tekutost plynov Zvukové javy reči
Zvukové javy reči Seberegulační vlastnosti osobnosti
Seberegulační vlastnosti osobnosti Zvuk je
Zvuk je Práca s bágrom bratislava
Práca s bágrom bratislava Lichobežník
Lichobežník Množiny bodů dané vlastnosti pracovní list
Množiny bodů dané vlastnosti pracovní list Struktura a vlastnosti kapalin
Struktura a vlastnosti kapalin Množiny bodov danej vlastnosti priklady
Množiny bodov danej vlastnosti priklady Flegmatik vyznam
Flegmatik vyznam Vlastnosti vlka v bajkách
Vlastnosti vlka v bajkách Frekvence tónů hz
Frekvence tónů hz Vlastnosti leadera
Vlastnosti leadera Stavba ludskeho oka
Stavba ludskeho oka Predmety a ich vlastnosti
Predmety a ich vlastnosti Neživé věci mají lidské vlastnosti
Neživé věci mají lidské vlastnosti Kretschmerova typologie
Kretschmerova typologie Bahenný plyn
Bahenný plyn Trojboký ihlan sieť
Trojboký ihlan sieť Vlastnosti osobnosti
Vlastnosti osobnosti Rovnobežníky
Rovnobežníky Kretschmerova typologia
Kretschmerova typologia Lichoběžník vlastnosti
Lichoběžník vlastnosti Vlastnosti čtverce
Vlastnosti čtverce Vlastnosti kvapalin
Vlastnosti kvapalin