KEMIJSKI RAUN Zakon stalnih masenih odnosa Kako glasi

























- Slides: 26

KEMIJSKI RAČUN Zakon stalnih masenih odnosa

Kako glasi zakon MASA REAKTANATA JEDNAKA JE MASI PRODUKATA H 2 + O 2 → H 2 O 2 g + 32 g = 34 g Ovo je matematički točni Ali kemijski nije Da bi kemijski bilo točno reakcuju treba izjednačiti: l

Primjer 1. 2 H 2 + O 2 → 2 H 2 O Sada je kemijski reakcija točno izjednačena pa dolazi do promjene mase reaktanata i mase produkata: 4 g + 32 g = 36 g Sada je reakcija u potpunosti točna.

Količina tvari ili množina tvari Je ona količina tvari koja sadrži onoliko jedinki koliko sadrži atoma 12 g ugljikovog izotopa C¹² obilježava se s “n” jedinica je “mol” n = m(g) / M(g/molu) m = masa tvari čiju množinu tražimo M = molarna masa tvari ( to je ustvari Mr ili Ar)

STEHIOMETRIJSKI ZAKONI Zakon stalnih masenih odnosa, ili zakon o stalnom sastavu spoja, ili I stehiometrijski zakon (Prustov zakon) Ovaj zakon je formulisao Ž. Prust 1808 g. , a on glasi: u sastav nekog spoja ulaze isti elementi spajaju se u stalnom masenom odnosu, ili: spoj ima stalan sastav bez obzira na način njegovog dobivanja l

ŠTO TAJ ZAKON ZNAČI ? l Znači ako analiziramo uzorke jednog istog spoja dobivenog na različite načine maseni odnos elemenat koji ulaze u sastav tog spoja uvek je isti

Zakon umnoženih masenih odnosa, ili II stehiometrijski zakon (Daltonov zakon) l Ako dva elementa obrazuju više od jedne vrste spoja, tada mase jednog elementa, koje se spajae s jednom te istom masom drugog elemena, stoje u odnosu malih celih brojeva.

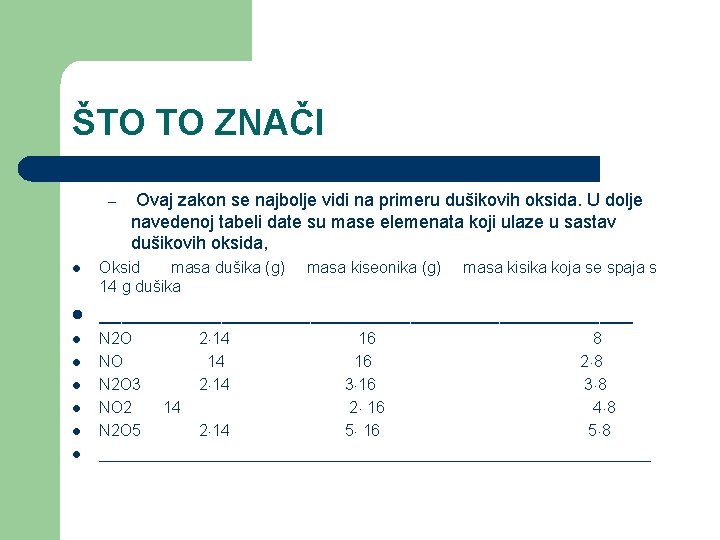
ŠTO TO ZNAČI – Ovaj zakon se najbolje vidi na primeru dušikovih oksida. U dolje navedenoj tabeli date su mase elemenata koji ulaze u sastav dušikovih oksida, l Oksid masa dušika (g) 14 g dušika l ________________________ l N 2 O 2 14 16 8 NO 14 16 2 8 N 2 O 3 2 14 3 16 3 8 NO 2 14 2 16 4 8 N 2 O 5 2 14 5 16 5 8 _______________________________ l l l masa kiseonika (g) masa kisika koja se spaja s

ŠTO SE VIDI IZ TABLICE l Iz tablice vidi se da količina kisika (g) koja se spaja s jednom te istom količinom dušika (14 g) stoje u odnosu malih celjelih brojeva, tj u odnosu 1: 2: 3. 4: 5.

AVOGADROV ZAKON l l u jednakim volumenima različitih plinova pri istom tlaku i temperaturi nalazi se jednak broj molekula. Avogadrov broj molekula = 6, 022 X 10²³ molˉ¹, molekula, iona, atoma

ŠTO IZ OVOG PROIZILAZI Pri istim uvjetima (tlak itemperatura 1 mol različitih plinova zauzima isti volumen. 2. Normalni uvjeti : Tlak 101, 3 KPa tem. ºC 1 mol bilo kojeg plina zauzima zapreminu od 22, 4 dm³ 1.

3. Način 2 H 2 + O 2 → 2 H 2 O Dva mola vodija reagira s molom kisika i dobivamo dva mola vode

PRIMJER 2. Izračunaj množinu 116 g Na. Cl Prvi korak: Naći M(Na. CL)= Ar(Na) + Ar(Cl) = 23 + 35 = 58 g/ molu

Odno smnožine reaktana i produkata u kemijskim reakcijama 2 H 2 + O 2 → 2 H 2 O 2 n : 1 n : 2 n n(H) / n(O) = 2 /1 m(H)/M(H) = 2 m(O) /M(O) m(H) = (64 g /16 g/molu) m(H) = 4 g l

Drugi korak m= 116 g M= 58 g/molu n = m/ M n = 116 g / 58 g/molu n = 2 mola

Primjer 2. Odredi količinu H, O i S u sumpornoj kiselini. Prvi korak n(H)=? n(O)=? n(S)=?

Drugi korak Mr (H 2 SO 4) = 2 Ar(H) + Ar(S) +4 Ar(O) = 2 x 1 + 32 + 4 x 16 = 2+32+64 = 98 n(H)= m(H) / M(H) = 2 g / 1 g/molu = 2 mola

Treći korak n(S) = m(S) / M(S) = 32 g / 32 g/molu = 1 mol n(O) = m(O) / M(O) = 64 g / 16 g/molu = 4 mola

Zaključak l Iz ova dva primjera vidimo da je količina od jednog mola neke tvari ustvari relativna atomska masa te tvari ili relativna molekulska masa tvari.

ZADATCi 1. 2. 3. 4. Izračunaj množinu kisikovih atoma u 2 mola bakrova(II)oksida. Izračunati množinu 175 g fosforne kiseline Izračunati masu barijeva hidroksida ako je n-možina barijeva hidroksida 3, 5 mola U šalici čaj otopljeno je 5 g šećera (C 12 H 22 O 11) koliko molova C, H, i O smo unjeli u organizam

ČITANJE KEMIJSKIH REAKCIJA Kemijske reakcije mogu se pročitati na više načina: 1. način 2 H 2 + O 2 → 2 H 2 O Dvije molekule vodika reagiraju s molekulom kisika i dobivamo dvije molekule vode l

Način 2. 2 H 2 + O 2 → 2 H 2 O 4 g vodika reagira s 32 g kisika i dobivamo 36 g vode

Način 2. 2 H 2 + O 2 → 2 H 2 O 4 g vodika reagira s 32 g kisika i dobivamo 36 g vode

3. Način 2 H 2 + O 2 → 2 H 2 O Dva mola vodija reagira s molom kisika i dobivamo dva mola vode

MOLSKI VOLUMEN l l l Molski volumen je volumen 1 mola i iskazuje se u dm³/molu Molski volumen se označuje Vºm = 22, 4 dm³ / mol i uvjek je konstantan Vºm = V

FORMULE KOJE SU MEĐUSOBNO POVEZANE l l l n =m(g) / M(g/molu) n =V°(dm³) / Vºmdm³/molu n =NA / NºA(molˉ¹) φ=Vdm³/ Vudm³ volumni udio W = m(g) / mu(g) maseni udio tvari u smjesi γ= =m(g) / Vdm³ - gustoća
 жозеф пруст
жозеф пруст Zakon umnozenih masenih odnosa
Zakon umnozenih masenih odnosa Lavoazjev zakon
Lavoazjev zakon Egzergona reakcija
Egzergona reakcija Zakon o očuvanju mase
Zakon o očuvanju mase Dzul lencov zakon
Dzul lencov zakon Konstanta elastičnosti opruge
Konstanta elastičnosti opruge Kako glasi arhimedov zakon
Kako glasi arhimedov zakon Enel procurement portal
Enel procurement portal Elektronska konfiguracija azota
Elektronska konfiguracija azota Kako glasi tekbir
Kako glasi tekbir Kemijski pribor
Kemijski pribor Zrak sastav
Zrak sastav Reagens za dokazivanje vode
Reagens za dokazivanje vode Zrak sastav
Zrak sastav Sastav morske vode
Sastav morske vode Libigov kondenzator
Libigov kondenzator Kategorizacija svinjskog mesa
Kategorizacija svinjskog mesa Pitagorina teorema pesmica
Pitagorina teorema pesmica Racunovodstvena jednacina glasi
Racunovodstvena jednacina glasi Kako se pogovarjamo z otroki in kako jih poslušamo
Kako se pogovarjamo z otroki in kako jih poslušamo Teorija objektnih odnosa
Teorija objektnih odnosa Odluka o potrebi zasnivanja radnog odnosa
Odluka o potrebi zasnivanja radnog odnosa Posebni uslovi za zasnivanje radnog odnosa
Posebni uslovi za zasnivanje radnog odnosa Projektivna identifikacija
Projektivna identifikacija Odluka o potrebi zasnivanja radnog odnosa
Odluka o potrebi zasnivanja radnog odnosa Dzulov zakon elektrotehnika
Dzulov zakon elektrotehnika















































