MAVANSKA SREDNJA KOLA STRUKTURA ATOMA KLARA KAKUKA prof
































- Slides: 55

MAČVANSKA SREDNJA ŠKOLA STRUKTURA ATOMA KLARA KAKUČKA, prof. hemije

Demokrit (460– 370 p. n. e. ) Atomi određuju osobine • “Materija se ne može deliti do beskonačnosti • Deljenjem se dolazi do najmanjeg dela koji se ne može dalje deliti “atoma” • Atomi su male čvrste čestice sve od istog materijala, ali različiti po obliku i veličini • Atoma ima bezbroj i oni se stalno kreću i spajaju • Ne postoji ništa osim atoma i praznog prostora, sve drugo je fantazija. ” –Demokrit

Definicija • ATOM JE NAJSITNIJA ČESTICA NEKOG ELEMENTA SA OSOBINAMA TOG ELEMENTA • Ima i sitnijih čestica ali su isti za sve elemente • Njihov broj u atomu određuje element

OSNOVNE POSTAVKE DALTONOVE ATOMSKE TEORIJE -1808. g. • Celokupna materija se sastoji od atoma • Svi atomi jednog hemijskog elementa su identični • Atomi različitih hemijskih elemenata imaju različite mase • Jedinjenja (složeni atomi) su specifična kombinacija atoma više od jednog hem. elementa • U hemijskim reakcijama, atomi se niti stvaraju niti razaraju već se samo preraspoređuju dajući novu supstancu

J. J. Thompson OTKRIĆE ELEKTRONA • 1897 g prvi put je bila otkrivena čestica manja od najmanjeg atoma • Tompsonov model atoma “puding od šljiva” RADEFORDOVO OTKRIĆE ATOMSKOG JEZGRA • Masa atoma skoncentrisana je u jezgru • Elektroni se nalaze u prostoru oko jezgra

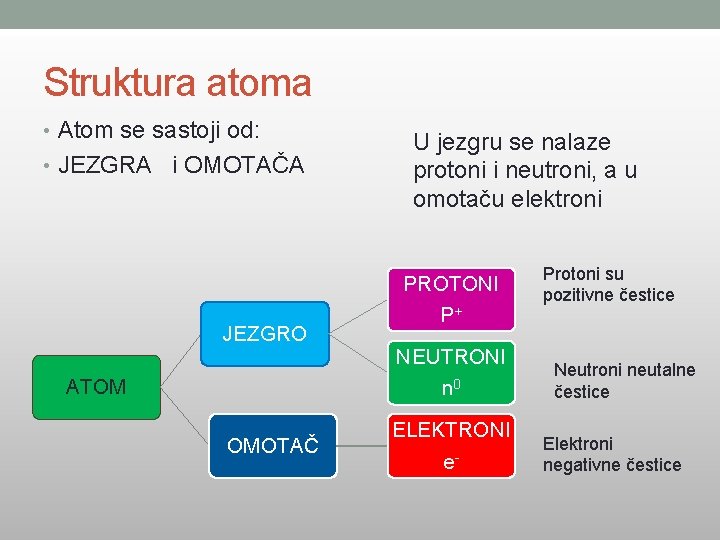
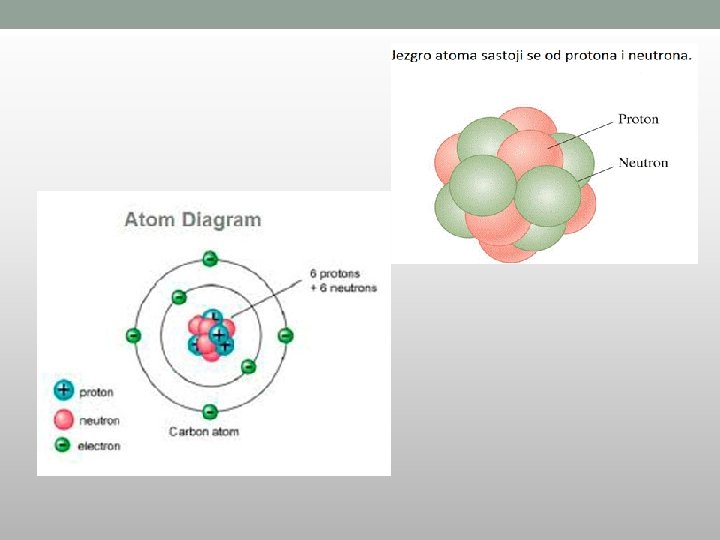
Struktura atoma • Atom se sastoji od: • JEZGRA i OMOTAČA JEZGRO ATOM OMOTAČ U jezgru se nalaze protoni i neutroni, a u omotaču elektroni PROTONI P+ NEUTRONI n 0 ELEKTRONI e- Protoni su pozitivne čestice Neutroni neutalne čestice Elektroni negativne čestice

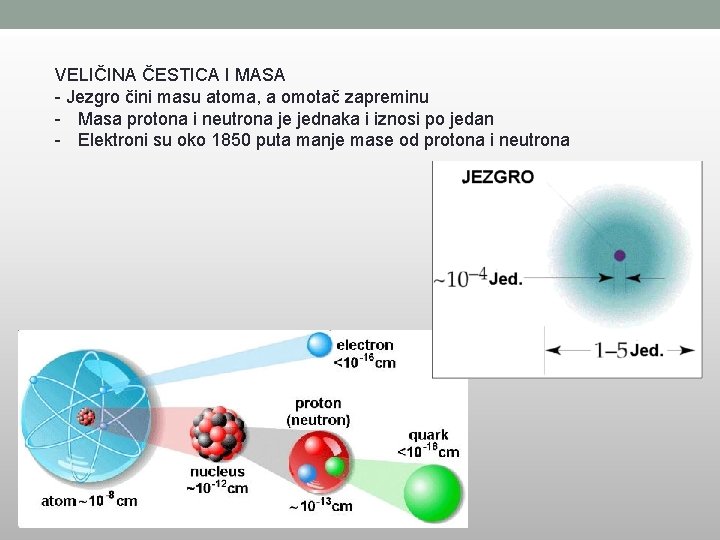
VELIČINA ČESTICA I MASA - Jezgro čini masu atoma, a omotač zapreminu - Masa protona i neutrona je jednaka i iznosi po jedan - Elektroni su oko 1850 puta manje mase od protona i neutrona

Naelektrisanje atoma • Iako ima naelektrisane čestice atom je ELEKTRONEUTRALAN jer ima isti broj protona i elektrona koji imaju istu količinu naelektrisanja suprotnog znaka • IZOTOPI su atomi istog elementa (isti broj protona i elektrona) a različite mase • Imaju različit broj neutrona

Iste čestice a različiti elementi!!! • Šta čini da se elementi razlikuju jedni od drugih? • Šta je uzrok formiranja beskrajno različitih supstanci?

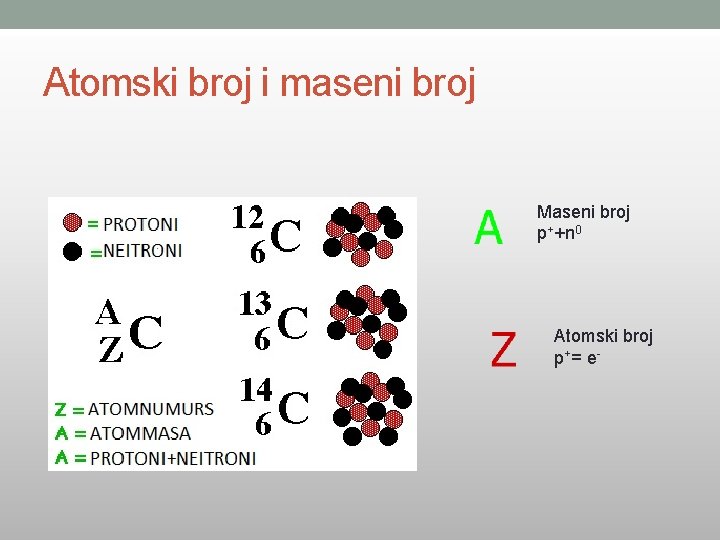
Atomski broj i maseni broj Maseni broj p++n 0 Atomski broj p+ = e -

MASENI BROJ = BROJ PROTONA + BROJ NEUTRONA 1 H 1 60 5 5

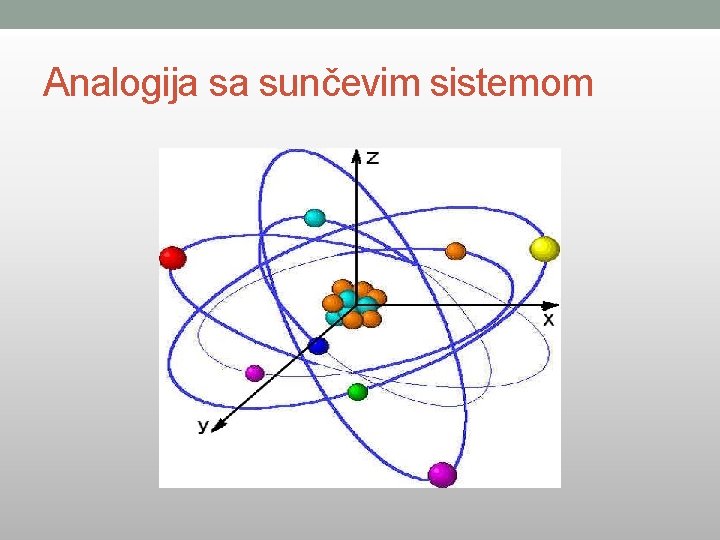
Analogija sa sunčevim sistemom


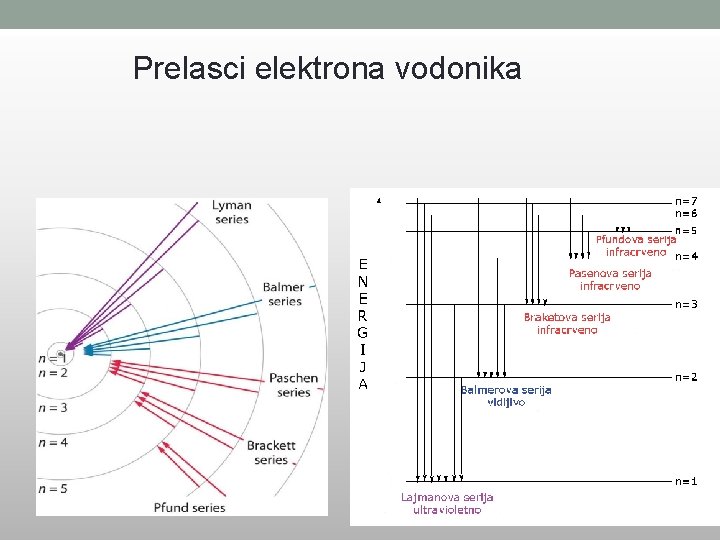
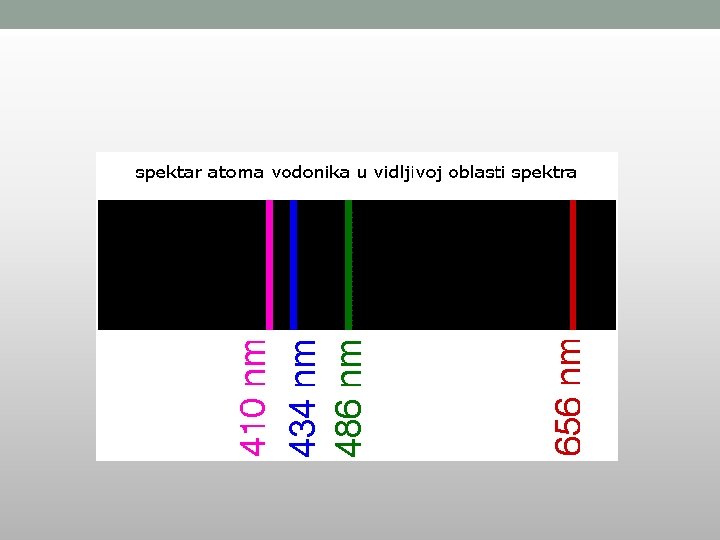
BOROVI POSTULATI • Elektron kruži oko jezgra atoma po određenim, dopuštenim, putanjama a da pri tome ne emituje energiju. • To je stacionarno stanje. • Najniža od tih putanja je osnovno ili normalno stanje atoma. • Apsorpcija i emitovanje energije od strane atoma se dešava samo prilikom skoka elektrona sa jedne dopuštene putanje na drugu. E 2 – E 1 = h·ν

Prelasci elektrona vodonika



Kvantno-mehanički model atoma • Dvojna priroda materije: talas i korpuskula –čeestica (de Brolji) • Hajzenbergov PRINCIP NEODREĐENOSTI • Nemoguće je istovremeno tačno ustanoviti brzinu i položaj elektrona u prostoru. • POSLEDICE PRINCIPA NEODREĐENOSTI • Elektronu u atomu se ne može pripisati određena putanja • • ORBITALA JE PROSTOR OKO JEZGRA ATOMA GDE JE NAJVEĆA VEROVATNOĆA NALAŽENJA ELEKTRONA

ELEKTRONSKE ORBITALE

Kvantni brojevi • Proizilaze iz rešenja talasne funkcije elektrona • Energija i kretanje elektrona u omotaču atoma definisano je sa 4 kvantna broja: • 1. Glavni kvantni broj n • 2. Azimutski, orbitalni ili sporedni kvantni broj l • 3. Magnetni kvantni broj m • 4. Spinski kvantni broj ms

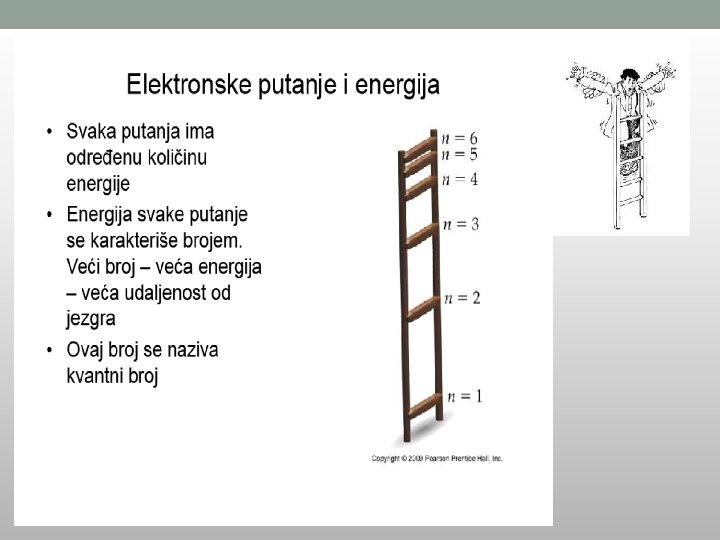
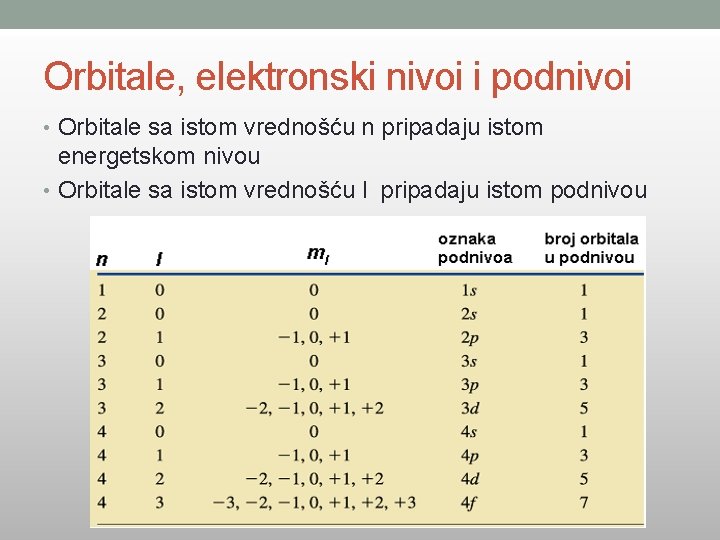
Glavni kvantni broj (n) • Predstavlja pozitivne cele brojeve od 1 do 7 (n=1, 2, 3, 4, 5, 6, 7) I • definiše energetski nivo elektrona (označava se i slovima K, L, M, N, O, P, Q); • Što je veća vrednost n, to je energetski nivo dalje od jezgra, • Udaljeniji elektroni poseduju veću energiju.

Drugi (azimutni, orbitalni) kvantni broj (l) • Može imati vrednosti l = 0, 1, 2, …n-1, • određuje podnivoe elektrona • označavaju se sa s, p, d, f; • l=0 • l=1 • l= 2 • l=3 s-podnivo p-podnivo d-podnivo f-podnivo

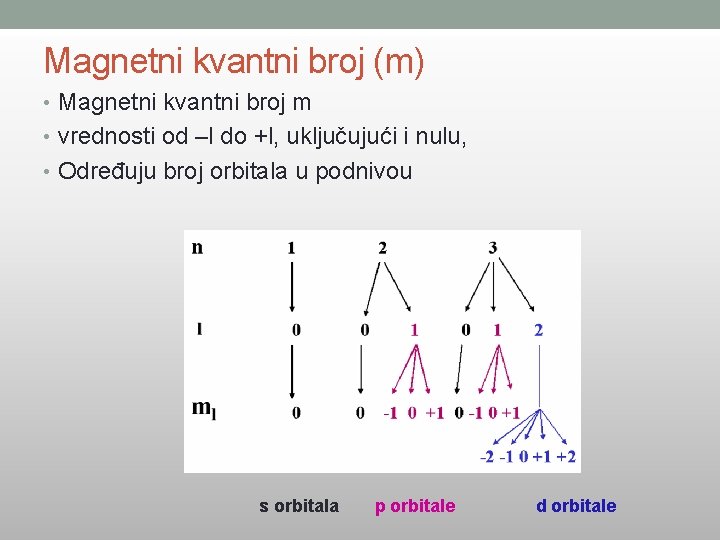
Magnetni kvantni broj (m) • Magnetni kvantni broj m • vrednosti od –l do +l, uključujući i nulu, • Određuju broj orbitala u podnivou s orbitala p orbitale d orbitale

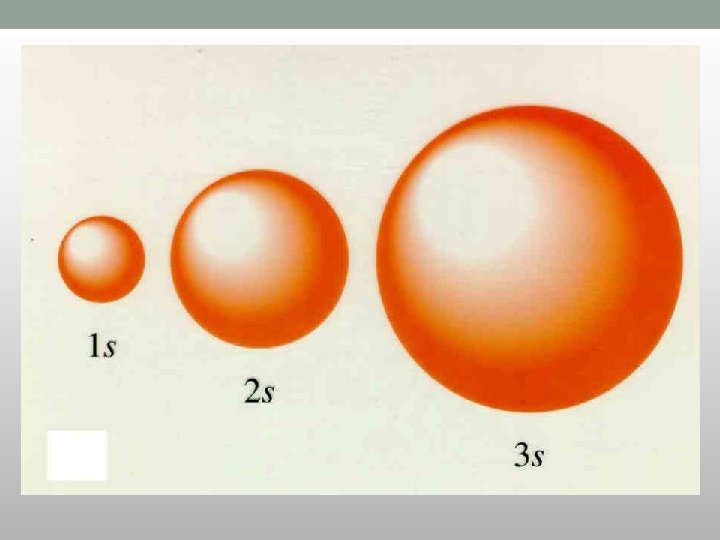
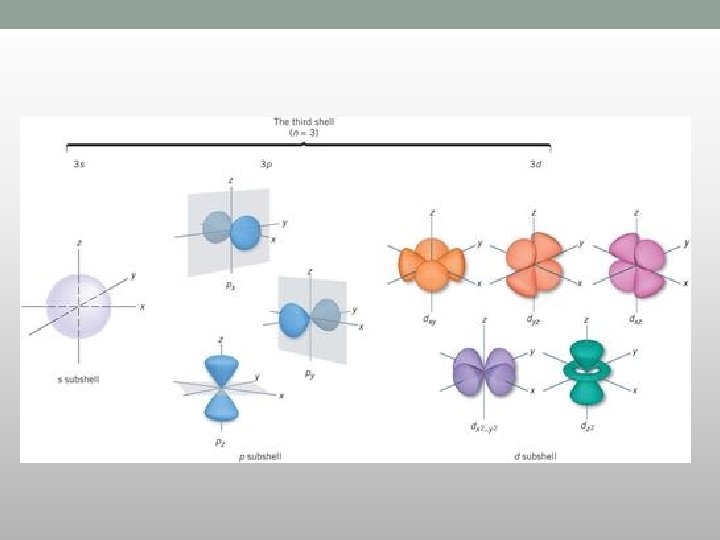
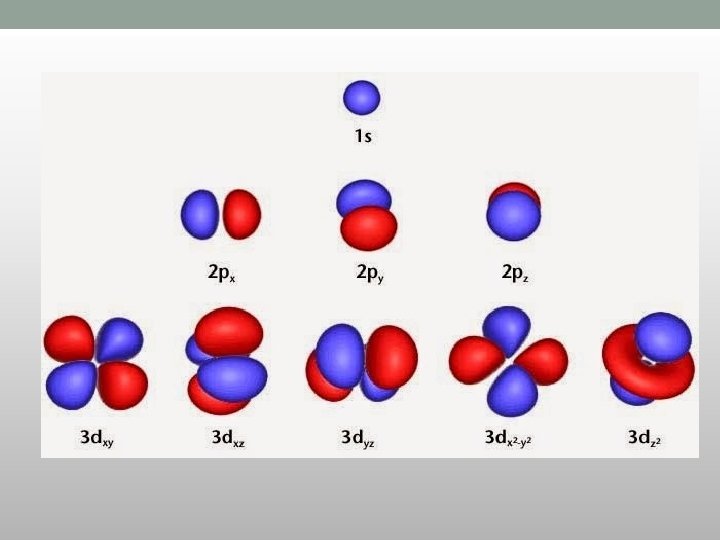
s-orbitale • Vrednost l = 0 • Jedna orbitala na energetskom nivou • Imaju oblik lopte (sfere) • Prečnik sfere raste sa porastom vrednosti n


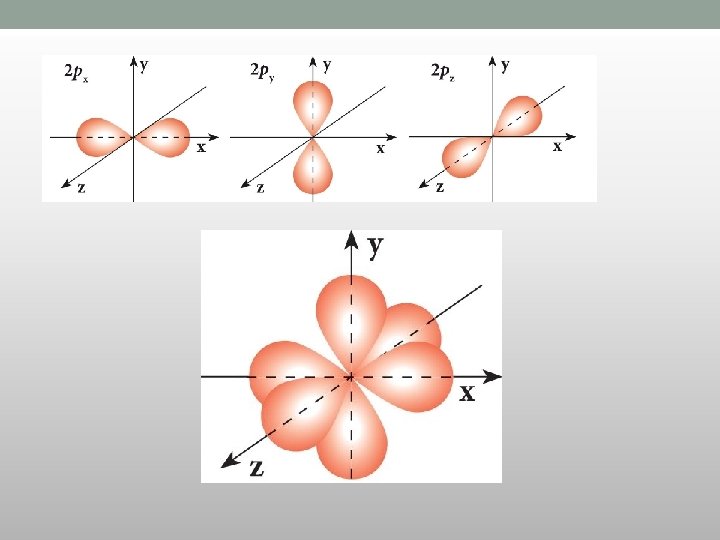
p-orbitale • Vrednost l = 1 • m= -1, 0, +1 • Ima tri orbitale iste energije elektrona • Imaju dva režnja i čvor između njih


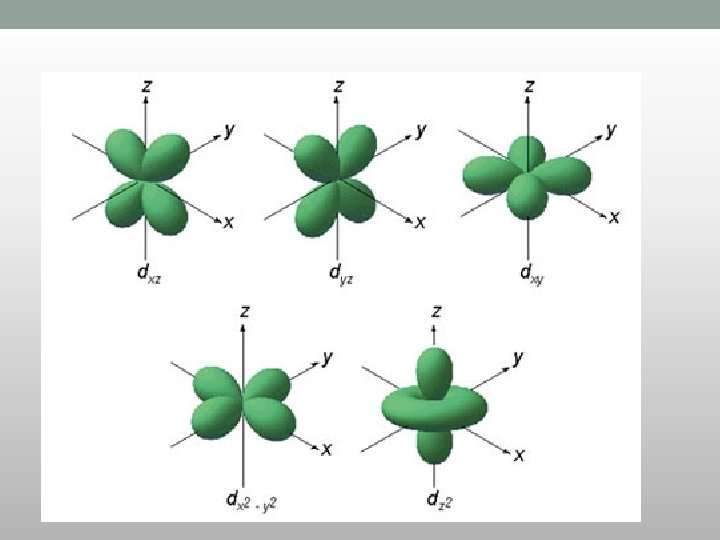
d-orbitale • Vrednost l = 2 • M=-2, -1, 0, +1, +2 • Ima pet d-orbitala iste energije elektrona • Četiri od pet orbitala imaju po četiri režnja, a peta podseća na p orbitalu sa đevrekom oko centra


f- orbitale • Vrednosti l=3 • m= -3, -2, -1, 0, 1, 2, 3 • Sedam f- orbitala iste energije elektrona



Orbitale, elektronski nivoi i podnivoi • Orbitale sa istom vrednošću n pripadaju istom energetskom nivou • Orbitale sa istom vrednošću l pripadaju istom podnivou

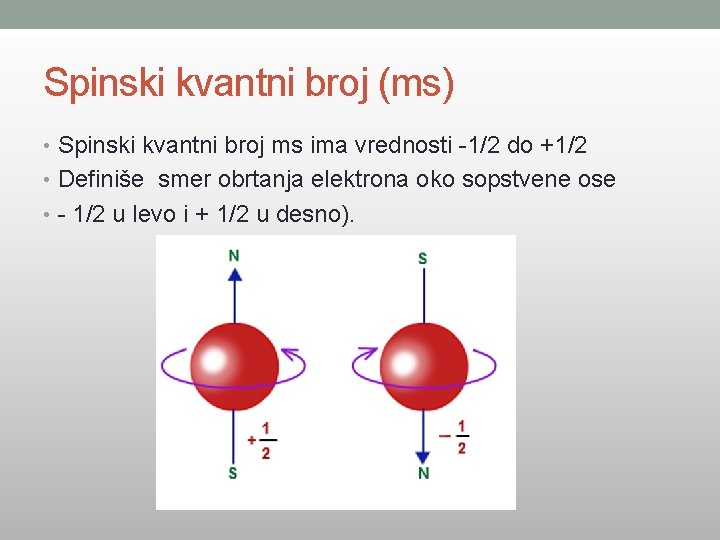
Spinski kvantni broj (ms) • Spinski kvantni broj ms ima vrednosti -1/2 do +1/2 • Definiše smer obrtanja elektrona oko sopstvene ose • - 1/2 u levo i + 1/2 u desno).

Elektronske konfiguracije • Paulijev princip isključivosti (Wolfgang Pauli) glasi • dva elektrona ne mogu da imati ista sva četiri kvantna broja. • Ako dva elektrona pripadaju istoj orbitali (n, l, m su isti), oni se međusobno moraju razlikovati po smeru spina (ms= +1/2 i ms = - ½) • Posledica: u jednoj orbitali mogu biti maksimalno 2 e- sa suprotnim spinovima

Elektronske konfiguracije • Hundovo pravilo – elektroni se razmeštaju unutar istovrsnih (degenerisanih) orbitala (orbitale iste energije, p i d orbitale istog podnivoa) tako da broj nesparenih elektrona sa paralelnim spinovima bude maximalan. • Elektroni degenerisanih orbitala zauzimaju što je moguće veći prostor u atomu, tako da su međusobno na što većem rastojanju. • Na taj način odbijanje između elektrona je manje, a energija atoma niža.

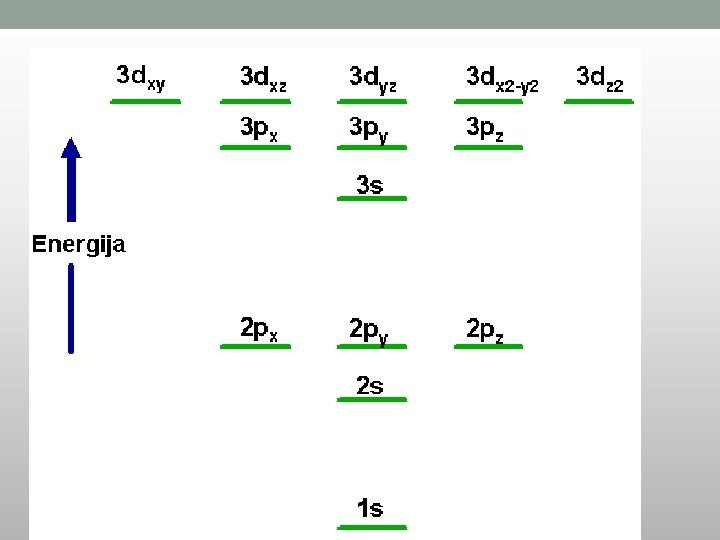
ELEKTRONSKA KONFIGURACIJA SA PORASTOM ENERGIJE ELEKTRONA



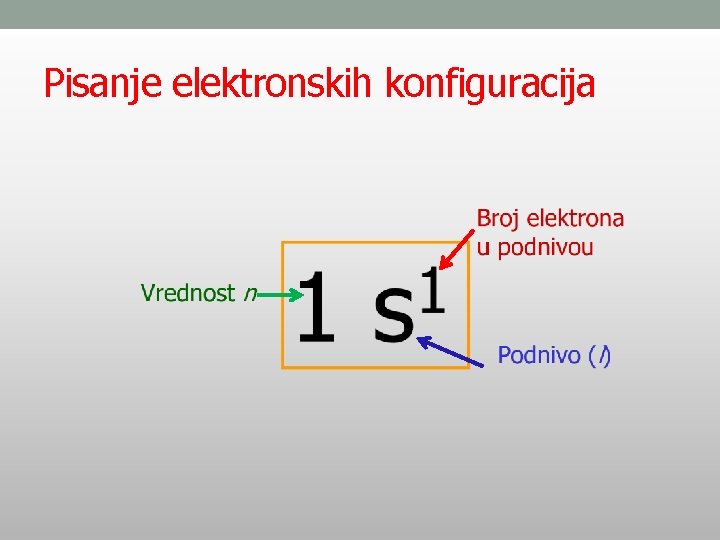
Pisanje elektronskih konfiguracija

Pisanje elektronskih konfiguracija • Atomska struktura natrijuma • Na je 11 -i elemenat u PS i taj poslednji elektron se smešta u 3 energetski nivo

Magnezijum 2 grupa PSE Ispunjena 1 s orbitala Preostao broj elektrona = 10

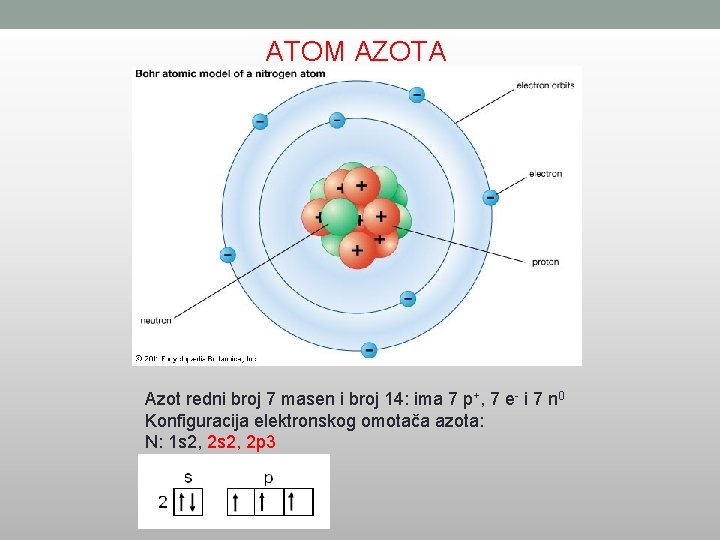
ATOM AZOTA Azot redni broj 7 masen i broj 14: ima 7 p+, 7 e- i 7 n 0 Konfiguracija elektronskog omotača azota: N: 1 s 2, 2 p 3

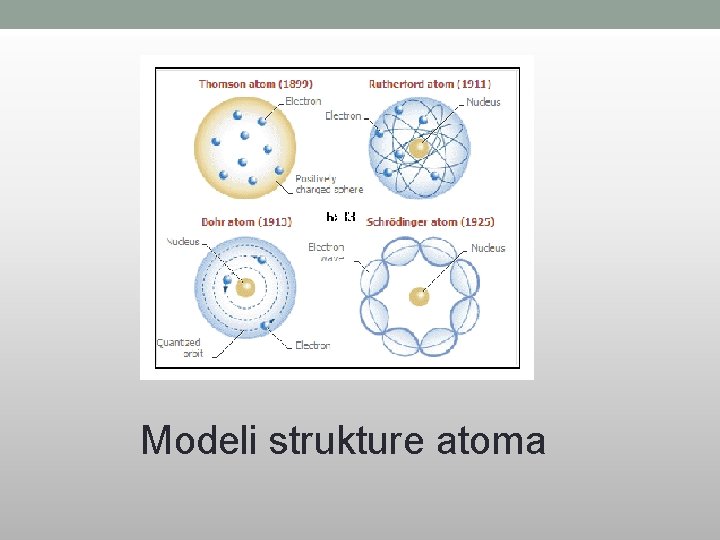
Modeli strukture atoma

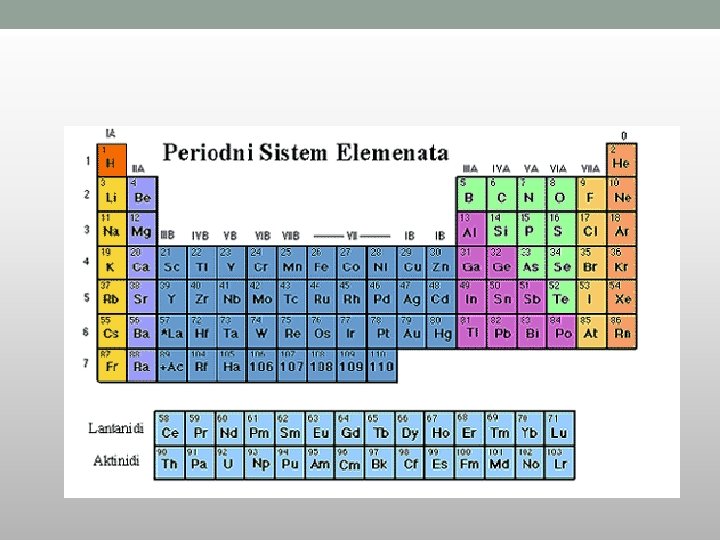
Periodni sistem elemenata i elektronska konfiguracija Mendeljejev je prvu verzija PSE objavio je 1869 god.

Zakon periodičnosti svojstava elemenata: • Mendeljejev: • “Hemijska svojstva elemenata su periodična funkcija njihovih relativnih atomskih masa” • Savremeni zakon periodičnosti: • “Hemijska svojstva elemenata su periodične funkcije njihovih elektronskih konfiguracija (rednih brojeva)”

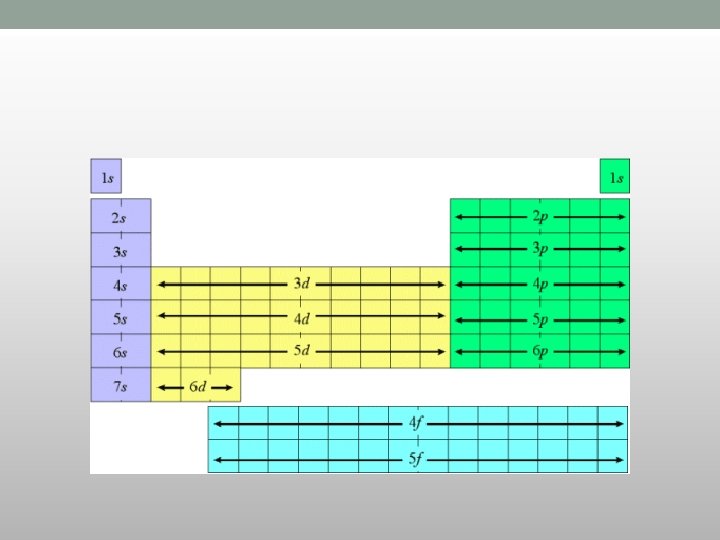
Periodni sistem elemenata i elektronska konfiguracija • U Periodnom sistemu elementi su poređani u nizu sa porastom njihovih • • • rednih (atomskih) brojeva (tj. sa povećanjem broja protona u jezgru i broja elektrona u elektronskom omotaču) i to u : - PERIODE i - GRUPE. Periode su horizontalni redovi u koje su ređani elementi po porastu broja protona u jezgru. Broj periode odgovara poslednjem energet. nivou (K, L, M, N, O , P , Q). Razlikujemo male i velike periode a sama dužina perioda je određena brojem podnivoa, koji se popunjavaju kada se formiraju periode. Grupe su vertikalni redovi u koje su ređani elementi po sličnim fiz. hem. osobinama čiji se atomi razlikuju po broju energetskih nivoa ali imaju istu konfiguraciju zadnjeg valentnog energetskog nivoa. • Elementi iste grupe periodnog sistema imaju slična hemijska svojstva



Periodni sistem elemenata i elektronska konfiguracija • Usled povećanja broja elektrona u elektronskom omotaču (u periodi) dolazi do: • - postepenog menjanja hemijskih svojstva i • - posle određenog broja novih elektrona ponovo se uspostavlja ista konfiguracija valentnih elektrona • što opet uslovljava slična hemijska svojstva tih elemenata.

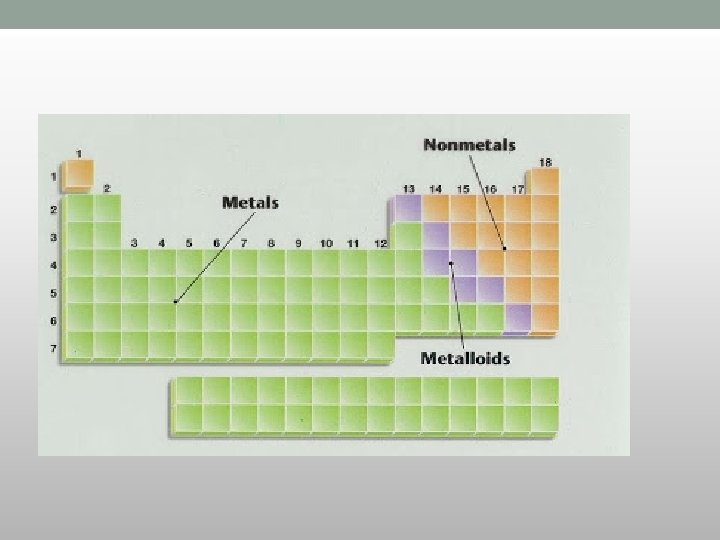
Periodni sistem elemenata i elektronska konfiguracija • Sa porastom rednog broja u grupi : • 1. raste: • - relativna atomska masa : , • - zapremina atoma, • - atomski poluprečnik • - metalni karakter elementa • 2. opada : • - energija prve jonizacije, • - elektronegativnost, • - standardni el. pot. ,

Periodni sistem elemenata i elektronska konfiguracija • Sa porastom rednog broja u periodi: • 1. raste: • - relativna atomska masa , • - veličina atoma, • - energija prve jonizacije • - afinitet prema elektronima • - elektronegativnost, standardni el. pot. , • - nemetalni karakter • 2. opada: • - metalni karakter elementa



HVALA NA PAŽNJI!!