Facultad de Ciencias Exactas y Naturales y Agrimensura


























































- Slides: 71

Facultad de Ciencias Exactas y Naturales y Agrimensura Universidad Nacional del Nordeste QUIMICA GENERAL Carreras: Ingeniería en Electrónica, Ingeniería Eléctrica, Ingeniería en Agrimensura Licenciatura en Física, Prof. en Física Unidad II: Estructura atómica de la materia

UNIDAD II: ESTRUCTURA ATÓMICA DE LA MATERIA. Evidencias que muestran la complejidad del átomo. Modelo atómico de Rutherford – Bohr. El átomo de hidrógeno. Naturaleza de la luz. Espectros atómicos. Rayos X y el número atómico. Dualidad onda – partícula. Principio de incertidumbre de Heisenberg. Modelo atómico moderno.

Cuando se estudie el tema se aprenderá: ØAcerca de la evidencia de la existencia y propiedades de los electrones, protones y neutrones. ØLas distribuciones de estas partículas en los átomos. ØAcerca de la naturaleza ondulatoria de la luz y cómo se relacionan longitud de onda, frecuencia y velocidad. ØLa descripción corpuscular de la luz, y como se relaciona con la descripción ondulatoria. ØAcerca de los espectros atómicos de emisión y absorción y cómo fueron la base de un importante avance en la teoría atómica. ØAcerca de la descripción mecanocuantica del átomo.




TEORÍA ATÓMICA DE DALTON üUn elemento se compone de partículas indivisibles extremadamente pequeñas llamadas átomos. üTodos los átomos de un elemento tienen propiedades idénticas que difieren de las de los átomos de los otros elementos. üLos átomos no pueden crearse, destruirse o transformarse en átomos de otro elemento. üLos compuestos se forman cuando átomos de diferentes elementos se combinan unos con otros en una relación de números enteros sencillos. üLos números relativos y clases de átomos son constantes en un compuesto dado. “los átomos no se crean ni se destruyen”

Un átomo puede definirse como la unidad básica de un elemento que puede entrar en combinación química y las partículas subatómicas que interesan en este hecho son:

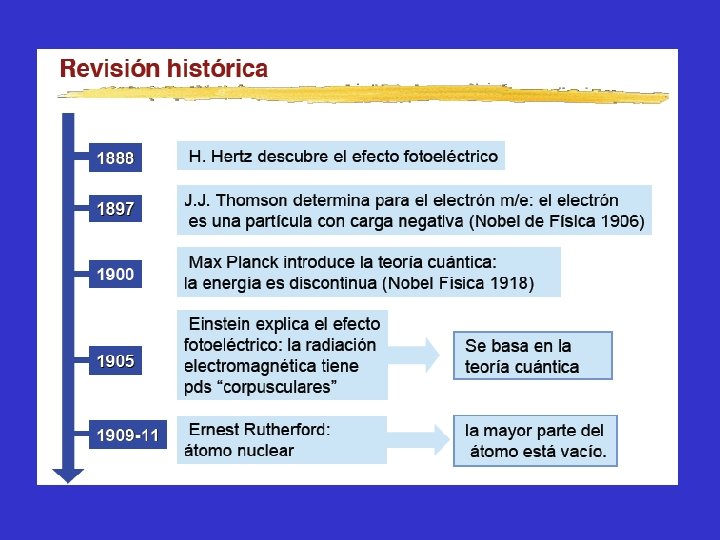
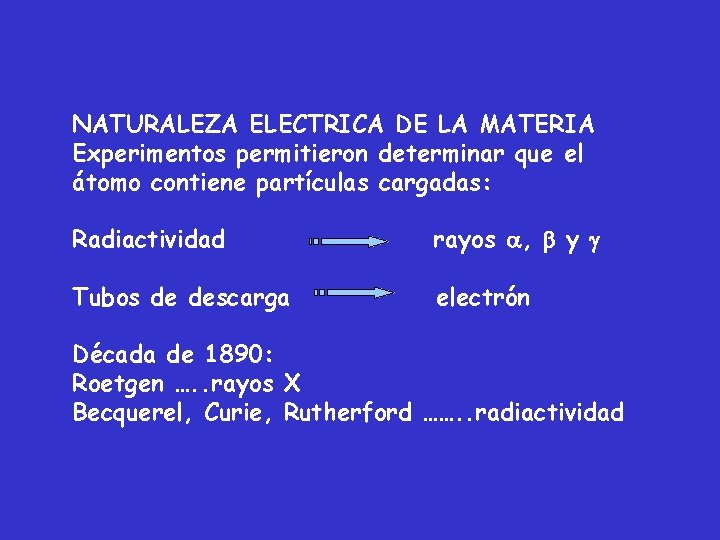
NATURALEZA ELECTRICA DE LA MATERIA Experimentos permitieron determinar que el átomo contiene partículas cargadas: Radiactividad rayos , y Tubos de descarga electrón Década de 1890: Roetgen …. . rayos X Becquerel, Curie, Rutherford ……. . radiactividad


La radiactividad es un término que se aplica para describir la descomposición espontánea de los átomos de ciertos elementos para producir tres clases de radiación: rayos , rayos y rayos : “ la descomposición del núcleo atómico” Los rayos son corpúsculos materiales que transportan carga eléctrica positiva. Se mueven a altas velocidades (30000 km/s), no son detectables por el ojo humano, son núcleos del elemento helio: 42 He 2+ Los rayos son partículas muy pequeñas que transportan carga eléctrica negativa. Son electrones que se mueven a velocidades cercanas a 200000 km/s. Los rayos son radiaciones luminosas invisibles al ojo humano con propiedades semejantes a los de la luz, se mueven a una velocidad de 300000 km/s.

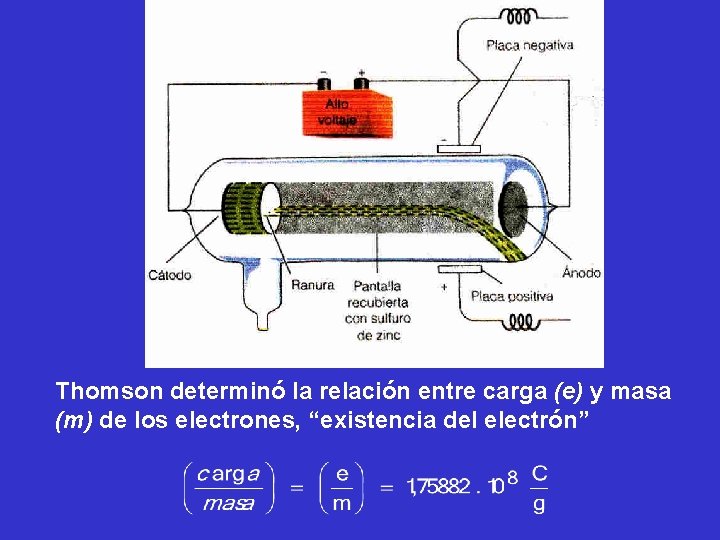
ELECTRON En 1881 George Stoney sobre el trabajo realizado por Faraday de electrólisis, sugirió el nombre de electrones a las unidades de cargas eléctricas asociadas con los átomos. La evidencia más convincente de la existencia de los electrones vino de los experimentos que usaban tubos de rayos catódicos


Thomson determinó la relación entre carga (e) y masa (m) de los electrones, “existencia del electrón”

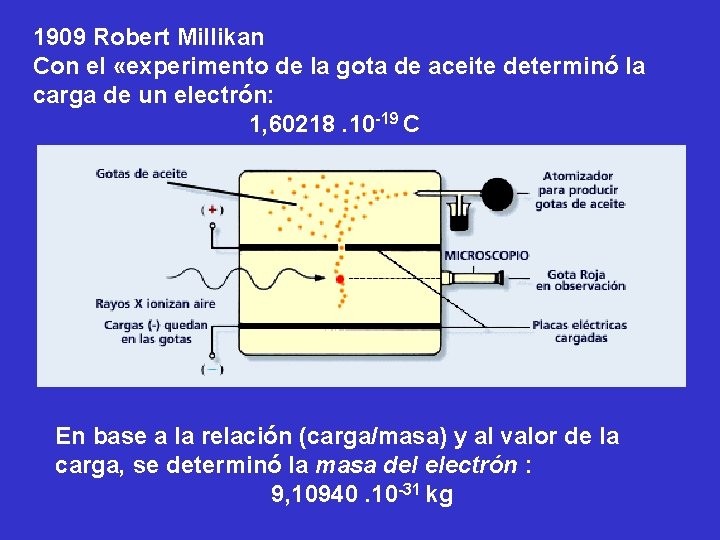
1909 Robert Millikan Con el «experimento de la gota de aceite determinó la carga de un electrón: 1, 60218. 10 -19 C En base a la relación (carga/masa) y al valor de la carga, se determinó la masa del electrón : 9, 10940. 10 -31 kg

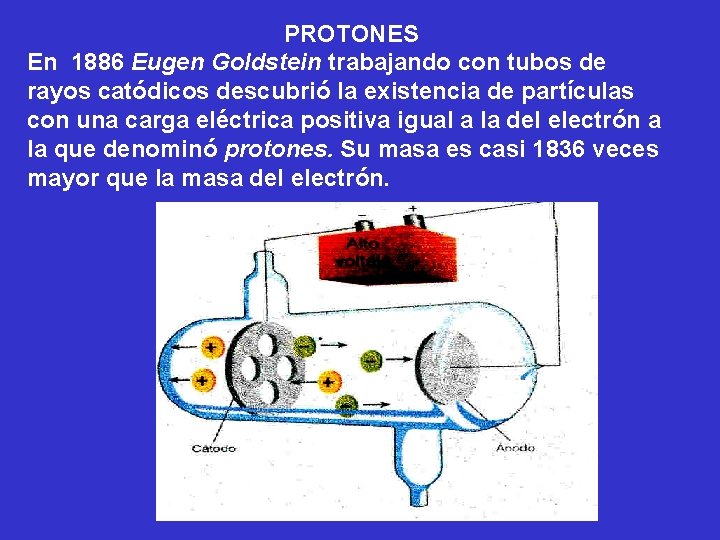
PROTONES En 1886 Eugen Goldstein trabajando con tubos de rayos catódicos descubrió la existencia de partículas con una carga eléctrica positiva igual a la del electrón a la que denominó protones. Su masa es casi 1836 veces mayor que la masa del electrón.

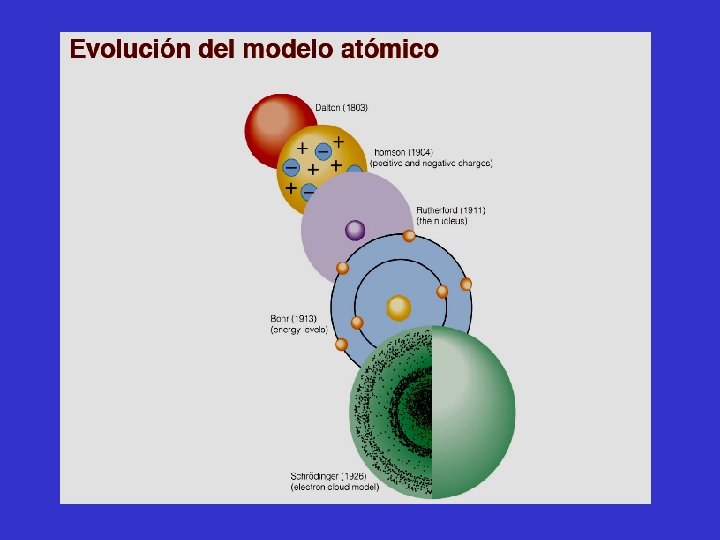
MODELO ATOMICO DE THOMSON Modelo del bizcocho de ciruelas o modelo del budín de pasas. El átomo debía de ser una esfera de materia cargada positivamente, en cuyo interior estaban incrustados los electrones.

El modelo atómico de Thomson, también conocido como el budín de pasas, es una teoría sobre la estructura atómica propuesta en 1897 por J. Thomson, descubridor del electrón antes del descubrimiento del protón y del neutrón. En dicho modelo, el átomo está compuesto por electrones de carga negativa en un átomo positivo, como pasas en un budín. Se pensaba que los electrones se distribuían uniformemente alrededor del átomo. • Es estático porque los electrones no tienen movimiento. • La masa y la carga eléctrica positiva se hallan repartidas y distribuidas uniformemente en todo el espacio ocupado por la esfera.

MODELO ATOMICO DE RUTHERFORD 1909: Ernest Rutherford había establecido que las partículas alfa ( ) son partículas cargadas positivamente que pueden ser emitidas por algunos átomos radiactivos.

Las experiencias de Rutherford y colaboradores determinaron que el átomo consiste en un núcleo cargado positivamente muy pequeño y denso rodeado por una nube de electrones que se hallan a una distancia relativamente grande de él.

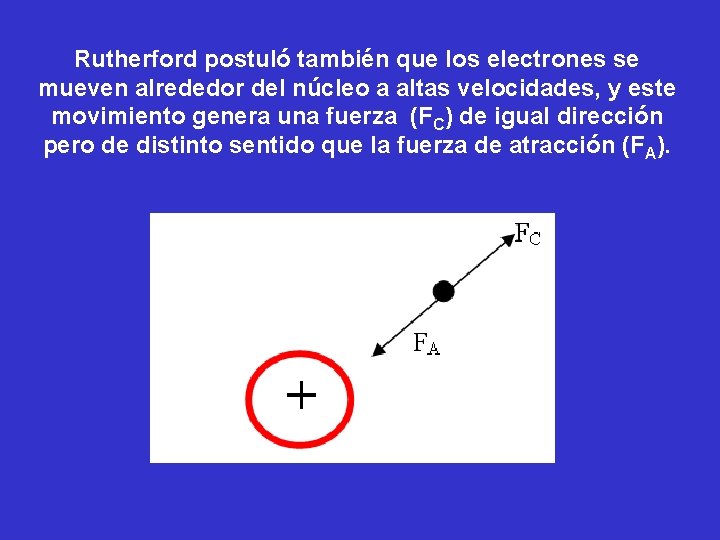
Rutherford postuló también que los electrones se mueven alrededor del núcleo a altas velocidades, y este movimiento genera una fuerza (FC) de igual dirección pero de distinto sentido que la fuerza de atracción (FA).


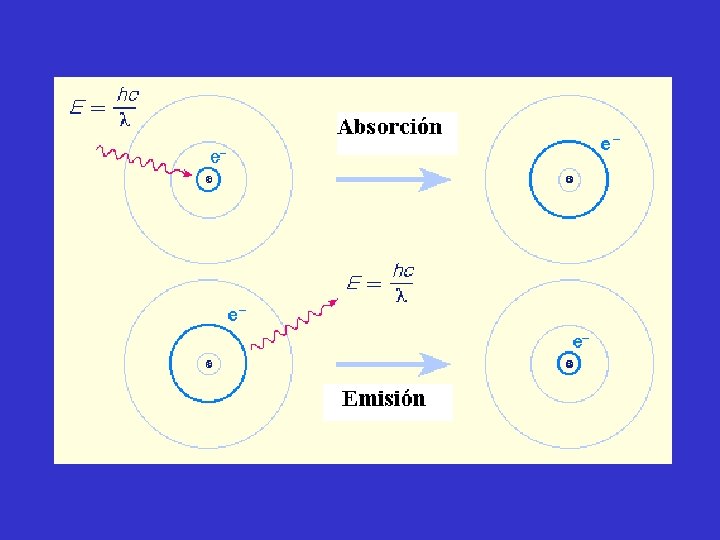
NATURALEZA DE LA LUZ Gran parte del conocimiento actual sobre la naturaleza de los átomos y moléculas, con todos sus detalles, procede de experiencias en las que la luz o las radiaciones interaccionan con la materia. Los fenómenos provocados por la luz pueden ser explicados a partir de las teorías ondulatoria y corpuscular

TEORIA ONDULATORIA Considera que la luz o radiación luminosa está formada por ondas electromagnéticas.

Un rayo de radiación electromagnética está formado por oscilaciones (variaciones en el tiempo) de campos eléctricos y magnéticos (con la misma longitud de onda y frecuencia) que viajan a través del espacio vacío, en planos perpendiculares entre sí, a una velocidad de 3 x 108 m. s-1. . =c c = 2, 9979 1010 cm/s ; se expresa en nm ó Å; en s-1 (Hz)

Son ejemplos de radiaciones electromagnéticas la luz visible, ondas de radio, rayos X, microondas, etc. estas formas de radiación, transfieren energía desde una región del espacio hasta otra.

Una razón por la que una radiación electromagnética es una buena herramienta para el estudio de los átomos, es que un campo eléctrico ejerce acciones sobre las partículas cargadas como los electrones. Cuando un rayo de luz pasa por donde está un electrón, su campo eléctrico impulsa al electrón, una y otra vez, primero en una dirección y luego en la dirección opuesta

El número de ciclos (cambios completos de dirección alejándose y acercándose a la fuerza y dirección iniciales) por segundo se denomina frecuencia de la radiación y se simboliza (nu). La unidad de frecuencia, 1 hertz (1 Hz) se define como 1 ciclo por segundo: 1 Hz = 1 s-1. La onda se caracteriza por su amplitud y su longitud de onda. La amplitud es la altura de la onda por sobre la línea central. El cuadrado de la amplitud determina la intensidad o brillo de la radiación. La longitud de onda (λ) es la distancia entre dos picos (crestas o valles).


Diferentes longitudes de onda de la radiación electromagnética corresponden a diferentes regiones del espectro. Nuestros ojos detectan radiación electromagnética con longitudes de onda comprendidas en el rango de 700 nm (luz roja) a 400 nm (luz violeta), rango denominado luz visible y la frecuencia de la luz visible determina su color. La luz blanca, que incluye a la luz solar, es una mezcla de todas longitudes de onda de la luz visible.

Se cumple la relación: c = λ. A una longitud de onda corta corresponde una radiación de alta frecuencia y a una longitud de onda larga corresponde una radiación de baja frecuencia. Por ejemplo, para hallar la λ de la luz azul de frecuencia 6, 4 x 1014 Hz, se aplica λ = c/ λ = 3 x 108 m. s-1 / 6. 4 x 1014 s-1 = 4, 7 x 10 -7 m (470 nm).

Ejercicio: a) calcule las longitudes de onda de las luces del semáforo a partir de los datos de frecuencia: verde, = 5, 75 x 1014 Hz; amarillo, = 5, 15 x 1014 Hz; rojo, =4, 27 x 1014 Hz. ; b) Cuál es la longitud de onda de una estación de radio que transmite a 98, 4 MHz. (1 MHz = 106 Hz) La radiación ultravioleta, es radiación de frecuencia mayor que la de la luz violeta, su longitud de onda es algo menor que 400 nm La radiación infrarroja, que experimentamos como calor tiene frecuencia menor y longitud de onda más larga que la luz roja; su longitud de onda es un poco mayor de 800 nm. Las microondas que se utilizan en radares y en hornos de microondas, poseen longitudes de onda comprendidas en el rango del milímetro al centímetro.

Radiación, cuantos y fotones. Max Planck, físico alemán, propuso que el intercambio de energía entre materia y radiación ocurre en cuantos o paquetes de energía. Su idea central fue que un átomo que oscila a una frecuencia puede intercambiar energía con sus alrededores solo en paquetes de magnitud E= h . La constante h, es llamada constante de Planck y tiene un valor h = 6, 626 x 10 -34 J. s.

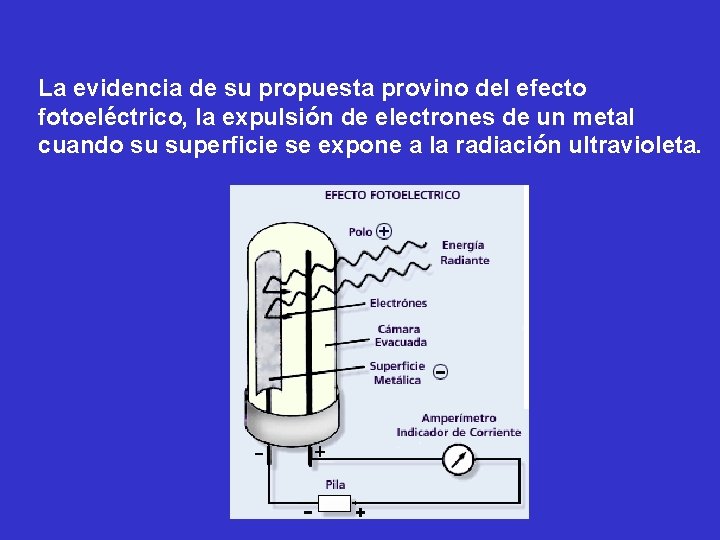
La evidencia de su propuesta provino del efecto fotoeléctrico, la expulsión de electrones de un metal cuando su superficie se expone a la radiación ultravioleta.

Las observaciones experimentales fueron las siguientes: a) los electrones no son expulsados a menos que la radiación posea una frecuencia por encima de cierto valor umbral característico de cada metal; b) los electrones son expulsados inmediatamente, sin importar cuán baja sea la intensidad de la radiación; c) la energía cinética de los electrones expulsados aumenta linealmente con la frecuencia de la radiación incidente.

TEORIA CORPUSCULAR Einsten propuso que la radiación electromagnética está compuesta por partículas, las que posteriormente fueron denominadas fotones. Cada fotón puede ser considerado como un paquete de energía y la energía de un único fotón se relaciona con la frecuencia de la radiación a través de la ecuación E= h . Explica fenómenos como el efecto fotoeléctrico

La intensidad de la radiación es un índice del número de fotones presentes, mientras que E= h , es una medida de la energía de cada fotón individual. La energía de un único fotón de luz azul de frecuencia 6, 4 x 1014 Hz es: E= (6, 626 x 10 -34 J. s) x (6, 4 x 1014 s-1) = 4, 2 x 10 -19 J. El efecto fotoeléctrico proporciona fuerte apoyo a la idea de que la radiación electromagnética consiste en fotones que se comportan como partículas. Sin embargo, hay abundante evidencia que demuestra que la radiación electromagnética se comporta como ondas, tal el caso de la difracción de un rayo de luz.

Los experimentos nos obligan a aceptar la dualidad onda partícula de la radiación electromagnética, en la cual se combinan los conceptos de ondas y de partículas. En el modelo ondulatorio, la intensidad de la radiación es proporcional al cuadrado de la amplitud de la onda. En el modelo de partículas, la intensidad es proporcional al número de fotones presentes en cada instante.

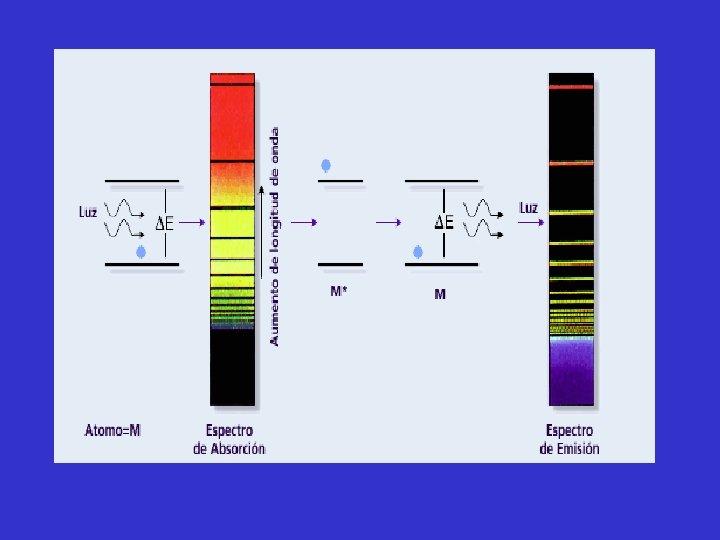
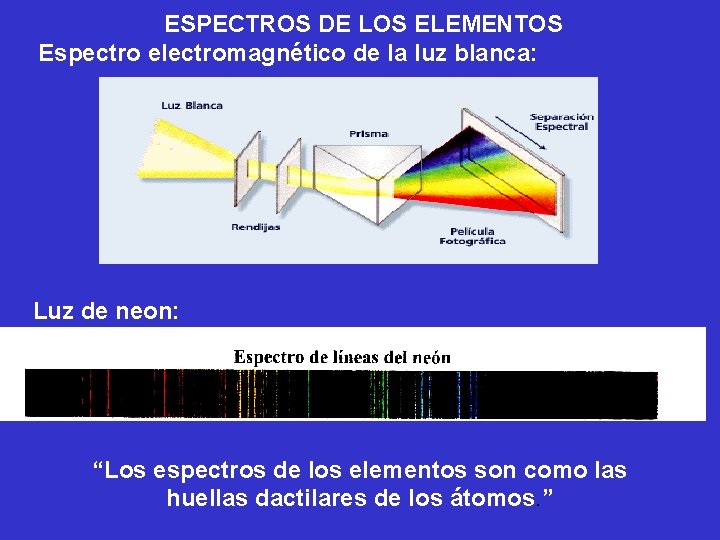
Teoría de Bohr del átomo de hidrógeno. Las investigaciones de Einsten prepararon el camino para resolver el misterio de los espectros de emisión de los átomos Los espectros de emisión de los átomos en fase gaseosa no muestran una distribución continua de longitudes de onda del rojo al violeta; más bien los átomos producen líneas brillantes en distintas partes del espectro visible. Estos espectros de líneas corresponden a la emisión de la luz sólo a ciertas longitudes de onda. Cada elemento tiene un espectro de emisión único.



ESPECTROS DE LOS ELEMENTOS Espectro electromagnético de la luz blanca: Luz de neon: “Los espectros de los elementos son como las huellas dactilares de los átomos. ”

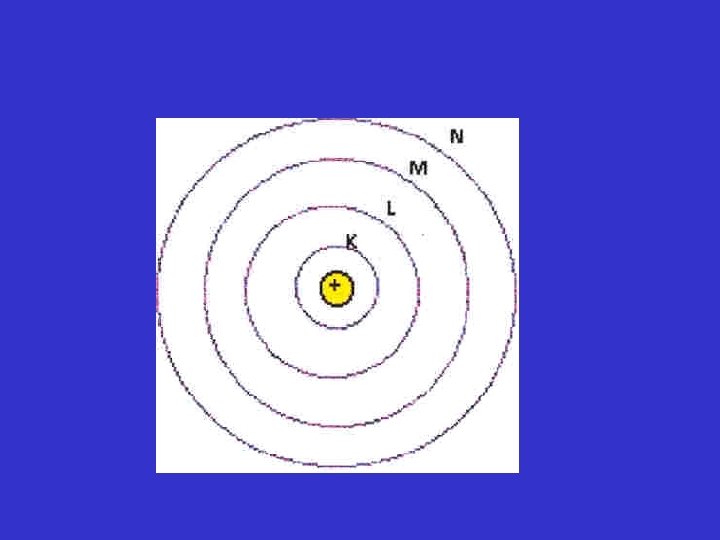
En 1913, después de los descubrimientos de Planck y Einsten, el físico danés, Niels Bohr, dio a conocer una explicación teórica del espectro de emisión del átomo de hidrógeno En esa fecha, los físicos ya sabían que los átomos estaban formados de electrones y protones. Consideraban al átomo como una unidad donde los electrones giraban alrededor del núcleo en órbitas circulares a gran velocidad, un movimiento semejante al de los planetas alrededor del sol. (Modelo Atómico de RUTHERFORD – BOHR)


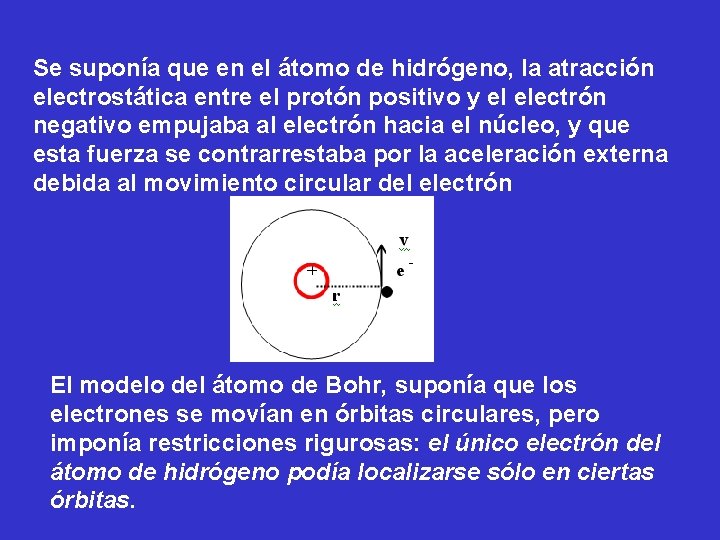
Se suponía que en el átomo de hidrógeno, la atracción electrostática entre el protón positivo y el electrón negativo empujaba al electrón hacia el núcleo, y que esta fuerza se contrarrestaba por la aceleración externa debida al movimiento circular del electrón El modelo del átomo de Bohr, suponía que los electrones se movían en órbitas circulares, pero imponía restricciones rigurosas: el único electrón del átomo de hidrógeno podía localizarse sólo en ciertas órbitas.

Como cada órbita tiene una energía particular, las energías asociadas al movimiento del electrón en las órbitas permitidas, deberían tener un valor fijo, es decir están cuantizadas. Bohr supuso que la emisión de radiación por un átomo de hidrógeno energizado se debía a la caída del electrón desde una órbita de mayor energía a otra de menor energía y esto originaba un cuanto de energía (un fotón) en forma de luz.

Bohr demostró que las energías que tiene el electrón en el átomo de hidrógeno están dadas por la expresión: En = - RH (1/n 2) R H : constante de Rydberg = 2, 18 x 10 -18 J; n: número cuántico principal = 1, 2, 3…. . número entero El signo negativo en la ecuación es una convención arbitraria para indicar que la energía del electrón en el átomo es menor que la energía del electrón libre, es decir, ubicado a una distancia infinita del núcleo. A la energía de un electrón libre se asigna un valor arbitrario igual a cero

Cuando el electrón se acerca más al núcleo (n disminuye), En aumenta su valor absoluto y lo vuelve más negativo. Su valor más negativo se alcanza para n=1 y corresponde al estado energético más estable conocido como estado fundamental o nivel basal y corresponde al estado de energía más bajo de un sistema. La estabilidad del electrón disminuye a medida que n aumenta n = 2, 3, …. . Cada uno de estos niveles es un estado excitado o nivel excitado y tiene mayor energía que el estado fundamental. Cuanto mayor sea el estado excitado, el electrón está más lejos del núcleo y este lo retiene con menor fuerza.

La teoría de Bohr ayuda a explicar el espectro de línea del átomo de hidrógeno. Si el átomo absorbe energía radiante, su electrón pasa de un estado de energía más bajo a otro de mayor energía (mayor valor de n). En cambio, si el electrón se mueve desde un estado de mayor energía a otro de menor energía, se emite energía radiante en forma de un fotón. La cantidad de energía necesaria para mover un electrón en el átomo de Bohr, depende de la diferencia de los niveles de energía entre los estados inicial y final

∆E = Ef – Ei; Ef = -RH (1/nf 2) ; Ei= -RH (1/ni 2) ∆ E = RH (1/ni 2 – 1/nf 2) Dado que esta transición lleva a la emisión de un fotón de frecuencia y energía h. , se puede escribir: ∆ E = h. = RH (1/ni 2 – 1/nf 2) Si se emite un fotón ni > nf, el término entre paréntesis es negativo y ∆E es negativo (la energía se pierde hacia los alrededores). Si se absorbe energía, ni< nf, el término entre paréntesis es positivo y ∆E positivo.

La brillantez de una línea del espectro depende del número de fotones emitidos que tengan la misma longitud de onda. El espectro de emisión del hidrógeno abarca una amplia gama de longitudes de onda desde el infrarrojo hasta el ultravioleta. Las series de transición llevan el nombre de sus descubridores: Series Lyman Balmer Paschen nf 1 2 3 ni 2, 3, 4… 3, 4, 5… 4, 5, 6… región del espectro ultravioleta visible y ultravioleta infrarrojo Brakett 4 5, 6, 7…. Infrarrojo

Series espectrales del hidrógeno Proceso de emisión en un átomo de hidrógeno excitado

La teoría de Bohr aplicada al átomo de hidrógeno tiene cuatro postulados : ØEl electrón gira alrededor del núcleo en órbitas circulares permitidas. ØCada órbita permitida tiene una energía definida, es decir la energía está cuantificada. ØCuando el electrón se halla en una órbita permitida es estable, es decir no irradia energía, sólo puede ganar o perder energía cuando pasa de una órbita permitida a otra. ØPara que el electrón se halle en una órbita permitida debe cumplir con la condición cuántica, la cual establece que el momento angular del electrón debe ser un múltiplo entero de la cantidad ( h/2 ).


Dualidad onda partícula de la materia. La naturaleza dual del electrón Se cuestionaba por qué las energías del electrón de hidrógeno eran cuantizadas, es decir por qué el electrón estaba circunscripto a girar en órbitas alrededor del núcleo a distancias fijas. En 1924, Louis de Broglie dio la solución a este enigma: propuso que un electrón enlazado al núcleo se comporta como una onda estacionaria. de Broglie llegó a la conclusión de que las ondas se comportan como partículas y éstas exhiben propiedades ondulatorias. Propuso que todas las partículas deberían ser consideradas como provistas de propiedades ondulatorias

Sugirió además que la longitud de onda asociada con la “onda de materia” es inversamente proporcional a la masa de la partícula, m, y a su velocidad, v. Las propiedades de partícula y de onda se relacionan por medio de la siguiente expresión: λ = h/m. v El lado izquierdo de la ecuación expresa la propiedad de una onda, su longitud de onda; el lado derecho incluye a la masa, una propiedad característica de una partícula. El carácter ondulatorio de los electrones fue detectado mediante la demostración de que producían imágenes de difracción. En la actualidad la difracción de electrones es una técnica importante para la determinación de las estructuras de las moléculas y para la exploración de las estructuras de las superficies sólidas

Ejercicio: Calcule la longitud de onda de las siguientes partículas: a) una pelota de tenis de masa 6, 00 x 10 -2 kg que viaja a una velocidad de 68 m/s; b) un electrón, masa = 9, 1094 x 10 -31 kg que se desplaza a 63 m/s. λ = h/mv; λ = 6, 63 x 10 -34 J. s/ (6, 0 x 10 -2 kg) x 63 m/s = 1, 6 x 10 -34 m. Este valor tan pequeño de longitud de onda, no puede ser medido por ningún dispositivo, por esto no hay manera de detectar las propiedades de onda de una pelota de tenis. λ = h/mv; λ = 6, 63 x 10 -34 J. s / (9, 1094 x 10 -31 kg) x 68 m/s = 1, 1 x 10 -5 m o 1, 1 x 104 nm. Esta longitud de onda se encuentra en la región infrarroja.

Este ejercicio nos muestra que aunque la ecuación de De Broglie, se aplica a distintos sistemas, las propiedades ondulatorias solo se observan en los electrones y otras partículas submicroscópicas. Esto se debe al valor tan pequeño de la constante de Planck que aparece en el numerador de la ecuación.

Mecánica cuántica La dualidad onda partícula barre los fundamentos de la física clásica y modifica nuestra comprensión de la radiación electromagnética y de la materia. En la mecánica clásica, una partícula tiene una trayectoria definida, su localización y el momento lineal están especificados en cada instante La propuesta de Bohr no podía explicar los espectros de emisión de los átomos que tenían más de un electrón como los de helio y litio. Tampoco explicaba por qué aparecían más líneas en el espectro de emisión del átomo de hidrógeno cuando se aplicaba un campo magnético.

Con el descubrimiento del comportamiento ondulatorio de los electrones surgió otro problema: cómo precisar la posición de una onda, ya que al extenderse en el espacio, no se puede saber su posición exacta. W. Heisenberg, formuló una teoría, que hoy se conoce como Principio de Incertidumbre de Heisenberg: “Es imposible conocer con certeza el momento p (definido como la masa x velocidad) y la posición de una partícula simultáneamente”. También se lo expresa: "es imposible determinar simultáneamente y con exactitud, la posición y la velocidad del electrón"

Matemáticamente esto se expresa: ∆x. ∆p ≥ h/4π. ; ∆p. ∆x ≥ ½ ћ Ћ: h partida, significa h/2π ∆x y ∆p son las incertidumbres en las mediciones de la posición y el momento respectivamente. Cuando se mide con mayor precisión el momento de una partícula (∆p pequeño), su posición se va a estimar con menor precisión (∆x se hace mayor). Aplicando este principio al átomo de hidrógeno, se deduce que en realidad, el electrón no viaja en la órbita alrededor del núcleo con una trayectoria bien definida, como suponía Bohr

La contribución de Bohr fue importante para la comprensión de los átomos y su sugerencia de que la energía de un electrón en un átomo está cuantizada, permanece inalterada. Pero esta teoría no describe por completo el comportamiento electrónico en los átomos. En 1926, mediante un desarrollo matemático complejo, el físico austriaco E. Schrödinger, formuló una ecuación que describe el comportamiento y la energía de las partículas subatómicas en general. Para resolver esta ecuación hay que hacer cálculos avanzados que no vamos a considerar en esta asignatura

Esta ecuación incorpora tanto el comportamiento de partícula, en términos de la masa m, como el de onda, en términos de una función de onda ψ (psi), la cual depende de la ubicación del sistema en el espacio (como la del electrón en un átomo). La probabilidad de encontrar al electrón en cierta región del espacio es proporcional al cuadrado de la función de onda ψ2.

Descripción mecánico-cuántica del átomo de hidrógeno. La ecuación de Schrödinger especifica los posibles estados de energía que puede ocupar el electrón del átomo de hidrógeno e identifica las respectivas funciones de onda. Los estados de energía y sus funciones de onda se caracterizan por un conjunto de números cuánticos con los que es posible construir un modelo comprensible del átomo de hidrógeno.

El concepto de densidad electrónica da la probabilidad de encontrar un electrón en cierta región del átomo. El cuadrado de la función de onda, ψ2, define la distribución de densidad electrónica alrededor del núcleo en el espacio tridimensional. Las regiones de alta densidad electrónica representan la mayor probabilidad de localizar un electrón, lo contrario se aplica a las regiones de baja densidad electrónica. En la mecánica cuántica, el concepto de órbita del modelo de Bohr, se sustituye por el de orbital atómico.

El orbital atómico se considera como la función de onda del electrón de un átomo. Decir que un electrón está en cierto orbital, significa que la distribución de densidad electrónica o probabilidad de localizar un electrón en el espacio, se expresa mediante el cuadrado de la función de onda asociada con ese orbital. Un orbital atómico tiene energía y distribución características de la densidad electrónica.

La ecuación de Schrödinger funciona bien para el átomo de hidrógeno, con un protón y un electrón, pero no se resuelve con exactitud para átomos que tengan más de un electrón. Los físicos y los químicos superan esta dificultad con métodos de aproximación. Se supone que la diferencia no es muy grande entre el comportamiento de átomos polielectrónicos y el átomo de hidrógeno.




Bibliografía: • Atkins, P. y Jones, L. “Principios de Química. Los caminos del descubrimiento”. Editorial Panamericana. 2006. • Atkins, P. y Jones, L. “Química. Moléculas. Materia. Cambio”. Ediciones Omega S. A. Barcelona. España. 1998 • Brown, T. , Le. May, H. , Bursten, B. “Química la Ciencia Central”. Prentice Hall Hispanoamericana S. A. México. 1998. • Burns. “Fundamentos de Química”. Prentice Hall. 1996. • Chang, R. “Química”. Mc. Graw-Hill Interamericana de México, S. A. de C. V. México. 2006. • Whitten, K. , Davis, R. , Peck, M. Química General. Mc. Graw. Hill/Interamericana de España S. A. U. 1998 http: //www. uv. es/~borrasj/EQEM_web_page/EQEM_index. html http: //www. educared. net/aprende/anavegar 3/premiados/ganadores/d/ 456/ http: //www. puc. cl/sw_educ/qda 1106/frame_contenidos. htm
 Bangolou
Bangolou Universidad de el salvador facultad de ciencias economicas
Universidad de el salvador facultad de ciencias economicas Ciencias quimicas unach
Ciencias quimicas unach Universidad de el salvador facultad de ciencias economicas
Universidad de el salvador facultad de ciencias economicas Facultad de ciencias economicas tucuman
Facultad de ciencias economicas tucuman Universidad de el salvador facultad de ciencias economicas
Universidad de el salvador facultad de ciencias economicas Thin and thick smear
Thin and thick smear Facultad de ciencias agricolas uce
Facultad de ciencias agricolas uce Facultad de ciencias universidad mayor
Facultad de ciencias universidad mayor Facultad de ciencias médicas y biológicas umsnh
Facultad de ciencias médicas y biológicas umsnh Facultad de ciencias físicas ucm
Facultad de ciencias físicas ucm Universidad de los andes facultad de ciencias
Universidad de los andes facultad de ciencias Facultad de ciencias economicas tucuman
Facultad de ciencias economicas tucuman Situaciones de enseñanza en ciencias naturales
Situaciones de enseñanza en ciencias naturales Luz y sonido ciencias naturales
Luz y sonido ciencias naturales Exactas
Exactas Ciencias naturales
Ciencias naturales Referentes de calidad ciencias naturales
Referentes de calidad ciencias naturales La capas de la tierra
La capas de la tierra Ciencias naturales
Ciencias naturales Tipos de fuerza ciencias naturales ejemplos
Tipos de fuerza ciencias naturales ejemplos Fuerza y movimiento ciencias naturales
Fuerza y movimiento ciencias naturales Mundo de las ciencias naturales
Mundo de las ciencias naturales Ciencias naturales
Ciencias naturales Reduccion reuso y reciclado ciencias naturales
Reduccion reuso y reciclado ciencias naturales Objetivos de la ciencias naturales
Objetivos de la ciencias naturales Camaleon y las naturales ciencias
Camaleon y las naturales ciencias Repasemos lo aprendido
Repasemos lo aprendido Estandares de ciencias naturales
Estandares de ciencias naturales Objetos rigidos y flexibles
Objetos rigidos y flexibles Ies suel
Ies suel Camaleon y las naturales ciencias
Camaleon y las naturales ciencias Objetivos priorizados ciencias naturales
Objetivos priorizados ciencias naturales Indicadores de ciencias naturales
Indicadores de ciencias naturales Ciencias naturales
Ciencias naturales Solubilidad
Solubilidad Apuntes de ciencias naturales
Apuntes de ciencias naturales Medios hipertonicos
Medios hipertonicos Ciencias naturales unidad 1
Ciencias naturales unidad 1 Lineamientos curriculares ciencias naturales
Lineamientos curriculares ciencias naturales Figuras de ciencias naturales
Figuras de ciencias naturales Lineamientos curriculares de ciencias naturales
Lineamientos curriculares de ciencias naturales Las ciencias naturales son
Las ciencias naturales son Tolerancias
Tolerancias Ecuaciones diferenciales por factor integrante
Ecuaciones diferenciales por factor integrante Cilindridad
Cilindridad Ecuaciones diferenciales exactas
Ecuaciones diferenciales exactas Exactas unlp
Exactas unlp Raices cuadradas perfectas
Raices cuadradas perfectas Facultad de voluntad
Facultad de voluntad Cele humboldt
Cele humboldt Vestidos griegos
Vestidos griegos Universidad de carabobo facultad de derecho
Universidad de carabobo facultad de derecho Facultad de medicina campeche
Facultad de medicina campeche Facultad natural
Facultad natural Facultad de informatica universidad de panama
Facultad de informatica universidad de panama Escolares facultad de arquitectura
Escolares facultad de arquitectura Universidad san martin de porres facultad de derecho
Universidad san martin de porres facultad de derecho Signo de puño percusion renal
Signo de puño percusion renal Facultad de pedagogia xalapa
Facultad de pedagogia xalapa Facultad miguel enriquez
Facultad miguel enriquez Prestec agaur uab
Prestec agaur uab Lmad plan de estudios
Lmad plan de estudios Medicina u austral
Medicina u austral Ueddi
Ueddi Organigrama de la facultad de ingeniería.
Organigrama de la facultad de ingeniería. Panam universidad
Panam universidad Universidad de arquitectura san juan
Universidad de arquitectura san juan Universidad javeriana - facultad de medicina
Universidad javeriana - facultad de medicina Facultad de economia oruro
Facultad de economia oruro Facultad de turismo en san marcos
Facultad de turismo en san marcos Facultad farmacia ull
Facultad farmacia ull






























































































