Facultad de Ciencias Exactas y Naturales y Agrimensura



























- Slides: 29

Facultad de Ciencias Exactas y Naturales y Agrimensura Universidad Nacional del Nordeste QUÍMICA GENERAL Carreras: Ingeniería en Electrónica, Ingeniería Eléctrica, Licenciatura en Física, Profesorado en Física Unidad VII: TERMOQUIMICA

La Termodinámica: es el estudio de la energía y sus transformaciones. Casi todas las reacciones químicas absorben o liberan energía en forma de calor. El calor es la transferencia de energía térmica entre dos cuerpos que están a diferentes temperaturas. La termoquímica, es la parte de la química que estudia el flujo de calor asociado a una reacción química o cambio físico. La ley de la conservación de la energía afirma que la energía no se puede crear ni destruir; pero se puede transformar de una forma a otra y transferir de un lugar a otro.

SISTEMA Y ENTORNO Sistema: es la porción que separamos para estudiar; es la sustancia o la mezcla de reacción que está siendo objeto de estudio (puede ser una mezcla de reacción colocada dentro de un recipiente, o un pedazo de Cu) Entorno: es todo aquello que se encuentra fuera del sistema (son los alrededores del sistema, por ejemplo los recipientes). Generalmente, solo se tiene en cuenta los alrededores inmediatos de un sistema. El entorno es donde hacemos las observaciones sobre la energía transferida al interior o al exterior del sistema. El entorno y el sistema juntos forman el universo. Sistema + Entorno = Universo Un sistema puede ser abierto si intercambia materia y energía con el entorno; cerrado cuando tiene una cantidad fija de materia y puede intercambiar energía con el entorno; aislado cuando no puede intercambiar nada.

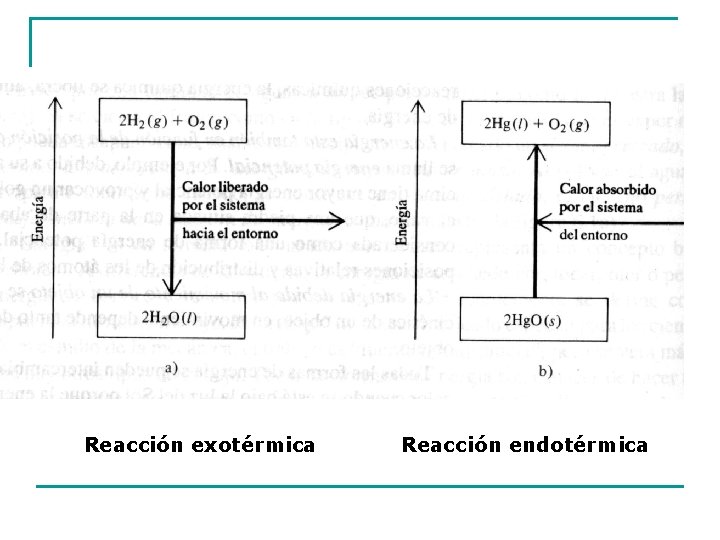
Reacciones exotérmicas y endotérmicas Desde el punto de vista del flujo de calor, se pueden distinguir dos tipos de reacciones o procesos. Reacciones exotérmicas: en las que una reacción desprende calor al ambiente. CH 4 (g) + 2 O 2 (g) CO 2 (g) + 2 H 2 O (ℓ) + energía Esta reacción libera calor al ambiente, que puede ser un vaso de precipitado con agua, y se observará un aumento de la temperatura del agua. El efecto de las reacciones exotérmicas es aumentar la temperatura ambiente. Reacciones endotérmicas: en las que el sistema reacciónate absorbe calor del ambiente. Ejemplo la fusión del hielo. H 2 O (s) + Energía H 2 O (ℓ) El proceso absorbe calor del ambiente (vaso precipitado) y la temperatura del agua disminuye. El efecto de una reacción endotérmica es disminuir la temperatura ambiente.

Reacción exotérmica Reacción endotérmica

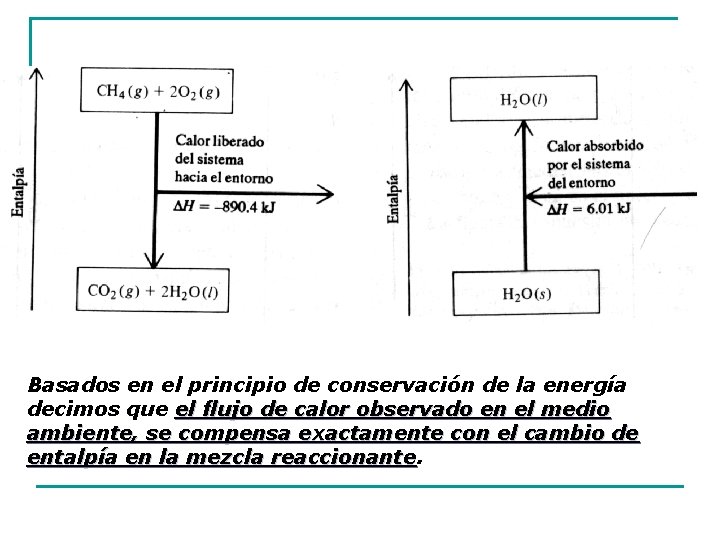
Entalpía y energía interna La mayoría de los cambios físicos y químicos ocurren en condiciones de presión constante. El calor absorbido o liberado por un sistema durante un proceso a presión constante se denomina entalpía y se representa por el símbolo H. H Es una propiedad extensiva, se la puede imaginar como una medida de la energía que un sistema puede dar en forma de calor. Como es imposible determinar la entalpía de una sustancia, lo que se mide realmente es el cambio de entalpía, ΔH, o entalpía de reacción. Un cambio en la entalpía de un sistema es igual al calor liberado o absorbido a presión constante

La entalpía de reacción puede ser positiva o negativa, según el proceso. En los procesos endotérmicos, ΔH es (+) (ΔH > 0) En los procesos exotérmicos, ΔH es (-) (ΔH < 0) Reacción exotérmica: < 0 es decir: Reacción endotérmica: > 0 es decir:

Basados en el principio de conservación de la energía decimos que el flujo de calor observado en el medio ambiente, se compensa exactamente con el cambio de entalpía en la mezcla reaccionante

La energía interna (U) es una medida de la cantidad de energía de un sistema; es su reserva total de energía. Es la capacidad de un sistema para realizar un trabajo Es la suma de todas las clases de energía que poseen las moléculas. No es fácil determinar la energía interna de un sistema pero si su variación que es el flujo de calor de la reacción a volumen constante. Ecuaciones termoquímicas Las ecuaciones termoquímicas son aquellas que muestran además de las relaciones de masa, los cambios de entalpía que ocurren en las reacciones químicas. Combinan una ecuación química y la entalpía asociada a la reacción. a) H 2 O (s) H 2 O (ℓ) ΔH = +6, 01 k. J/mol b) CH 4 (g) + 2 O 2 (g) CO 2 (g) + 2 H 2 O (ℓ) ΔH = -890, 4 kj/mol

● Los coeficientes estequiométricos siempre se refieren al número de moles de una sustancia, que reaccionan para dar el incremento de entalpía correspondiente. ● Cuando se invierte una ecuación, la magnitud de ΔH se mantiene igual, pero cambia el signo. Es decir si una reacción es endotérmica, la reacción inversa debe ser exotérmica y viceversa. a) H 2 O (ℓ) H 2 O (s) ΔH = -6, 01 k. J. /mol b) CO 2 (g) + 2 H 2 O (ℓ) CH 4 (g) + 2 O 2 (g) ΔH = +890, 4 k. J/mol ● Si se multiplican ambos lados de una ecuación termoquímica por un factor n, ΔH también se debe multiplicar por el mismo factor. Si n = 2 en el ejemplo de la fusión del hielo. 2 H 2 O (ℓ) 2 H 2 O (s) ΔH = 2. (-6, 01) k. J/mol = -12, 02 k. J/mol ● Cuando se escriben ecuaciones termoquímicas, siempre se debe especificar el estado físico de todos los reactivos y productos, porque esto ayuda a determinar el cambio real de entalpía Si en la combustión de CH 4 se obtuvo como producto vapor de agua en lugar de agua liquida. CH 4 (g) + 2 O 2 (g) CO 2 (g) + 2 H 2 O (g) ΔH = -802, 4 kj/mol

Calor de formación Normal (ΔHof) El estado normal de una sustancia, para la termodinámica, es su estado mas estable a la presión de 1 atm y a alguna temperatura especifica (25°C o 298 K a menos que se especifique otra temperatura). El calor normal de formación es la variación de entalpía que se produce cuando se forma un mol de un compuesto a partir de sus elementos en su estado más estable a una presión de una atm y 25°C. El “ O ” representa el estado normal, el subíndice “ f ” significa formación. Ag (s) + ½ Cl 2 (g) Ag. Cl (s) ΔH = -127 k. J ½ N 2 (g) + O 2 (g) NO 2 (g) ΔH = +33, 9 kj

Por convención, el calor de formación de cualquier elemento en su forma más estable es cero. Los valores de ΔHof están tabulados (la mayoría son < 0). Entalpía normal de reacción Es la variación de entalpía que acompaña a una reacción química que se efectúa a 25ºC y 1 atm. Se puede calcular a partir de los ΔHof de compuestos n y m coeficientes estequiométricos de reactivos y productos.

Ejemplo: A partir de los valores de tabla, halle el ΔH° de la siguiente reacción: C 3 H 8 (g) + 5 O 2 (g) + 3 CO 2 (g) + 4 H 2 O (ℓ) ΔHof de tabla CO 2 (g) = -393, 5 kj/mol H 2 O (ℓ) = -285, 8 kj/mol C 3 H 8 (g) = -103, 8 kj/mol

Ejercitación: ● Haciendo uso de la tabla de calores normales de formación, escribir las ecuaciones termoquímicas para la formación de: a) NH 3 (g) b) KCl. O 3 (s) c) Al 2 O 3 (s) d) Na 2 SO 4 (s) e) Ca. CO 3 (s) ● En base a las entalpías de formación, calcule la entalpía normal de la reacción: 4 NH 3 (g) +5 O 2 (g) 4 NO (g) +6 H 2 O (g) ΔHof de tabla NH 3 (g) = -46, 2 kj/mol H 2 O (g) = -241, 8 kj/mol NO (g) = -90, 4 kj/mol

Calor normal de combustión (ΔH°C) El calor de combustión es la variación de entalpía, que acompaña a la combustión completa de 1 mol de compuesto orgánico para dar CO 2 (g) y H 2 O (l). También se lo define como: El calor de combustión es la cantidad de energía liberada por cada mol de hidrocarburo quemado. Metano CH 4 (g) + 2 O 2 (g) CO 2 (g) + 2 H 2 O (l) ∆HºC= -890 k. J Ejercicio: escribir la ecuación termoquímica de combustión de los siguientes compuestos: a) C 6 H 6 (l) b) C 8 H 18 (g)

Calor de neutralización (ΔH°N) Es la variación de entalpía que se produce cuando reaccionan cantidades equivalentes de soluciones diluidas de un ácido fuerte y una base fuerte a presión de 1 atm y temperatura de 25°C HNO 3 (ac) + KOH (ac) KNO 3 (ac) + H 2 O (ℓ) H+ (ac) + NO 3 - (ac) + K+ (ac) + OH- (ac) K+ (ac) + NO 3 - (ac) + + H 2 O (ℓ) H+ (ac) + OH- (ac) H 2 O (ℓ) ΔH°N = -56, 2 k. J/mol La cantidad de calor liberado se debe a la formación de un mol de H 2 O a partir de sus iones acuosos. Es una constante independientemente del ácido y de la base, siempre que sean fuertes y soluciones diluidas.

Curvas de calentamiento El calentamiento puede provocar un aumento de la temperatura o bien un cambio de estado sin que se modifique la temperatura. Cuando se suministra calor a un sólido, este se calienta. Pero al alcanzar su punto de fusión, aun cuando se le continúe suministrando calor, el sólido permanece a la misma temperatura fija durante el proceso de fusión hasta que todo el sólido haya fundido. Durante la fusión (1° meseta de la curva) el sistema absorbe calor aunque la temperatura permanece constante. El calor ayuda a las moléculas a vencer las fuerzas de atracción en el sólido. Si se suministra calor a un líquido (a presión constante), la temperatura aumenta hasta que se alcanza el punto de ebullición. Entonces la temperatura permanece constante hasta que haya suministrado suficiente calor para hacer hervir a todo el líquido. La temperatura permanece constante durante el periodo en el que el aumento de la energía cinética se utiliza para vencer las fuerzas de cohesión en el liquido.


El calor molar de fusión (ΔHfus) es la energía o cantidad de calor necesaria (en k. J) para fundir 1 mol de un sólido en su punto de fusión El calor molar de vaporización (ΔHVap) de un líquido es la energía o cantidad de calor (en k. J) necesaria para vaporizar 1 mol de un líquido en su punto de ebullición. Hvap = Hm (vapor) – Hm (líquido) Calor sensible: cuando el calor absorbido por una sustancia, provoca una variación de la temperatura sin producir un cambio de estado o fase (zona de pendientes en curva de alentamiento). Calor latente: cuando el calor absorbido provoca un cambio de estado o fase a temperatura constante (zonas de mesetas en curva de alentamiento).

Leyes de la termoquímica ● Ley de Lavoisier-Laplace Esta ley establece que el calor de formación de un compuesto es numéricamente igual pero de signo opuesto al calor de descomposición. Una consecuencia importante de esta ley es que las ecuaciones termoquímicas pueden ser invertidas, siempre que se cambie el signo del calor, manteniendo igual su valor numérico. S (s) + O 2 (g) SO 2 (g) ΔH° = -296, 1 k. J SO 2 (g) S (s) + O 2 (g) ΔH° = +296, 1 k. J ● Ley de Hess (ley de la suma del calor) Esta ley establece que en una reacción química a volumen constante o a presión constante, el cambio de entalpía es el mismo, independientemente de que la reacción se efectúe en un paso, o en una serie de pasos.

La variación de entalpía de una reacción se puede calcular a partir de cualquier secuencia de reacciones siempre que la suma de todas ellas sea igual a la reacción deseada. Depende solamente de los estados inicial y final, y no de los estados intermedios por los que puede pasar un sistema. El gran valor práctico de esta ley, es que en base a ella las ecuaciones termoquímicas, pueden ser sumadas o restadas como ecuaciones algebraicas. Los calores de reacción que no pueden ser determinados por vía experimental directa, se pueden calcular en base a otros datos termoquímicos (por aplicación de la ley) Si una reacción termoquímica se puede expresar como la suma de dos o más reacciones: Ecuación = Ec (1) + Ec (2) + Ec (3) + Ec (4) +…………. Entonces ΔH = ΔH 1+ ΔH 2 + ΔH 3 + ΔH 4 +………………….

Por aplicación de esta ley, se puede determinar el calor de una reacción, a partir de los calores de combustión de todos los reactivos y productos. EJEMPLO: La reacción de combustión del C: C (s) + O 2 (g) CO 2 (g) ΔH°=? Se puede considerar como la suma de dos reacciones: 1) C (s) + ½ O 2 (g) CO (g) 2) CO (g) + ½ O 2 (g) CO 2 (g) 3) C (s) + O 2 (g) CO 2 (g) ΔH° 1 = -110, 5 k. J ΔH° 2 = -283, 0 k. J ΔH° 3 = ΔH° 1 + ΔH° 2 = -393, 5 k. J

2) Calcular ΔH° del CH 4 C (grafito) + 2 H 2 (g) CH 4 (g) ΔH° = ? El cambio de entalpía para esta reacción no puede medirse directamente. Hay que aplicar la ley de Hess para calcular. Datos: a) C (grafito) + O 2 (g) CO 2 (g) b) 2 H 2 (g) + O 2 (g) 2 H 2 O (ℓ) c) CH 4 (g) + 2 O 2 (g) CO 2 (g) + 2 H 2 O (ℓ) ΔH° = -393, 5 KJ ΔH° = -571, 6 KJ ΔH° = -890, 4 KJ Debemos obtener una ecuación que contenga como reactivos C y H 2 y como producto CH 4. C (grafito) + O 2 (g) CO 2 (g) ΔH° = -393, 5 KJ 2 H 2 (g) + O 2 (g) 2 H 2 O (ℓ) ΔH° = -571, 6 KJ CO 2 (g) + 2 H 2 O (ℓ) CH 4 (g) + 2 O 2 (g) ΔH° = +890, 4 KJ C (grafito) + 2 H 2 (g) CH 4 (g) ΔH° = -74, 7 KJ

Espontaneidad de las reacciones Uno de los objetivos de la Química, es predecir si se producirá o no una reacción cuando se juntan los reactivos. Si se produce, se dice que la reacción es “espontánea”, cuando se produce por si misma, se produce sin alguna fuerza externa. (un trozo de Fe, expuesto al aire se oxida). Espontánea no significa que sea rápida. La oxidación del Fe ocurre espontáneamente pero es una reacción muy lenta. Siempre que una reacción, sea espontánea en determinadas condiciones, se cumplirá que la reacción inversa es no espontánea en las mismas condiciones. Criterio de espontaneidad Para decidir si una reacción dada va a ser espontánea a una temperatura y presión dada no alcanza considerar ΔH; hay que tener en cuenta otro factor; ese factor es la variación de entropía

La entropía (S) es una medida directa del grado de desorden de un sistema. A medida que aumenta el desorden aumenta la entropía. La entropía de los sólidos es menor que la entropía de los líquidos y es mucho menor a la entropía de los gases En el ejemplo de la fusión del hielo, el aumento de la entropía es la fuerza motriz que impulsa este proceso. El aumento del desorden supera ampliamente el hecho de que el proceso sea endotérmico, por eso la reacción es espontánea. Actualmente se toma como criterio de espontaneidad el valor de ΔG: función de Gibbs o energía libre.

La energía libre es la energía potencialmente disponible para realizar un trabajo útil. Si en una reacción se libera energía útil (ΔG es negativo) podemos estar seguros de que la reacción es espontánea. -ΔG = +W Las dos magnitudes termodinámicas que afectan la espontaneidad son: la variación de entalpía (ΔH) y la variación de entropía (ΔS). J. W. Gibbs introdujo una nueva función termodinámica que vincula ΔH y ΔS, y permite determinar si una reacción es espontánea o no. Esta función se llama energía libre de Gibbs o simplemente energía libre, libre y se la simboliza con la letra “G” Energía libre de Gibbs de un estado

El signo de ΔG se puede utilizar para determinar si una reacción es espontánea o no. Para una reacción, que se desarrolla a temperatura y presión constante: 1) Si ΔG es negativo ; la reacción es espontánea 1. 2) Si ΔG es positivo; la reacción no se producirá espontáneamente en el sentido que esta escrita. Se producirá la reacción inversa. 3) Si ΔG =0 ; el sistema reaccionante está en equilibrio , la reacción no tiende a producirse en ningún sentido. ΔG es una verdadera medida de la tendencia que tiene una reacción a producirse.

Ecuación de Gibbs-Helmholtz La ecuación que relaciona ΔG, ΔH y ΔS es la llamada ecuación de Gibbs-Helmholtz Esta ecuación nos dice, que la tendencia a producirse una reacción, ΔG, depende de dos funciones, ΔH y ΔS multiplicada por la temperatura absoluta ● Si ΔH y ΔS son positivos; ΔG será negativo solo cuando TΔS sea de mayor magnitud que ΔH. (se cumple a temperaturas elevadas) ● Si ΔH es positivo y ΔS es negativo; ΔG será positivo independientemente de la temperatura. ● Si ΔH es negativo y ΔS es positivo; ΔG será negativo independientemente de la temperatura. ● Si ΔH es negativo y ΔS es negativo; ΔG será negativo solo cuando TΔS sea de menor magnitud que ΔH (se cumple a bajas temperatura).

En todas las reacciones espontáneas, hay una tendencia a alcanzar un estado de mínima energía y máximo desorden.
 Facultad de ciencias quimicas unach
Facultad de ciencias quimicas unach Universidad de el salvador facultad de ciencias economicas
Universidad de el salvador facultad de ciencias economicas Facultad de ciencias economicas tucuman
Facultad de ciencias economicas tucuman Universidad de el salvador facultad de ciencias economicas
Universidad de el salvador facultad de ciencias economicas Trypanosoma bruzi
Trypanosoma bruzi Facultad de ciencias agricolas uce
Facultad de ciencias agricolas uce Facultad de ciencias universidad mayor
Facultad de ciencias universidad mayor Facultad de ciencias médicas y biológicas umsnh
Facultad de ciencias médicas y biológicas umsnh Facultad de ciencias físicas ucm
Facultad de ciencias físicas ucm Universidad de los andes facultad de ciencias
Universidad de los andes facultad de ciencias Facultad de ciencias economicas tucuman
Facultad de ciencias economicas tucuman Bangolou
Bangolou Universidad de el salvador facultad de ciencias economicas
Universidad de el salvador facultad de ciencias economicas Ciencias naturales
Ciencias naturales Lineamientos curriculares ciencias naturales
Lineamientos curriculares ciencias naturales Figuras de ciencias naturales
Figuras de ciencias naturales Lineamientos curriculares de ciencias naturales
Lineamientos curriculares de ciencias naturales Ciencia de los seres vivos
Ciencia de los seres vivos Situaciones de enseñanza en ciencias naturales
Situaciones de enseñanza en ciencias naturales Exactas
Exactas Ciencias naturales
Ciencias naturales Referentes de calidad ciencias naturales
Referentes de calidad ciencias naturales Capas de la tierra
Capas de la tierra Ciencias naturales
Ciencias naturales Tipos de fuerza ciencias naturales ejemplos
Tipos de fuerza ciencias naturales ejemplos Fuerza y movimiento ciencias naturales
Fuerza y movimiento ciencias naturales Mundo de las ciencias naturales
Mundo de las ciencias naturales Ciencias naturales
Ciencias naturales Reducción reuso reciclado y degradación de los materiales
Reducción reuso reciclado y degradación de los materiales Juan cabezas castillo
Juan cabezas castillo




















































