ESTRUCTURA ATOMICA Qumica EG 1 tomo Unidad ms






















![Li 3 electrons 1 s 2 2 s 1 [He] 2 s 1 Química Li 3 electrons 1 s 2 2 s 1 [He] 2 s 1 Química](https://slidetodoc.com/presentation_image_h2/fa6a9c3b363895724d156e29e9091ff5/image-36.jpg)











- Slides: 57

ESTRUCTURA ATOMICA Química EG 1

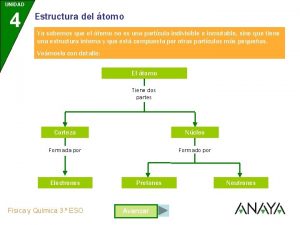
Átomo • Unidad más pequeña de un elemento químico que mantiene su identidad o sus propiedades y no es posible dividirse mediante procesos químicos. Química EG 2

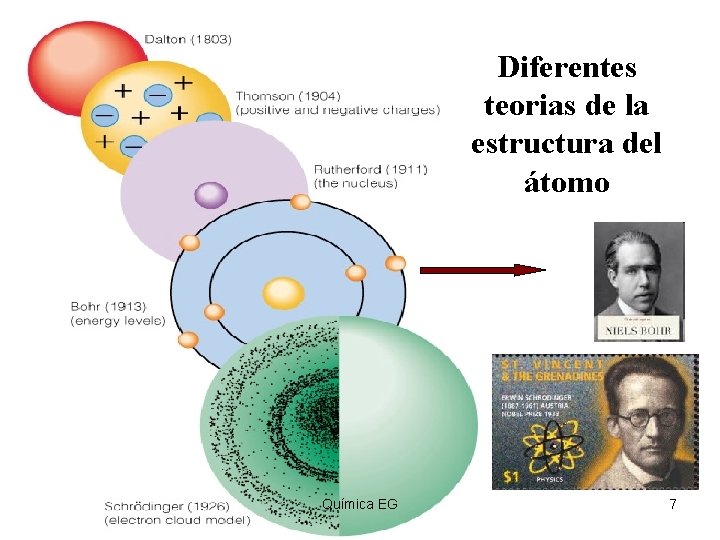
Primeras teorías del Atomo John Dalton (1766 -1844) 1. La materia está formada por partículas diminutas llamadas átomos. 2. Todos los átomos de un determinado elemento son semejantes, y distintos a los átomos de otro elemento. 3. Los átomos de dos o más elementos diferentes se combinan para dar lugar a la formación de compuestos. Un compuesto determinado siempre está formado por los mismos tipos de átomos y siempre contiene el mismo número de cada tipo de átomo. 4. Una reacción química es una reorganización, separación o combinación de átomos. Durante una reacción química, ni se crean ni se destruyen átomos. Química EG 3

Estructura del átomo • Partículas atómicas J. J. Thomson descubrió las partículas con carga negativa llamadas electrones, considerando que el átomo es eléctricamente neutro se dedujo que también contenían las partículas con carga positiva Química EG 4

Continuación de teoría atómica • Ernest Rutherford continuó con los experimentos de partículas atómicas y llegó a la conclusión que las partículas con carga positiva debían estar en lo que denominó núcleo y por lo tanto las partículas con carga negativa se encontraban alrededor del núcleo. • Debido a que la masa del núcleo era mayor a la masa de los protones predijeron la existencia de las partículas sin carga. Química EG 5

Postulados de Dalton Química EG 6

Diferentes teorias de la estructura del átomo Química EG 7

modelo de THOMSON • Dentro de los átomos hay unas partículas diminutas, con carga eléctrica negativa, a las que se llamó electrones • El átomo debía ser una esfera de materia cargada positivamente, en cuyo interior estaban incrustados los electrones. Química EG 8

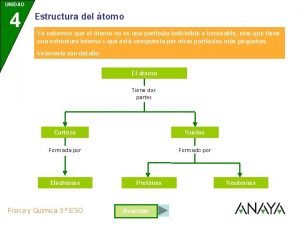
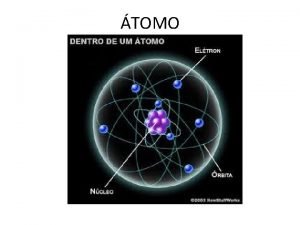
MODELO DE RUTHERFORD • El átomo está formado por dos partes: núcleo y corteza • El núcleo es la parte central, de tamaño muy pequeño, donde se encuentra toda la carga positiva y prácticamente, toda la masa del átomo. • La corteza es casi un espacio vacío, inmenso en relación con las dimensiones del núcleo. • Aquí se encuentran los electrones con masa muy pequeña y carga negativa. Química EG 9

James Chadwick • James Chadwick (1891 -1972). Físico británico. En 1935 recibió el Premio Nobel de física por demostrar la existencia de los neutrones. • • Se sabía que el hidrógeno, el átomo más sencillo, contenía solamente un protón, y que el átomo de helio contenía dos protones. Por tanto, la relación entre la masa de un átomo de helio y un átomo de hidrógeno debería ser 2: 1. (Debido a que los electrones son mucho más ligeros que los protones, se puede ignorar su contribución a la masa atómica. ) Sin embargo, en realidad la relación es 4: 1. Química EG 10

MODELO DE BOHR • Modelo atómico de Bohr Los electrones solo pueden girar en ciertas órbitas de radios determinados, ya que solo pueden tener dietos niveles de energía definidos Química EG 11

MODELO DE SHRODINGER • Dentro de un mismo nivel energético existen subniveles. • Describe a los electrones por medio de una función la cual representa la probabilidad de presencia en una región delimitada del espacio. • Esta zona de probalididad se conoce como orbital. Química EG 12

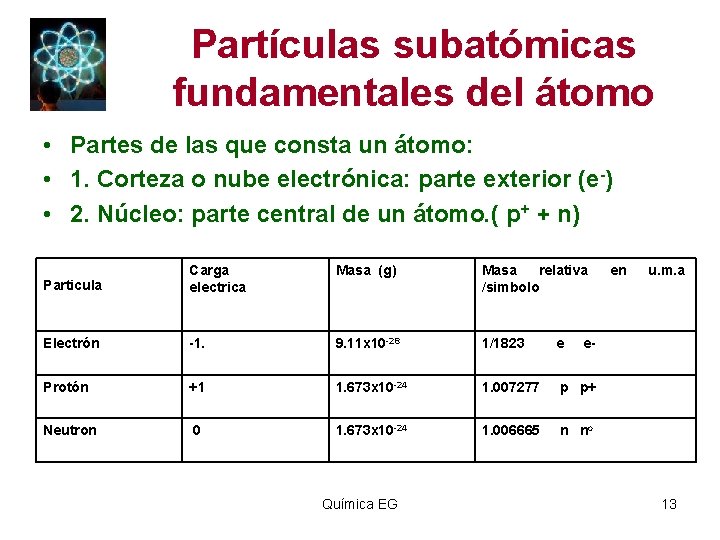
Partículas subatómicas fundamentales del átomo • Partes de las que consta un átomo: • 1. Corteza o nube electrónica: parte exterior (e-) • 2. Núcleo: parte central de un átomo. ( p+ + n) Particula Carga electrica Masa (g) Masa relativa /simbolo Electrón -1. 9. 11 x 10 -28 1/1823 e Protón +1 1. 673 x 10 -24 1. 007277 p p+ Neutron 0 1. 673 x 10 -24 1. 006665 n no Química EG en u. m. a e- 13

Ø Los átomos tienen un diámetro de 0. 1 -1. 0 nm Ø 1 nm ≈ 10 -9 metros Ø El núcleo (donde estan lo protones y neutrones) tiene un diámetro de alrededor de 10 -15 m. Diámetro aproximado Química EG 14

Número atómico • Todos los átomos de un mismo elemento químico , tienen en el núcleo el mismo número de protones, este número caracteriza a cada elemento y lo distingue de los demás es el número atómico , se representa por “Z” • Los átomos son eléctricamente neutros, debido a que tienen igual número de protones que de electrones. Química EG 15

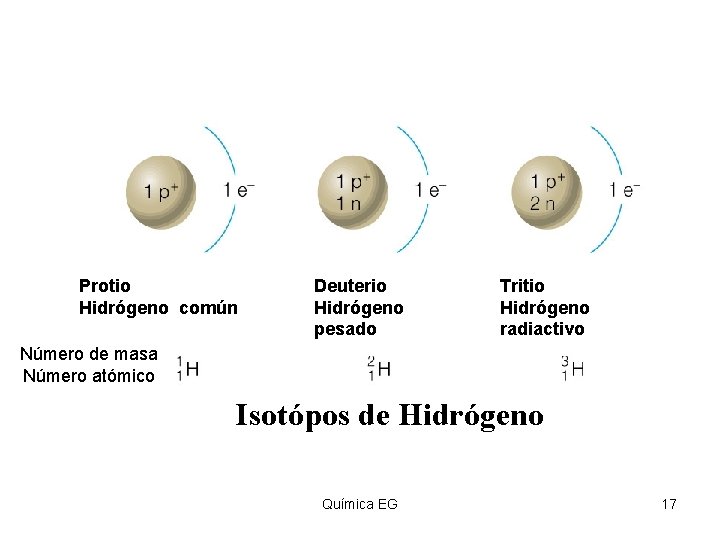
Isótopos Ø La suma del número de protones y el número de neutrones de un átomo recibe el nombre de número másico y se representa con la letra “A”. Ø Aunque todos los átomos de un mismo elemento se caracterizan por tener el mismo Ø numero atómico, pueden tener distinto número de neutrones. Ø Isotopos: Ø Formas atómicas de un mismo elemento que se diferencian en su número másico Química EG 16

Insert figure 4. 24 Protio Hidrógeno común Deuterio Hidrógeno pesado Tritio Hidrógeno radiactivo Número de masa Número atómico Isotópos de Hidrógeno Química EG 17

Isotopos del Magnesio 12 Mg • 24 Mg Mg es estable con 12 neutrones • 25 Mg Mg es estable con 13 neutrones • 26 Mg Mg es estable con 14 neutrones Química EG 18

Peso atómico • Concepto: Promedio ponderado de las masas atómicas de la mezcla de todos los isótopos naturales de un elemento. Esta masa es la que aparece en la tabla periódica. Recordar que un elemento puede tener dos o más isótopos cuyas masa difieren, el peso atómico de tal elemento dependerá de las proporciones relativas de sus isótopos. Química EG 19

MASA ATÓMICA Química EG 20

Representación de los isotopos • Esquema: A A= número de masa X= símbolo del elemento Z Z= número atómico Química EG 21

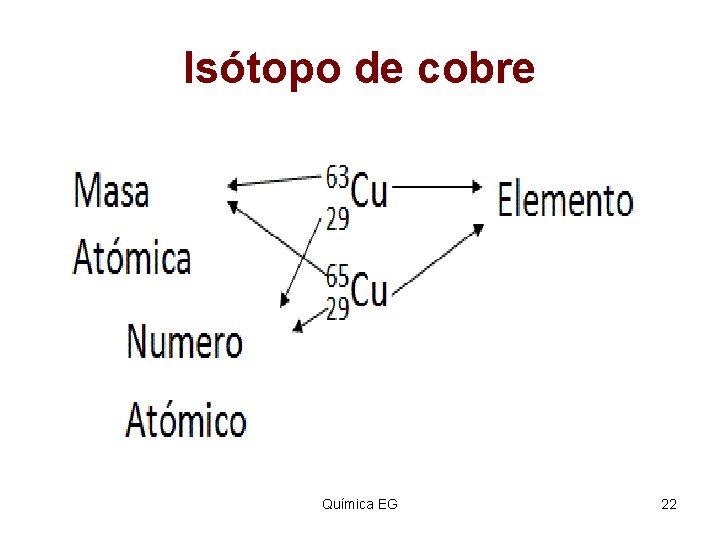
Isótopo de cobre Química EG 22

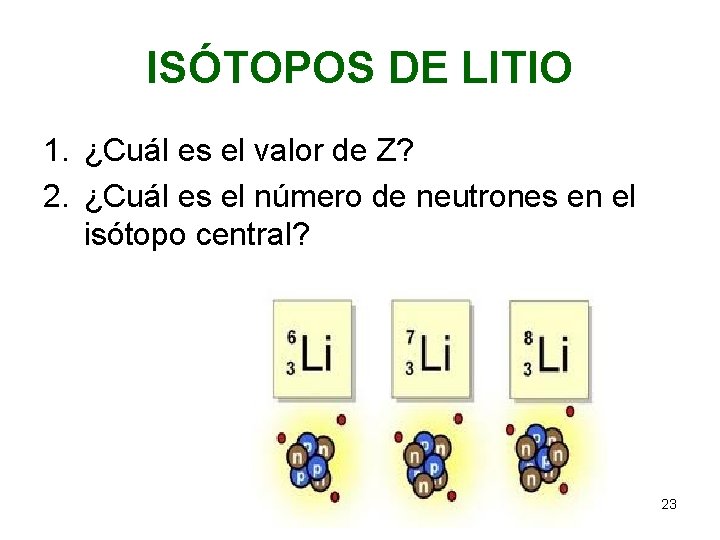
ISÓTOPOS DE LITIO 1. ¿Cuál es el valor de Z? 2. ¿Cuál es el número de neutrones en el isótopo central? Química EG 23

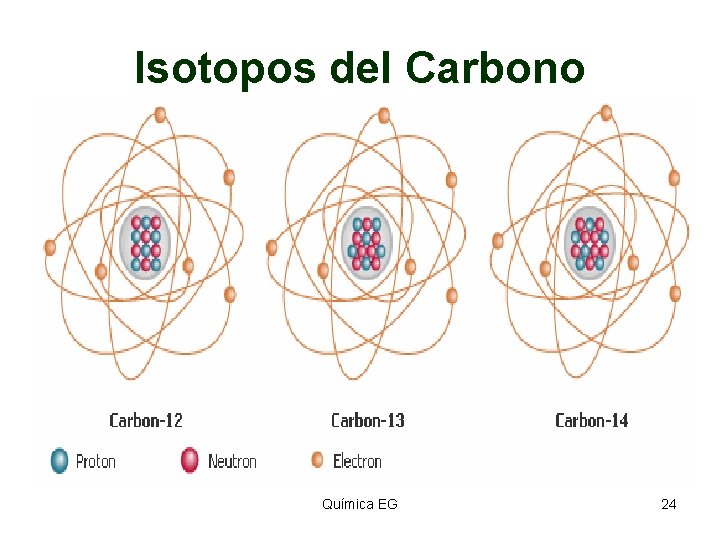
Isotopos del Carbono Química EG 24

Isótopos radiactivos Química EG 25

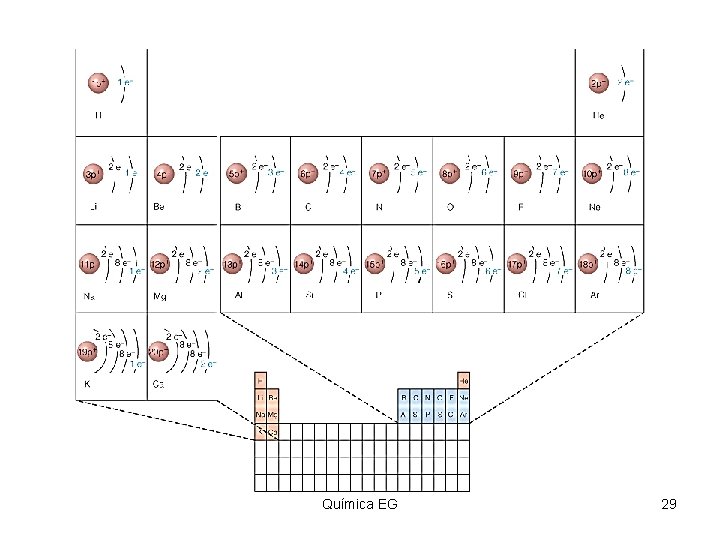
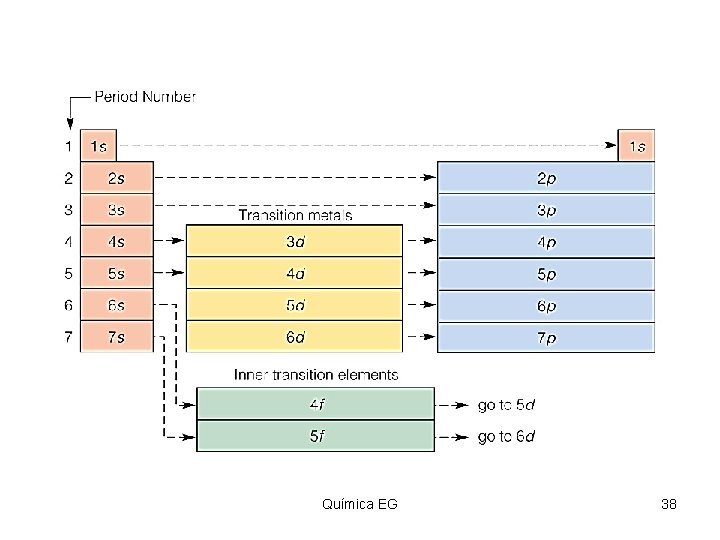
Configuración electrónica Para su estudio nos ayudaremos por los trabajos de Niels Bohr (1885 -1962) físico-danés, quien se apoyo en los estudios de otros científicos (Planck-Einstein) para sugerir que los electrones de los átomos existen en niveles de energía específicos. Química EG 26

Niveles de energía El número máximo de electrones en cualquier nivel de energía se determina según la fórmula 2 n 2, donde n es igual al número del nivel de energía que se esté llenando. Llamando electrones de valencia a los electrones más externos en un átomo y que son utilizados en la formación de nuevos compuestos. Química EG 27

Distribución de electrones segun el nivel de energía • Nivel 2 n 2 • • 2(1)2 2(2)2 2(3)2 2(4)2 1 2 3 4 # máximo número de electrones 2 8 18 32 Química EG 28

Insert figure 5. 23 Química EG 29

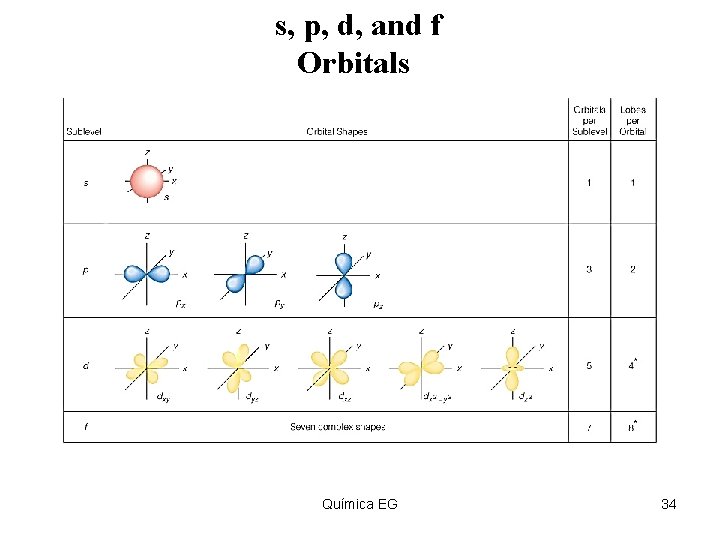
Estructura electrónica De acuerdo con los cálculos de la mecánica cuántica, cada nivel de energía de un átomo está constituido por uno o más subniveles (llamados capas). Cada subnivel tiene uno o más orbitales atómicos que poseen un forma tridimensional específica. Química EG 30

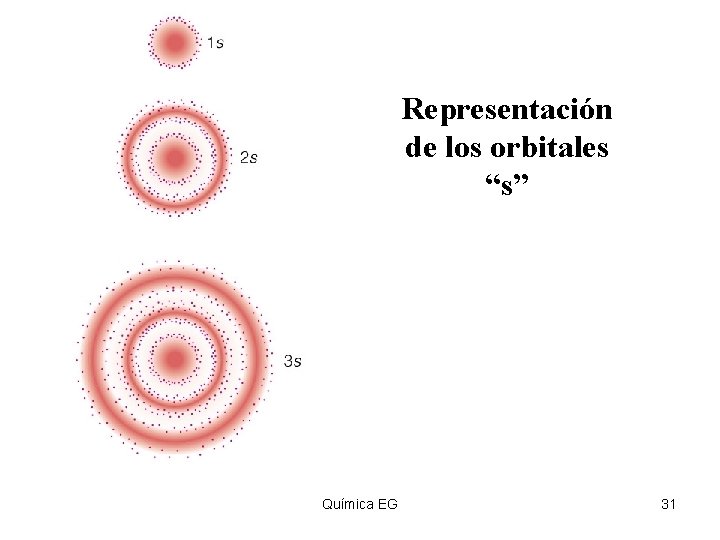
Representación de los orbitales “s” Química EG 31

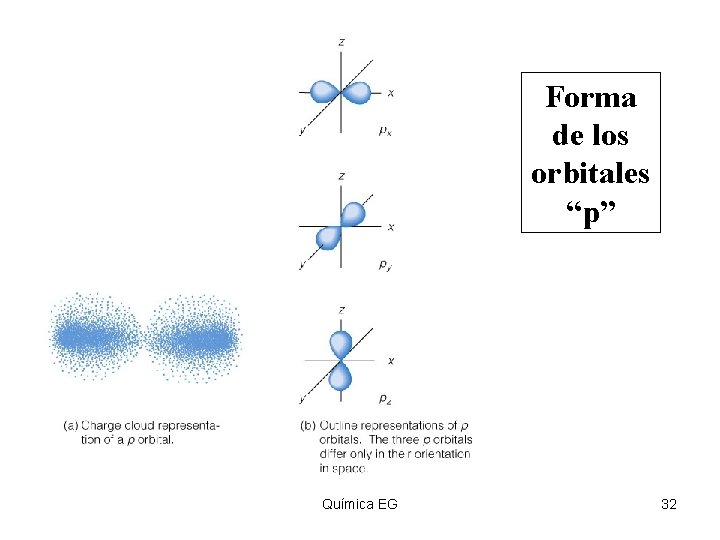
Forma de los orbitales “p” Insert figure 5. 29 Química EG 32

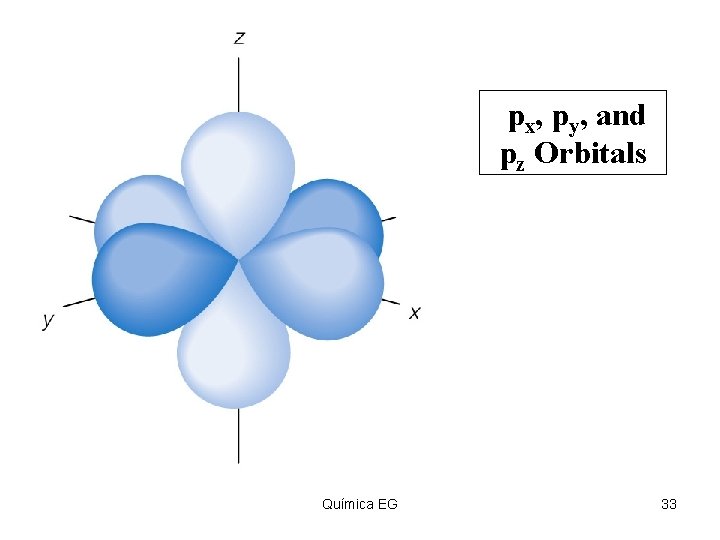
px, py, and pz Orbitals Insert figure 5. 30 Química EG 33

s, p, d, and f Orbitals Insert figure 5. 31 Química EG 34

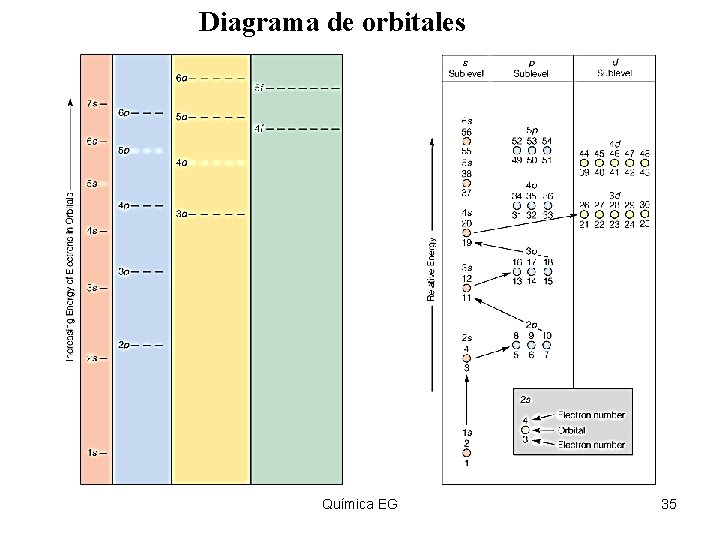
Diagrama de orbitales Insert figure 5. 36 Química EG 35
![Li 3 electrons 1 s 2 2 s 1 He 2 s 1 Química Li 3 electrons 1 s 2 2 s 1 [He] 2 s 1 Química](https://slidetodoc.com/presentation_image_h2/fa6a9c3b363895724d156e29e9091ff5/image-36.jpg)
Li 3 electrons 1 s 2 2 s 1 [He] 2 s 1 Química EG 36

Insert figure 5. 32 Química EG 37

Insert figure 5. 33 Química EG 38

Insert figure 5. 34 Química EG 39

Insert figure 5. 35 Química EG 40

Regla diagonal Química EG 41

Configuración electrónica • Hacer ejercicios 1. Átomo de Bohr 2. Configuración electrónica como átomo. 3. Configuración electrónica como ion. 4. C. E. desarrollada, semidesarrollada y abreviada. Química EG 42

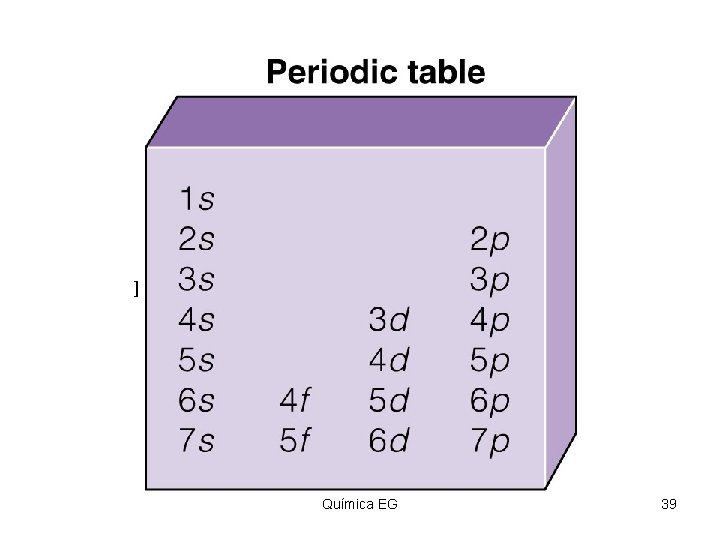
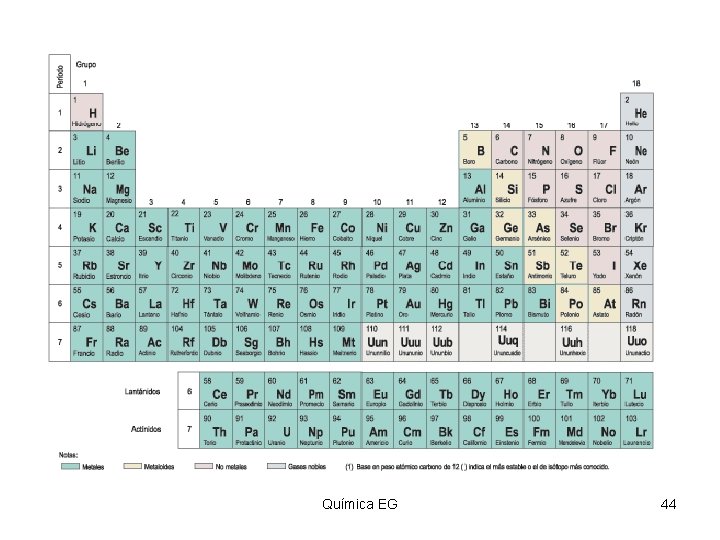
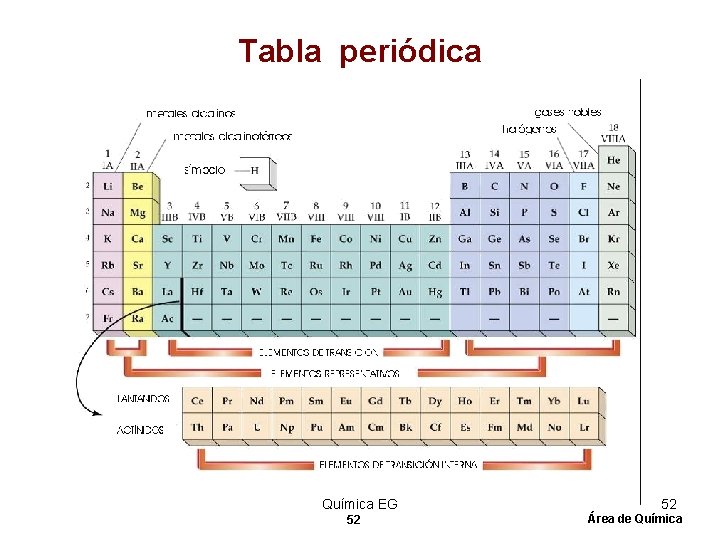
TABLA PERIODICA Documento (tabla) que contiene un ordenamiento de los elementos conforme a número atómico creciente, de modo que los elementos con propiedades similares aparecen en la misma columna. Química EG 43

Química EG 44

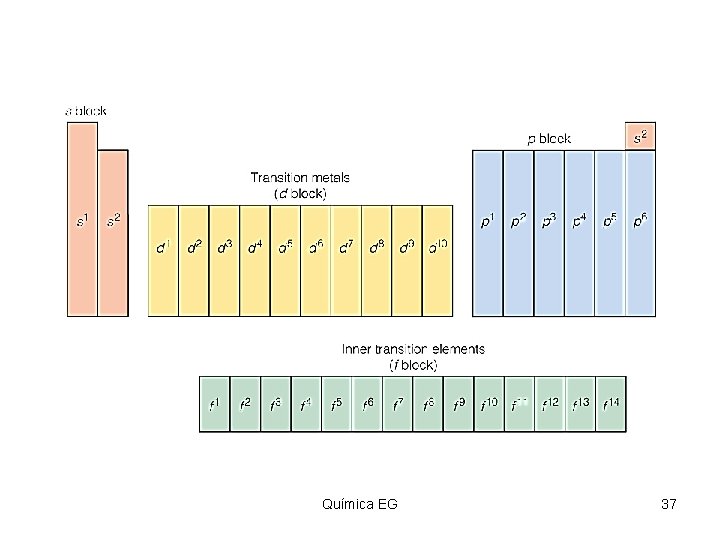
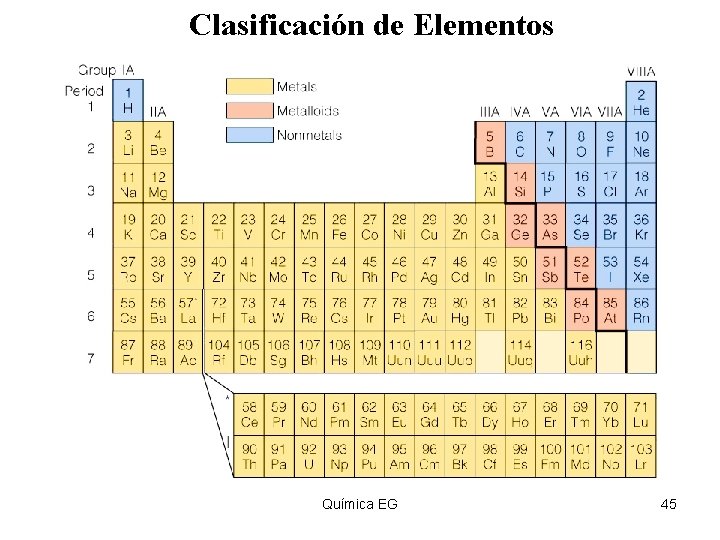
Clasificación de Elementos Insert figure 4. 6 Química EG 45

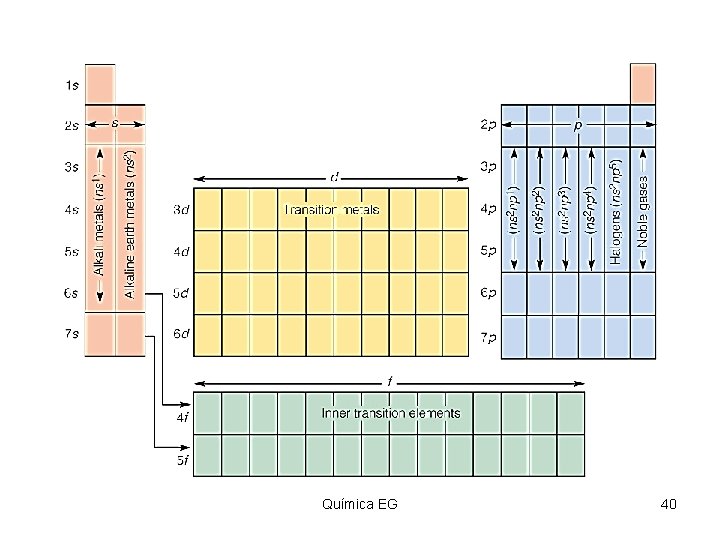
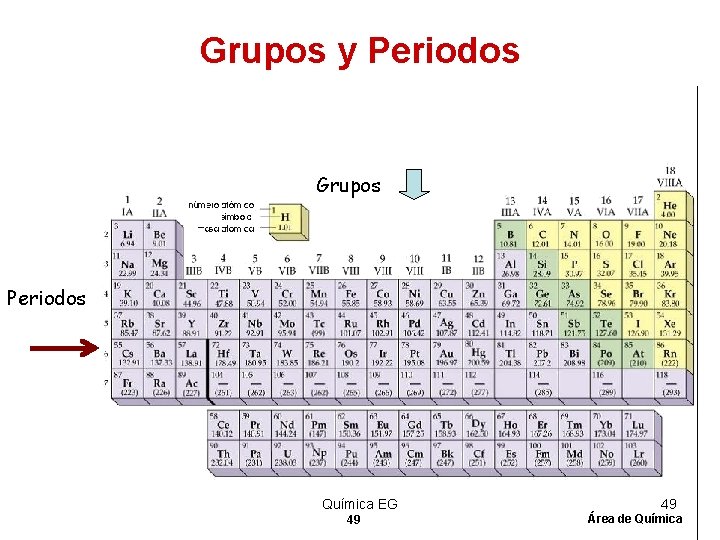
Periodos de elementos • Los Periodos de elementos son las filas horizontales de la tabla periódica. Las propiedades de los elementos varían de izquierda a derecha a lo largo de la tabla periódica. • En la izquierda, la tabla periódica inicia con unos metales muy reactivos, y en el lado derecho se ubican los no metales que terminan cada periodo con un gas noble no reactivo. Química EG 46 46 Área de Química

Grupos y familias Ø Las columnas verticales de elementos en la tabla periódica son llamadas grupos o familias. Ø Los elementos en el mismo grupo o familia tienen propiedades químicas similares. Ø Los elementos representativos pertenecen a los dos primeros grupos y los últimos seis. Ø Estos son designados como grupos “A” o grupos 1, 2, 13 -18. Química EG 47 47 Área de Química

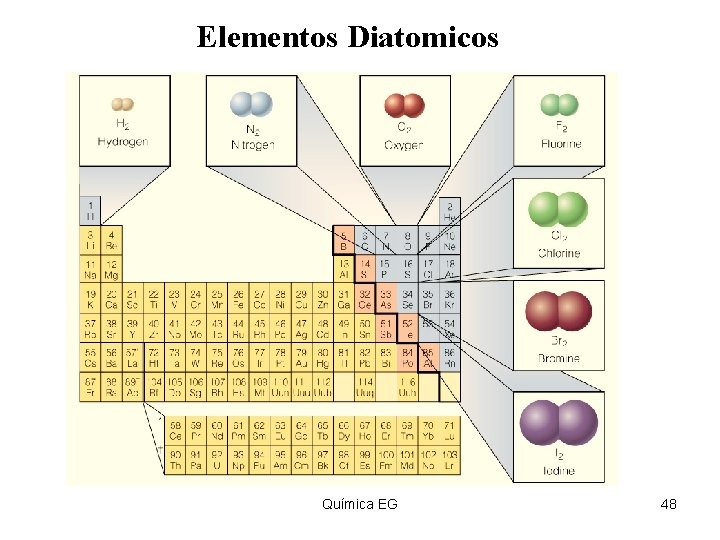
Elementos Diatomicos Química EG 48

Grupos y Periodos Grupos Periodos Química EG 49 49 Área de Química

Metales, no-metales y metaloides Ø Metales – sustancias brillosas, opacas, buenos conductores del calor y la electricidad, maleables, dúctiles. Ejemplo: Cu. Ø Lado izquierdo de la tabla. Ø No-metales – no conducen la electricidad o calor, no maleables o dúctiles. Ejemplo; C. Ø Lado derecho de la tabla. Ø Metaloides – Elementos que tienen propiedades de ambos metales y no metales. Débiles conductores de la electricidad. Ejemplo: Si. Química EG 50 50 Área de Química

Nombre de algunas familias • • • Groupo 1: metales alcalinos. Groupo 2: metales alcalinotérreos. Groupo 7: halogenos. Groupo 8: gases nobles. Elementos de transición – IIIB-IIB. Elementos de transición interna – lantánidos y actínidos. Química EG 51 51 Área de Química

Tabla periódica Química EG 52 52 Área de Química

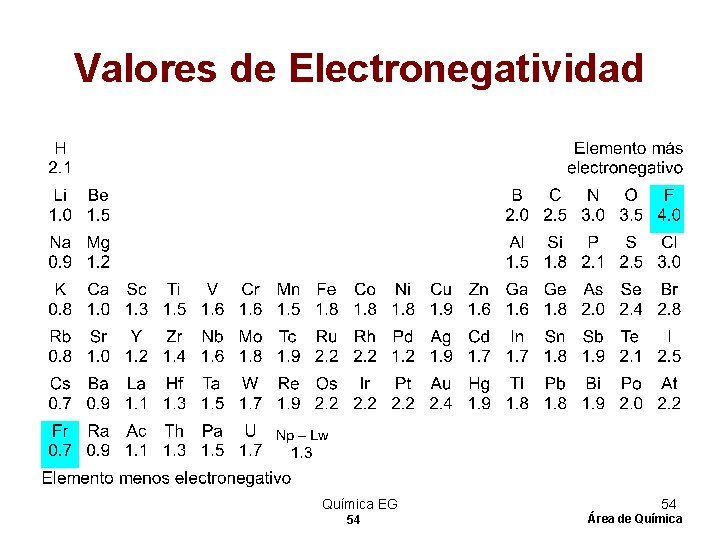
Electronegatividad 1 Capacidad que tiene un átomo de atraer electrones comprometidos en un enlace. 2 Los valores de E. N. Son útiles para predecir el tipo de enlace que se puede formar entre átomos de diferentes elementos. Química EG 53 53 Área de Química

Valores de Electronegatividad Química EG 54 54 Área de Química

ELECTRONEGATIVIDAD • Es una medida del poder de un átomo o un grupo de átomos para atraer electrones desde otras partes de la entidad molecular. • El concepto fue cuantificado por numerosos autores, incluyendo especialmente a Linus Pauling y Mulliken. Química EG 55

Recordatorio Química EG 56

Ejemplos Química EG 57
 Unidades de millar centenas decenas unidades
Unidades de millar centenas decenas unidades Partes del tomo
Partes del tomo Tomo cerovšek
Tomo cerovšek Asumo riesgos y tomo la iniciativa
Asumo riesgos y tomo la iniciativa Mensajes selectos tomo 1
Mensajes selectos tomo 1 Ajla tomo
Ajla tomo Esde tomo ii
Esde tomo ii Estructura del atomo
Estructura del atomo Codigo nacional de electricidad tomo iv
Codigo nacional de electricidad tomo iv Principi di chimica moderna - tomo a soluzioni
Principi di chimica moderna - tomo a soluzioni E+a galaxy
E+a galaxy Leo primero tomo 1 primero basico
Leo primero tomo 1 primero basico Subestandar ejemplos
Subestandar ejemplos Cercano esta jehova a los quebrantados de corazon
Cercano esta jehova a los quebrantados de corazon Tomi keber
Tomi keber Tomo fix
Tomo fix Tomo mano romanas veimare
Tomo mano romanas veimare Tömő utca onkológia
Tömő utca onkológia Tomo el jugo en un a. cuchillo b. vaso c. plato
Tomo el jugo en un a. cuchillo b. vaso c. plato Principi di chimica moderna tomo b soluzioni
Principi di chimica moderna tomo b soluzioni 1 tomo
1 tomo Mientras cenaban jesus tomo el pan y pronuncio
Mientras cenaban jesus tomo el pan y pronuncio Tadej golob
Tadej golob 10 november diperingati sebagai hari pahlawan
10 november diperingati sebagai hari pahlawan Tomo hd
Tomo hd Espectrometria de massa
Espectrometria de massa Modelo atómico de bohr características
Modelo atómico de bohr características Icp
Icp S masa atomica
S masa atomica Massa atômica
Massa atômica Teoria atomica della materia
Teoria atomica della materia Democrito de abdera teoria
Democrito de abdera teoria Massa molar formula
Massa molar formula Notacion atomica
Notacion atomica Partículas subatómicas
Partículas subatómicas Massa atomica relativa definizione
Massa atomica relativa definizione Joseph priestley
Joseph priestley Modelo atomico
Modelo atomico Masa atmica
Masa atmica Teoria atomica de dalton
Teoria atomica de dalton Cunoscand masa molara a carbonului
Cunoscand masa molara a carbonului Malha cristalina
Malha cristalina Spettroscopia di emissione
Spettroscopia di emissione La mole schema
La mole schema Soluzioni chimica più capitolo 8
Soluzioni chimica più capitolo 8 Massa atômica
Massa atômica Dimensões à escala atómica exercicios
Dimensões à escala atómica exercicios Spettroscopia atomica
Spettroscopia atomica Notacion atomica
Notacion atomica Democrito teoria atomica
Democrito teoria atomica 1803
1803 Microscopie de forta atomica
Microscopie de forta atomica Composizione percentuale
Composizione percentuale Constante de avogrado
Constante de avogrado Numero di massa
Numero di massa Proposiciones atomicas
Proposiciones atomicas Legge di proust
Legge di proust Massa atómica relativa
Massa atómica relativa