Cintica Enzimtica Prof Dr Henning Ulrich Influncia do




![Influência do Substrato Ä Concentração de substrato [S]: afeta a velocidade da reação; Ä Influência do Substrato Ä Concentração de substrato [S]: afeta a velocidade da reação; Ä](https://slidetodoc.com/presentation_image/360d10020def64ab291cbe7dff7c635c/image-5.jpg)
![Influência do Substrato Ä [E] = cte Ä [S] = V 0 linear Ä Influência do Substrato Ä [E] = cte Ä [S] = V 0 linear Ä](https://slidetodoc.com/presentation_image/360d10020def64ab291cbe7dff7c635c/image-6.jpg)


![Influência do Substrato Ä Qualquer instante da reação: E e ES; Ä [S] = Influência do Substrato Ä Qualquer instante da reação: E e ES; Ä [S] =](https://slidetodoc.com/presentation_image/360d10020def64ab291cbe7dff7c635c/image-9.jpg)





![Complexo enzima-substrato: ES v (formação) = k 1 [S] [E] { v (“degradação”) = Complexo enzima-substrato: ES v (formação) = k 1 [S] [E] { v (“degradação”) =](https://slidetodoc.com/presentation_image/360d10020def64ab291cbe7dff7c635c/image-16.jpg)

![Variável dependente: velocidade de reação, função de [S]. Constante*: velocidade máxima Variável independente: concentração Variável dependente: velocidade de reação, função de [S]. Constante*: velocidade máxima Variável independente: concentração](https://slidetodoc.com/presentation_image/360d10020def64ab291cbe7dff7c635c/image-18.jpg)
![Parâmetros Cinéticos Ä Exemplo: [S] (g/L) 0, 25 0, 51 1, 03 2, 52 Parâmetros Cinéticos Ä Exemplo: [S] (g/L) 0, 25 0, 51 1, 03 2, 52](https://slidetodoc.com/presentation_image/360d10020def64ab291cbe7dff7c635c/image-19.jpg)

![Inibidores Competitivos Ä [S] Vmáx = Km Ä Experimento • 1º [E], [S] = Inibidores Competitivos Ä [S] Vmáx = Km Ä Experimento • 1º [E], [S] =](https://slidetodoc.com/presentation_image/360d10020def64ab291cbe7dff7c635c/image-22.jpg)

![Inibidores Competitivos Ä Relação entre as velocidades com e sem inibidor Ä [S] = Inibidores Competitivos Ä Relação entre as velocidades com e sem inibidor Ä [S] =](https://slidetodoc.com/presentation_image/360d10020def64ab291cbe7dff7c635c/image-24.jpg)
![Inibidores Não-Competitivos Ä Ocupa outro sítio ES, EI e EIS; Ä [S] = não Inibidores Não-Competitivos Ä Ocupa outro sítio ES, EI e EIS; Ä [S] = não](https://slidetodoc.com/presentation_image/360d10020def64ab291cbe7dff7c635c/image-25.jpg)













- Slides: 45

Cinética Enzimática Prof. Dr. Henning Ulrich



![Influência do Substrato Ä Concentração de substrato S afeta a velocidade da reação Ä Influência do Substrato Ä Concentração de substrato [S]: afeta a velocidade da reação; Ä](https://slidetodoc.com/presentation_image/360d10020def64ab291cbe7dff7c635c/image-5.jpg)
Influência do Substrato Ä Concentração de substrato [S]: afeta a velocidade da reação; Ä Efeito de [S]: varia durante o curso de uma reação S P; Ä Velocidade inicial (V 0): [S] >> [E] tempo muito curto [S] = constante.
![Influência do Substrato Ä E cte Ä S V 0 linear Ä Influência do Substrato Ä [E] = cte Ä [S] = V 0 linear Ä](https://slidetodoc.com/presentation_image/360d10020def64ab291cbe7dff7c635c/image-6.jpg)
Influência do Substrato Ä [E] = cte Ä [S] = V 0 linear Ä [S] = V 0 Ä V 0 = Vmáx

Influência do Substrato Ä Alguns casos a V 0 não pode ser medida • Não existe técnica experimental; • Equação química não representa a transformação; Ä Velocidade da reação: • Velocidade média de consumo ou produção; • Variação de uma propriedade no sistema.

Influência do Substrato Ä Vitor Henri (1903): E liga-se ao S para formar ES passo obrigatório; Ä Leonor Michaelis e Maud Menten (1913) • E combina-se reversivelmente com S ES E+S • ES se rompe E e P ES k 2 k 1 k-1 ES E+P
![Influência do Substrato Ä Qualquer instante da reação E e ES Ä S Influência do Substrato Ä Qualquer instante da reação: E e ES; Ä [S] =](https://slidetodoc.com/presentation_image/360d10020def64ab291cbe7dff7c635c/image-9.jpg)
Influência do Substrato Ä Qualquer instante da reação: E e ES; Ä [S] = velocidade da reação [S]; Ä Vmáx = todas as moléculas de E estiverem na forma ES enzima “saturada”; Ä [S]: estado pré-estacionário ES; • Estado estacionário [ES] = cte; • V 0 estado estacionário.

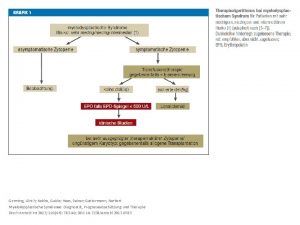
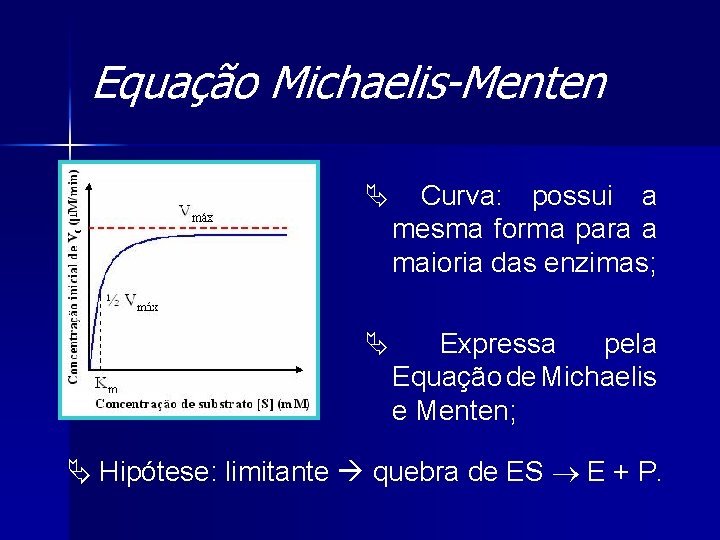
Equação Michaelis-Menten Ä Curva: possui a mesma forma para a maioria das enzimas; Ä Expressa pela Equação de Michaelis e Menten; Ä Hipótese: limitante quebra de ES E + P.

Equação Michaelis-Menten Ä Equação da velocidade para uma reação catalisada enzimaticamente e com um único substrato; Ä Relação quantitativa entre a V 0, a Vmáx e a [S] inicial relacionadas através de Km.

Equação Michaelis-Menten Ä Relação numérica: V 0 é metade de Vmáx; Ä km = “afinidade” pelo substrato; Km afinidade Ä Vmáx é proporcional à [E].

Significado de Km e Vmáx Ä Equação Michaelis dependência hiperbólica; e Menten = Ä Mecanismos de reação diferentes catalisam reações com 6 ou 8 passos; Ä Significado e magnitude de Vmáx e Km varia; Ä Km: depende de aspectos específicos do mecanismo de reação.

Significado de Km e Vmáx Ä K 2 << K-1 afinidade da enzima; Ä K 2 >> K-1; Ä K 2 e K-1 são comparáveis a Km função complexa; Ä Vmáx: número de passos da reação e identidade dos passos limitantes.

Significado de Km e Vmáx E+S K 1 K-1 ES K 2 K-2 EP K 3 E+P Ä Enzima na saturação: EP e Vmáx = k 3. [Et]; Ä Kcat = velocidade limitante de qualquer reação enzimas saturadas; Ä Kcat e Km = ambiente celular, concentração do substrato e química da reação.
![Complexo enzimasubstrato ES v formação k 1 S E v degradação Complexo enzima-substrato: ES v (formação) = k 1 [S] [E] { v (“degradação”) =](https://slidetodoc.com/presentation_image/360d10020def64ab291cbe7dff7c635c/image-16.jpg)
Complexo enzima-substrato: ES v (formação) = k 1 [S] [E] { v (“degradação”) = k-1[ES] + k 2 [ES] = (k-1 + k 2) [ES] Estado estacionário (“steady state”): [ES] = constante v de formação = v de “degradação” ou: k 1 [S] [E] = (k-1 + k 2) [ES] [E] / [ES] = (k-1 + k 2) / k 1 { (k-1 + k 2) / k 1 = Km Constante de Michaelis [ES] = [S] [E] / Km { [E] = [ET] – [ES] { [ES] = ([ET] – [ES]) [S] / Km [ES] = [ET] [S] / Km – [ES] [S] / Km {[ES] + [ES] [S] / Km = [ET] [S] / Km ([ES] Km + [ES] [S]) / Km = [ET] [S] / Km { [ES] = [ET] [S] / Km + [S] [ES] (Km + [S]) / Km = [ET] [S] / Km

![Variável dependente velocidade de reação função de S Constante velocidade máxima Variável independente concentração Variável dependente: velocidade de reação, função de [S]. Constante*: velocidade máxima Variável independente: concentração](https://slidetodoc.com/presentation_image/360d10020def64ab291cbe7dff7c635c/image-18.jpg)
Variável dependente: velocidade de reação, função de [S]. Constante*: velocidade máxima Variável independente: concentração do substrato. Constante de Michaelis: KD aparente de ES. * “Constante”: Vmax é função de [E]total
![Parâmetros Cinéticos Ä Exemplo S gL 0 25 0 51 1 03 2 52 Parâmetros Cinéticos Ä Exemplo: [S] (g/L) 0, 25 0, 51 1, 03 2, 52](https://slidetodoc.com/presentation_image/360d10020def64ab291cbe7dff7c635c/image-19.jpg)
Parâmetros Cinéticos Ä Exemplo: [S] (g/L) 0, 25 0, 51 1, 03 2, 52 4, 33 7, 25 Vo (g/L. h) 0, 78 1, 25 1, 66 2, 19 2, 35 2, 57

Parâmetros Cinéticos Ä Exemplo: Lineweaver-Burk

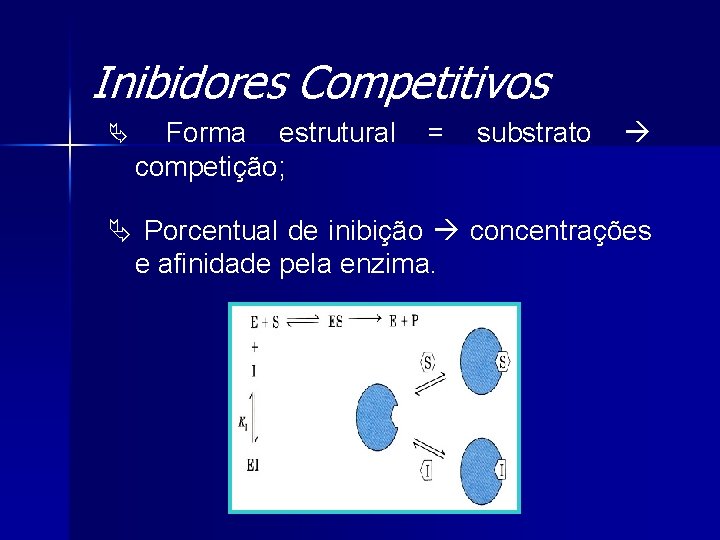
Inibidores Competitivos Ä Forma estrutural competição; = substrato Ä Porcentual de inibição concentrações e afinidade pela enzima.
![Inibidores Competitivos Ä S Vmáx Km Ä Experimento 1º E S Inibidores Competitivos Ä [S] Vmáx = Km Ä Experimento • 1º [E], [S] =](https://slidetodoc.com/presentation_image/360d10020def64ab291cbe7dff7c635c/image-22.jpg)
Inibidores Competitivos Ä [S] Vmáx = Km Ä Experimento • 1º [E], [S] = cte • 2º [E], [I] = cte 1/V 0 x 1/[S]

Inibidores Competitivos Ä Equação de Michaelis e Menten Ä Lineweaver-Burk
![Inibidores Competitivos Ä Relação entre as velocidades com e sem inibidor Ä S Inibidores Competitivos Ä Relação entre as velocidades com e sem inibidor Ä [S] =](https://slidetodoc.com/presentation_image/360d10020def64ab291cbe7dff7c635c/image-24.jpg)
Inibidores Competitivos Ä Relação entre as velocidades com e sem inibidor Ä [S] = influência do [I] desprezível.
![Inibidores NãoCompetitivos Ä Ocupa outro sítio ES EI e EIS Ä S não Inibidores Não-Competitivos Ä Ocupa outro sítio ES, EI e EIS; Ä [S] = não](https://slidetodoc.com/presentation_image/360d10020def64ab291cbe7dff7c635c/image-25.jpg)
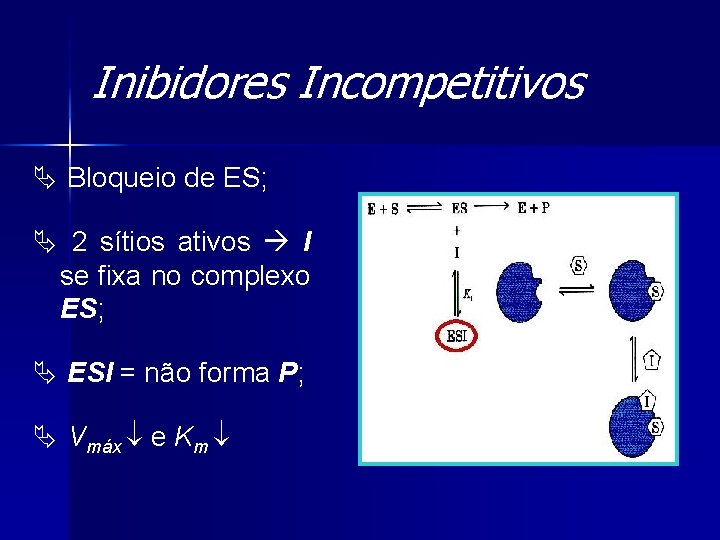
Inibidores Não-Competitivos Ä Ocupa outro sítio ES, EI e EIS; Ä [S] = não leva todas as E produtiva; Ä Vmáx e Km normal.

Inibidores Não-Competitivos Ä Equação da velocidade: Ä Lineweaver-Burk

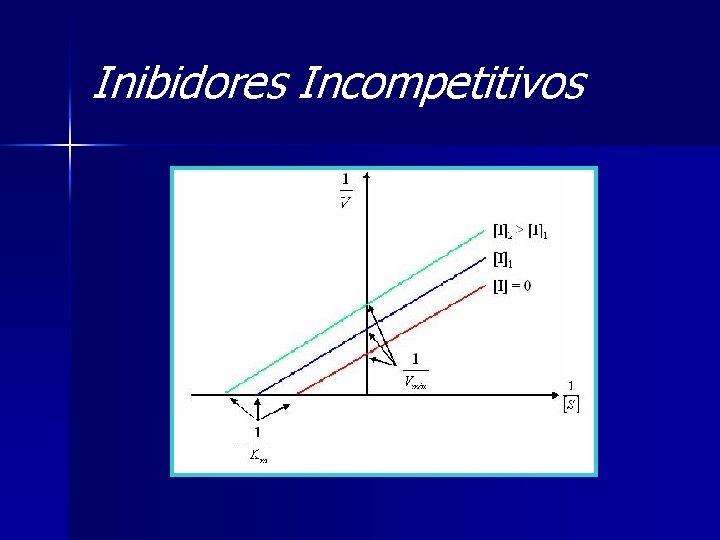
Inibidores Incompetitivos Ä Bloqueio de ES; Ä 2 sítios ativos I se fixa no complexo ES; Ä ESI = não forma P; Ä Vmáx e Km

Inibidores Incompetitivos Ä Equação da velocidade: Ä Lineweaver-Burke:

Inibidores Incompetitivos

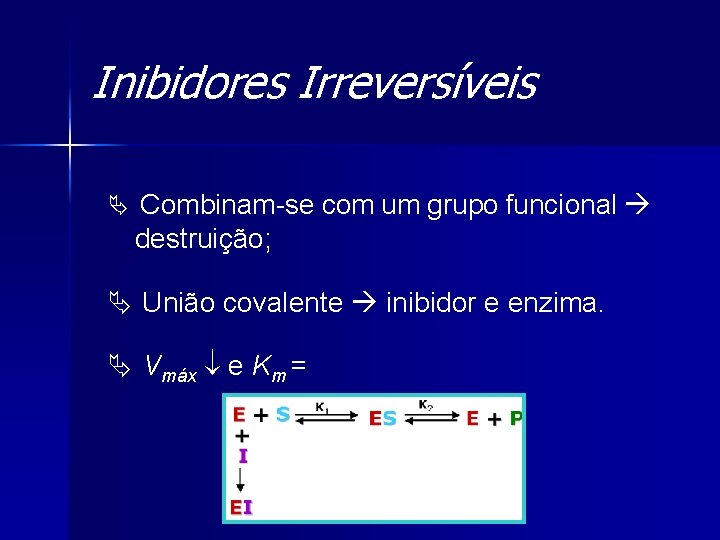
Inibidores Irreversíveis Ä Combinam-se com um grupo funcional destruição; Ä União covalente inibidor e enzima. Ä Vmáx e Km =

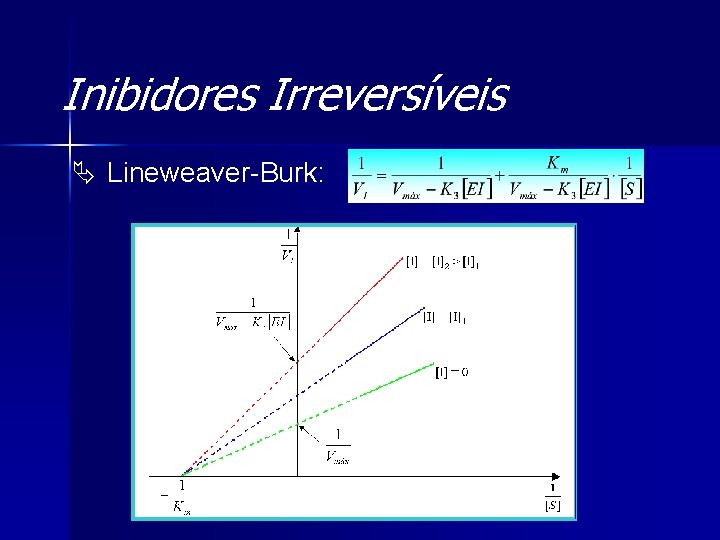
Inibidores Irreversíveis Ä Equação de Michaelis e Menten:

Inibidores Irreversíveis Ä Lineweaver-Burk:

Influência do p. H Ä Valor de p. H ótimo = atividade máxima; Ä Velocidade da reação: p. H afasta do ótimo; Ä Influência do p. H: análise dos grupos dissociáveis; Ä Ácidos (Brönsted): compostos capazes de dissociar-se, liberando H+.

Influência do p. H HA A + H+ Ä p. H HA A Ä Aminoácidos: Ä p. H -COO- captam prótons = -COOH; Ä p. H -NH 3+ são dissociados = NH 2; - -- NH +. Ligação eletrostática = -COO 3 Ä

Influência do p. H Ä p. H ótimo depende do número e tipo de grupos ionizáveis estrutura primária; Ä Variações do p. H afeta substrato com grupos ionizáveis; Ä Estabilidade da enzima: temperatura, força iônica, concentração de substratos ou cofatores da enzima e concentração da enzima, entre outros.

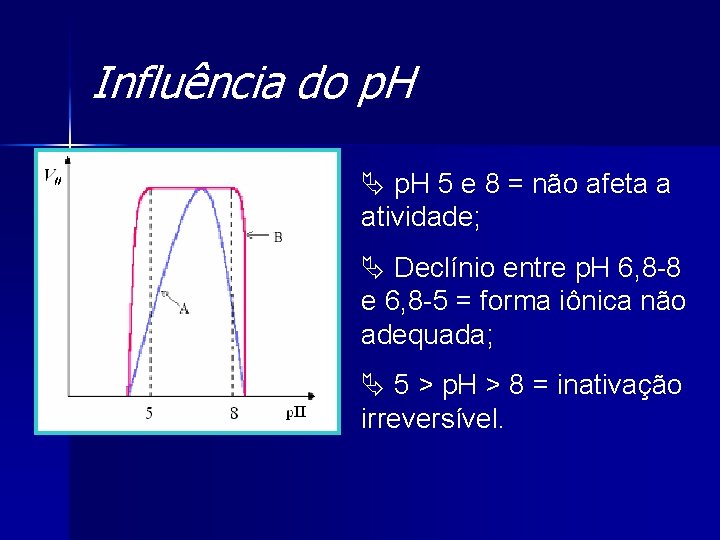
Influência do p. H Ä p. H 5 e 8 = não afeta a atividade; Ä Declínio entre p. H 6, 8 -8 e 6, 8 -5 = forma iônica não adequada; Ä 5 > p. H > 8 = inativação irreversível.

Influência da Temperatura Ä T velocidade de reação = energia cinética; Ä T muito elevadas = desnaturação da enzima • Rompidas as pontes de hidrogênio alterações estruturas = nova conformação; • T desnaturação pouco acima da T ótima.

Influência da Temperatura Ä Enzimas PM 1 cadeia polipeptídica e pontes dissulfeto = estáveis ao calor; Ä Efeito da T = p. H, força iônica e a presença ou ausência de ligantes; Ä Substratos protegem desnaturação. a enzima da

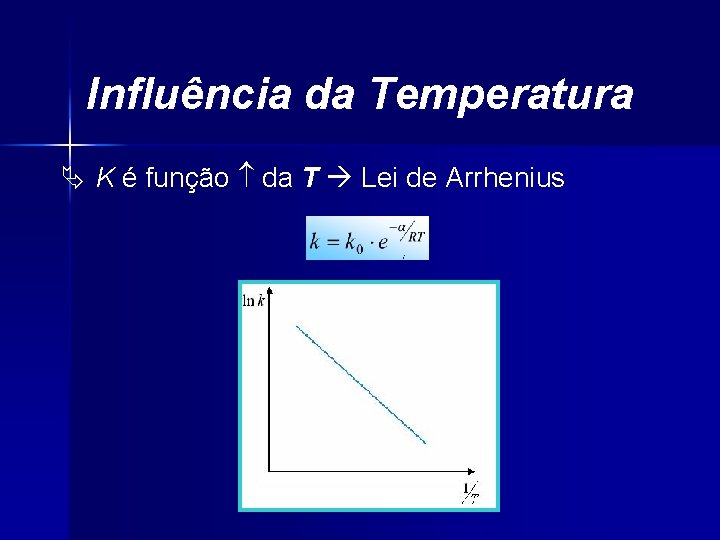
Influência da Temperatura Ä K é função da T Lei de Arrhenius

Influência da Temperatura Ä Enzimas são termolábeis enzimática = inativação términa reação Ä Efeito da T na velocidade das reações coeficiente de temperatura • Velocidade quando a T 10ºC.

Regulação da Atividade Ä Sistema enzimático: produto da reação da 1ª enzima substrato da enzima subseqüente; Ä Enzimas reguladoras determina velocidade da seqüência; • Atividade catalítica ou sinais; Ä Moléculas sinalizadoras metabólitos ou cofatores. a pequenos

Enzimas Alostéricas Ä Ligação não-covalente e reversível modulador; Ä Inibição por retroalimentação • Enzima reguladora inibida pelo P final da via reequilibra as necessidades celulares; Ä Moduladores: inibidores ou estimuladores.

Enzimas Alostéricas Ä Modulador = substrato homotrópicas; Ä Modulador substrato heterotrópicas; Ä Sítio alostérico específico para o modulador; Ä Curva de saturação sigmóide subunidades múltiplas.

Enzimas Alostéricas Ä curvas de variação de atividade moduladores inibidores, ativadores ou os dois tipos.

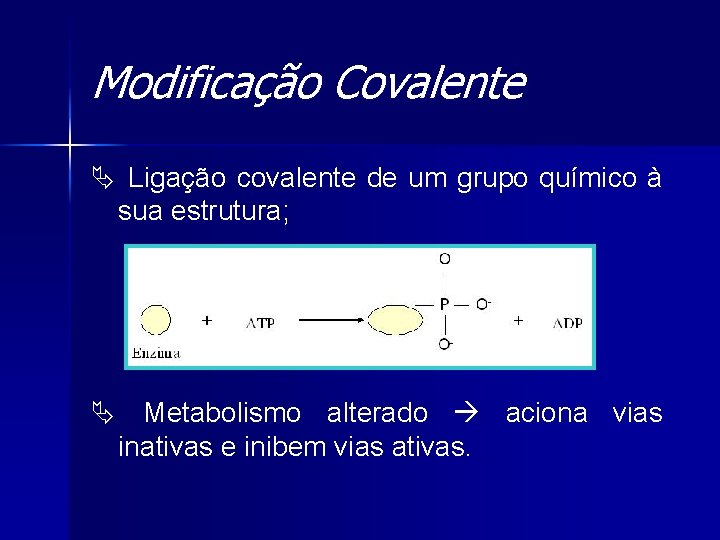
Modificação Covalente Ä Ligação covalente de um grupo químico à sua estrutura; Ä Metabolismo alterado aciona vias inativas e inibem vias ativas.
 Qumica
Qumica Inhibicion
Inhibicion Cintica
Cintica Cintica
Cintica Capacidade termica massica
Capacidade termica massica Cintica
Cintica Cintica
Cintica Catlyse
Catlyse Cintica
Cintica Cintica
Cintica Equação de michaelis menten
Equação de michaelis menten Cintica
Cintica Cintica
Cintica Cintica
Cintica Qumica
Qumica Teoria cinetica de los gases
Teoria cinetica de los gases Trabalho sobre energia
Trabalho sobre energia Molecularitat
Molecularitat Martin henning fdic
Martin henning fdic Elise henning
Elise henning Henning soller
Henning soller Laura henning
Laura henning Supertidal
Supertidal Erich fromm haben oder sein
Erich fromm haben oder sein Matthias henning
Matthias henning Carley nuzzo
Carley nuzzo Henning jørgensen aau
Henning jørgensen aau Henning schulzrinne
Henning schulzrinne Henning hermjakob
Henning hermjakob Kamfjord bo og behandlingssenter
Kamfjord bo og behandlingssenter Henning fjell johansen
Henning fjell johansen Jan henning pedersen
Jan henning pedersen Henning fjell johansen
Henning fjell johansen Henning brandt
Henning brandt Henning kurz
Henning kurz Kriminalgeschichte des christentums gesamtausgabe
Kriminalgeschichte des christentums gesamtausgabe Ulrich classen
Ulrich classen Hans ulrich goessl
Hans ulrich goessl Ulrich ellenborg
Ulrich ellenborg Zwingli
Zwingli Ulrich zwingli
Ulrich zwingli Modello di ulrich
Modello di ulrich Haas
Haas Ulrich kampffmeyer
Ulrich kampffmeyer Ulrich uwer
Ulrich uwer Ulrich hohenester
Ulrich hohenester