Cintica enzimtica Enzimas michaelianas Efecto de inhibidores Regulacin

Cinética enzimática Enzimas michaelianas Efecto de inhibidores Regulación de la actividad enzimática

Energía de activación Una enzima aumenta la velocidad de reacción, pero no altera el G o la constante de equilibrio

Enzima micheliana Hipérbola Enzima alostérica Sigmoide


Enzimas michaelianas • Formación del complejo enzima-sustrato • Suposición de equilibrio rápido k-1>>> k 2 • La concentración del complejo enzima-sustrato se mantiene constante durante toda la reacción. Teoría del estado estacionario E + S k 1 k-1 ES Complejo enzimasustrato k 2 E + P

Curva de progreso de los componentes de una reacción Michaelis–Menten simple
![Curva de progreso de una reacción catalizada por una enzima Vo 2 [S 2] Curva de progreso de una reacción catalizada por una enzima Vo 2 [S 2]](http://slidetodoc.com/presentation_image/09822b5867995823bad322642117a516/image-7.jpg)
Curva de progreso de una reacción catalizada por una enzima Vo 2 [S 2] [P] Vo 1 [S 1] d [P] - d[S] = v= dt dt Tiempo

Ecuación de Michaelis Menten k 1 k 2 E + S E + P k-1 d [P ] = k 2 [ES] v= dt

k-1 k 2 E + S E + P k 1 En estado estacionario, la velocidad de formación y rompimiento del complejo ES es igual: k 1 [E][S] = k-1 [ES] + k 2 [ES] = k 1 k-1 + k 2 [E][S]
![[E][S] [ES] = k-1 + k 2 [E]T = [E]L + [ES] k 1 [E][S] [ES] = k-1 + k 2 [E]T = [E]L + [ES] k 1](http://slidetodoc.com/presentation_image/09822b5867995823bad322642117a516/image-10.jpg)
[E][S] [ES] = k-1 + k 2 [E]T = [E]L + [ES] k 1 ([E]T - [ES]) [S] [ES] = k-1 + k 2 k 1 ([E]T - [ES]) [S] = Km [ES] [E]T [S] [ES] = Km + [S] Km
![[E]T [S] [ES] = Km + [S] v = k 2[ES] [E]T[S] k 2 [E]T [S] [ES] = Km + [S] v = k 2[ES] [E]T[S] k 2](http://slidetodoc.com/presentation_image/09822b5867995823bad322642117a516/image-11.jpg)
[E]T [S] [ES] = Km + [S] v = k 2[ES] [E]T[S] k 2 v = Km + [S] A altas concentraciones de sustratos v= Vmax = k 2 [E]T Vmax [S] v = Km + [S]
![Ecuación de Michaelis Menten Vo 2 [S 2] [P] Vo 1 [S 1] Tiempo Ecuación de Michaelis Menten Vo 2 [S 2] [P] Vo 1 [S 1] Tiempo](http://slidetodoc.com/presentation_image/09822b5867995823bad322642117a516/image-12.jpg)
Ecuación de Michaelis Menten Vo 2 [S 2] [P] Vo 1 [S 1] Tiempo Vo = d. P dt
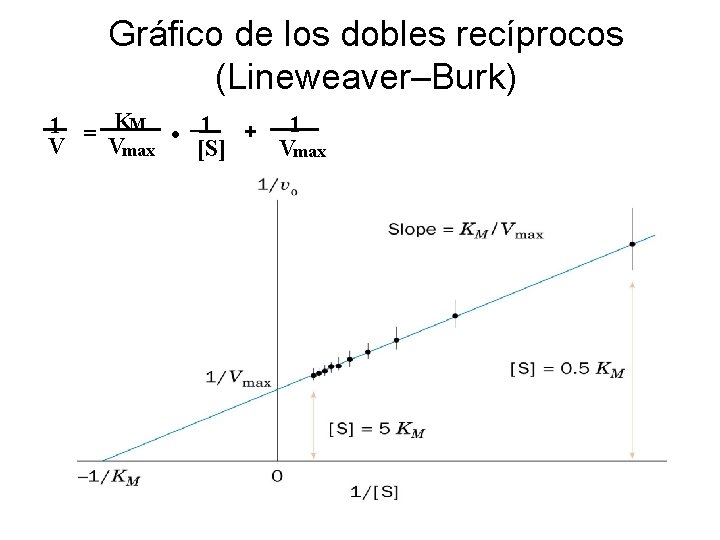
Gráfico de los dobles recíprocos (Lineweaver–Burk) 1 = KM • 1 + 1 Vmax V [S] Vmax
![Conclusiones de la ecuación de Michaelis - Menten • cuando [S]= KM, la ecuación Conclusiones de la ecuación de Michaelis - Menten • cuando [S]= KM, la ecuación](http://slidetodoc.com/presentation_image/09822b5867995823bad322642117a516/image-14.jpg)
Conclusiones de la ecuación de Michaelis - Menten • cuando [S]= KM, la ecuación queda: • cuando [S] >> KM, la ecuación queda • cuando [S] << KM, la ecuación queda

Significado of Km • • • Km da cuenta de la afinidad de la enzima por el sustrato Km baja significa una alta afinidad por el sustrato; Km alta significa una baja afinidad por el sustrato Si se compara una enzima con dos sustratos Hexokinasa : D-fructosa Km = 1. 5 m. M D-glucosa Km = 0. 15 m. M Si se compara dos enzimas con el mismo sustrato Hexokinasa: D-glucosa Km = 0. 15 m. M Glucokinasa: D-glucosa Km = 20 m. M
![kcat o número de recambio Vmax = k 2 [E]T En la cinética de kcat o número de recambio Vmax = k 2 [E]T En la cinética de](http://slidetodoc.com/presentation_image/09822b5867995823bad322642117a516/image-16.jpg)
kcat o número de recambio Vmax = k 2 [E]T En la cinética de Michaelis -Menton k 2= kcat Kcat es el número de moles de sustrato convertidos a producto por segungo y por mol de enzima Es una medida útil para comparar las actividades de diferentes enzimas

Significado de la kcat o el número de recambio, cont…. .

Efecto de inhibidores • Inhibidor reversible: unión no covalente de un compuesto a una enzima - Inhibidor competitivo - Inhibidor no competitivo - Inhibidor acompetitivo • Inhibidor irreversible : generalmente es un compuesto que se une covalentemente a la enzima

Inhibidores reversibles

Inhibidor competitivo Ki = constante de disociación para el inhibidor

Ejemplo de un inhibidor competitivo
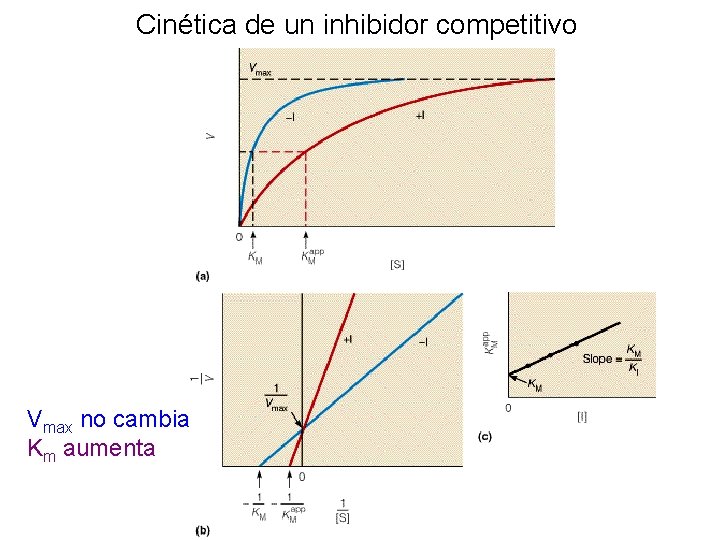
Cinética de un inhibidor competitivo Vmax no cambia Km aumenta

Inhibidor no-competitivo

Cinética para un inhibidor no-competitivo Vmax dismunuye Km no cambia

Regulación de la actividad enzimática 1. Regulación alostérica 2. Modificación covalente reversible 3. Activación proteolítica 4. Cambio en el número de enzima presente

Enzimas alostéricas
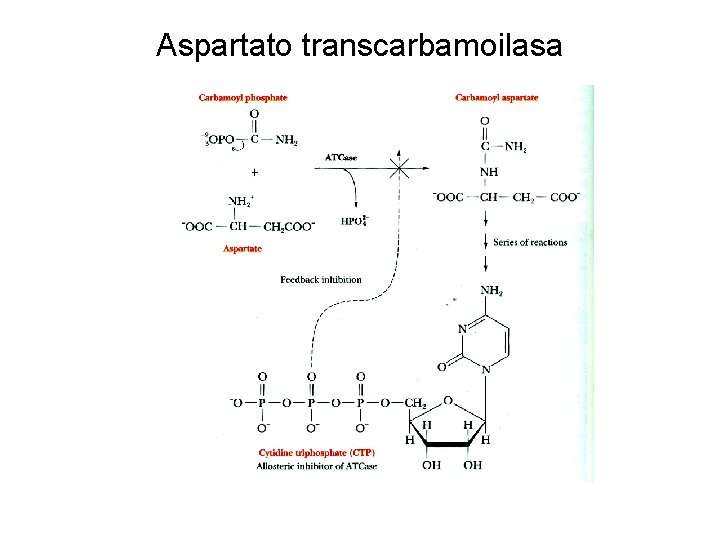
Aspartato transcarbamoilasa

Aspartato transcarbamoilasa Estado R Estado T

Regulación de la actividad enzimática Modificación covalente
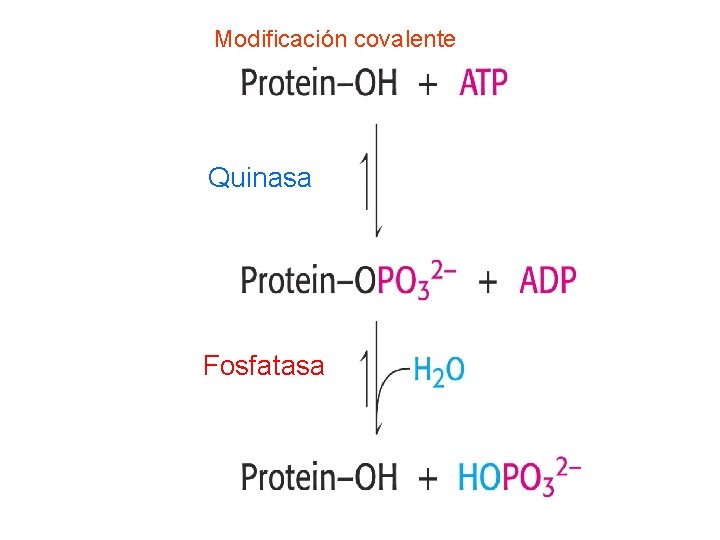
Modificación covalente Quinasa Fosfatasa

Activación por rompimiento proteolítico

Secreción de los zimógenos

Zymogen activation by proteolytic cleavage Zymogens orange, active enzymes yellow Secreted by cells that line duodenum Digestive proteins of duodenum 33

Activación proteolítica del chimotripsinógeno 3 cadenas unidas por dos puentes disúlfuro (A-B y B-C)
- Slides: 34