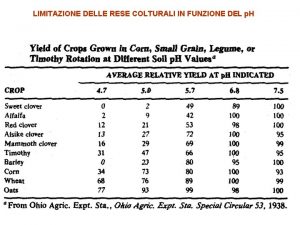
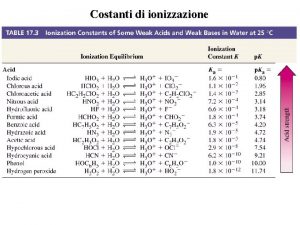
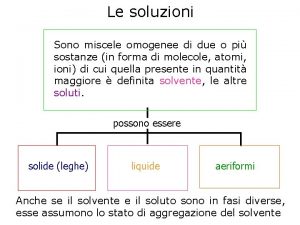
1 Se la soluzione acquosa 0 1 M






































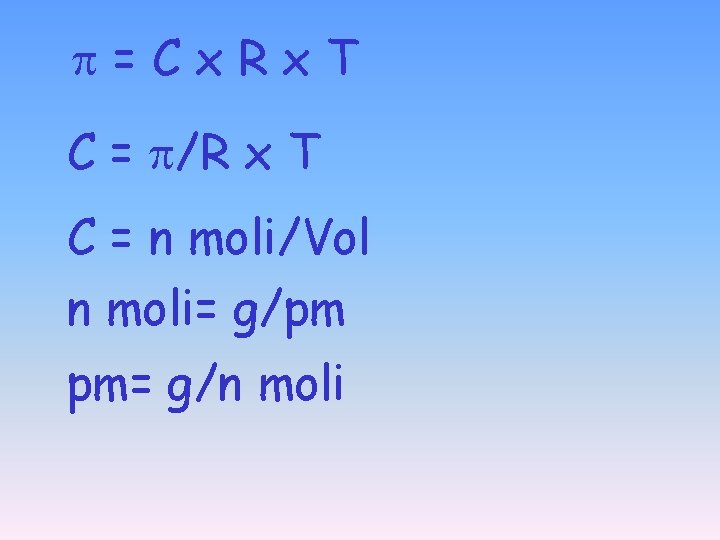










![CH 3 COO- + H 2 O K i= [OH-] [CH 3 COOH] [CH CH 3 COO- + H 2 O K i= [OH-] [CH 3 COOH] [CH](https://slidetodoc.com/presentation_image_h/27f00b1e9a4e022055a51a676b50e058/image-55.jpg)






- Slides: 64

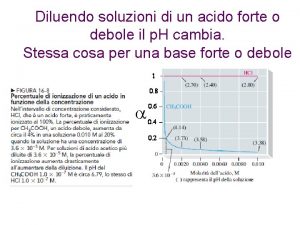
1. Se la soluzione acquosa 0. 1 M di una sostanza ha p. H = 4. 5, la sostanza in soluzione è: A. Un acido forte B. Un acido debole C. Una sostanza neutra D. Una base di Lewis E. Una base debole Poiché il valore del p. H è inferiore a 7 sicuramente la sostanza in soluzione è un acido. Per stabilire se si tratta di un acido forte o debole bisogna calcolare la [H 3 O+] e verificare se questa risulta uguale alla concentrazione dell’acido, CA. Infatti, nel caso di acidi forti, [H 3 O+] = CA, mentre nelle soluzioni di acidi deboli si ha che [H 3 O+] < CA.

2. Il p. H di una soluzione 10 -8 molare di HCl (acido forte) è: A. Uguale a 7 B. Uguale a 8 C. Inferiore a 7 D. Inferiore a 6 E. indeterminabile Se noi applichiamo la regola p. H = -log [H 3 O+] per cui si ottiene un p. H = 8 commettiamo un errore grossolano. In ogni soluzione acida, [H 3 O+] > 10 -7 e quindi il p. H < 7; in realtà in soluzioni molto diluite, gli ioni provenieti dall’autoprotolisi dell’acqua non sono trascurabili e contribuiscono alla concentrazione totale degli ioni [H 3 O+]. La concentrazione degli ioni H 3 O+ provenienti dall’acqua è pari a 10 -7. La concentrazione totale degli ioni H 3 O+ sarà uguale a (10 -7 + 10 -8) M, ovvero 1. 1 x 10 -7 M. Si ha quindi p. H = -log 1. 1 x 10 -7 = 6. 9 (risposta C)

3. Se un litro di soluzione aquosa di HCl a p. H = 4 viene diluito con acqua a 10 litri, il p. H della soluzione ottenuta è: A. 0. 4 B. 10 C. 3 D. 5 E. 14 Ricordando che il p. H = -log [H 3 O+], la concentrazione degli ioni H 3 O+ risulta pari a 10 -4. Quando diluiamo a 10 litri, utilizziamo la formula: C 1 x V 1 = C 2 x V 2 per cui C 2 = 10 -5 che corrisponde a un p. H = 5 (risposta D)

4. A quale dei seguenti valori di p. H si ha la massima concentrazione degli ioni H 3 O+? A. 6. 12 B. 8. 14 C. 6. 6 D. 3. 11 E. 3. 5 Ricordando che il p. H = -log [H 3 O+], a valori alti di concentrazione corrispondono bassi valori di p. H, per cui tra i valori proposti quello più basso corrisponde alla lettera D.

5. In una reazione di neutralizzazione si ha sempre: A. Il p. H finale è uguale a quello iniziale B. La concentrazione finale degli ioni H 3 O+ è nulla C. Il p. H finale è diverso da quello iniziale D. Il p. H finale è maggiore di quello iniziale E. Il p. H finale è minore di quello iniziale Ricordiamo che la reazione di neutralizzazione è una reazione tra un acido e una base; se si tratta di un acido e di una base forte il p. H finale sarà uguale a 7, ma se abbiamo a che fare con acidi e basi di forza differente il p. H finale sarà acido o basico a seconda delle sostanze coinvolte. Non esiste, però, una regola generale per poterlo prevedere; sicuramente sarà diverso da quello iniziale (risposta C).

6. Qual è la normalità di una soluzione all’ 8% (p/V) di Na. OH (PM = 40)? A. 2 B. 8 C. 1 D. 4 E. 40 8% significa 8 g in 100 ml ossia 80 g in 1000 ml (= 1 l); la normalità (N) è pari a numero equivalenti / 1 litro; numero di equivalenti = grammi / peso equivalente; p. e. = PM/ n. di equivalenti In questo caso Na. OH è un idrossido monofunzionale per cui il PM = PE, quindi Numero di equivalenti = grammi /PM = 80 / 40 = 2 (risposta A).

6. Un campione di gas occupa un volume di 0, 5 L a 10 °C e 0, 2 atm. Quale è il volume a 1 atm e 0°C? A. 0, 1 B. 0, 01 C. 0, 05 D. 1 E. 0, 15 Dalla legge generale dei gas PV=n. RT n 1=n 2 per cui V 2 = V 1 x __ T 2 x __ P 1 T 1 P 2 P 1 V 1 = P ____ 2 V 2 T 1 T 2 0, 5 x 273 x 0, 2 _____ 283+ 0 0, 096 ≈ 0, 1

7. Se un litro di soluzione acquosa contiene 360 g di HCl (PM = 36) e 360 g di Na. OH (PM = 40) il suo p. H è: A. neutro B. 8 C. 12 D. Minore di 7 E. Maggiore di 7 Bisogna calcolare la concentrazione delle due sostanze: M(HCl) = n. moli/ V(1 l) = g/PM = 360 g / 36 = 10 M. M(Na. OH) = 360/40 = 9 M. Trattandosi di acido e base forti, [H 3 O+] = Ca = 10 e [OH-] = Cb = 9 per cui [H 3 O+] > [OH-] e il p. H è minore di 7 (risposta D).

8. Se una soluzione ha p. H pari a 3 la concentrazione degli ioni OH - è: A. 1 x 10 -11 B. 11 C. 1 x 10 -3 D. 1 x 10 -8 E. Non ci sono OH- perché la soluzione è acida Ricordiamo che p. H = -log [H 3 O+] quindi [H 3 O+] = 1 x 10 -3. p. OH + p. H = 14; p. OH = 14 – 3 = 11 p. OH = -log [OH-]; 11 = -log [OH-] e [OH-] = 1 x 10 -11(risposta A)

9. In 100 ml di una soluzione di HCl 0, 1 N vengono sciolti 0, 01 moli di idrossido di sodio. Una sola delle affermazioni è corretta. Quale? A. Il p. H aumenta perché la soluzione è costituita da elettroliti forti B. Il p. H diminuisce perché la soluzione è costituita da elettroliti forti C. Il p. H aumenta perché la ionizzazione dell’acido cloridrico diminuisce D. Il p. H aumenta perché aumenta la concentrazione degli ossidrilioni E. Il p. H aumenta perché la soluzione è costituita da elettroliti di forza differente

10 A quale p. H si ha la maggior concentrazione di idrogenioni: A. 5 B. 6, 5 C. 7 D. 8 E. 10

11. 1 L di acqua a 18 °C viene saturato con Al(OH)3. Quanti grammi di alluminio passano in soluzione se il prodotto di solubilità di Al(OH) 3 è di 4, 32 x 10 -14 (p. a. Al=27)? : A. 5, 4 x 10 -2 B. 5, 4 x 10 -3 C. 5, 4 x 10 -1 D. 0, 054 E. 0, 54 Al(OH)3 Al+3 + 3 OHs 3 s s x (3 s)3 = 27 s 4 = Kps = 4, 32 x 10 -14 s 4=____ 4, 32 x 10 -14 = 0, 16 x 10 -14 4 s= √ 0, 16 x 10 -14 = 2 x 10 -4 27 g = n x p. a. = 2 x 10 -4 x 27 = 54 x 10 -4

12. Quale è il p. H di una soluzione acquosa di KCl 0, 5 M A. 5 B. 7, 5 C. 7, 0 D. 2 E. 8

13. Partendo da una soluzione di acido cloridrico con p. H uguale a 1 (soluzione A), desidero ottenere una soluzione con p. H uguale a 4 (soluzione B). Di quante volte devo diluire la soluzione A per ottenere la soluzione B? A. 3 B. 4 C. 104 D. 1000 E. 10. 000

14. Rispetto all’acqua pura, una soluzione di Na. Cl: A. È più acida B. È meno acida C. Ha la stessa acidità D. È meno basica E. È più basica o più acida a seconda della concentrazione

15. Il bicarbonato di sodio sciolto in acqua dà una soluzione il cui p. H è: A. basico B. acido C. neutro D. fortemente acido E. Acido o basico a seconda della concentrazione

16. Un sistema tampone è formato da: A. Acidi forti e basi forti B. Acidi e basi deboli in presenza dei loro sali C. Un acido debole aggiunto a Na. Cl D. Un acido o base debole neutralizzati E. Soluzioni diluite di acidi deboli

17. Se 100 ml di una soluzione tampone formata da un acido debole ed un suo sale con una base forte viene diluito con acqua a 100 litri, il p. H della soluzione ottenuta: A. Diventa acido B. Aumenta C. diminuisce D. Resta invariato E. Aumenta o diminuisce a seconda del volume della soluzione tampone

18. Quale delle seguenti soluzioni ha il p. H minore? A. HCl 0, 8 N B. HCl 0, 1 N C. HCl 0, 01 N D. HCl 0, 2 N E. HCl 1 N

19. Una soluzione acquosa 10 -6 M di KOH presenta una concentrazione di ioni H 3 O+ paria: A. 10 -10 M B. 10 -5 M C. 108 M D. 6 x 10 -7 M E. 10 -8 M

20. Individuare, tra le seguenti sostanze l’acido forte: A. Acido acetico B. Acido carbonico C. Acido oleico D. Idrossido di sodio E. Acido nitrico

21. Quale è il p. H di una soluzione di Na. OH 0, 1 M? A. 13 B. 2 C. 0, 13 D. 10 E. 0, 01

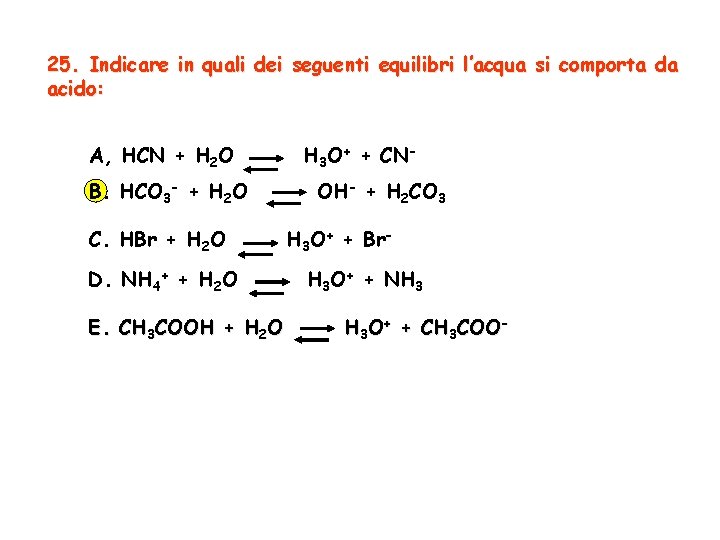
23. L’ idrolisi salina è il fenomeno: A. Dovuto al passaggio di corrente continua attraverso le soluzioni acquose dei sali B. Corrisponde alla scissione di ioni di carica opposta dei componenti dei sali, quando questi vengono disciolti in acqua C. Che provoca la formazione di soluzioni acide o basiche quando determinati tipi di sali, anche se stechiometricamente neutri, vengono disciolti in acqua D. Della scissione dell’acqua a mezzo della corrente elettrica E. Della scissione dell’acqua provocata dalla dissoluzione dei sali

25. Indicare in quali dei seguenti equilibri l’acqua si comporta da acido: A, HCN + H 2 O B. HCO 3 - + H 2 O C. HBr + H 2 O D. NH 4+ + H 2 O E. CH 3 COOH + H 2 O H 3 O+ + CNOH- + H 2 CO 3 H 3 O+ + Br. H 3 O+ + NH 3 H 3 O+ + CH 3 COO-

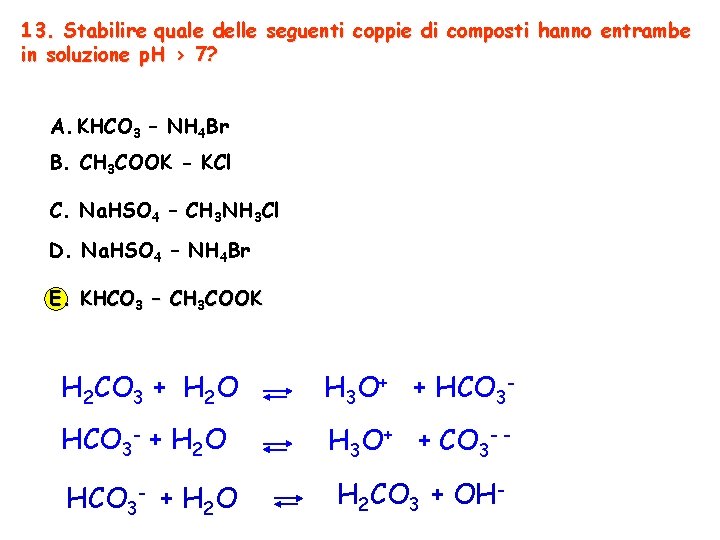
13. Stabilire quale delle seguenti coppie di composti hanno entrambe in soluzione p. H > 7? A. KHCO 3 – NH 4 Br B. CH 3 COOK - KCl C. Na. HSO 4 – CH 3 NH 3 Cl D. Na. HSO 4 – NH 4 Br E. KHCO 3 – CH 3 COOK H 2 CO 3 + H 2 O H 3 O+ + HCO 3 - + H 2 O H 3 O+ + CO 3 - - HCO 3 - + H 2 O H 2 CO 3 + OH-

1. 100 ml di una soluzione 0. 2 M di urea sono mescolati con 300 ml di una soluzione 100 m. M dello stesso composto. La soluzione ottenuta ha concentrazione…. A B C D 150 m. M 15 m. M 12. 5 m. M

M=n moli/Vol n moli tot= n moli di 0, 2 M + n moli di 100 m. M n moli tot= 0, 1 x 0, 2 + 0, 3 x 0, 1= 0, 02+0, 03= 0, 05 M= 0, 05/0, 4= 0, 125

1. 100 ml di una soluzione 0. 2 M di urea sono mescolati con 300 ml di una soluzione 100 m. M dello stesso composto. La soluzione ottenuta ha concentrazione…. A B C D 150 m. M 15 m. M 12. 5 m. M

2. Una soluzione acquosa allo 0. 24% (p/v) di urea (PM= 60) ha una concentrazione…. A B C D 40 x 10 -3 M 4 x 10 -3 M 2. 4 m. M 24 m. M

Una soluzione acquosa allo 0. 24% (p/v) vuol dire % P/V Percento Peso/Volume grammi di Soluto per 100 ml di Soluzione Quindi sono 0, 24 gr di Urea che pesa 60 n moli g/PM= 0, 24/60=0, 004 abbiamo 100 ml quindi M=n moli/ Vol=0, 004/0, 1=0, 04

2. Una soluzione acquosa allo 0. 24% (p/v) di urea (PM= 60) ha una concentrazione…. A B C D 40 x 10 -3 M 4 x 10 -3 M 2. 4 m. M 24 m. M

3. In 30 ml di una soluzione 50 m. M di fruttosio (C 6 H 12 O 6) sono contenuti…. A B C D 270 mg di fruttosio 1. 5 mmoli di fruttosio 1270 mmoli di fruttosio 150 mg di fruttosio

3. In 30 ml di una soluzione 50 m. M di fruttosio (C 6 H 12 O 6) sono contenuti…. M=n moli/Vol A B C D n moli=Mx. Vol n moli=0. 05 x 0. 03 n moli=0. 0015 270 mg di fruttosio 1. 5 mmoli di fruttosio 1270 mmoli di fruttosio 150 mg di fruttosio

3. In 30 ml di una soluzione 50 m. M di fruttosio (C 6 H 12 O 6) sono contenuti…. M=n moli/Vol n moli=Mx. Vol n moli=0. 0015 n moli=g/p. m. pm C 6 H 12 O 6 = 6 Cx 12 12 Hx 1 6 Ox 16 72 12 96 180 g=n moli x pm g=0. 0015 x 180 0. 27 g

3. In 30 ml di una soluzione 50 m. M di fruttosio (C 6 H 12 O 6) sono contenuti…. A B C D 270 mg di fruttosio 1. 5 mmoli di fruttosio 1270 mmoli di fruttosio 150 mg di fruttosio

4. Diluendo 5 ml di una soluzione di solfato (IV) di di sodio 1. 5 M al volume di 250 ml si ottiene una soluzione…. A B C D 30 m. M 40 m. M 55 m. M

4. Diluendo 5 ml di una soluzione di solfato (IV) di di sodio 1. 5 M al volume di 250 ml si ottiene una soluzione…. Mconc x Vconc = Mdil x Vdil 1, 5 x 5= Mdil x Mdil = 1, 5 x 5/250 Mdil = 0. 03 250

4. Diluendo 5 ml di una soluzione di solfato (IV) di di sodio 1. 5 M al volume di 250 ml si ottiene una soluzione…. A B C D 30 m. M 40 m. M 55 m. M

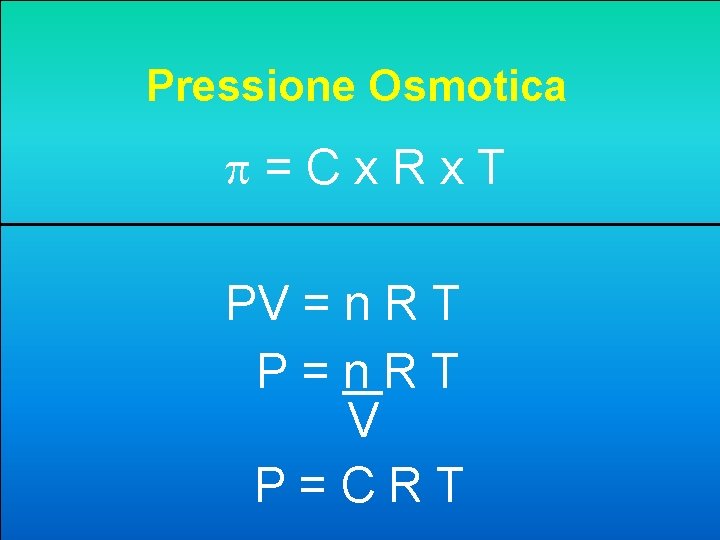
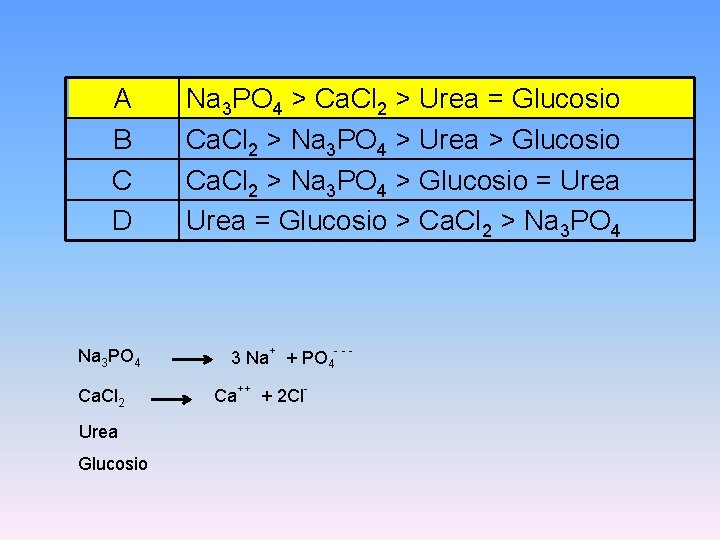
5. Ordinare secondo i valori di Pressione Osmotica Decrescente soluzioni 0. 1 M dei seguenti soluti. A B C D Na 3 PO 4 > Ca. Cl 2 > Urea = Glucosio Ca. Cl 2 > Na 3 PO 4 > Urea > Glucosio Ca. Cl 2 > Na 3 PO 4 > Glucosio = Urea = Glucosio > Ca. Cl 2 > Na 3 PO 4

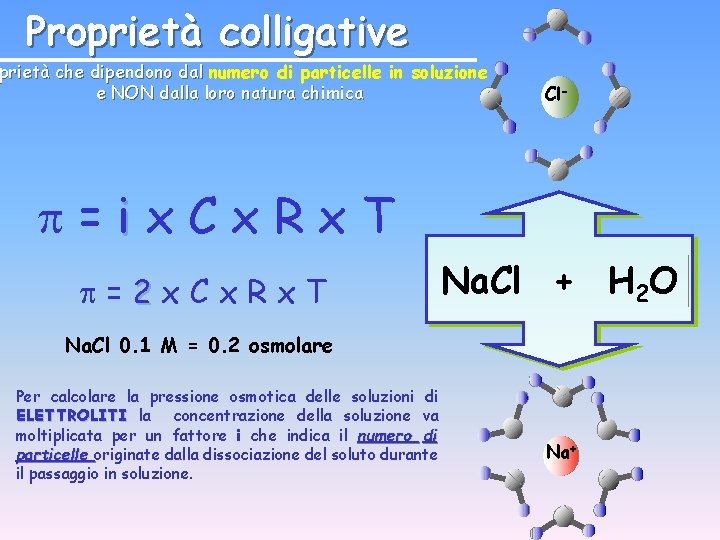
Pressione Osmotica =Cx. Rx. T PV = n R T P=n. RT V P=CRT

Proprietà colligative prietà che dipendono dal numero di particelle in soluzione e NON dalla loro natura chimica Cl- =ix. Cx. Rx. T =2 x. Cx. Rx. T Na. Cl + H 2 O Na. Cl 0. 1 M = 0. 2 osmolare Per calcolare la pressione osmotica delle soluzioni di ELETTROLITI la concentrazione della soluzione va moltiplicata per un fattore i che indica il numero di particelle originate dalla dissociazione del soluto durante il passaggio in soluzione. Na+

A B C D Na 3 PO 4 Ca. Cl 2 Urea Glucosio Na 3 PO 4 > Ca. Cl 2 > Urea = Glucosio Ca. Cl 2 > Na 3 PO 4 > Urea > Glucosio Ca. Cl 2 > Na 3 PO 4 > Glucosio = Urea = Glucosio > Ca. Cl 2 > Na 3 PO 4 3 Na+ + PO 4 - - Ca++ + 2 Cl-

6. In 500 ml della soluzione di un peptide di peso molecolare non noto sono contenuti 4. 32 g del composto. La pressione osmotica della soluzione, a 25°C, è 0. 244 atm. Qual è il peso molecolare del composto? A B C D 433 866 86, 6 72, 6
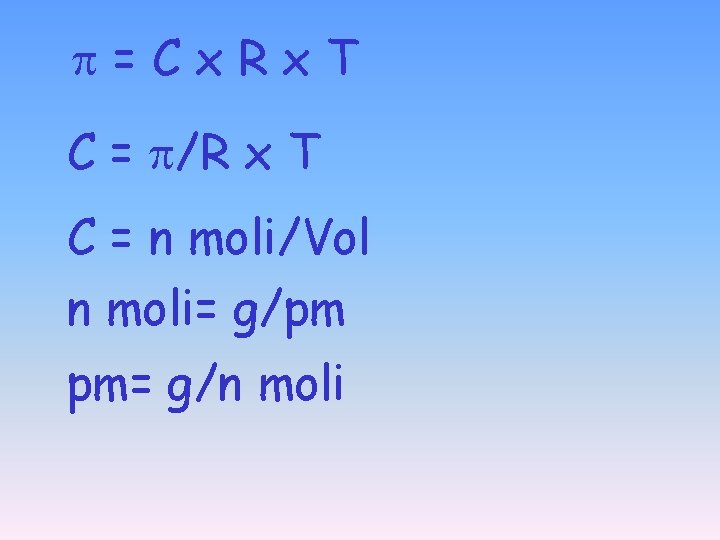
=Cx. Rx. T C = /R x T C = n moli/Vol n moli= g/pm pm= g/n moli

6. In 500 ml della soluzione di un peptide di peso molecolare non noto sono contenuti 4. 32 g del composto. La pressione osmotica della soluzione, a 25°C, è 0. 244 atm. Qual è il peso molecolare del composto? A B C D 433 866 86, 6 72, 6

7. Mescolando 50 ml di una soluzione 0. 2 M di urea con 25 ml di una soluzione 0. 1 M di (NH 4)2 SO 4 si ottiene una soluzione la cui pressione osmotica, a 25°C, è… A B C D 2. 04 atm 4. 08 atm 4. 89 atm 5. 7 atm

7. Mescolando 50 ml di una soluzione 0. 2 M di urea con 25 ml di una soluzione 0. 1 M di (NH 4)2 SO 4 si ottiene una soluzione la cui pressione osmotica, a 25°C, è… =Cx. Rx. T C = n moli/volume n moli=C x volume

7. Mescolando 50 ml di una soluzione 0. 2 M di urea con 25 ml di una soluzione 0. 1 M di (NH 4)2 SO 4 si ottiene una soluzione la cui pressione osmotica, a 25°C, è… A B C D 2. 04 atm 4. 08 atm 4. 89 atm 5. 7 atm

8. A 25°C, la pressione osmotica di una soluzione composta mescolando 5 ml di fosfato (V) di trisodio 5 m. M, 10 ml di solfato (VI) di disodio 10 m. M, 20 ml di cloruro di sodio 20 m. M, 30 ml di glucosio 30 m. M è… A B C D 790 mm. Hg 0, 601 atm 601 mm. Hg 0. 79 atm

1. Calcolare il valore approssimato del p. H di una soluzione acquosa di acido cloridrico preparata disciogliendo 20 mg in 250 ml A B C D 2. 1 2. 7 1. 8 1. 4

2. Calcolare il valore approssimato del p. H di una soluzione acquosa di ammoniaca preparata disciogliendo 20 mg in 250 ml A B C D 12. 3 6. 8 3. 8 10. 2

p. H di soluzioni di BASI deboli NH 3 + H 2 O NH 4+ + OH- [OH-] Kb Cb p. H = 14 - log Kb Cb Basi deboli p. OH = ½ p Kb – ½ log Cb

2. Calcolare il valore approssimato del p. H di una soluzione acquosa di ammoniaca preparata disciogliendo 20 mg in 250 ml A B C D 12. 3 6. 8 3. 8 10. 2

3. Calcolare il valore approssimato del p. H di una soluzione acquosa di acetato di sodio preparata disciogliendo 0. 5 grammi del sale in 30 ml A B C D 5. 0 9. 9 4. 1
![CH 3 COO H 2 O K i OH CH 3 COOH CH CH 3 COO- + H 2 O K i= [OH-] [CH 3 COOH] [CH](https://slidetodoc.com/presentation_image_h/27f00b1e9a4e022055a51a676b50e058/image-55.jpg)
CH 3 COO- + H 2 O K i= [OH-] [CH 3 COOH] [CH 3 COO-] Kb [OH-] CH 3 COOH + OH[OH-] [CH 3 COOH] = Kb [OH-]2 Cs [CH 3 COO-] Cs = Kw Ka Kb • Cs p. OH = - log [OH-] - ½ log Kb – ½ log Cs p. OH = ½ p Kb – ½ log Cs

3. Calcolare il valore approssimato del p. H di una soluzione acquosa di acetato di sodio preparata disciogliendo 0. 5 grammi del sale in 30 ml A B C D 5. 0 9. 9 4. 1

4. Calcolare il valore approssimato del p. H di una soluzione acquosa preparata mescolando 100 ml di acido fosforico 250 m. M e 500 ml di idrossido di sodio 100 m. M A B C D 4. 1 9. 7 2. 7 7. 5

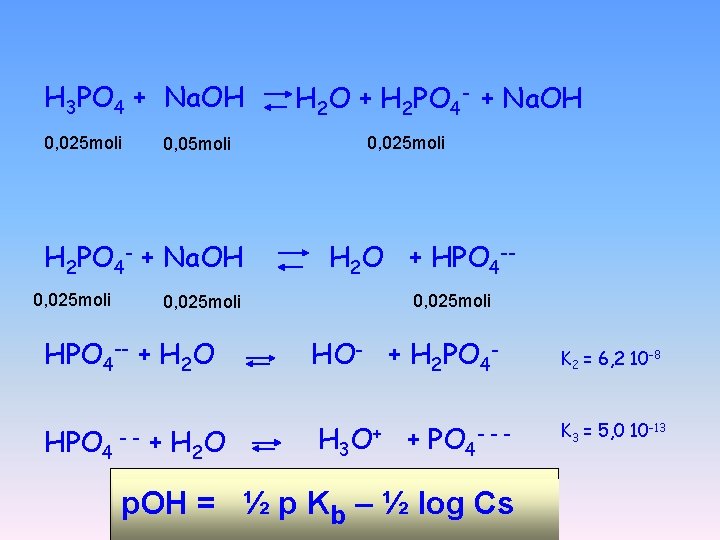
H 3 PO 4 + Na. OH 0, 025 moli H 2 O + HPO 4 -0, 025 moli HPO 4 -- + H 2 O HPO 4 0, 025 moli 0, 05 moli H 2 PO 4 - + Na. OH 0, 025 moli H 2 O + H 2 PO 4 - + Na. OH -- + H 2 O HO- + H 2 PO 4 H 3 O+ + PO 4 --- p. OH = ½ p Kb – ½ log Cs K 2 = 6, 2 10 -8 K 3 = 5, 0 10 -13

4. Calcolare il valore approssimato del p. H di una soluzione acquosa preparata mescolando 100 ml di acido fosforico 250 m. M e 500 ml di idrossido di sodio 100 m. M A B C D 4. 1 9. 7 2. 7 7. 5

5. Calcolare il valore approssimato del p. H di una soluzione acquosa preparata mescolando 40 ml di acido fosforico 25 m. M e 25 ml di idrossido di sodio 20 m. M A B C D 3. 1 4. 0 4. 3 2. 1

H 3 PO 4 + Na. OH 0, 001 moli 0, 0005 moli __ H 2 O + H 2 PO 4__ 0, 0005 moli

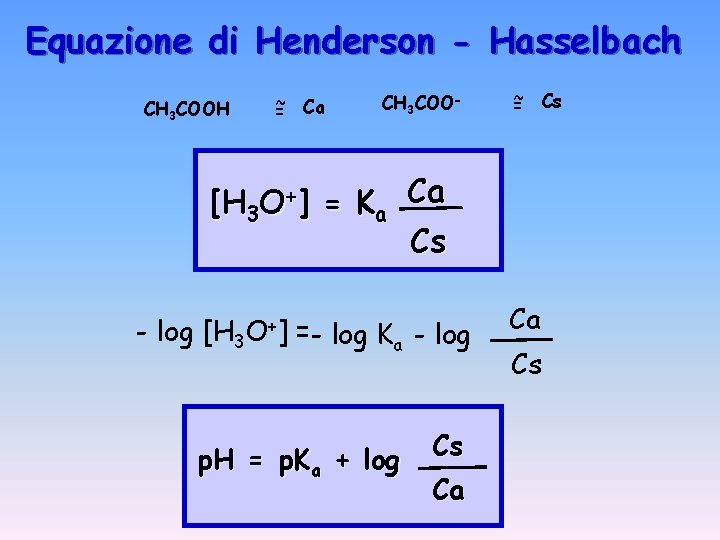
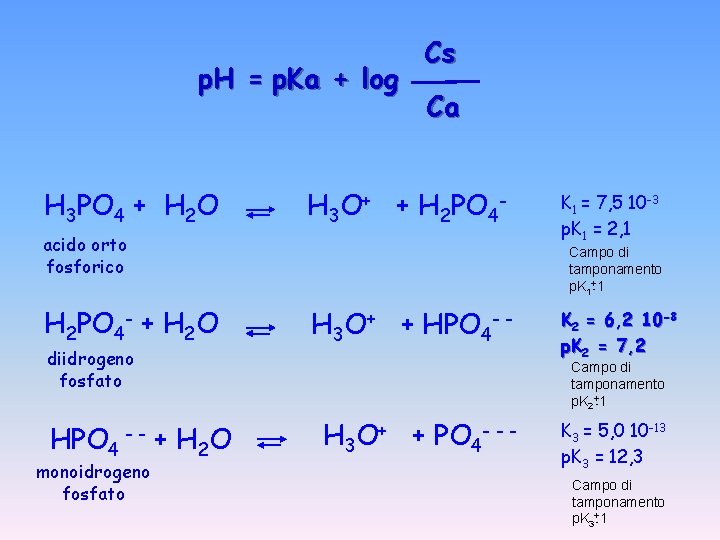
Equazione di Henderson - Hasselbach CH 3 COOH ~ Ca = CH 3 COO- ~ = Cs [H 3 O+] = Ka Ca Cs - log [H 3 O+] = - log Ka - log p. H = p. Ka + log Cs Ca Ca Cs

p. H = p. Ka + log H 3 PO 4 + H 2 O Cs Ca H 3 O+ + H 2 PO 4 - acido orto fosforico Campo di tamponamento p. K 1+-1 H 2 PO 4 - + H 2 O diidrogeno fosfato HPO 4 -- monoidrogeno fosfato K 1 = 7, 5 10 -3 p. K 1 = 2, 1 H 3 O+ + HPO 4 - - K 2 = 6, 2 10 -8 p. K 2 = 7, 2 Campo di tamponamento p. K 2+-1 + H 2 O H 3 O+ + PO 4 --- K 3 = 5, 0 10 -13 p. K 3 = 12, 3 Campo di tamponamento p. K 3+-1

5. Calcolare il valore approssimato del p. H di una soluzione acquosa preparata mescolando 40 ml di acido fosforico 25 m. M e 25 ml di idrossido di sodio 20 m. M A B C D 3. 1 4. 0 4. 3 2. 1
 Rettangolo con 12 pentamini
Rettangolo con 12 pentamini Soluzione satura
Soluzione satura Modello di markowitz
Modello di markowitz Funzione
Funzione Soluzioni chimica più dalla materia alla nomenclatura
Soluzioni chimica più dalla materia alla nomenclatura Soluzione
Soluzione Curva di riscaldamento di un miscuglio
Curva di riscaldamento di un miscuglio La stella nascosta di samuel loyd soluzione
La stella nascosta di samuel loyd soluzione Soluzione
Soluzione Giuseppe valitutti
Giuseppe valitutti Soluzione
Soluzione Soluzione
Soluzione Polaresale.com
Polaresale.com Uniprog risco
Uniprog risco Soluzione
Soluzione Soluzione immagine
Soluzione immagine Preparazione soluzione tampone
Preparazione soluzione tampone Polare e apolare
Polare e apolare Titolazione acido-base zanichelli
Titolazione acido-base zanichelli Trinapoli
Trinapoli Sistemi di disequazioni lineari
Sistemi di disequazioni lineari Soluzione
Soluzione Soluzione
Soluzione Normalità di una soluzione
Normalità di una soluzione Il paradosso del barbiere soluzione
Il paradosso del barbiere soluzione Soluzione tampone
Soluzione tampone Soluzione telefonia aziendale
Soluzione telefonia aziendale Solubilit
Solubilit Iceberg delle competenze
Iceberg delle competenze Soluzione
Soluzione Chimica analitica
Chimica analitica Soluzione
Soluzione Legge henry
Legge henry Normalità di una soluzione
Normalità di una soluzione Einstellung o impostazione soggettiva
Einstellung o impostazione soggettiva Soluzione
Soluzione Maura danese
Maura danese Soluzione neutra
Soluzione neutra Paradosso di russell
Paradosso di russell Spontaneita
Spontaneita Un carpentiere ha 32 metri di tavole soluzione
Un carpentiere ha 32 metri di tavole soluzione Acido forte e debole
Acido forte e debole Distillazione azeotropica
Distillazione azeotropica Cubo di rubik angoli
Cubo di rubik angoli Moli/litro
Moli/litro Soluzioni chimica piu verde
Soluzioni chimica piu verde Osserva la foto scattata a roma soluzione
Osserva la foto scattata a roma soluzione Pressione osmotica
Pressione osmotica Preparazione di soluzioni a concentrazione nota
Preparazione di soluzioni a concentrazione nota Soluzione
Soluzione Come si risolve un'equazione pura
Come si risolve un'equazione pura