Elettrolisi soluzione acquosa salina Alcuni potenziali standard di











- Slides: 13

Elettrolisi soluzione acquosa salina



Alcuni potenziali standard di riduzione E° Na+ 2 H 2 O Zn++ +e + 2 e > > > Na° -2. 71 H 2 + 2 OH- -0. 83 Zn° -0. 76 2 H 3 O + 2 e > H 2 + 2 H 2 O 0. 00 2 H+ + 2 e > H 2 0. 00 Cu++ + 2 e > Cu° +. 034 O 2 + 2 H 2 O + 4 e > 4 OH- + 0. 40 02 + 4 H 3 O + 4 e > 6 H 2 O + 1. 23 Cl 2 + 2° 2 Cl- + 1. 36 > Gli elementi che precedono si ossidano a spese di quelli che seguono H 2 + Cl 2 > 2 H+ 2 Cl. H-H + Cl-Cl > H+Cl- + H+Cl. Al catodo si riducono prima gli elementi che seguono All’anodo si ossidano prima glie elementi che seguono Na+/Na° 2 H 2 O/H 2 + 2 OH 2 H 3 O/H 2 + 2 H 2 -2. 71 -0. 83 precede su Na+ 0. 00 (poco presente)




Nella elettrolisi di Na. Cl in soluzione acquosa si deve considerare anche la possibilità che agli elettrodi possa avvenire la riduzione e ossidazione del solvente acqua : (in competizione con Na+ e Cl-) l’idrogeno da positivo può acquistare elettroni e ridursi a idrogeno neutro atomico e subito molecolare H 2 da 2 H+ 2 OH- > H 2 + 2 OHL’ossigeno da negativo può cedere elettroni e ossidarsi ad atomo (e poi formare molecola) da 2 H+ O-- > 2 H+ 0. 5 O 2 In pratica al catodo : riduzione dell’acqua : si libera H 2° Na* rimane in soluzione e forma Na*OHAll’anodo: ossidazione del cloro si libera Cl 2 Vedi tabella potenziali redox che influisce sulla precedenza nella reazione agli elettrodi (insieme alla concentrazione e altri fattori…)




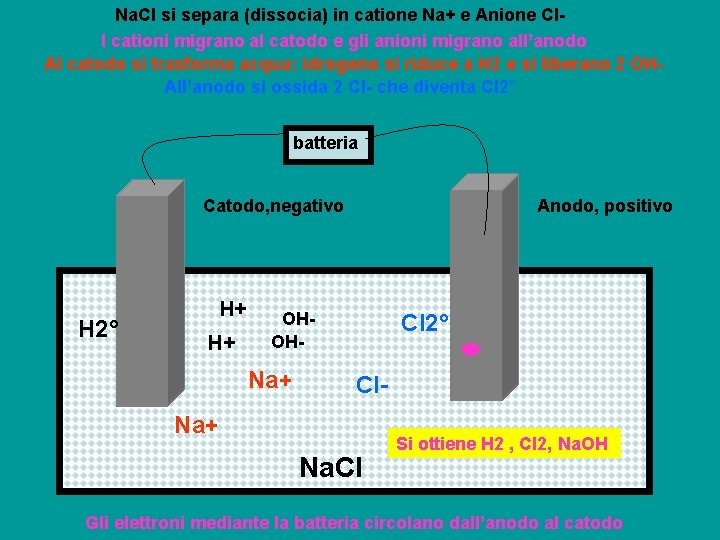
Na. Cl si separa (dissocia) in catione Na+ e Anione Cl. I cationi migrano al catodo e gli anioni migrano all’anodo Al catodo si trasforma acqua: idrogeno si riduce a H 2 e si liberano 2 OHAll’anodo si ossida 2 Cl- che diventa Cl 2° batteria Catodo, negativo H 2° H+ H+ Anodo, positivo OHOH- Na+ Cl 2° Cl- Na+ Na. Cl Si ottiene H 2 , Cl 2, Na. OH Gli elettroni mediante la batteria circolano dall’anodo al catodo

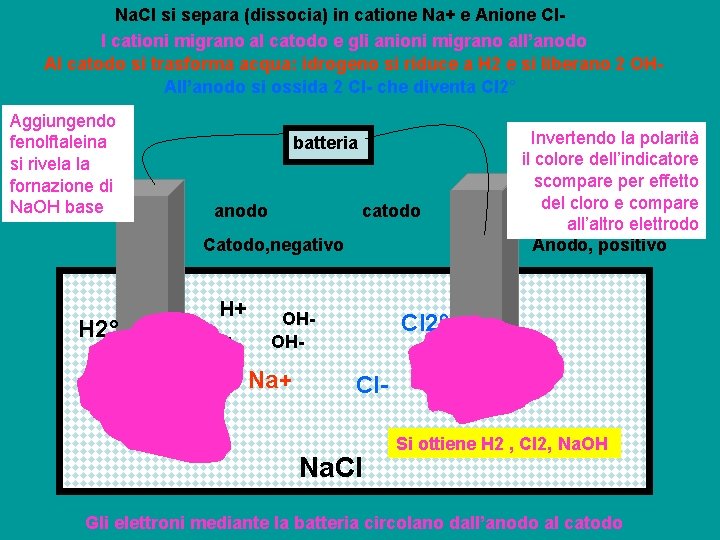
Na. Cl si separa (dissocia) in catione Na+ e Anione Cl. I cationi migrano al catodo e gli anioni migrano all’anodo Al catodo si trasforma acqua: idrogeno si riduce a H 2 e si liberano 2 OHAll’anodo si ossida 2 Cl- che diventa Cl 2° Aggiungendo fenolftaleina si rivela la fornazione di Na. OH base batteria anodo catodo Catodo, negativo H 2° H+ H+ OHOH- Na+ Invertendo la polarità il colore dell’indicatore scompare per effetto del cloro e compare all’altro elettrodo Anodo, positivo Cl 2° Cl- Na+ Na. Cl Si ottiene H 2 , Cl 2, Na. OH Gli elettroni mediante la batteria circolano dall’anodo al catodo
 Spontaneità reazione
Spontaneità reazione Pila daniell
Pila daniell Soluzioni capitolo 19 zanichelli chimica
Soluzioni capitolo 19 zanichelli chimica Potenziali standard di riduzione
Potenziali standard di riduzione Pila daniell zanichelli
Pila daniell zanichelli Potenziali standard di riduzione
Potenziali standard di riduzione Elettrolisi
Elettrolisi Entrare in conflitto sinonimo
Entrare in conflitto sinonimo Esempi grandezze variabili
Esempi grandezze variabili Conducibilità delle soluzioni
Conducibilità delle soluzioni Elettrolisi metalli
Elettrolisi metalli Elettrolisi acqua
Elettrolisi acqua Posca chimica soluzioni capitolo 21
Posca chimica soluzioni capitolo 21 Istituto comprensivo trento 5
Istituto comprensivo trento 5