Elettrolisi ignea e in soluzione acquosa Na Cl












- Slides: 22

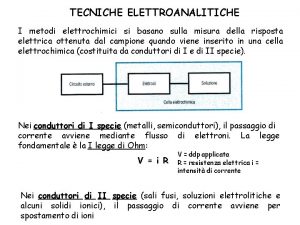
Elettrolisi ignea e in soluzione acquosa Na. Cl, HCl, Na. OH H 2 SO 4 Galvanostegia galvanoplastica raffinazione elettrolitica

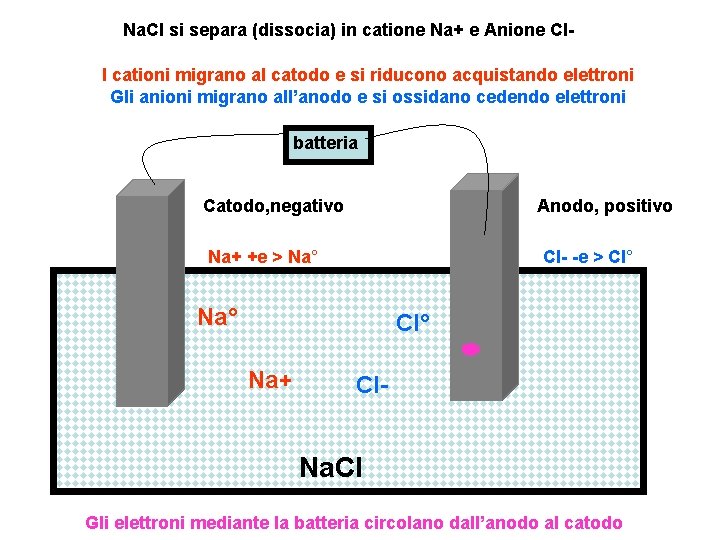
Na. Cl si separa (dissocia) in catione Na+ e Anione Cl. I cationi migrano al catodo e si riducono acquistando elettroni Gli anioni migrano all’anodo e si ossidano cedendo elettroni batteria Catodo, negativo Anodo, positivo Na+ +e > Na° Cl- -e > Cl° Na° Cl° Na+ Cl- Na. Cl Gli elettroni mediante la batteria circolano dall’anodo al catodo

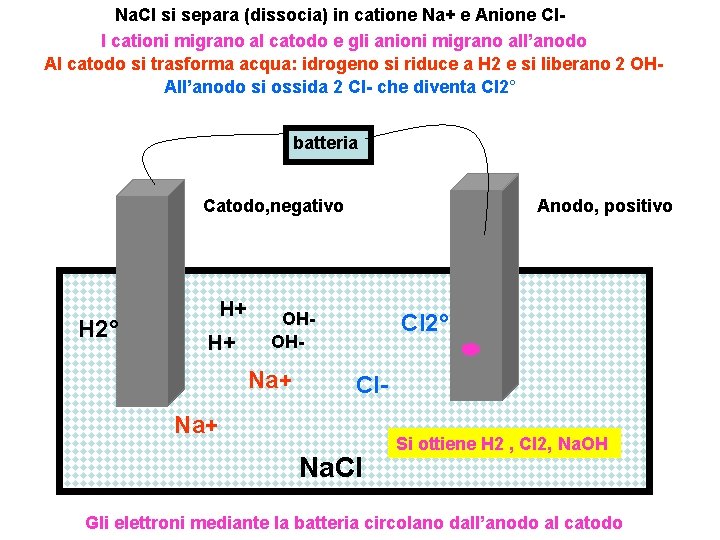
Na. Cl si separa (dissocia) in catione Na+ e Anione Cl. I cationi migrano al catodo e gli anioni migrano all’anodo Al catodo si trasforma acqua: idrogeno si riduce a H 2 e si liberano 2 OHAll’anodo si ossida 2 Cl- che diventa Cl 2° batteria Catodo, negativo H 2° H+ H+ Anodo, positivo OHOH- Na+ Cl 2° Cl- Na+ Na. Cl Si ottiene H 2 , Cl 2, Na. OH Gli elettroni mediante la batteria circolano dall’anodo al catodo

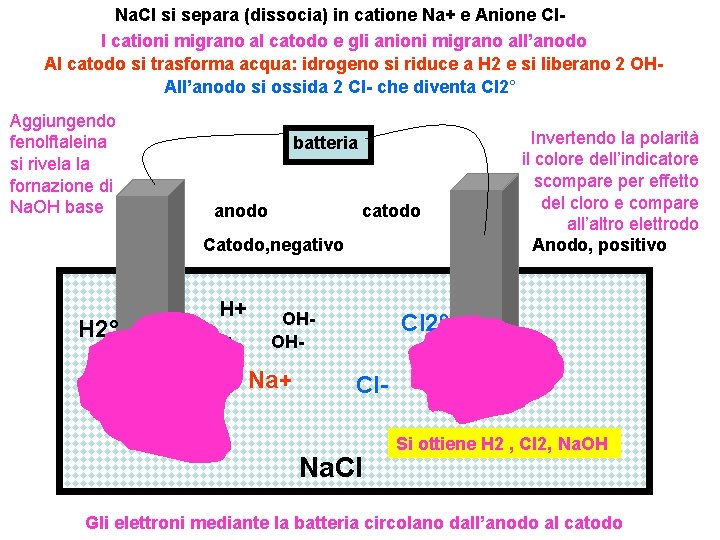
Na. Cl si separa (dissocia) in catione Na+ e Anione Cl. I cationi migrano al catodo e gli anioni migrano all’anodo Al catodo si trasforma acqua: idrogeno si riduce a H 2 e si liberano 2 OHAll’anodo si ossida 2 Cl- che diventa Cl 2° Aggiungendo fenolftaleina si rivela la fornazione di Na. OH base batteria anodo catodo Catodo, negativo H 2° H+ H+ OHOH- Na+ Invertendo la polarità il colore dell’indicatore scompare per effetto del cloro e compare all’altro elettrodo Anodo, positivo Cl 2° Cl- Na+ Na. Cl Si ottiene H 2 , Cl 2, Na. OH Gli elettroni mediante la batteria circolano dall’anodo al catodo

Vaschetta nella quale avviene elettrolisi di Na. OH in acqua colore ciclamino per presenza di fenolftaleina presso il catodo ove si trova Na+ che forma Na. OH con gli ossidrili liberati nella riduzione dell’acqua che libera idrogeno

Nella elettrolisi di Na. Cl in soluzione acquosa si deve considerare anche la possibilità che agli elettrodi possa avvenire la riduzione e ossidazione del solvente acqua : (in competizione con Na+ e Cl-) l’idrogeno da positivo può acquistare elettroni e ridursi a idrogeno neutro atomico e subito molecolare H 2 da 2 H+ 2 OH- > H 2 + 2 OHL’ossigeno da negativo può cedere elettroni e ossidarsi ad atomo (e poi formare molecola) da 2 H+ O-- > 2 H+ 0. 5 O 2 In pratica al catodo : riduzione dell’acqua : si libera H 2° Na* rimane in soluzione e forma Na*OHAll’anodo: ossidazione del cloro si libera Cl 2 Vedi tabella potenziali redox che influisce sulla precedenza nella reazione agli elettrodi (insieme alla concentrazione e altri fattori…)

Alcuni potenziali standard di riduzione E° Na+ 2 H 2 O Zn++ +e + 2 e > > > Na° -2. 71 H 2 + 2 OH- -0. 83 Zn° -0. 76 2 H 3 O + 2 e > H 2 + 2 H 2 O 0. 00 2 H+ + 2 e > H 2 0. 00 Cu++ + 2 e > Cu° +. 034 O 2 + 2 H 2 O + 4 e > 4 OH- + 0. 40 02 + 4 H 3 O + 4 e > 6 H 2 O + 1. 23 Cl 2 + 2° 2 Cl- + 1. 36 > Gli elementi che precedono si ossidano a spese di quelli che seguono H 2 + Cl 2 > 2 H+ 2 Cl. H-H + Cl-Cl > H+Cl- + H+Cl. Al catodo si riducono prima gli elementi che seguono All’anodo si ossidano prima glie elementi che seguono Na+/Na° 2 H 2 O/H 2 + 2 OH 2 H 3 O/H 2 + 2 H 2 -2. 71 -0. 83 precede su Na+ 0. 00 (poco presente)

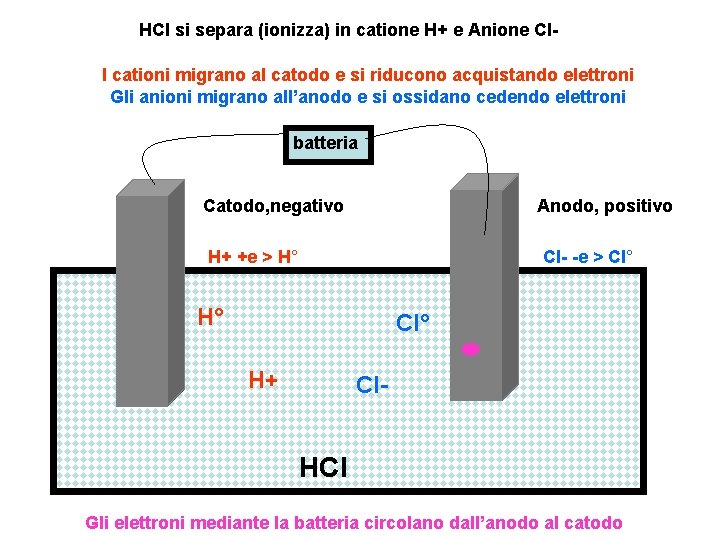
HCl si separa (ionizza) in catione H+ e Anione Cl. I cationi migrano al catodo e si riducono acquistando elettroni Gli anioni migrano all’anodo e si ossidano cedendo elettroni batteria Catodo, negativo Anodo, positivo H+ +e > H° Cl- -e > Cl° H° Cl° H+ Cl- HCl Gli elettroni mediante la batteria circolano dall’anodo al catodo

Nella elettrolisi di HCl in soluzione acquosa si deve considerare anche la possibilità che agli elettrodi possa avvenire la riduzione e ossidazione del solvente acqua : (in competizione con H+ e Cl-) l’idrogeno da positivo può acquistare elettroni e ridursi a idrogeno neutro atomico e subito molecolare H 2 da 2 H+ 2 OH- > H 2 + 2 OHL’ossigeno da negativo può cedere elettroni e ossidarsi ad atomo (e poi formare molecola) da 2 H+ O-- > 2 H+ 0. 5 O 2 In pratica al catodo : riduzione di H+ dell’acido : si libera H 2° All’anodo: ossidazione del cloro si libera Cl 2 2 HCl > 2 H+ 2 Cl- > H 2 + Cl 2 Vedi tabella potenziali redox che influisce sulla precedenza nella reazione agli elettrodi (insieme alla concentrazione e altri fattori…)

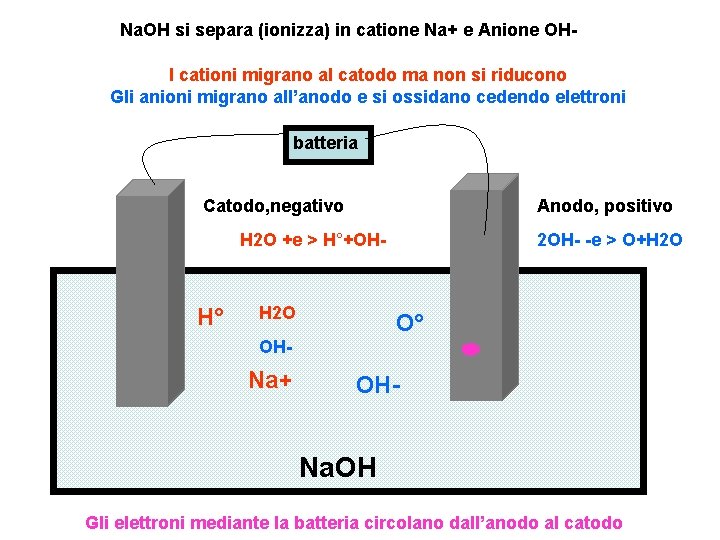
Na. OH si separa (ionizza) in catione Na+ e Anione OHI cationi migrano al catodo ma non si riducono Gli anioni migrano all’anodo e si ossidano cedendo elettroni batteria Catodo, negativo Anodo, positivo H 2 O +e > H°+OH- H° H 2 O 2 OH- -e > O+H 2 O O° OH- Na+ OH- Na. OH Gli elettroni mediante la batteria circolano dall’anodo al catodo

Nella elettrolisi di Na. OH in soluzione acquosa si deve considerare anche la possibilità che agli elettrodi possa avvenire la riduzione e ossidazione del solvente acqua : (in competizione con H+ e OH-) l’idrogeno dell’acqua da positivo può acquistare elettroni e ridursi a idrogeno neutro atomico e subito molecolare H 2 da 2 H 2 O + 2° > H 2 + 2 OHl’ossigeno degli ossidrili può cedere elettroni all’anodo e ossidarsi l 2 OH- - 2° > 0. 5 O 2 + H 2 O In pratica al catodo : riduzione di H+ dell’acqua : si libera H 2° All’anodo: ossidazione del ossigeno dell’OH si libera O 2 2 Na. OH + 2 H 2 O > 2 Na+ 2 OH- + 2 H 2 O > > H 2 + 0. 5 O 2 + 2 Na+ + 2 OH- + H 2 O Praticamente avviene elettrolisi di una molecola di H 2 O > H 2 + 0. 5 O 2

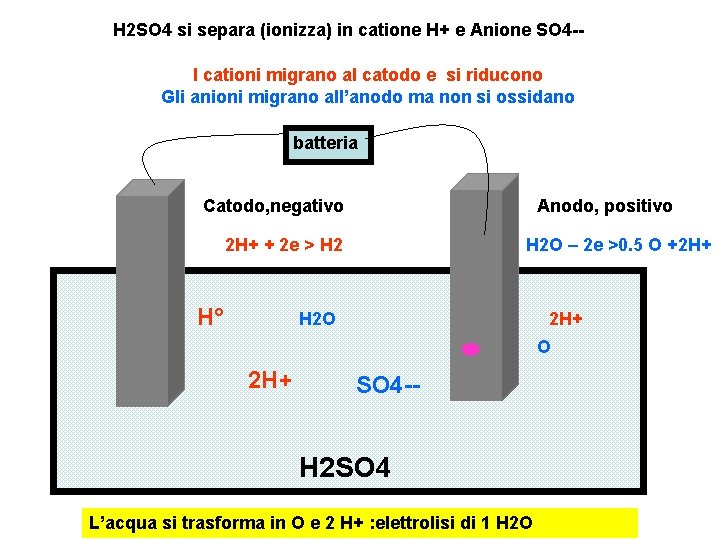
H 2 SO 4 si separa (ionizza) in catione H+ e Anione SO 4 -I cationi migrano al catodo e si riducono Gli anioni migrano all’anodo ma non si ossidano batteria Catodo, negativo Anodo, positivo 2 H+ + 2 e > H 2 H° H 2 O – 2 e >0. 5 O +2 H+ H 2 O 2 H+ SO 4 -- H 2 SO 4 L’acqua si trasforma in O e 2 H+ : elettrolisi di 1 H 2 O

Voltametro di Hoffmann : Elettrolisi di acqua acidulata con acido solforico Notare volume di H doppio di volume ossigeno H 2 O > H 2+0. 5 O 2 ossigeno idrogeno catodo batteria anodo

Nella elettrolisi di H 2 SO 4 in soluzione acquosa si deve considerare anche la possibilità che agli elettrodi possa avvenire la riduzione e ossidazione del solvente acqua : (in competizione con H+ e OH-) Al catodo si riducono gli H+ presenti all’anodo SO 4– non si ossida invece si ossida O dell’acqua H 2 O – 2 e > O + 2 H+ In pratica al catodo : riduzione di H+ dell’acido : si libera H 2° All’anodo: ossidazione del ossigeno della H 2 O si libera O 2 e H+ H 2 SO 4 + H 2 O > 2 H+ SO 4 -- H 2 O > > H 2 + 0. 5 O 2 + 2 H+ + SO 4 -- Praticamente avviene elettrolisi di una molecola di H 2 O > H 2 + 0. 5 O 2

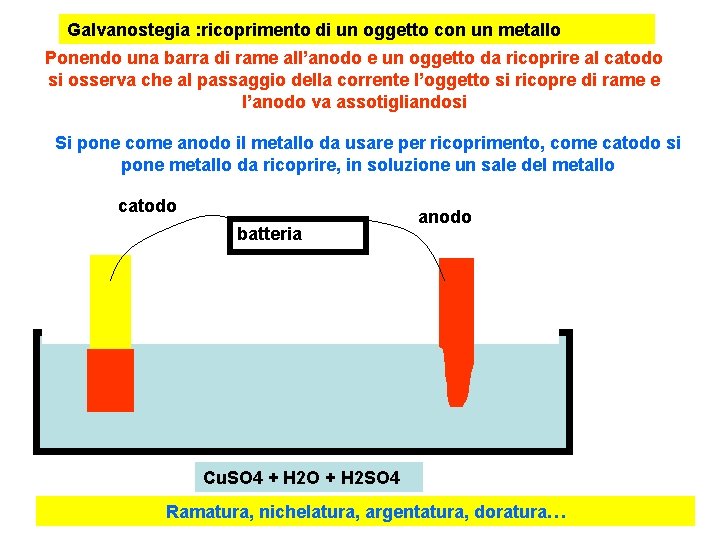
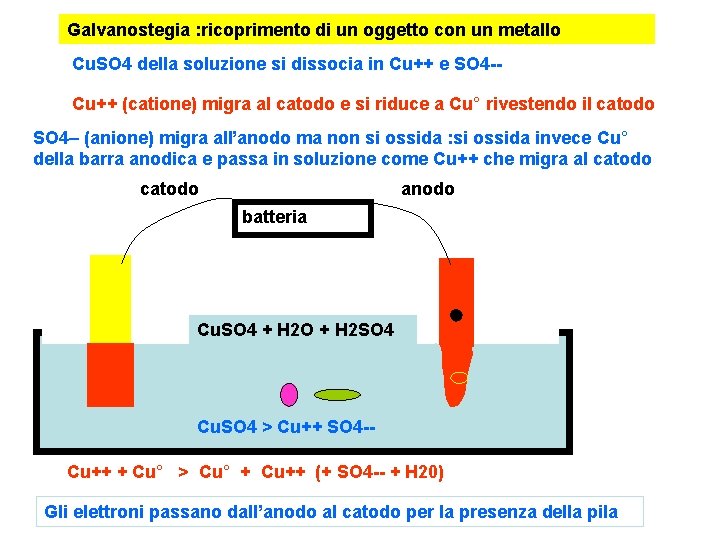
Galvanostegia : ricoprimento di un oggetto con un metallo Ponendo una barra di rame all’anodo e un oggetto da ricoprire al catodo si osserva che al passaggio della corrente l’oggetto si ricopre di rame e l’anodo va assotigliandosi Si pone come anodo il metallo da usare per ricoprimento, come catodo si pone metallo da ricoprire, in soluzione un sale del metallo catodo batteria anodo Cu. SO 4 + H 2 O + H 2 SO 4 Ramatura, nichelatura, argentatura, doratura…

Galvanostegia : ricoprimento di un oggetto con un metallo Cu. SO 4 della soluzione si dissocia in Cu++ e SO 4 -Cu++ (catione) migra al catodo e si riduce a Cu° rivestendo il catodo SO 4– (anione) migra all’anodo ma non si ossida : si ossida invece Cu° della barra anodica e passa in soluzione come Cu++ che migra al catodo anodo batteria Cu. SO 4 + H 2 O + H 2 SO 4 Cu. SO 4 > Cu++ SO 4 -Cu++ + Cu° > Cu° + Cu++ (+ SO 4 -- + H 20) Gli elettroni passano dall’anodo al catodo per la presenza della pila

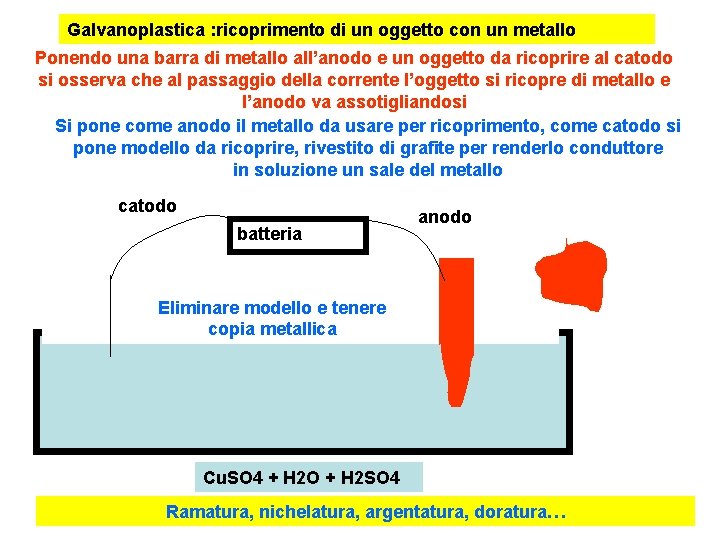
Galvanoplastica : ricoprimento di un oggetto con un metallo Ponendo una barra di metallo all’anodo e un oggetto da ricoprire al catodo si osserva che al passaggio della corrente l’oggetto si ricopre di metallo e l’anodo va assotigliandosi Si pone come anodo il metallo da usare per ricoprimento, come catodo si pone modello da ricoprire, rivestito di grafite per renderlo conduttore in soluzione un sale del metallo catodo batteria anodo Eliminare modello e tenere copia metallica Cu. SO 4 + H 2 O + H 2 SO 4 Ramatura, nichelatura, argentatura, doratura…

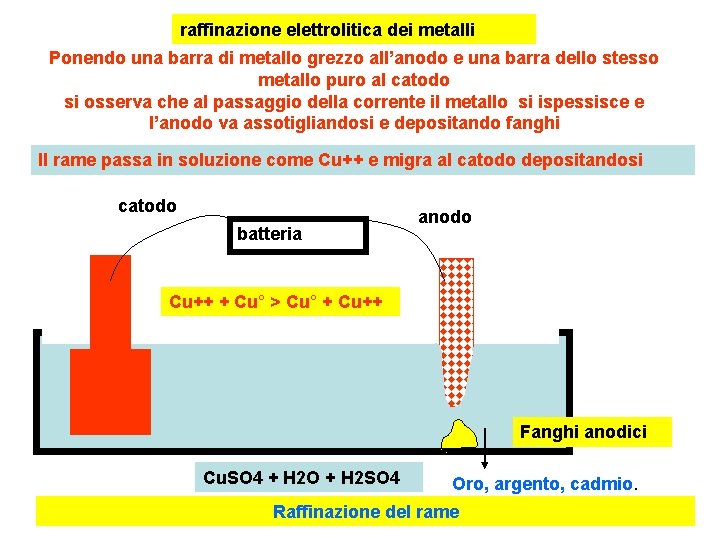
raffinazione elettrolitica dei metalli Ponendo una barra di metallo grezzo all’anodo e una barra dello stesso metallo puro al catodo si osserva che al passaggio della corrente il metallo si ispessisce e l’anodo va assotigliandosi e depositando fanghi Il rame passa in soluzione come Cu++ e migra al catodo depositandosi catodo batteria anodo Cu++ + Cu° > Cu° + Cu++ Fanghi anodici Cu. SO 4 + H 2 O + H 2 SO 4 Oro, argento, cadmio. Raffinazione del rame

Usando un chiodo ricoperto di rame come anodo e un oggetto metallico come catodo, si osserva che il rame all’anodo passa in soluzione come Cu++ e migrando al catodo si riduce ramando l’oggetto Chiodo di ferro normale, grigio Chiodo di ferro rivestito di rame, rosso

Oggetto da ramare, grigio, al catodo chiodo ramato, rosso, all’anodo soluzione di solfato di rame acidulata con H 2 SO 4

Chiodo chiaro da rivestire di rame al cadodo Chiodo ricoperto di rame da fornire alla soluzione per ramatura

Dopo il passaggio della corrente il chiodo al catodo si è ricoperto un poco di rame e quello all’anodo si è un poco schiarito
 Elettrolisi di sali fusi
Elettrolisi di sali fusi Elettrolisi metalli
Elettrolisi metalli Tecniche elettrochimiche
Tecniche elettrochimiche Istituto comprensivo trento 5
Istituto comprensivo trento 5 Elettrolisi zanichelli
Elettrolisi zanichelli Conducibilità delle soluzioni
Conducibilità delle soluzioni Soluzioni capitolo 22 zanichelli chimica più
Soluzioni capitolo 22 zanichelli chimica più Elettrolisi
Elettrolisi Elettrolisi dell'acqua zanichelli
Elettrolisi dell'acqua zanichelli Soluzioni tampone
Soluzioni tampone Polare e apolare
Polare e apolare Soluzione sovrasatura definizione
Soluzione sovrasatura definizione Soluzione
Soluzione Soluzione
Soluzione Soluzione satura
Soluzione satura Soluzione
Soluzione Mappa concettuale acidi e basi
Mappa concettuale acidi e basi Soluzione
Soluzione Gestione telefonia aziendale
Gestione telefonia aziendale Keb glucosio
Keb glucosio Soluzione
Soluzione Un carpentiere ha 32 metri di tavole soluzione
Un carpentiere ha 32 metri di tavole soluzione Soluzione
Soluzione